保护碱基基设计引物
引物保护碱基列表格

11月13日引物合成的详解需要什么级其余引物?答:引物常用的纯化方式C18脱盐,OPC纯化,PAGE纯化,HPLC纯化。
依据实验需要,确立订购引物的纯度级别。
应用引物长度要求纯度级别要求一般PCR扩增<45base OPC一般PCR扩增>45base PAGE诊疗PCR扩增<40base OPC,PAGE DNA测序20base左右OPC亚克隆,点突变等依据实验要求定OPC,PAGE,HPLC基因建立(全基因合成)依据实验要求定PAGE反义核酸依据实验要求定PAGE修饰引物依据实验要求定PAGE,HPLC怎样计算引物的浓度?答:引物保留在高浓度的状况下比较稳固。
引物一般配制成10-50pmol/ul。
一般状况下,建议将引物的浓度配制成50pmol/ul,加水的体积(微升)按以下方式计算:V(微升)=OD数*(乘)33*(乘)(乘)20000/(除)引物的分子量。
引物的分子量能够从合成报告单上获取。
假如需要配制成其余浓度,按上述公式换算。
注意:1OD260=33ug/ml.怎样计算引物的Tm值?答:引物设计软件都能够给出Tm,与引物长度、碱基构成、引物使用缓冲的离子强度有关。
长度为25mer以下的引物,Tm计算公式为:Tm=4℃(G+C)+2℃(A+T)关于更长的寡聚核苷酸,Tm计算公式为:Tm=+xLog10[Na+]+(%GC)–600/size公式中,Size=引物长度。
怎样溶解引物?答:干燥后的引物质地特别松散,开盖前最好离心一下,或管垂直向上在桌面上敲敲,将引物粉末采集到管底。
依据计算出的体积加入去离子无菌水或10mMTris缓冲液,室温搁置几分钟,振荡助溶,离心将溶液采集到管底。
溶解引物用的水一般不要用蒸馏水,因为有些蒸馏水的pH值比较低(pH4-5),引物在这类条件下不稳固。
怎样保留引物?答:引物合成后,经过一系列办理和纯化步骤,旋转干燥而成片状物质。
引物在溶解前,室温状态下能够长久保留。
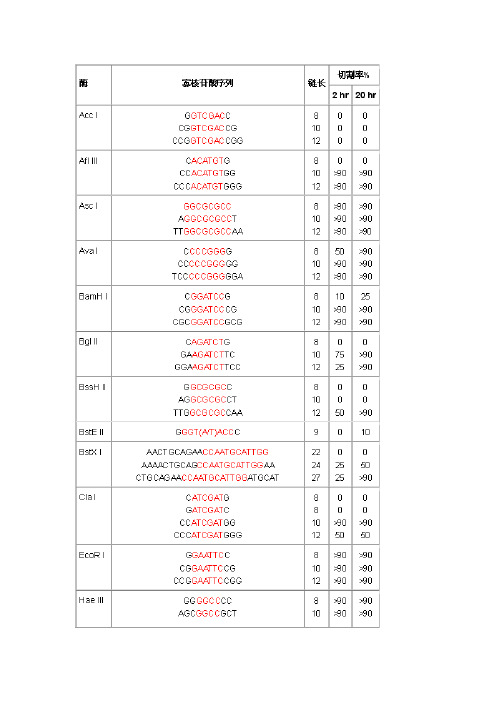
酶切保护碱基表 引物设计原则
PCR引物设计原则PCR引物设计的目的是为了找到一对合适的核苷酸片段,使其能有效地扩增模板DNA序列。
因此,引物的优劣直接关系到PCR的特异性与成功与否。
要设计引物首先要找到DNA序列的保守区。
同时应预测将要扩增的片段单链是否形成二级结构。
如这个区域单链能形成二级结构,就要避开它。
如这一段不能形成二级结构,那就可以在这一区域设计引物。
现在可以在这一保守区域里设计一对引物。
一般引物长度为15~30碱基,扩增片段长度为100~600碱基对。
让我们先看看P1引物。
一般引物序列中G+C含量一般为40%~60%。
而且四种碱基的分布最好随机。
不要有聚嘌呤或聚嘧啶存在。
否则P1引物设计的就不合理。
应重新寻找区域设计引物。
同时引物之间也不能有互补性,一般一对引物间不应多于4个连续碱基的互补。
引物确定以后,可以对引物进行必要的修饰,例如可以在引物的5′端加酶切位点序列;标记生物素、荧光素、地高辛等,这对扩增的特异性影响不大。
但3′端绝对不能进行任何修饰,因为引物的延伸是从3′端开始的。
这里还需提醒的是3′端不要终止于密码子的第3位,因为密码子第3位易发生简并,会影响扩增的特异性与效率。
综上所述我们可以归纳十条PCR引物的设计原则:①引物应用核酸系列保守区内设计并具有特异性。
②产物不能形成二级结构。
③引物长度一般在15~30碱基之间。
④ G+C含量在40%~60%之间。
⑤碱基要随机分布。
⑥引物自身不能有连续4个碱基的互补。
⑦引物之间不能有连续4个碱基的互补。
⑧引物5′端可以修饰。
⑨引物3′端不可修饰。
不能选择A,最好选择T⑩引物3′端要避开密码子的第3位。
PCR引物设计的目的是找到一对合适的核苷酸片段,使其能有效地扩增模板DNA 序列。
如前述,引物的优劣直接关系到PCR的特异性与成功与否。
对引物的设计不可能有一种包罗万象的规则确保PCR的成功,但遵循某些原则,则有助于引物的设计。
1.引物的特异性引物与非特异扩增序列的同源性不要超过70%或有连续8个互补碱基同源。
引物设计保护碱基列表
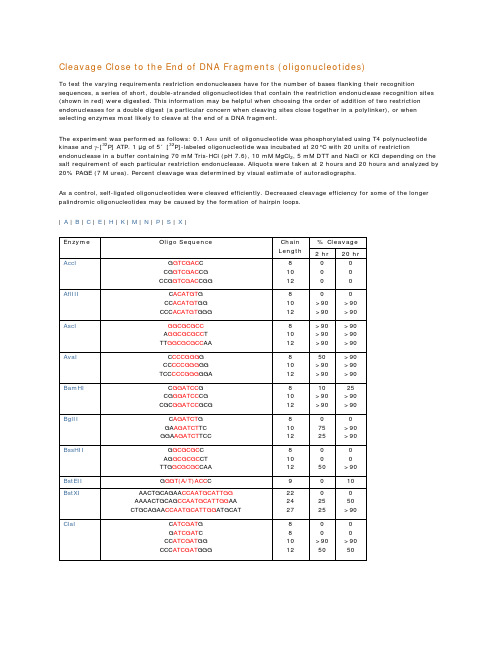
Cleavage Close to the End of DNA Fragments (oligonucleotides)To test the varying requirements restriction endonucleases have for the number of bases flanking their recognition sequences, a series of short, double-stranded oligonucleotides that contain the restriction endonuclease recognition sites (shown in red) were digested. This information may be helpful when choosing the order of addition of two restriction endonucleases for a double digest (a particular concern when cleaving sites close together in a polylinker), or when selecting enzymes most likely to cleave at the end of a DNA fragment.The experiment was performed as follows: 0.1 A260 unit of oligonucleotide was phosphorylated using T4 polynucleotide kinase and γ-[32P] ATP. 1 µg of 5´ [32P]-labeled oligonucleotide was incubated at 20°C with 20 units of restriction endonuclease in a buffer containing 70 mM Tris-HCl (pH 7.6), 10 mM MgCl2, 5 mM DTT and NaCl or KCl depending on the salt requirement of each particular restriction endonuclease. Aliquots were taken at 2 hours and 20 hours and analyzed by 20% PAGE (7 M urea). Percent cleavage was determined by visual estimate of autoradiographs.As a control, self-ligated oligonucleotides were cleaved efficiently. Decreased cleavage efficiency for some of the longer palindromic oligonucleotides may be caused by the formation of hairpin loops.| A | B | C | E | H | K | M | N | P | S | X |。
引物设计保护碱基列表上课讲义

引物设计保护碱基列
表
在分子克隆实验中,有时我们会在待扩增的目的基因片段两端加上特定的酶切位点,用于后续的酶切和连接反应。
由于直接暴露在末端的酶切位点不容易直接被限制性核酸内切酶切开,因此在设计PCR引物时,人为的在酶切位点序列的5‘端外侧添加额外的碱基序列,即保护碱基,用来提高将来酶切时的活性。
添加保护碱基,需要考虑两个因素:一是碱基数目,一是碱基种类。
添加保护碱基时,最关心的应该是保护碱基的数目,而不是种类。
什么样的酶切位点,添加几个保护碱基,是有数据可以参考的,见附表。
添加什么保护碱基,如果严格点,是根据两条引物的Tm值和各引物的碱基分布及GC含量。
如果某条引物Tm值偏小,GC%较低,添加时多加G或C,反之亦反。
保护碱基列表。
PCR设计引物时酶切位点的保护碱基

PCR设计引物时酶切位点的保护碱基引物设计是PCR实验的关键步骤之一,引物的好坏会直接影响到PCR反应的成功与否。
而在引物设计过程中,酶切位点的保护碱基是需要考虑的重要因素之一在PCR实验中,引物的作用是指定PCR反应的放大区域,并提供启动位点供聚合酶结合。
一般情况下,引物至少需要包含一段特定的DNA序列,以便与目标序列互补配对。
在引物设计过程中,选择合适的酶切位点是十分必要的。
酶切位点是指位于特定DNA序列上的限制酶可以识别并切割的区域。
酶切位点的选择通常需要考虑如下几个方面:1.切割效果:选择切割效果好的酶切位点可以提高PCR反应的特异性和灵敏度。
经典的选择是选择一种具有4-6个碱基的酶切位点,并且该位点在引物中间的位置。
这可以有效防止酶切位点的保护碱基对PCR反应的影响。
2.特异性:引物需要选择适合的酶切位点,以确保只有目标序列被放大,而不包括其他与之相关的非特异性序列。
因此,在选择酶切位点时应尽量避免与其他非特异性序列存在相似性。
3.引物长度:引物长度的选择也与酶切位点相关。
如果引物长度过短,可能会导致酶切位点过于靠近PCR反应产物的端点,从而使切割效果不佳。
因此,在引物设计时,应选择适当的引物长度,以保证酶切位点的保护碱基不会对PCR反应产物的生成产生不利影响。
酶切位点的保护碱基是指在特定的DNA序列上,通过选择相应的碱基来避免受到酶切的影响。
常见的保护碱基有甲基化碱基、磷酸化碱基以及接上阻断扩增的非互补碱基等。
1.甲基化碱基:将酶切位点中的一些碱基进行甲基化处理,可以有效地阻止特定酶的切割作用。
甲基化碱基可以通过DNA甲基转移酶进行甲基化修饰。
2.磷酸化碱基:磷酸化碱基是在引物设计过程中添加磷酸基团的方法,通过给酶切位点添加一个磷酸基团来阻断酶的切割作用。
3.非互补碱基:为了阻断酶切位点的切割作用,可以在酶切位点的周围引入一个与其不互补的碱基序列。
这样可以阻断酶的结合和切割。
总的来说,选择合适的酶切位点和保护碱基对PCR实验的成功至关重要。
保护碱基列表概要

11月13日引物合成的详解1.引物是如何合成的?目前引物合成基本采用固相亚磷酰胺三酯法。
DNA合成仪有很多种,主要都是由ABI/PE公司生产,无论采用什么机器合成,合成的原理都相同,主要差别在于合成产率的高低,试剂消耗量的不同和单个循环用时的多少。
亚磷酰胺三酯法合成DNA片段,具有高效、快速的偶联以及起始反应物比较稳定的特点。
亚磷酰胺三酯法是将DNA固定在固相载体上完成DNA链的合成的,合成的方向是由待合成引物的3’端向5’端合成的,相邻的核苷酸通过3’一5’磷酸二酯键连接。
第一步是将预先连接在固相载体 CPGt的活性基团被保护的核苷酸与三氯乙酸反应,脱去其5’ -羟基的保护基团DMT获得游离的5’ -羟基。
第二步,合成DNA的原料,亚磷酰胺保护核苷酸单体,与活化剂四氮唑混合,得到核苷亚磷酸活化中间体,它的3’端被活化,5’ -羟基仍然被DMT保护,与溶液中游离的5’ -羟基发生缩合反应。
第三步,带帽(capping)反应,缩合反应中可能有极少数 5’ -羟基没有参加反应(少于2%),用乙酸酐和1-甲基咪唑终止其后继续发生反应,这种短片段可以在纯化时分离掉。
第四步,在氧化剂碘的作用下,亚磷酰形式转变为更稳定的磷酸三酯。
经过以上四个步骤,一个脱氧核苷酸被连接到固相载体的核苷酸上。
再以三氯乙酸脱去它的5’ -羟基上的保护基团DMT重复以上步骤,直到所有要求合成的碱基被接上去。
合成过程中可以观察TCA处理阶段的颜色判定合成效率。
通过氨水高温处理,连接在CPGL的引物被切下来,通过 OPC,PAGE? 手段纯化引物,成品引物用 C18浓缩,脱盐,沉淀。
沉淀后的引物用水悬浮,测定OD260定量,根据定单要求分装。
2.引物纯化方式有哪些,如何选择?♦C18柱脱盐:有人称其为简易反相柱,它对DNA有特异性的吸附,可以被有机溶解洗脱,但不会被水洗脱,所以能有效地去除盐分。
它不能有效去除比目的片段短的小片段。
实际上,它是一种脱盐的作用。
保护碱基列表概要

11月13日引物合成的详解1.引物是如何合成的?目前引物合成基本采用固相亚磷酰胺三酯法。
DNA合成仪有很多种, 主要都是由ABI/PE 公司生产,无论采用什么机器合成,合成的原理都相同,主要差别在于合成产率的高低,试剂消耗量的不同和单个循环用时的多少。
亚磷酰胺三酯法合成DNA片段,具有高效、快速的偶联以及起始反应物比较稳定的特点。
亚磷酰胺三酯法是将DNA固定在固相载体上完成DNA 链的合成的,合成的方向是由待合成引物的3′端向5′端合成的,相邻的核苷酸通过3′→5′磷酸二酯键连接。
第一步是将预先连接在固相载体CPG上的活性基团被保护的核苷酸与三氯乙酸反应,脱去其5′-羟基的保护基团DMT,获得游离的5′-羟基。
第二步,合成DNA的原料,亚磷酰胺保护核苷酸单体,与活化剂四氮唑混合,得到核苷亚磷酸活化中间体,它的3′端被活化,5′-羟基仍然被DMT保护,与溶液中游离的5′-羟基发生缩合反应。
第三步,带帽(capping)反应,缩合反应中可能有极少数5′-羟基没有参加反应(少于2%),用乙酸酐和1-甲基咪唑终止其后继续发生反应,这种短片段可以在纯化时分离掉。
第四步,在氧化剂碘的作用下,亚磷酰形式转变为更稳定的磷酸三酯。
经过以上四个步骤,一个脱氧核苷酸被连接到固相载体的核苷酸上。
再以三氯乙酸脱去它的5′-羟基上的保护基团DMT,重复以上步骤,直到所有要求合成的碱基被接上去。
合成过程中可以观察TCA处理阶段的颜色判定合成效率。
通过氨水高温处理,连接在CPG上的引物被切下来,通过OPC, PAGE等手段纯化引物,成品引物用C18浓缩,脱盐,沉淀。
沉淀后的引物用水悬浮,测定OD260定量,根据定单要求分装。
2.引物纯化方式有哪些,如何选择?◆C18柱脱盐:有人称其为简易反相柱,它对DNA有特异性的吸附,可以被有机溶解洗脱,但不会被水洗脱,所以能有效地去除盐分。
它不能有效去除比目的片段短的小片段。
实际上,它是一种脱盐的作用。
保护碱基

保护碱基
限制性内切酶识别特定的DNA序列,除此之外,酶蛋白还要占据识别位点两边的若干个碱基,这些碱基对内切酶稳定的结合到DNA双链并发挥切割DNA作用是有很大影响的,被称为保护碱基。
在分子克隆实验中,有时我们会在待扩增的目的基因片段两端加上特定的酶切位点,用于后续的酶切和连接反应。
由于直接暴露在末端的酶切位点不容易直接被限制性核酸内切酶切开,因此在设计PCR引物时,人为的在酶切位点序列的5‘端外侧添加额外的碱基序列,即保护碱基,用来提高将来酶切时的活性。
其次,在分子克隆实验中选择载体的酶切位点时,相临的两个酶切位点往往不能同时使用,因为一个位点切割后留下的碱基过少以至于影响旁边的酶切位点切割。
添加原则
1、添加保护碱基,需要考虑两个因素:一是碱基数目,一是碱基种类。
2、添加保护碱基时,最关心的应该是保护碱基的数目,而不是种类。
什么样的酶切位点,
添加几个保护碱基,是有数据可以参考的,见附表。
3、添加什么保护碱基,如果严格点,是根据两条引物的Tm值和各引物的碱基分布及GC
含量。
如果某条引物Tm值偏小,GC%较低,添加时多加G或C,反之亦反。
附表一、靠近PCR片段末端识别位点的酶切效率(Fermentas)
当识别位点靠近DNA分子末端时,有些限制酶的酶切效率非常低。
表列出了Fermentas 公司限制酶的识别位点靠近PCR片段末端不同碱基数的切割效率。
(酶切时间为16小时)
2、保护碱基列表(BioLabs)。
