02-第二章:烯烃与二烯烃B1
二烯烃的分类

二烯烃的分类一、概述二烯烃(Dienes)是一类化学物质,指的是含有两个不相邻的碳碳双键的烃类化合物。
它们具有高度的反应活性和广泛的应用领域,被广泛用于有机合成和聚合反应等领域。
根据分子中双键的分布和性质,可以将二烯烃分为共轭二烯烃、非共轭二烯烃和环状二烯烃等不同类别。
二、共轭二烯烃共轭二烯烃指的是具有相邻的两个碳碳双键的烃类化合物。
共轭二烯烃的双键之间存在π电子的共轭,并且可以通过形成共轭体系来增强化学反应的活性。
常见的共轭二烯烃有丁二烯和戊二烯等。
1. 丁二烯丁二烯(Butadiene)是一种重要的共轭二烯烃,化学结构式为H2C=CH-CH=CH2。
它可以通过石油提炼或者从煤气中分离得到。
丁二烯是合成橡胶的重要原料,广泛用于合成聚丁二烯橡胶、丁腈橡胶、丁基橡胶等。
2. 戊二烯戊二烯(Pentadiene)也是一种常见的共轭二烯烃,化学结构式为H2C=CH-CH2-CH=CH2。
戊二烯可以通过碳氢化合物的热解反应得到。
它在有机合成中具有重要的应用价值,可以合成大量的有机化合物,如用于合成香料、染料、医药中间体等。
三、非共轭二烯烃非共轭二烯烃指的是具有两个不相邻的碳碳双键的烃类化合物。
与共轭二烯烃不同,非共轭二烯烃的双键之间不存在π电子的共轭效应,因此其反应活性相对较低。
常见的非共轭二烯烃有丙烯、异丁烯等。
1. 丙烯丙烯(Propylene)是一种非常重要的非共轭二烯烃,化学结构式为H2C=CH-CH3。
丙烯是石油裂解产物中的一种重要组分,广泛用于合成塑料、橡胶、纤维等。
此外,丙烯还可以通过煤焦化气中的丙烯和丙烯衍生物的化学合成进行生产。
2. 异丁烯异丁烯(Isobutylene)是一种非共轭二烯烃,化学结构式为H2C=C(CH3)-CH2。
异丁烯是一种重要的烯烃化学原料,可以用于合成丁烷、异戊醇以及丙烯等有机化合物。
此外,异丁烯还被广泛应用于聚合反应和涂料工业等领域。
四、环状二烯烃环状二烯烃是一类含有两个双键的环状化合物。
2020高中化学竞赛有机化学第二章(烯烃、炔烃)(共63张PPT)

2020化学竞赛·有机化学(基础版)·第二章(烯烃、炔烃)
二烯烃: CH2 = CH—CH = CH2 1,3—丁二烯
CH2=CH — CH2
2—烯丙基—1,3—环己二烯
2020化学竞赛·有机化学(基础版)·第二章(烯烃、炔烃)
3)标出烯烃的顺反异构及E/Z式命名 (a)顺反命名法
2020化学竞赛·有机化学(基础版)·第二章(烯烃、炔烃)
一、烯烃和炔烃的结构特征
2020化学竞赛·有机化学(基础版)·第二章(烯烃、炔烃)
乙烯的结构
乙烯分子所有的碳和氢 原子都分布在同一平面
双键上的碳采取 sp2杂化,形 成处于同一平面上的三个 sp2 杂化轨道
2020化学竞赛·有机化学(基础版)·第二章(烯烃、炔烃)
乙炔的结构
π
π
π
H
H σ C σ C σH π
H3C CH2示C例H2:
C H
Cl C
Br
(E)-1-氯-1-溴-1-戊烯
H3C CC
H
CH2CH2CH3 CH3
(Z)-3-甲基-2-己烯
H3C C
H
H
CH3
CC
C
CH2CH3
CH3
(Z),(Z)-2,5-=甲基 -2,4-庚二烯
2020化学竞赛·有机化学(基础版)·第二章(烯烃、炔烃)
三、电子效应也称为极性效应:由于分子中电子云 分布不均匀而引起分子化学的变化,称为电子效应。
2020化学竞赛·有机化学(基础版)·第二章(烯烃、炔烃)
(3)键角
类型 键角
正常单键 109°18′
C=C双键 120°
C≡C叁键 180°
(4)键的极性
用偶极矩衡量。键的偶极矩如C—H为0.4D,C—O为 1.5D。分子的偶极矩是分子内各键的偶极矩的矢量和。 如甲烷偶极矩为0,是非极性分子;氯甲烷为1.86D, 是极性分子。分子的极性对其熔点、沸点、溶解度 等都有影响。键的极性对化学反应有决定性的作用。
有机化学—二烯烃

二烯烃分子中含有两个或两个以上碳碳双键的不饱和链烃称为多烯烃.多烯烃中最重要的是分子中含有两个双键的二烯烃,二烯烃的通式为C n H2n—2一、二烯烃的的分类根据二烯烃中两个双键相对位置的不同,可将二烯烃分为3类.1、累积二烯烃:两个双键与同一个碳原子相连接,例如:丙二烯CH2=C=CH2。
2、隔离二烯烃:连个双键被两个或两个以上的单键隔开,即分子骨架为C=C—(C)n—C=C 的二烯烃称为隔离二烯烃。
3、共轭二烯烃:两个双键被一个单键隔开,即分子骨架为C=C-C=C的二烯烃称为共轭二烯烃。
例如:1,3—丁二烯(CH2=CH-CH=CH2).二、二烯烃的命名二烯烃系统命名法是以含有两个C=C的最长碳链为主链,作为母体二烯烃。
从最靠近C=C的一端开始将主链上的碳原子编号,两个C=C的位次标明于母体二烯烃名称之前.取代基的位置随着主链上碳原子的编号位次而定.含有10个以上碳原子的二烯烃,命名时需在“二烯”前面加上“碳”字。
例如:CH2=C(CH3)—CH=CH2命名:CH3CH2CH=CH—CH2—CH=CH(CH2)4CH3命名:三、1,3-丁二烯的性质(1)加成反应:与烯烃相似,1,3-丁二烯能与卤素、卤化氢发生加成反应,跟Br2按1:1进行的加成反应有1,4-加成反应和1,2—加成反应两种形式. 按1:2进行时则完全加成。
如:︳R(2)聚合反应:R -C H =C H 2—C H 2—C H — n1,3—丁二烯型:“破两头,加中间”,通式: (三)双烯合成共轭二烯烃与某些具有碳碳双键的不饱和化合物发生1,4—加成反应生成环状化合物的反应称为双烯合成,也叫第尔斯—阿尔德(Diels —Alder )反应。
这是共轭二烯烃特有的反应。
它将链状化合物转变成六元环状化合物,因此又叫环合反应。
例如:(条件:20—40MPa ,200摄氏度) 例题: 完成下列反应式: (1) (CH 3)CHCH=CH 2 + Br 2 −−→−4CCl(2) CH 3CH 2C (CH 3)=CH 2 + HCl → (3) CH 3CH=C(CH 3)CH 2CH 3 −−−→−OH Zn O 23/(4) CH 3CH 2CH=CH 2 + H 2O −→−+H(5) CH 2=CH-CH=CH 2 + CH 2=CH-COOH →练习1、下列分子式只表示一种物质的是( )A 。
第二章 第二节 第2课时 烯烃的加成、氧化规律

(2)CH2==CH—CH==CH2与足量Br2的完全加成
CH2==CH—CH==CH2+2Br2―→
。
3.烯烃的加聚反应 (1)二烯烃的加聚反应:nCH2==CH—CH==CH2―催――化―剂→
CH2—CH==CH—CH2 (2)多个烯烃的加聚反应:nCH2==CH2+nCH2==CH—CH3 ―催――化―剂→
1.β-月桂烯的结构如图所示,一分子该物质与两分子溴发生
加成反应的产物(只考虑位置异构)理论上最多有
A.2种
√C.4种
B.3种 D.6种
2.现有两种烯烃:CH2==CH2和
。它们的混合物进行聚合
反应,则聚合反应的产物中含有如下四种物质中的
① CH2—CH2
②
③
A.①④
B.③
④
C.②
√D.①②④
二
(主要产物) (次要产物)
研究发现,当不对称单烯烃与卤化氢发生加成反应时,通常“氢加到 含氢多的不饱和碳原子的一侧”,即遵循马尔科夫尼科夫规则(简称 马氏规则)。
2.二烯烃的加成 二烯烃是分子中含有两个碳碳双键的烯烃。 (1)n(CH2==CH—CH==CH2)∶n(Br2)=1∶1的两种加成方式
√C.CH3CH==CHCH==CHCH3
D.CH3CH2CH==CHCH2CH3
2.(2021·银川高二月考)已知某种烯烃经臭氧氧化后,在Zn存在下水解,可得到醛
和酮。如:
(酮)+R″CHO(醛)
现有分子式为C7H14的某烯烃,它与H2加成后生成2,3-二甲基戊烷,它经臭氧氧化 后,在Zn存在下水解得到乙醛和一种酮,据此推知该烯烃的结构简式为
A.
B.
√C.
D.
烯烃的氧化规律
烯烃和二烯烃
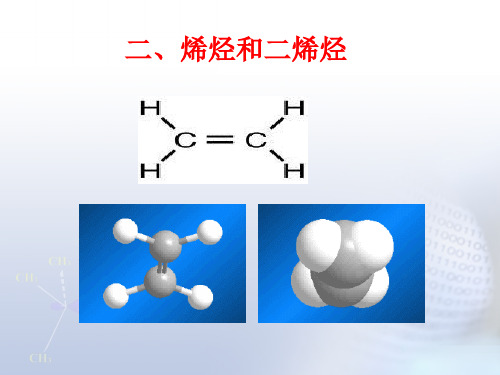
CnH2n-2(n≧4)
烯烃的结构、同分异构体和命名
(一)、乙烯的结构
1.平面构型
118° 121°
说明:乙烯分子中的两个碳原子和四个氢原子都在同一
个平面上。它们彼此间的夹角约为120°,双键的键长比 单键的短,键能比单键的两倍小。所以化学性质活泼。
同系物:结构相似:都含有一个碳碳双键的链烃;
组成上相差一个或若干个“CH2”原子团。 如:丙烯,1-丁烯,1-己烯等等
C
3
C H 2
CH3
1
CH2 CH3
③
②
4-甲基-3-乙基-2-戊烯
【例题1】用系统命名法命名下列化合物
CH2 CH H3C H2C CH CH2 CH2 CH3 CH3CH2CH
C
CHCH3
CH3 CH3
3-乙基-1-己烯 3,4-二甲基-2-己烯
CH3 H3C H C CH3 C H C H C CH2 CH3
写出丙烯的分子式、电子式和结构简式
它们的化学性质与乙烯的相似;物理性质一般地 也随着碳原子数目的增加而递变,与烷烃类似。
(二)、烯烃的同分异构现象
1、碳链异构
2、双键位置异构
如:写出C4H8 属于烯烃的同分异构体
H2C CHCH2CH3
H2C C CH3 CH3
H3CHC CHCH3
烯烃同分异构体的推导方法:
加成反应、加聚反应、氧化反应
加成反应 1 ) 1,4-加成反应
H2C
①
H2C Br
②
C H
③
C H
④
CH2 Br
①
C H ②
C H ③
CH2
+ Br2
有机化学第二章 链烃——二烯烃
湖南中医大学药学院有机药化教研室
一、分类和命名
根据分子中两个双键的相对位置,二烯烃可分为: 根据分子中两个双键的相对位置,二烯烃可分为: 两个双键的相对位置
C C C 累积 二烯 烃
C
CH ( CH2 )n CH
C
n ≥1
孤立二烯烃
C
CH
CH
各种共轭效应的对分子影响的相对强度是: ★ 各种共轭效应的对分子影响的相对强度是:
π ,π - 共轭> p ,π - 共轭> σ,π- 超共轭> σ, p - 超共轭 共轭> 共轭> 超共轭>
四、共轭二烯的化学性质
1.1,2-加成和 . 加成和1,4-加成 加成和 加成
+ 。
CH2=CH-CH=CH2 + HCl CH3-CH-CH=CH2
共轭效应的强度取决于取代基中的中心原子的电负性与主量子数的大小。 共轭效应的强度取决于取代基中的中心原子的电负性与主量子数的大小。 取代基中的中心原子的电负性与主量子数的大小
电负性越大, 效应越强 越强。 电负性越大,-C 效应越强。 共轭体系: ★ π-π共轭体系 共轭体系
同周期元素,随原子序数增大, 效应增强 增强: 同周期元素,随原子序数增大,-C 效应增强:
★ 共轭效应的特性
1、几何特性: 几何特性: 共平面性(参与共轭的原子处于同一平面) 共平面性(参与共轭的原子处于同一平面) 键长的平均化,共轭链越长,平均化程度越大。 键长的平均化,共轭链越长,平均化程度越大。 电子特性:共轭链中π电子云容易离域并正负交替极化。 2、电子特性:共轭链中π电子云容易离域并正负交替极化。 影响分子偶极矩 极化度高
π电子转移用弧形箭头表示 电子转移用弧形箭头表示
有机化学 02 第二章习题及答案.doc

第2章 习题及答案1.写出下列化合物的构造式。
(烷烃)(1)3-甲基-3-乙基-6-异丙基壬烷 (2)2,2,3,3-四甲基戊烷 (3)2,3-二甲基庚烷 (4)2,4-二甲基-4-乙基庚烷 (5)2-甲基-3-乙基己烷 (6)三乙基甲烷(7)甲基乙基异丙基甲烷 (8)乙基异丁基叔丁基甲烷 (9)5-甲基螺[3.4]辛烷 (10)1,7,7-三甲基环[2.2.1]庚烷 解:(2)(3)(4)(5)(6)(7)(8)CH 3CH 22CH 22CH 2CH 32CH 3CH 3CH(CH 3)2(1)(9)(10)CH 3CCCH 2CH 33CH 33CH 3CH 3CHCHCH 2CH 2CH 2CH 3CH 33CH 322CH 2CH 3CH 3CH 3CH 2CH 3CH 3CHCHCH 2CH 2CH 32CH 3CH 3CH 3CH 2CH 2CHCH 3C(CH 3)33CH 3CHCH(CH 3)22CH 3CH 3CH 2CHCH 2CH 32CH32.将下列化合物用系统命名法命名。
(烷烃)(1)(CH 3CH 22CH 2CH 3)3CH3CH 3(2)CH 3CH 2CH 2CHCH 2CH 2CH 33)3(CH 3)3CCH 2CH(CH 2CH 3)2(3)CH 3CH 2CHCH 2CHCH 2CHCH 33CHCH 2CH 3CH 33(4)(5)(6)332解:(1)3,3,11,11-四甲基-7-(4,4-二甲基己基)十三烷;(2)4-叔丁基庚烷;(3)2,2-二甲基-4-乙基己烷;(4)2,6-二甲基-4-仲丁基辛烷;(5)反-1-甲基-3-异丙基环己烷;(6)1-甲基螺[2.4]庚烷;3.用系统命名法命名下列化合物(烯烃 炔烃 二烯烃)。
CH 3CH 2CH 2CHCH 2CH 2CH 3CH 2CH 3CHCH 2CH 2C3(1)(2)(3)(4)(5)CHCH 2CH 3CH 3C CCH 2CH 3CH 3(H 3C)3CH 3CC C C H H 3C HCHC 2H 5H(6)C CH(7)(8)(9)(10)(11)(12)CH 2CH 3CH 2CCHH H 3CH 3(CH 3)2CCHCHCH2PhCH CHCHCH 2ClCl解:(1)3-正丙基-1-己烯;(2)5-甲基-1-己炔;(3)1-甲基-5-乙基-1,3-环己烯;(4)(E)-2,2,3,4-四甲基-3-己烯;(5)(2E, 4E)-2,4-庚二烯;(6)环丙基乙炔;(7)1-乙基-2-炔丙基环己烯;(8)(E, E)-2,4-己二烯;(9)2-甲基-2,4-己二烯;(10)1-苯基-1,3-丁二烯;(11)苯乙烯;(12)2,3-二氯环[2.2.1]庚-2-烯。
烃6 —— 烯烃和二烯烃:烯烃的性质(2)

11
CH CH 2 +2MnO 2 OH OH
+2KOH
2)酸性条件
H3C CH2 CH CH2
KMnO4 H2SO4
H3C CH2 C O + O C OH 丙酸 OH OH CO2 + H2O
H3C CH2 C CH CH3 CH3
KMnO4
H2SO4
H3C CH2 C O + O C CH3
丁酮
Ag
O R CH CH2 + R' C O O H 过氧酸 R CH O
O CH2 + R' C OH
羧酸
环氧化物
4、α-氢原子的反应
•取代
H3C CH CH2
+
Cl2
400~500℃
CH2 CH CH2 Cl
•氧化
H2C CHCH3 + O2
CuO/Al2O3 350~400℃
H2C CHCHO
模块一
烃
二、烯烃的化学性质
加成反应 聚合反应 氧化反应
官能团
H H C H C H C H H
α- 碳原子 α- 氢原子
α -氢原子的反应
3、氧化反应
•高锰酸钾氧化
• •
碱性条件 酸性条件
•催化氧化
(1)高锰酸钾氧化
1)碱性条件
3 RCH CH 2
+ 2 KMnO 4 +4 H2O
碱性 或中性ห้องสมุดไป่ตู้质 3 R
CH3
OH
乙酸
高锰酸钾氧化总结
R
C
H R
C
R H
C
H
紫红色的高锰 RCOOH 酸钾溶液在反 应中迅速褐色, 可用来鉴定不 R 饱和烃。不同 C O 结构的烯烃生 R 成不同的氧化 CO2+ H2O 产物,可用于 烯烃结构测定
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2014-3-11
材料学院《有机化学》多媒体
7
2、σ键与 π键的特点比较
σ键:
可单独存在,存在于任何 共价键中; 成键轨道沿键轴重叠,重 叠程度大; 键能大,较稳定;电子云 受核约束大,不易被极 化;成键的两个原子可沿 键轴自由旋转。
π键:
只与σ键同时存在; 成键p轨道平行重叠, 重叠程度小; 键能较小,不稳定; 电子云受核约束小, 易被极化;成键原子 不可沿键轴自由旋转。
2014-3-11 材料学院《有机化学》多媒体 31
(四)加次卤酸: 氯加在含氢多的碳原子上,合成卤代醇的方法。
H 2C
CH2
+
H O
Cl
H 2C Cl
CH2 OH
H 3C
CH
CH2
+
H O
Cl
CH OH CH2 Cl
32
H 3C
2014-3-11 材料学院《有机化学》多媒体
三、自由基电加成反应 (free radical additon)
H2C CH2 + H2O
H3PO4 300℃ , 7MPa
CH3 CH2OH
(CH3)2C CH2 + H2O
(CH3)2C CH2 + H
+
H+ 25℃
+
(CH3)3 C OH
H2O (CH3)3C OH2 (CH3)3C OH +H+
+
(CH3)2C
CH3
2014-3-11
材料学院《有机化学》多媒体
H C X
δ+ δ
C C X
18
材料学院《有机化学》多媒体
烯烃与HX加成有重排产物:
H (CH3)2CHCH CH2+HCl (CH3)2 C + CH CH3 Cl H (CH3)2C CH Cl CH3
重排 氢转移 + Cl (CH3)2C CH CH (CH3)2C 3 H Cl H CH CH3
• HCl和HI没有过氧化物效应。
• HBr在没有过氧化物存在时仍是按马氏规则 加成。
2014-3-11
材料学院《有机化学》多媒体
35
四、氧化反应 (oxidation)
高锰酸钾氧化 臭氧化反应
2014-3-11
材料学院《有机化学》多媒体
36
(一) 高锰酸钾氧化
与冷的碱性或中性高锰酸钾的稀溶液反应生 成邻二醇
• 甲基越多,正电荷分散的可能性越大,碳正 离子越稳定。
2014-3-11 材料学院《有机化学》多媒体 24
碳正离子的重排
(CH3)2CHCH CH2
HCl
+ (CH3)2C CH CH3
重排
H
(CH3)2CHCHCH3 Cl
+ (CH3)2C CH2 CH3 (CH3)2C CH2 CH3 Cl
2014-3-11
材料学院《有机化学》多媒体
37
与热的高锰酸钾浓溶液或酸性高锰酸钾反应, C=C断裂,生成酮、酸或酮和酸的混合物。
2014-3-11
材料学院《有机化学》多媒体
38
R1 CH CHR2
KMnO4 H3O+
R1 COOH + R2 COOH
KMnO4 RCH CH2 + H3O R1 KMnO4 RCH C R2 H3O+
C
+
CH3
(C)
3oC+ (B)
2014-3-11
材料学院《有机化学》多媒体
23
σ-p超共轭效应对碳正离子中间体稳定性的影响
• 当带正电荷碳原子的 p 轨 道轴和α -C –H 键的σ轨 道轴在同一平面时,这两 个轨道可发生部分重叠, 使部分正电荷分散到甲基 上,起稳定碳正离子的作 用。
H H H + C C H H
2014-3-11 材料学院《有机化学》多媒体 6
(3)双键的键能不是单键的两倍,破坏一个单键(σ键)需 345.8kJ ∙ mol-1; 破 坏 双 键 中 的 另 一 个 键 的 能 量 是264.6 kJ∙mol-1,该键键能小,易断裂(π键)。 C=C由σ+ π组成 (4)双键上的两个碳原子不能象 σ键那样自由旋转,碳碳双 键上所连接的原子和基团具有固定的空间排列 —— 不可旋转 性。
第二章:烯烃
主要内容:
第一节:烯烃的分类、异构与命名 第四节:烯烃的化学性质 第五节:共轭二烯烃
2014-3-11
材料学院《有机化学》多媒体
1
第一节:烯烃的分类、异构与命名
一、结构:
官能团:C = C
sp
通式:CnH2n
2
B A
C C
B A
2014-3-11
材料学院《有机化学》多媒体
2
烯烃的结构
材料学院《有机化学》多媒体
5
1、乙烯的结构特点:
H
0.110nm
C
0.134nm
H C
116.7°
H
121.6°
H
(1)分子中的所有原子同处于一个平面,每个碳原子上的两个 C-H 键和一个 C-C 键互成 120 ,构成三角形状 —— 分子的平面 性; (2)其双键是由两个碳的sp2杂化轨道重叠形成的Csp2-Csp2 σ键和未参与杂化的p轨道侧面重叠形成的π键构成——双键的 不等性;
2014-3-11 材料学院《有机化学》多媒体
氢迁移
25
碳正离子的重排
CH 3 CH 3 C CH CH 3 CH 2 ¡> H
+
CH 3 CH 3 C CH Cl CH 3 Cl CH 3 C CH 3 CH CH 2 H CH 2 H CH 3
重排 CH 3
CH 3
C Cl C
CH CH 2 H
C C H X
X=Cl, Br
卤化氢的反应活性: HI > HBr > HCl > HF
2014-3-11
材料学院《有机化学》多媒体
17
1、反应机理 • 第一步 生成正碳离子
X C C +H X
δ
H
δ+
C
C
δ+
H C C
+
• 第二步 卤素负离子进攻正碳离子,生成卤代烷
H C
2014-3-11
C
+
H +X C
CH2 CHCH3 + HCl
2014-3-11
CH3 CHCH3 Cl
主
CH3CH2 CH2Cl 次
材料学院《有机化学》多媒体 21
马氏规则的实质是:在加成反应的第一步, 优先生成较稳定的碳正离子。
a CH3 CH CH2 +H Br a b + 快 CH CH CH CH3 3 CH CH3 3 Br
RCOOH + CO2 + H2O
RCOOH + R1 CO R2
现象:KMnO4紫色消失,可鉴别双键的存在。
2014-3-11 材料学院《有机化学》多媒体 39
(二) 臭氧化反应 (ozonization)
含6-8%臭氧的氧气和烯烃作用,生成臭氧 化合物的反应称为臭氧化反应。
C C + O3 O C C O O
2°
较稳定,易形成
b + 快 CH3 CH2CH2 CH3 CH2CH2Br
1° 较不稳定,不易形成 加成反应的区域选择性取决于碳正离子的 2014-3-11 22 材料学院《有机化学》多媒体 稳定性。
CH3 CH3 C=CH2 (A) HBr CH3 CH3
o
CH3 CH2 CH3
+
CH 1C
+
• • • • • 催化加氢反应 亲电加成反应 自由基加成反应 氧化反应 硼氢化反应 α-氢的取代反应 • 聚合反应
2014-3-11 材料学院《有机化学》多媒体 12
一、催化加氢反应
C C + H2
催化剂
C C H H
放热
将烯烃和氢吸附在金属表面,使π键 和H-H键松弛,降低反应所需活化能
2014-3-11
2014-3-11
材料学院《有机化学》多媒体
8
二、烯烃的命名与同分异构 1、系统命名法: (1)选主链。按主链C原子数称 “ 某烯 ” ;多 于10个碳的烯烃用中文数字加“碳烯”。 (2)编号。C=C双键具最低位次,取代基具 较低位次。 ( 3 )命名。取代基位次 -取代基数目 - 取代基 名称-双键位次-某烯烃。
CH 3 Cl CH 3 CH 3
2014-3-11
CH CH 2 H
(主)
26
CH 3
材料学院《有机化学》多媒体
(二) 加硫酸
C + H OSO2OH C H C H2O C H C OH
C
OSO2OH
工业制备醇的方法 间接水合法 (indirect hydration)
2014-3-11 材料学院《有机化学》多媒体 27
氢带着一对电子转移到相邻带正电荷的碳原子 上,形成较稳定的叔碳正离子,它再与氯负离子结 合产生重排产物。
2014-3-11 材料学院《有机化学》多媒体 19
2、区域选择性和反应活性
C C
+ HX
C C H X
不对称烯烃与卤化氢加成有两种取向:
CH2 CHCH3 + HCl
CH2 CHCH2 CH3 + HBr
2p 2s 2s 2p sp2 orbitals 2p orbital
H
H
H
2014-3-11 材料学院《有机化学》多媒体
