第三章二元合金的相结构与相图
合集下载
第三章合金的结构与相图

硬性和耐磨性,是高合金钢和 结
硬质合金中的重要组成相。
构
如:W2C, VC, TiC, MoC, TiN, VN 等。
35
② 间隙化合物
当(d非 /d过)>0.59时,形成
的间隙化合物一般具有复杂的 晶格结构。 如:Fe3C, dC/dFe =0.61, 正交 晶格 特点: 熔点、硬度更高
作用: 在钢中也起强化相作用。
27
1. 根据溶质原子在溶剂晶格中分布情况的不同, 可将固溶体分为( )和( )。 2. 相是指合金中( )与( )均匀一致的组成部分。 3. 固溶体与金属间化合物在晶体结构和力学性能 方有何不同?
28
特点与变化
晶粒的大小与形状无 明显的变化; 位错密度变化不大; 电阻明显降低; 强度硬度略有降低,
可能形成无限固溶体;
对于间隙固溶体,则只能形成有限固溶体。
18
3 按溶质原子在固溶体中分布是否有规律分
➢ 无序固溶体:溶质原子呈无序分布的固溶体; ➢ 有序固溶体:溶质原子呈有序分布的固溶体; ➢间隙固溶体都 是无序固溶体。
19
(三)、影响固溶体结构形式和溶解度的因素
1. 原子大小
溶剂与溶质的原子直径差别:
铁原子 碳原子
通常固溶体不能用一个化学式表示
12
(一). 溶质元素在固溶体中的溶解度
固溶体的浓度: 溶质原子溶于固溶体中的量,称为固溶体的浓度。
质量百分比: C=(溶质元素的质量/固溶体的质量)100% 原子百分比: C=(溶质元素的原子数/固溶体的总原子数)100%
固溶体的溶解度: 在一定条件下,溶质元素在固溶体中的极限浓度称 为溶质元素在固溶体中的溶解度。
31
1、金属间化合物的种类
硬质合金中的重要组成相。
构
如:W2C, VC, TiC, MoC, TiN, VN 等。
35
② 间隙化合物
当(d非 /d过)>0.59时,形成
的间隙化合物一般具有复杂的 晶格结构。 如:Fe3C, dC/dFe =0.61, 正交 晶格 特点: 熔点、硬度更高
作用: 在钢中也起强化相作用。
27
1. 根据溶质原子在溶剂晶格中分布情况的不同, 可将固溶体分为( )和( )。 2. 相是指合金中( )与( )均匀一致的组成部分。 3. 固溶体与金属间化合物在晶体结构和力学性能 方有何不同?
28
特点与变化
晶粒的大小与形状无 明显的变化; 位错密度变化不大; 电阻明显降低; 强度硬度略有降低,
可能形成无限固溶体;
对于间隙固溶体,则只能形成有限固溶体。
18
3 按溶质原子在固溶体中分布是否有规律分
➢ 无序固溶体:溶质原子呈无序分布的固溶体; ➢ 有序固溶体:溶质原子呈有序分布的固溶体; ➢间隙固溶体都 是无序固溶体。
19
(三)、影响固溶体结构形式和溶解度的因素
1. 原子大小
溶剂与溶质的原子直径差别:
铁原子 碳原子
通常固溶体不能用一个化学式表示
12
(一). 溶质元素在固溶体中的溶解度
固溶体的浓度: 溶质原子溶于固溶体中的量,称为固溶体的浓度。
质量百分比: C=(溶质元素的质量/固溶体的质量)100% 原子百分比: C=(溶质元素的原子数/固溶体的总原子数)100%
固溶体的溶解度: 在一定条件下,溶质元素在固溶体中的极限浓度称 为溶质元素在固溶体中的溶解度。
31
1、金属间化合物的种类
合金的结构与二元合金相图

构和组织
• (二) 金属化合物 • 合金中的组元按一定原子数量比相互作用而形成的具有金属特性的新
相叫金属化合物.例如Mg (六方晶格) 与Si (金刚石型晶格) 熔合. 可以形成Mg2Si (立方晶格). 金属化合物一般可用分子式大致表 示其组成. • 金属化合物具有复杂的晶体结构. 熔点较高. 硬度高. 而脆性大. 当它 呈细小颗粒均匀分布在固溶体基体上时. 将使合金的强度、硬度及耐 磨性明显提高. 这一现象称为弥散强化. 因此金属化合物在合金中常作 为强化相存在. 它是许多合金钢、有色金属和硬质合金的重要组成相.
上一页 下一页 返回
第二节 二元合金相图
• 2. 二元合金相图的一般识读 • (1) 相结构或组织状态符号. • L———液相. α、β、γ———不同的固溶体相结构或晶粒组织. L +
下一页 返回
第一节 合金的结构和组织
• 二、合金相结构的类型 • 在熔合合金中. 两组元的原子怎么熔合在一块呢? 研究发现. 合金中的
组元. 不论是二元或三元的. 原子要么以固溶方式相互熔合. 要么以化 合的方式相互熔合. 所谓固溶. 是一组元保留自己晶格类型. 另外的组 元以原子形式进入其中. 所谓化合. 则是指两组元的原子各以一定数量 比相互作用形成新的第三种晶格类型. • (一) 固溶体 • 以固溶方式形成的相结构叫固溶体. 其中保留了晶格的组元叫溶剂. 进 入它里面的其他组元原子叫溶质. 按溶质原子在溶剂晶格中位置的固 溶方式. 固溶体分为置换型和间隙型两大类.
上一页 下一页 返回
第二节 二元合金相图
• 上述合金结晶的特点告诉我们. 对于一个合金系. 仅用一个冷却曲线图 是无法表达清楚的. 必须用更复杂的图形. 这就出现了二元合金相图. 所谓二元合金相图. 是表示二元合金系内相结构或组织状态与温度、 成分之间变化关系的坐标图形. 相图如果是在平衡条件(等温、等压、 等容) 下测定的. 又叫平衡图. 不平衡状态下的相图与平衡状态下的相 图有一定区别.
• (二) 金属化合物 • 合金中的组元按一定原子数量比相互作用而形成的具有金属特性的新
相叫金属化合物.例如Mg (六方晶格) 与Si (金刚石型晶格) 熔合. 可以形成Mg2Si (立方晶格). 金属化合物一般可用分子式大致表 示其组成. • 金属化合物具有复杂的晶体结构. 熔点较高. 硬度高. 而脆性大. 当它 呈细小颗粒均匀分布在固溶体基体上时. 将使合金的强度、硬度及耐 磨性明显提高. 这一现象称为弥散强化. 因此金属化合物在合金中常作 为强化相存在. 它是许多合金钢、有色金属和硬质合金的重要组成相.
上一页 下一页 返回
第二节 二元合金相图
• 2. 二元合金相图的一般识读 • (1) 相结构或组织状态符号. • L———液相. α、β、γ———不同的固溶体相结构或晶粒组织. L +
下一页 返回
第一节 合金的结构和组织
• 二、合金相结构的类型 • 在熔合合金中. 两组元的原子怎么熔合在一块呢? 研究发现. 合金中的
组元. 不论是二元或三元的. 原子要么以固溶方式相互熔合. 要么以化 合的方式相互熔合. 所谓固溶. 是一组元保留自己晶格类型. 另外的组 元以原子形式进入其中. 所谓化合. 则是指两组元的原子各以一定数量 比相互作用形成新的第三种晶格类型. • (一) 固溶体 • 以固溶方式形成的相结构叫固溶体. 其中保留了晶格的组元叫溶剂. 进 入它里面的其他组元原子叫溶质. 按溶质原子在溶剂晶格中位置的固 溶方式. 固溶体分为置换型和间隙型两大类.
上一页 下一页 返回
第二节 二元合金相图
• 上述合金结晶的特点告诉我们. 对于一个合金系. 仅用一个冷却曲线图 是无法表达清楚的. 必须用更复杂的图形. 这就出现了二元合金相图. 所谓二元合金相图. 是表示二元合金系内相结构或组织状态与温度、 成分之间变化关系的坐标图形. 相图如果是在平衡条件(等温、等压、 等容) 下测定的. 又叫平衡图. 不平衡状态下的相图与平衡状态下的相 图有一定区别.
第3章__二元合金相图

1、相图相区分析 T,C 1500 1400 1300 1200 1100 1000 1083 Cu 固相区 20 40 60 Ni% 80 L 液相区
液相线 纯镍 熔点
1455
L+
纯铜 熔点
Ni 100
固相线
固液两相区
2、合金的结晶过程
L L
平衡结晶
形核和晶粒的长大
能量起伏 结构起伏 成分起伏
图3-17 匀晶相图合金的结晶过程
3、杠杆定律及其应用
设合金成分为ω,合金的总质量 为m,在T温度时,固相成分ωα, 液相成分ωL,对应的质量 m α , mL mL m m
mLL m m
mL bc m L ab
mL bc m ab m ac m ac m ab
T,C
T,C 1 L L+(+)+
183
L+
M
L
E
L+
N
2L+
+
Pb X3
(+ )+ (+ )+ + Ⅱ Sn
t
标注了组织组成物的相图
M
E
N
三、相图与性能的关系
1. 合金的使用性能与相图的关系
固溶体中溶质浓度↑ → 强度、硬度↑ 组织组成物的形态对强度影响很大。组织越细密,强度越高。
二、共晶相图
液相线
固相线
T,C
Pb
L+
L
L+
Sn
固溶线
+
Sn%
固溶线
铅-锡合金共晶相图
液相线 纯镍 熔点
1455
L+
纯铜 熔点
Ni 100
固相线
固液两相区
2、合金的结晶过程
L L
平衡结晶
形核和晶粒的长大
能量起伏 结构起伏 成分起伏
图3-17 匀晶相图合金的结晶过程
3、杠杆定律及其应用
设合金成分为ω,合金的总质量 为m,在T温度时,固相成分ωα, 液相成分ωL,对应的质量 m α , mL mL m m
mLL m m
mL bc m L ab
mL bc m ab m ac m ac m ab
T,C
T,C 1 L L+(+)+
183
L+
M
L
E
L+
N
2L+
+
Pb X3
(+ )+ (+ )+ + Ⅱ Sn
t
标注了组织组成物的相图
M
E
N
三、相图与性能的关系
1. 合金的使用性能与相图的关系
固溶体中溶质浓度↑ → 强度、硬度↑ 组织组成物的形态对强度影响很大。组织越细密,强度越高。
二、共晶相图
液相线
固相线
T,C
Pb
L+
L
L+
Sn
固溶线
+
Sn%
固溶线
铅-锡合金共晶相图
第三章合金的结构与相图本章重点1`固溶体与化合物及其特性

⑤ 温度
固溶体的溶解度受温度的影响较大, 一般温度越高,固溶体的溶解度越大。 如,奥氏体在727℃能溶解0.77%的碳, 而在1148℃则能溶解2.11%的碳。
3、固溶体的性能
当溶质元素的含量极少时,固溶体的性 能与溶剂金属基本相同。随着溶质元素含量 的升高,固溶体的性能发生明显变化,表现 在强度、硬度升高,塑性、韧性有所下降, →固溶强化。
金属间化合物
FeS, MnS 等
一般化合物
金属间化合物可以作为合金的组 成相(强化相),而非金属化合物在 合金中大多属于有害杂质。如FeS 在 钢中引起热脆。
1、金属间化合物的组织与性能特点
金属间化合物具有复杂的晶格结构, 熔点高,硬而脆,其在合金中的分布形 态对合金的性能影响很大,当金属间化 和物以大块状或成片状形态分布时,合 金的强度、塑性均很差;当金属间化合 物呈弥散状质点分布时,合金的强度高, 塑性、韧性较好。
范围内变化,电子化合物可以溶解一定量的组
元,形成以电子化合物为基的固溶体。
C、间隙化合物
由原子直径较大的过渡族元素与原子直径 很小的C、N、B等元素组成,过渡族元素的原 子占据晶格的正常位置,尺寸较小的非金属元 素原子有规则地嵌入晶格空隙中,形成间隙化 合物。
① 间隙相
当非金属元素原子与过渡族金属元素原 子直径的比值(d非/d过)<0.59时,形成的间 隙化合物具有比较简单的晶格结构,成为间 隙相。 如:W2C, VC, TiC, MoC, TiN, VN 等。
偏析的存在,会使金属强度下降,塑 性较差,耐腐蚀性降低,应采用均匀化退 火(扩散退火)予以消除。
第四节 二元共晶相图 当合金的二组元在液态时无限互溶, 在固态时有限互溶,且发生共晶反应, 此合金系的相图为二元共晶相图。
第三章 二元合金的相结构与结晶(包晶相图)4(16)-10-2剖析

α
包晶偏析:因包晶转变 不能充分进行而导致的 成分不均匀现象。
四、包晶转变的实际应用
包晶转变特点:
包晶转变的形成相依附在初生相上形成; 包晶转变的不完全性。(不彻底性)
组织设计:如轴承合金需要的软基体上分布硬质点的组织。 首先形成硬质点,包晶反应形成软固溶体包于其外层
晶粒细化。 包晶反应生成细小化合物,异质形核。
包晶反应的推广
包晶反应(Peritectic) L + 包析反应(Peritectoid) + 合晶反应(Syntectic) L1 + L2
第三章 二元合金的相结构与结晶
§3-1 合金中的相 §3-2 合金的相结构 §3-3 二元合金相图的建立 §3-4 匀晶相图及固溶体的结晶 §3-5 共晶相图及其合金的结晶 §3-6 包晶相图及其合金的结晶 §3-7 其它类型的合金相图 §3-8 二元相图的分析及使用
§3-6 包晶相图及其合金的结晶
室温组织组成:β+αⅡ
室温相组成: α+β
三、不平衡结晶及其组织
原因 新生β相依附于α相生核长大, β相将α相包围
液体和α相反应形成β相,须 通过β相层进行扩散
原子在固体中的扩散低于液体, 包晶转变缓慢
冷却速度快.包晶转变被抑制 不能完全进行
剩余的液体在低于包晶转变温 度直接转变为β
保留下来的α,以及形成的β 相成分都不均匀。
(2) 线:
液相线: ACB,固相线:APDB。 固溶线:PE、DF线分别为中的固溶线(溶解度曲线)。
包晶线:水平线PDC
一、相图分析
(3)相区:
三个单相区: L、、; 三个两相区:L+、L+、+; 一个三相区:即水平线PDC; L + + 。
第3章合金相图和合金的凝固

rb wL 100% ab
w
ar 100% ab
动画3-3 杠杆定律证明
3.3 匀晶相图及固溶体的结晶 匀晶相图:两组元在液态无限互溶、固态也无限互溶的二元合 金相图。 匀晶转变:从液相结晶出单相固溶体的结晶过程。
主要二元合金系:Cu-Ni、Ag-Au、Cr-Mo、Cd-Mg、Fe-Ni、 Mo-W等。
2)温度t3 温度到t3时,最后一滴液体结晶成固体,固溶体的成分完全与合 金成分一致,成为均匀(C0)的单相固溶体组织时。
固溶体结晶过程概述:
固溶体晶核的形成(或原晶体的长大),产生相内(液相或固相)的 浓度梯度,从而引起相内的扩散过程,这就破坏了相界面处的 平衡(造成不平衡),因此,晶体必须长大,才能使相界面处重新
不是3,与合金的成分C0不同, 因此,仍有一部分液体尚未结 晶,一直要到t4温度才能结晶 完毕。
晶内偏析:一个晶粒内部化学成分不均匀的现象 枝晶偏析:固溶体树枝状晶体枝干和枝间化学成分不同的现象
影响晶内偏析的因素: 1)分配系数k0 当k01时,k0值越小,则偏析越大; 当k01时,k0越大,偏析也越大。 2)溶质原子的扩散能力 结晶的温度较高,溶质原子扩散能力又大,则偏析程度较小;反之,则 偏析程度较大。 3)冷却速度 冷却速度越大,晶内偏析程度越严重。 削除晶内偏析的方法: 扩散退火或均勺化退火
两相。
对二元系来说,组元数c=2,当f=0时,P=2-0+1=3,说明 二元系中同时共存的平衡相数最多为3个。
(2)利用相律可以解释纯金属与二元合金结晶时的一些差别。 纯金属结晶时存在液、固两相,其自由度为零,说明纯金属 在结晶时只能在恒温下进行。 二元合金结晶时,在两相平衡条件下,其自由度f=2-2+1, 说明此时还有一个可变因素(温度),因此,二元合金将在一定
二元合金的相结构与结晶相图建立与匀晶相图2258103
上式与力学中的杠杆定律完全相似,因此称之为杠杆定律,其含义为 合金在某温度下两平衡相的重量比等于该温度下与各自相区距离较远 的成分线段之比。
9
在杠杆定律中,杠杆的支点是合金的成分,杠杆的端
点是所求的两个平衡相的成分。
例(如图)
0.53 0.45 Q 100% 61.5% 0.58 0.45 0.58 0.53 QL 100% 38.5% 0.58 0.45
3
4
三、相律及杠杆定律
(一) 相律及其应用
相律:表示平衡条件下,系统的组元数、相数和自由度数之间的关系。 表达式:
F=C-P+2 (压力:不等) F=C-P+1 (压力:常数) C-组元数(component); P-相数(phase); F-自由度数(free) 平衡系统的自由度数:平衡系统的独立、可变的因素数。 (在保持合金系的相数不变的条件下,合金系中可改变的、影 响合金状态的内部因素和外部因素的数目) (成分、温度、压力)
如 Cu-Ni,Fe-Cr, Au-Ag Cu-Ni合金相图
15
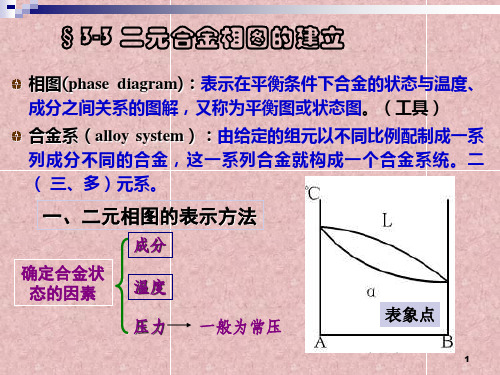
一、相图分析
两个点——Cu和Ni的熔点
两条线——上面是液相线,
下面是固相线。
L
三个区——液相区L ,
固相区 ,
+
L
固液共存的两相区(L+ )。
16
二、固溶体合金的平衡结晶过程
平衡结晶——极缓慢的冷却条件下进行的结晶过程
§3-3 二元合金相图的建立
相图 (phase diagram) :表示在平衡条件下合金的状态与温度、 成分之间关系的图解,又称为平衡图或状态图。(工具)
9
在杠杆定律中,杠杆的支点是合金的成分,杠杆的端
点是所求的两个平衡相的成分。
例(如图)
0.53 0.45 Q 100% 61.5% 0.58 0.45 0.58 0.53 QL 100% 38.5% 0.58 0.45
3
4
三、相律及杠杆定律
(一) 相律及其应用
相律:表示平衡条件下,系统的组元数、相数和自由度数之间的关系。 表达式:
F=C-P+2 (压力:不等) F=C-P+1 (压力:常数) C-组元数(component); P-相数(phase); F-自由度数(free) 平衡系统的自由度数:平衡系统的独立、可变的因素数。 (在保持合金系的相数不变的条件下,合金系中可改变的、影 响合金状态的内部因素和外部因素的数目) (成分、温度、压力)
如 Cu-Ni,Fe-Cr, Au-Ag Cu-Ni合金相图
15
一、相图分析
两个点——Cu和Ni的熔点
两条线——上面是液相线,
下面是固相线。
L
三个区——液相区L ,
固相区 ,
+
L
固液共存的两相区(L+ )。
16
二、固溶体合金的平衡结晶过程
平衡结晶——极缓慢的冷却条件下进行的结晶过程
§3-3 二元合金相图的建立
相图 (phase diagram) :表示在平衡条件下合金的状态与温度、 成分之间关系的图解,又称为平衡图或状态图。(工具)
三、二元合金相图和合金的凝固

2018/3/29
金属学与热处理
14
二、固溶体的平衡结晶过程
2018/3/29
金属学与热处理
15
在1点温度以上, 合金为液相L。 缓慢冷却至1~2温度之间时, 合金发生匀晶反应: L→α , 从液相中逐 在1~2点之间任意温度都可以用杠杆定理确定液相L和固相α 的相对
渐结晶出α 固溶体。
含量和成分。
2018/3/29
金属学与热处理
5
2018/3/29
金属学与热处理
6
三、相律及杠杆定理
1.相律及其应用
f c p 2
f —自由度数 c—系统的组元数 p—平衡条件下系统的相数 当系统的压力为常数时
f c p 1
2018/3/29 金属学与热处理 7
自由度是指在保持合金系中相的数目不变的条件下,合 金系中可以独立改变的影响合金状态的内部和外部因素 的数目。 影响合金状态的因素有合金的成分、温度和压力,当压 力不变时,则合金的状态由成分和温度两个因素确定。 纯金属的自由度最多只有一个; 二元系合金的自由度最多为2个; 三元系合金的自由度最多为3个。
的成份是不同的,它应按固相 线变化。如果冷却速度较快,
固体中原子难以通过扩散满足
相图中的平衡成份,则就产生 了不平衡凝固过程。此时,通 常先结晶的固溶体内部含高熔 点组元,而后结晶的外部则富 含低熔点组元。 这种在晶粒内部出现的成份
下图是在金相显微镜下观察 到的Cu-Ni合金不平衡凝固的 铸态组织,Ni熔点高,先结晶 出的枝干富含Ni,耐浸蚀,呈 白亮色枝间后结晶含Cu多,易 受浸蚀,呈黑色。 扩散退火的方法可消除晶内 偏析。
成全部共晶组织的成分和 温度范围称为伪共晶区。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配制一系列成分不等的合金
名称 熔点 合金1 合金2 合金3 …….. 合金9 合金10 合金11
金属A 高
100% 90% 80% …….. 20% 10% 0%
金属B 低 0% 10% 20%
……. 80% 90% 100%
热分析法
纯金属的结晶
T
t
热分析法得到的冷却曲线
Temperature/℃
例:室温下纯铁、钢中的相 纯铁:α-Fe; 钢:铁素体(α)+渗碳体(Fe3C)。
α相
α相
Fe3C 相
纯铁
0.45%C 钢
一、相的分类
相结构,实际指合金的晶体结构。 (一)固溶体
定义:合金组元通过溶解形成一种成分和性能均匀 的、且晶格类型与组元之一相同的固相称为固溶体。 其中与固溶体晶格相同的组元为溶剂,一般在合金中 含量较多;另一组元为溶质。溶液即液溶体,固溶 体中溶剂、溶质概念同液溶体类似。
(1)原子尺寸
组元间原子半径越相近,固溶度越大。 原因:溶质原子引起溶剂晶格畸变,产生畸变 能。原子半径相差越大,晶格畸变能越高,晶 格越不稳定,当畸变能高到一定程度,溶质原 子将不再溶入固溶体,只能形成新的相。
溶剂与溶质原子的尺寸差别可用Δr 衡量: Δr =(r溶剂 - r溶质)/ r溶剂
Δr越大,固溶度越小。
置 换 固 溶 体
Z
置换固溶体与间隙固溶体
间
隙
固
溶
Z
体
置换原子
间隙原子
Y
X
Y
• 按固溶度分类 (1)有限固溶体——溶质原子在固溶体中的浓度 有一定限度(极限浓度),超过这个限度就不再 溶解了,这个限度称为溶解度或固溶度。
(2)无限固溶体——溶质原子可以以任意比例溶 入溶剂,固溶度可达到100%。
电子浓度: 价电子数目与原子数目之比。 现象:溶质元素的原子价越高,溶解度越小。 原因:固溶体中的电子浓度存在极限值,超过极限 值,固溶体就不稳定,形成另外的新相。 不同晶体结构的极限电子浓度不同:
F.C.C:1.36,B.C.C: 1.48 。
(4)晶体结构
溶质与溶剂的晶体结构相同,溶解度较大。 形成无限固溶体的必要条件:溶质的晶体结构与 溶剂的晶体结构一定相同(如Cu-Ni合金等)。 例Fe合金: Ni、Co、Cr、V与Fe原子尺寸差别<8%, Ni、Co与Fe形成面心立方晶格无限固溶体, Cr、V与Fe形成体心立方晶格无限固溶体。
合金系——由给定的组元以不同的比例配制成 的一系列成分不同的合金系统。 例:Fe-C: 90%Fe-10%C、 80%Fe-20%C、
50%Fe-50%C、 20%Fe-80%C 根据组元数,合金可分为:
二元合金、三元合金、 多元合金。
不同的组元之间由于物理化学的相互作用,形成具有一 定晶体结构、化学成分的新的物质—相。 合金中的相 —— 指合金中结构相同,成分和性能均一, 并有界面与其他部分分开的均匀组成部分(phase)。
Pb-Sn合金, 钢(Fe-C合金), 锡青铜(Cu-Sn(<14%)合金)。
合金的强度、硬度、耐磨性等机械性能比纯金属高;某些合 金还具有特殊的电、磁、光、热等物理和化学性能,因此合 金比纯金属应用广泛得多。
组元——组成合金最基本的、独立的物质。 组元可以是金属、非金属元素或稳定化合物。 例如:在Fe-C合金中,Fe、C均为组元。
有序固溶体特点:溶质原子可形成自己的亚点阵。 一定条件下固溶体可以在有序和无序间相互转化。
例:室温下, 当Fe-Al合金成分变化时: a. Fe-Al (<25%atm)合金——无序相:α相; b. Fe-Al (25%~35%atm)合金——有序相:Fe3Al; c. Fe-Al(35%~50%atm)合金——有序相:FeAl。
第三章 二元合金的相结构与相图
本章目的 1、讨论合金中的相概念及其类型; 2、介绍不同类型的二元相图; 3、分析相图与合金性能之间的关系。
本章要求 1、相、组织、相组成、组织组成; 2、固溶体和金属化合物; 3、掌握分析相图的基本方法; 4、正确运用杠杆定律。
3.1 合金的相结构
合金的概念: 一种金属元素与另一种或几种其它元素,经熔炼或其它方法 结合而成的具有金属特性(结合键主要是金属键)的物质。
三、金属化合物
金属化合物的晶格类型和特性不同于任一组元。
1、正常价化合物 —— 按化合价规律形成,成分固定不变 ,正常价化合物具有严格的化合比,可用化学式表示。如 Mg2Si、Mg2Sn、MgS、MnS等。这类化合物具有较高的硬度, 脆性较大,常作为有色金属的强化相。
2、电子化合物 —— 不遵守化合价规律,而是按一定电子浓 度的比值形成的化合物。电子浓度不同,化合物的晶格类型 也不同。这类化合物硬而脆,虽用化学式表示,但成分可变, 如Cu3Al。
间隙化合物
结构:复杂的晶体结构。 性能:很高的熔点和硬 度,但不如间隙相高。 如钢中的 Fe3C、Cr23C6、 Fe3W3C等。 用途:碳钢、合金钢中 重要的强化相。
3.2 二元合金相图的建立
相——指合金中结构相同,成分和性能均一, 并有界面与其他部分分开的均匀组成部分。
给定的合金系究竟以什么状态(相)存在,包 含哪些相,这是由内因和外因共同决定的。外 因有温度和压力,内因则是化学成分。相图用 于表示它们之间的关系。
二元合金的结晶 L L+S S
热分析法得到的冷却曲线
相图的建立
温 度
温 度
时间 A 90 70 50 30 B
温
度
L
a c
L
+
S d
S
A
acb : 液相线
adb : 固相线
L : 液相区
S : 固相区 b
L+S:液、固两 B 相共存区
三、相律(又称为Gibbs相律)
• 吉布斯(Jsoiah Willard Gibbs,1839-1903年),是 美国著名数学物理学家、数学化学家。在1875-1878 年间,他先后分两部分在康涅狄格(州)科学院学报 (Trans. Conn. Acad. Sci.)上发表 《关于多相物质 的平衡》的文章,共计约400页,700多个公式。吉布 斯的“相律”对于多相体系是“放置四海而皆准”的 具有高度概括性的普适规律。它的重要意义在于推动 了化学热力学及整个物理化学的发展,也成为相关领 域,诸如冶金学和地质学等重要的理论工具。
由于晶体中的间隙是有限的,所以间隙固溶体 必定是有限固溶体,无限固溶体一定是置换固 溶体。
当然并不是所有有限固溶体都是间隙固溶体, 也并不是所有置换固溶体都是无限固溶体。
• 按溶质原子在固溶体中分布是否有规律分类
(1)无序固溶体 ——溶质原子随机地分布于溶 剂的晶格中,看不出次序或规律性。
(2)有序固溶体 ——溶质原子按适当比例、 按一定的规律分布于溶剂的晶格中,可以是置换 式有序固溶体,也可以是间隙式有序固溶体。
固溶强化
正常晶格
晶格畸变
固溶强化的特点:
•(1)溶质与溶剂原子尺寸相差越大,溶质原子 浓度越高,引起的晶格畸变越大,固溶强化效果 越大。
•(2)间隙原子的强化效果一般比置换原子的大。 因为间隙原子引起的点阵畸变较大。
•(3)综合机械性能好。适当控制溶质含量,不 仅可以显著提高材料的强度、硬度,而且材料的 塑性、韧性不会明显降低。
3、间隙相与间隙化合物
过渡族金属M可与非金属元素H,B,C,N等原 子半径很小的非金属元素形成化合物。
rx/rm< 0.59
形成具有简单晶体结构 (fcc、bcc、hcp)的化 合物称为间隙相。
rx/rm>0.59
形成化合物结构复杂, 通常称为间隙化合物或 复杂间隙相。
间隙相
结构:简单的晶体结构,如面 心立方、体心立方等。 性能:极高的熔点和硬度,具 有明显的金属特性,可提高钢 的强度、热强性、红硬性和耐 磨性。如:VC; TiC; W2C等。 用途:硬质合金和高硬度工具、 模具的重要组织组成。
4、固溶体的结构特点
•晶格发生畸变
•偏聚与(短程)有序 •有序化(长程有序)
5、固溶强化
固溶体中随着溶质原子的加入,强度、硬度升高, 塑性、韧性降低的现象——固溶强化。
——金属材料的主要强化手段或途径之一。
例如:南京长江大桥采用廉价的16Mn,其中 含1.2%~1.6%Mn,抗拉强度较相同碳含量的 普通碳素钢提高60%。
当成分固定,温度变化时: Fe3Al: < 550℃:完全有序;
550℃ ~ 950℃:部分有序; > 950℃:完全无序固溶体。都能形成置换固溶体, 但固溶度往往相差很大。 如在Cu中: Ni可以无限互溶,
Zn最大溶解度为39%, Pb几乎不溶解于铜。 固溶度影响因素:主要有原子尺寸、电负性、 电子浓度和晶体结构等。
(2)电负性
负电性: 元素的原子获得或吸引电子的相对 倾向。获得电子,原子变为负离子。
┗ 可衡量元素间的化学亲和力,即形成 化合物的倾向性。
——取决于两元素在周期表中的位置。两元 素相距越远,电负性相差越大,越易形成化 合物。
—— 元素间电负性相差越小,越易形成固 溶体,而且固溶体的固溶度越大。
(3)电子浓度——原子价
• 相律表示在平衡条件下,系统的自由度数、组元 数和相数之间的关系。
• 相律数学表达式为:F = C - P + 2 系 系平 统 统衡 自 组相 由 元数 度数
当系统压力为常数,即恒压条件下,相律数学表 达式为:F = C - P +1。
平衡
一定条件下,合金系参与相变过程的各相成分与相对质量不再 变化所达到的一种状态。平衡不是静止不变的过程,而是一种 动态的平衡,这时合金系是稳定的,各相成分与相对质量不随 时间发生变化。
