2010年高考分类考点3 氧化还原反应
高考化学专题复习氧化还原反应

氧化还原反应专题复习一、氧化还原反应的基本概念1.氧化还原反应(1)概念:氧化还原反应是指有电子转移(电子得失或共用电子对的偏移)的反应(2)特征:反应过程中元素化合价发生变化2.氧化还原反应的基本架构3.相关概念二、氧化还原反应分析抓住概念、正确分析元素化合价的变化是其关键1.氧化剂、还原剂及其产物的分析[讨论]1.在5NH4NO32HNO3+N2↑+9H2O中,被氧化的氮原子与被还原的氮原子的物质的量之比为()A.3:5B.5:5C.5:3D.5:82.单质X和Y相互反应生成X2+、Y2-,现有下列叙述:①X被氧化、②X是氧化剂、③X具有氧化性、④Y2-是还原产物、⑤Y2- 具还原性、⑥X2+具氧化性、⑦Y的氧化性比X2+的氧化性强。
其中正确的是()A.①②③④B.①④⑤⑥⑦C.②③④D.①③④⑤2.电子得失的分析及其守恒原理的应用一般有两种方法分析:单线桥法和双线桥法。
[讨论]1.在一定条件下,锌与稀硝酸以5:12的物质的量之比反应,则该反应的还原产物是()A.N2B.N2OC.NOD.NO22.在化学反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4发生时,1molCu2+能氧化P的物质的量是()A.1/5molB.11/5molC.2/5molD.1/3mol三、氧化剂、还原剂1.氧化性、还原性的判断(1)根据具体反应来判断:同种物质的不同元素(离子)具有不同的氧化性或还原性如:HCl与活泼金属、MnO2(2)根据元素化合价判断:同一元素的不同价态具有不同的氧化性或还原性:(3)氧化性、还原性的相对性一种具体的物质在与不同的物质反应时会表现出不同的氧化、还原性。
如:SO2与H2S、Cl22.氧化性、还原性强弱的判断(1)利用周期表判断(2)利用金属活动顺序判断(3)根据具体反应来判断(4)根据电化学原理来判断:原电池的正负极、电解放电顺序等(5)一般同种元素的离子氧化性;高价离子>低价离子[讨论]1.常温下,下列反应都能向右进行:2W+X2=2X-+W2,2Y-+W2=2W-+Y2,2X-+Z2=2Z-+Y2由此得出的正确结论是()A.X-、Y-、Z-、W-中的Z-的还原性最强B.X2、Y2、Z2、W2中Z2的氧化性最弱C.2Z-+Y2=2Y-+Z2不能向右进行D.还原性X->Y-2.用X、Y、Z三种金属组成的合金暴露在潮湿的空气中,经一段时间后,合金的表面只有Y的化合物出现。
高考化学专题复习之氧化还原反应知识点总结
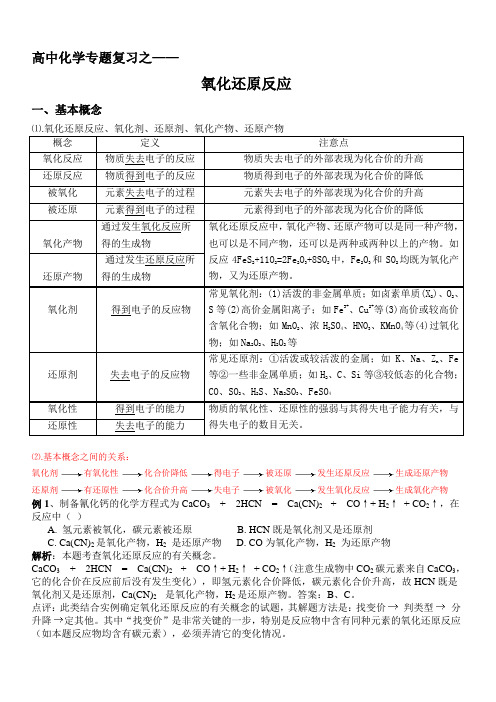
高中化学专题复习之——氧化还原反应一、基本概念⑴.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力⑵.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物例1、制备氰化钙的化学方程式为CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑,在反应中()A. 氢元素被氧化,碳元素被还原B. HCN既是氧化剂又是还原剂C. Ca(CN)2是氧化产物,H2是还原产物D. CO为氧化产物,H2为还原产物解析:本题考查氧化还原反应的有关概念。
CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑(注意生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。
2010年高考化学试题分类汇编——电化学基础

A 正极反应为:Zn—2e-=Zn2+
B电池反应为:Zn+Cu2+=Zn2+ +CU
C 在外电路中,电子从负极流向正极
D 盐桥中的K+移向ZnSO4溶液
解析:Zn是负极,故A错;
电池总反应和没有形成原电池的氧化还原反应相同,故B正确;
(2010江苏卷)11.右图是一种航天器能量储存系统原理示意图。
下列说法正确的是
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
②阳极是Al发生氧化反应,要生成氧化膜还必须有H2O参加,故电极反应式为:2Al+3H2O-6e - Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解。
(2)电镀时,阳极Cu可以发生氧化反应生成Cu2+。
(3)铁被保护,可以是做原电池的负极,或者电解池的阴极,故若X为碳棒,开关K应置于N处,Fe做阴极受到保护;若X为锌,开关K置于M处,铁是做负极,称为牺牲阳极保护法。
C. 负极的电极反应式为Al-3e-=Al3+
D. 充电时,阴极发生的电极反应式为:
试题解析:
本题涵盖电解池与原电池的主体内容,涉及电极判断与电极反应式书写等问题。根据给出的正极得电子的反应,原电池的电极材料Li-Al/FeS可以判断放电时(原电池)负极的电极反应式为Al-3e-=Al3+。A、Li和Al分别是两极材料。B、应有Al的参加。D、应当是阳极失电子反应。
高考氧化还原反应考点汇总(下)

【例1】进行实验。甲:B中大量白色沉淀;乙:B中少量白色沉淀。检验白 色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同 的原因: ___________________________________________________________ ___________________________________________________________。 (5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产 生白色沉淀,由此得出的结论是 __________________________________________________。
Na 性质:还原性 38. 碱金属+H2O 39. Na+CuSO4溶液 40 Na+O 40. N +O2→NaO N O 41 Na+O 41. N +O2→Na N 2O2 09北京选择12 推断题 活泼金属与水反应
13全国II选择10 钠与溶液的反应 12北京选择7 12北京选择7 N 的缓慢氧化 Na Na的剧烈氧化
【例4】 (3)震荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过 量,能观察到的现象是 __________________________________; W的单质与氢氟酸反应生成两 种无色气体,该反应的化学方程式是__________________。
(1)W位于元素周期表第 素 期表第 周期第 期第 族 W的原子半径比 族; 的 半 X的 (填“大”或“小”)。 (2)Z的第一电离能比 的第 电离能比W的 (填“大”或“小”); (填 大 或 小 ); XY2由固态变 为气态所需克服的微粒间作用力是 ;氢元素、X 、Y 的原 子 共同形成多种分子,写 其中 种 形成同种分子间 键 子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名 质 称 。
高考真题分析(氧化还原反应)

专题3 氧化还原反应1.(2011·全国II 卷)某含铬Cr2O72- 废水用硫亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。
该沉淀干燥后得到n molFeO·FeyCrx O3 。
不考虑处理过程中的实际损耗,下列叙述错误的是A .消耗硫酸亚铁铵的物质量为n(2-x)molB .处理废水中Cr2O72- 的物质量为nx 2mol C .反应中发生转移的电子数为3nx molD .在FeO·FeyCrx O3中3x=y2.(2011·上海卷)氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。
下列反应与Br2+SO2+2H2O=H2SO4+2HBr 相比较,水的作用不相同的是A .2Na2O2+2H2O=4NaOH+O2↑B .4Fe(OH)2+O2+2H2O=4Fe(OH)3C.2F2+2H2O=4HF+O2D .2Al+2NaOH+2H2O=2NaAlO2+3H2↑3.(2011·江苏卷)NaCl 是一种化工原料,可以制备一系列物质(如图)。
下列说法正确的是A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应D.如图所示转化反应都是氧化还原反应4.(2011·上海卷)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S 气体。
若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 _________________ 。
(2)上述反应中的氧化剂是 __________,反应产生的气体可用吸收_______。
高考化学考前专题3 氧化还原反应复习课件

MnO
-
4
>
Fe3+
>
Cu2+。
(3)①碱式滴定管(乙)下端有一段橡胶管,能被酸性高锰酸钾
溶液氧化,因此应该使用酸式滴定管(甲)装酸性高锰酸钾溶
液。终点时,溶液的颜色变为紫色或紫红色。②n(KMnO4) =0.100 mol·L-1×0.100 L=0.010 mol。根据关系式 Cu2O~ 2Fe3+~2Fe2+~2/5KMnO4,可得 n(Cu2O)=0.010 mol×5/2= 2.5×10-2 mol,而 m(Cu2O)=2.5×10-2 mol×144 g·mol-1= 3.6 g,w(Cu2O)=3.6 g/5 g×100%=72%。
命题猜想 2 向盛有 KI 溶液的试管中加入少许 CCl4 后滴加 氯水,振荡,静置,CCl4 层变成紫色。如果继续向试管中 滴加氯水,振荡,CCl4 层会逐渐变浅,最后变成无色,生 成物之一为 HIO3。则有关该过程的说法不正确的是( ) A.CCl4 层由紫色变成无色的化学反应方程式为 I2+5Cl2 +6H2O===2HIO3+10HCl B.整个过程中每生成 1 mol HIO3 共转移 6NA 个电子 C.整个过程中的还原剂有 KI、I2 D.若把 KI 换成 KBr,则 CCl4 层变为橙红色,继续滴加 氯水,CCl4 层的颜色没有变化,则 Cl2、HIO3、HBrO3 的氧化性由强到弱的顺序是 Cl2>HBrO3>HIO3
H2===LiNH2+LiH,下列有关说法正确的是
()
A.Li2NH 中 N 被氧化
B.该反应中 H2 既是氧化剂又是还原剂
C.在标准状况下,11.2 L H2 参加反应,转移的电子为 1 mol
D.在反应中被氧化的元素原子与被还原的元素原子个数
高考综合化学复习——氧化还原反应

8、
Fe2O3
CO
CO2
Fe
CuSO4 Fe FeSO4 Cu
Cl2
Cl2 HClO HCl
Cl2
Zn ZnCl2 ZnCl2
01:50:12
9、2N2H4 + 2NO2 = 3N2 + 4H2O 1:2
01:50:12
10、
(1) MnO2 + 4HCl(浓)△= MnCl2 + Cl2↑+2H2O (2)2KMnO4 +16HCl (浓) = 2KCl+ 2MnCl2 + 5Cl2↑+8H2O
高考综合化学复习(1)——氧化还原反应 二、考点点击
例3:
①中氧化产物:Fe(NO3)2 还原产物:Cu ②中氧化产物:Cu(NO3)2 还原产物:Ag 还原性最强:Fe 氧化性最强:AgNO3
例4: ( B ) 得失电子的难易程度 得失电子的多少
3、 I-
01:50:12
三、课后训练 1(B ) 2(D ) 3(B ) 4(D ) 5(A ) 6(A )
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
得到2e- ,化合价降低,被还原
相等 相等
01:50:12
高考综合化学复习(1)——氧化还原反应 二、考点点击
例1:
有氧化性:H+ HNO3 S 有还原性:Cl- Zn Cu
FeCl3 S
例2: ( B )
01:50:12
高考综合化学复习(1)——氧化还原反应 二、考点点击
2、氧化性、还原性强Leabharlann 判断(1)、 强 (2)、 弱
2010高考化学必考要点难点详解---氧化还原反应

【考点4】氧化还原反应1.(07年山东理综·15)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。
若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为()提示:①H2C2O4是二元弱酸②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2OA.0.008889 B.0.08000 C.0.1200 D.0.24002.(07年广东化学·5)氯气是一种重要的工业原料。
工业上利用反应在3Cl2+2NH3=N2+6HCl 检查氯气管道是否漏气。
下列说法错误..的是()A.若管道漏气遇氨就会产生白烟B.该反应利用了Cl2的强氧化性C.该反应属于复分解反应D.生成1molN2有6mol电子转移3.(08年广东理基·33)氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子陶瓷等工业领域。
在一定条件下,AlN可通过反应:Al2O3+N2+3C高温2AlN+3CO 合成。
下列叙述正确的是()A.上述反应中,N2是还原剂,Al2O3是氧化剂B.上述反应中,每生成1 mol AlN需转移3 m电子C.AlN中氮的化合价为+3D.AlN的摩尔质量为41 g4.(08年海南化学·4)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。
当生成1 mol硝酸锌时,被还原的硝酸的物质的量为()A.2 mol B.1 mol C.0.5 mol D.0.25 mol5.(09年福建理综·6)下列类型的反应,一定发生电子转移的是()A.化合反应B.分解反应C.置换反应D.复分解反应6.(09年广东化学·17)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+下列说法正确的是()A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱B.在H2O2分解过程中,溶液的pH逐渐下降C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变D.H2O2生产过程要严格避免混入Fe2+7.(09年广东理基·25)钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点3 氧化还原反应
1.(2010·安徽高考·T7·6分)亚氨基锂(Li 2NH )是一种储氢容量高、安全 性好的固体储氢材料,其储氢原理可表示为:Li 2NH+H 2LiNH 2+LiH ,下列有
关说法正确的是
A. Li 2NH 中N 的化合价是1-
B.该反应中H 2既是氧化剂又是还原剂
C.+Li 和H -的离子半径相等
D.此法储氢和钢瓶储氢的原理相同 【命题立意】本题考查了氧化还原反应的有关概念、离子半径大小的比较等。
【思路点拨】正确地写出元素化合价的变化,是分析氧化还原反应的关键。
【规范解答】选B 。
A 项,Li 2NH 中氮的化合价为-3价,A 错;C 项,Li +的半径小于H -的半径,C 错;D 项,钢瓶储氢是物理过程,而该方法为化学方法,D 错。
【类题拓展】几个特殊氧化还原反应中元素化合价标法及电子转移数目的计算: 1.在Cl 2+H 2O=HClO+HCl 中,Cl 2既是氧化剂又是还原剂(0+1
2
Cl
Cl →、0
-1
2
Cl
Cl →)
,在标准状况下,22.4L 氯气参加反应时,电子转移数N A ;类似情况的还有 Cl 2+2NaOH=NaCl+NaClO+H 2O 。
2.在2Na 2O 2+2H 2O===4NaOH+O 2↑中,Na 2O 2既是氧化剂又是还原剂(-1
-2
2
2Na O O →、-1
222Na O O →)
,当有7.8g Na 2O 2参加反应时,电子转移数目为0.1 N A 。
要正确求算
反应中电子数目问题,需标反应中氧化剂、还原剂与还原产物、氧化产物之间元素化合价的变化,只计算得到或失去电子数目即可,因氧化还原反应中得失电子总数相同,不要将得失电子数加起来。
3.6HCl+KClO 3====KCl+3Cl 2↑+3H 2O 中,HCl 中氯元素的化合价为-1价,KClO 3中氯元素的化合价为+5价,它们发生归中反应生成了Cl 2。
4.H2SO4(浓)+H2S====S↓+SO2↑+2H2O中,浓硫中硫元素的化合价为+6价,硫化氢中硫元素的化合价为-2价;发生氧化还原反应时,由+6价的硫变成了+4价的硫,由-2价硫的变成了0价的硫,化合价不能交叉。
2.(双选)(2010·海南高考·T7·4分)下列物质中既有氧化性又有还原性的是A.HclO
B.Al2O3
C.N2O3
D.SiO2
【命题立意】本题从理论的角度考查元素化合价与物质氧化性、还原性的关系。
【思路点拨】熟记化合价与物质氧化性、还原性的关系口诀:
高价氧化低价还原,中间价态两俱全。
【规范解答】选A、C。
HClO中Cl为+1价,N2O3中N为+3价,均处于中间价态(氯元素的化合价还有0、﹣1、+3、+5、+7,氮元素的化合价还有﹣3、0、+1、+2、+4、+5),既能失去电子化合价升高,也可得到电子化合价降低,故既有氧化性又有还原性,A、C 正确;Al2O3中Al为+3价,SiO2中Si为+4价,均是最高价,不能再失去电子表现还原性,只能得到电子,表现氧化性,B、D错误。
【类题拓展】物质氧化性、还原性的判断
物质氧化性、还原性除与中心元素原子的化合价有关,还与其他元素原子有关,如HCl,氢元素处于最高价,只有氧化性,氯元素处于最低价,只有还原性,所以HCl既有氧化性又有还原性。
