第4章 环烃
合集下载
第4章环烃

注:3、环丙烷和环丁烷不被高锰酸钾氧化。
KMnO4
不反应
例:
KMnO4 CH CH2
COOH HCOOH CO 2 H2O
这一反应可用于鉴别环丙烷和C=C或C≡C的化合物 4、环烯烃有不饱和键的通性。
思考题: 1、完成下列反应式:
1、
CH CH2 Br 2
高温
2、 CH3 C CH2 KMnO4 ,H
三元环 四元环
五元环
六元环
(二)环己烷及其衍生物的构象 1、环己烷构象
船式构象
椅式构象
2
3
4
e
1
6 5
a
a
e
1
3 2
6
54
解释:1、a键为直立键或竖键;e键为平伏键或横键; 2、在室温条件下,一种椅式构象可以转变成另 一种椅式构象。在相互转变中,原来的a键变 成了e键,而原来的 e键变成了a键。
O
R-C-Cl
AlCl3
O
R-C + + AlCl4-
七、苯环上取代基的定位规律
(一)一取代苯的定位效应
当苯环已有一个取代基再进行亲电取代反应
时,新引进的取代基可以进入原有取代基的邻间
和对位,生成三种异构体。
Z
Z
Z
Z
HNO3
NO2
H2SO4
+
+
NO2 NO2
问题:已有的取代基,对新进入的取代基的定位作 用以哪一种为主,即以哪一种异构体为主?
(二)芳香性的特性 (1)化学性质上:虽然是一种高度不饱和烃, 但其性质与烯烃和炔烃不同,苯环较难进行加 成和氧化,而较易进行取代反应;具有异常的 稳定性,表现出低的氢化热和燃烧热。 (2)结构上:闭环的共轭体系(共平面); π电子符合4n+2(n=0,1,2,3…)休克尔 规则。
第4章环烃

环戊烷以信封状构象存 在,为非平面结构,其 中有四个碳原子在同一 平面,另一个碳原子在 这个平面之外; C-C-C 夹角为108°,与正常轨 道夹角的差距为1.5°, 角张力小于环丙烷和环 丁烷,角张力甚微,是 比较稳定的环。
三.环己烷的结构
1.环己烷分子结构:在两种极端构象——椅式和船式
中,碳碳键之间的夹角为109.5°,环很稳定。
平伏键(e键)与直立键(a键)的转换
在室温时,环己烷的椅式构象可通过C-C键的转动,由一种 椅式构象变为另一种椅式构象,则原来的a键变成了e键,而 原来的e键变成了a键。当六个碳原子上连的都是氢时,两种 构象是同一构象。连有不同基团时,则构象不同。
4.取代环己烷分子的构象
A.一元取代环己烷的构象
Br
+ Br2
FeBr3 55~60℃
+ HBr
59~65% (主)
反应历程
2Fe + 3Br2 Br2 + FeBr3 H
2 FeBr3
路易斯酸,接受电子
Br+ + FeBr4 H
Br (或
)
+ Br+
+
+
Br
H
+
+ FeBr4﹣ Br
Br + HBr + FeBr3
2. 硝化反应
反应条件
丙烷中两个SP3轨道的夹角是上述两种作用的平 衡位置105.5 o。
电子云偏向环 平面外侧,容 易受亲电试剂 进攻,故似烯 烃进行加成反 应。
弯曲键(香蕉键)
CH
3
CH2 109 28′
。
CH3
影响脂环烃稳定性因素之一
有机化学-第四章 环烃
环戊烷分子中,碳碳键的夹角为108°,接近sp3杂化轨 道间夹角,角张力很小,是比较稳定的环。
环己烷分子中6个碳原子不在同一平面上,碳原子之间的 键角为109°28′,分子中没有张力。
大环原子在不同的平面内,键角接近正常的键角,为
无张力环。
环三十烷
三、环己烷的构象
1 椅式构象和船式构象
六个碳原子均为sp3杂化,在保持键角109°28′不变的情况
H2SO4
NO2 NO2
甲苯硝化比苯容易,主要产物为邻位和对位取代产物。
CH3
HNO3 , H2SO4 30℃
CH3 NO2 +
CH3
NO2
(3) 磺化反应 苯与浓硫酸加热,或与发烟硫酸在室温下作用,生 成苯磺酸。苯磺酸也是强酸,酸性与硫酸接近。
浓 H2SO4 , 80℃ or H2SO4(SO3) , 室温
2 直立键和平伏键
椅式构象中的碳氢键可以分为两类,6个碳氢键与分
子的对称轴平行,叫做直立键或a键。
另外6个碳氢键指向环外,与直立键成109°28′的角, 平伏着向环外伸展,叫做平伏键或e键。
一个椅式构象的环己烷,可以通过碳碳单键的旋转变成 另一种椅式构象,叫做转环作用。
X
X
当环己烷上的氢原子被其它基团取代后,由于其它基团 都比氢原子大,所以取代基以e键和环相连占优势。
环己烷以上的环烷烃则很难发生加氢反应。
2 与溴的作用
环丙烷在室温下可以和溴进行亲电加成反应,生成开
链化合物。环丁烷要在加热条件下才能和溴加成。
+ Br2
BrCH2CH2CH2Br
1,3-二溴丙烷
+ Br2
Δ
BrCH2CH2CH2CH2Br
第四章 环烃

比如: 烷基-CH3,羟基-OH,烷氧基-OCH3, 氨基-NH2等,由于C,
O,N的电负性大于H,O的电负性大于C,所以都是给电子的; 如果A的电负性小于B,那么它就是吸电子的。 比如:硝基-NO2,羧基-COOH,醛基-CHO,都是吸电子的。
电负性:F>O>Cl>N>S>C>H
试判断下列化合物发生亲电取代,试剂进入苯环的位置。
e键:平伏键(横键) (equatorial bonds)
• a键转变成e键,e键转变成a键;
• 环上原子或基团的空间关系保持,即键的取向不变。
2) 船式构象
H H
6
183pm
5 4
H H
3
H H
1
H
H
H
6 5 3 1
H H H H HH
• 存在: 非键连作用; 扭转张力;
4
H H
H
2
2
H
H
稳定性:椅式构象环己烷 > 船式构象环己烷 室温下,平衡有利于椅式构象(优势构象)。 2. 取代环己烷的构象 1) 一取代环己烷的构象
六. 苯环上取代基的定位效应 1. 单取代苯的定位效应
苯环上已有基团对第二个取代基进入位置产生制约作用
1) 邻对位定位基 (使第二个取代基主要进入它的邻对位)
致活的邻对位定位基(除X外).X为致钝的邻对位定位基. 2) 间位定位基(使第二个取代基主要进入它的间位)
致钝的间位定位基。
若基团以:-AB 表示 如果A的电负性大于B,那么它就是给电子的。
3) 顺、反环烷烃 受环的限制,σ 键不能自由旋转。环上取代基在空间的 排列方式不同,产生顺反(几何)异构。
顺(cis):两个取代基在环同侧; 反(trans):两个取代基在环异侧。
第四章 环烃

O + O2 V2O5 4000 CH CH C O C O + CO2 + H2O
返回
2.2.3 亲电取代反应历程
以傅氏反应为例,亲电反应历程如下: 首先 酰基与ALCl3作用形成酰基正离子: O O
R-C- Cl + AlCl3
O H Slow C-R Quick
R-C
+
AlCl4
O C R
O + R-C
2.2.1 苯的结构及芳香性的概念
化学分析证明苯的分子式为C6H6,碳氢比为1, 和乙炔一样。因此苯是一个非常不饱和的化合物。 按以前烯炔的经验,不饱和烃应该容易与Br2 或 HX 起加成反应,但苯却不容易起这些加成反应, 烯、炔容易被KMnO4 氧化,但苯却不容易,表 现对氧化剂有一定的稳定性;另外,苯容易与一 些试剂起取代反应,其中的H 被-NO2、-SO4H、 -X所取代,而烯、炔在同样的条件下是不起反应 和。苯环这些不容易起加成,不容易被氧化而容 易发生取代反应的特殊性质就叫苯的化学方面的 芳香性。
环烷烃
环烯烃
环炔烃
下面我们先讲异构 现象和命名的内容。
返回
1.1 异构现象和命名 环烷烃和烯烃具有相同的通式CnH2n。因此它们互 为异构,如环丙烷和丙烯,这是官能团异构。同样的环 烯烃具有和炔烃相同的通式。脂环烃的异构现象更加复 杂,如C6H12的环烃至少有下面几种异构体:
如果环上有两个以上的取代基时,如:
第四章 环烃
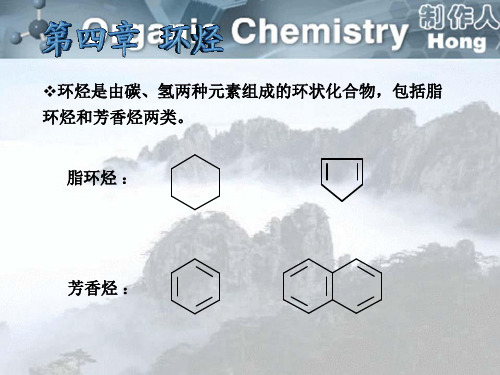
环烃是指分子中的碳架形成环状的碳 氢化合物。根据结构和性质我们把环烃分 成脂环烃和芳香烃两大类。
1. 2.
脂环烃 芳香烃
1.
脂环烃
1.1
异构现象和命名 1.2 环烷烃的结构 1.3 环烷烃的化学性质
第04章环烃

CH3
CH3 CH3 C CH CH3
H2O
OSO3H
CH3 CH3
CH3 C CH CH3 OH
加成产物符合马式规则
氧化反应
环丙烷对氧化剂稳定,不被高猛酸 钾、臭氧等氧化剂氧化。例如:
CH3 CH=C
CH3
KMnO4
COOH
CH3 C=O CH3
故可用高猛酸钾溶液来区别烯烃与 环丙烷衍生物。
环烃性质小结
X Y
X Y
CH3 CH3
1 O3 2 分解
OO CH3C-CCH3 + 2 OHC-CHO
CH3
CH3 1 O3 2 分解
OO 2CH3C-CH + OHC-CHO
二 苯现在的表达方式
价键式
分子轨道离域式
共振式
自旋偶合价键理论 (1986年Copper等提出)
二、苯分子结构的价键观点
现代物理方法(射线法、光谱法、偶
环丙烷的结构与张力学说
理论上: 1°饱和烃,C为sp3杂化,键角为109.5°
2° 三员环,成环碳原子应共平面,内角为60°
HH
H
60°
H
H
H
自相 矛盾
故三元环的结构特殊。
现代物理方法测定,环丙烷分子中: 键角 C-C-C = 105.5°; H-C-H =114°。
所以环丙烷分子中碳原子之间的sp3
对称轴
H
H
直立键
H
H
H H
H
H H
H H
H
平伏键
环己烷的直立键和平伏键
在室温时,环己烷的椅式构象可通过C-C键 的转动(而不经过碳碳键的断裂),由一种椅
式构象变为另一种椅式构象,在互相转变中, 原来的a键变成了e键,而原来的e键变成了a键
第四章 环 烃

CH2
强调:在室温时用 强调:在室温时用Br2-H2O或Br2-CCl4溶 或 不能将环丙烷及其衍生物与烯烃、 液不能将环丙烷及其衍生物与烯烃、炔烃 等区分开来。 等区分开来。
环丙烷对氧化剂较稳定,它不与KMnO4水溶液 环丙烷对氧化剂较稳定,它不与 或臭氧作用,故可用KMnO4溶液来区别环丙烷及其 溶液来区别环丙烷及其 或臭氧作用,故可用 衍生物和烯烃、炔烃等化合物 等化合物。 衍生物和烯烃、炔烃等化合物。
H3C CH3
顺-1,4-二甲基环己烷 , 二甲基环己烷
反-1,4-二甲基环己烷 , 二甲基环己烷
2. 螺环烃 脂环烃分子中两个碳环共有一个碳原子 脂环烃分子中两个碳环共有一个碳原子。
单螺环的命名:根据成环碳原子的总数称为螺某烷,在螺字后面的方括号 螺原子不计算在内) 将小 中,用阿拉伯数字标出两个碳环碳原子数目(螺原子不计算在内),将小 的数字排在前面, 隔开, 的数字排在前面,数字之间用下角圆点隔开,编号是从较小环中与螺原子相
第四章 环 烃
环烃是由碳 环烃是由碳和氢两种元素组成的环状化合物。根据它 是由 两种元素组成的环状化合物。 环状化合物 们的结构 性质,又可分为脂环烃 芳香烃。 结构或 脂环烃和 们的结构或性质,又可分为脂环烃和芳香烃。
§ 4~1 脂环烃
一、脂环烃的分类
碳原子的 饱和程度 饱和脂环烃 不饱和脂环烃 环炔烃 环烷烃 环烯烃
4.稠环烃 稠环烃
三、环烷的结构
说明: 说明:环烯烃 、环炔烃分子中的碳碳双键和碳碳 三键的电子结构与烯、炔烃相同, 三键的电子结构与烯、炔烃相同,故具有一般不 饱和键的通性。 饱和键的通性。
环烷烃的结构: 环烷中的碳原子为sp3杂化 环烷烃的结构: 环烷中的碳原子为 杂化。 杂化。
汪小兰有机化学第四版第四章-环烃

总目录
说明:
• 小环不稳定,虽然它们的分子中都没有不 饱和键, 但却能与氢气、卤素、卤化氢 等试剂发生c—c键断裂的开环加成反应。
• 随着环的增大,开环加成活性降低。
总目录
三、小环对氧化剂稳定
KMnO4/ H+
COOH
+
O
总目录
第三节 环烷烃的结构与稳定性
一、环丙烷的结构 1. 环张力的提出
(109.5°- 60°)/2 = 24.75°
总目录
2. 弯曲键的概念
总目录
C—C原子间不连成直线,而是弯曲重叠,比
σ 键弱,又有别于π 键,介于两者之间,更 接近π 键。
电子云分布在C—C外侧,易被亲电试剂进 攻,有一定的烯烃性质。
3. 燃烧热和非平面结构
燃烧热是指1 mol化合物完全燃烧生成二氧化碳和水时所放出的热 量。它反映了分子的内能大小。
三、定位效应的应用
第五节 多环芳烃
一、联苯
二、稠环芳烃
第六节 非苯系芳烃
一、芳香性的几个特征
二、休克尔规则
三、非苯芳烃
四、大环芳烃
40
第一节 苯的结构
一、苯的凯库勒式
H H
H H
简写:
符合实验事实:
H
① 满足C的四价性; ② 一种一元取代物;
③ 三种二元取代物。
H
不符合实验事实: ① 难与Br 加成; ② 一种邻二2 取代物。
•烃
氢化热 (kJ/mol) 离域能(kJ/mol)
离域能(共轭能)越大,共轭体系越稳定。
.
52
四、苯分子结构的共振论解释
1. 共振论的基本要点
(1)各种可能的经典结构——极限式; (2)共振符号(); (3)真实分子是各种极限式的共振杂化体; (4)各种极限式的贡献不同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
加压
(二)化学性质
亲电取代反应历程
E
H
E
+E+
慢
+
快
+ H+
正离子中间体 卤代反应历程
Br Br + FeBr3
H + Br+
慢
Br+ + FeBr4Br
快
Br
三、苯环亲电取代反应 的定位法则
(一)定位法则
定位法则:已有的基团对后进入基团进入 苯环的位置产生制约作用,这种制约作用 称为取代基的定位法则。
2.环戊烷
3.环已烷
二、脂环烃的稳定性
其它环烷烃结构
4.中级脂环烃(8-12C原子环)
C原子都不在同一平面内,分子内由于H原 子较拥挤,有较大的原子间斥力,因此体 系能量较高,稳定性比大环略差一些。
5.大环化合物都较稳定(12个C以上 的环)
经X-射线分析,分子呈皱折状,C原子间 的键角接近正常的正四面体键角,无张力。
凯库勒
建筑学与化学相结合的红娘 。
凯库勒早年曾入吉森大学学习建筑,原想成
为建筑师,受到建筑师的训练,具有一定的 形象思维能力,后在J.von李比希的影响下改
学化学 .他善于运用模型方法,把化合物的 性能与结构联系起来。1866年凯库勒首次满 意地写出了苯的结构式,指出芳香族化合物 的结构含有封闭的碳原子环,环中六个碳原 子是由单键与双键交替相连的,以保持碳原 子为四价。苯环结构的诞生。是有机化学发 展史上的一块里程碑。
2.加卤素
三员环与X2在常温下即可发生开环反应, 四员环与X2在常温下不发生开环反应,但 加热后反应可发生,环戊烷以上的环烷烃 很难与溴发生加成反应。
+ Br2
+ Br2ห้องสมุดไป่ตู้
室温
加热
CH2BrCH2CH2Br
CH2BrCH2CH2CH2Br
(二)化学性质
3.加卤化氢
环丙烷及其衍生物很容易与卤化氢发生加成反 应而开环,环戊烷以上的环烷烃很难与卤化氢 发生加成反应。 环丙烷的衍生物与卤化氢发生加成反应时应遵 守马氏规则,氢原子加在含氢较多的碳原子上。
6
一、分类、命名
3.螺环
两个环共用一个碳原子的环烃称为螺环烃。 共用的碳原子称螺碳原子。
一、分类、命名
3.螺环
螺〔各环所含碳原子数〕某烃.
一、分类、命名
3.螺环
编号:
从小环与螺原子相邻的碳原子开始,沿 小环编号,经过螺原子到大环。 可能情况下给取代基以尽量小的编号。
一、分类、命名
第二节 芳香烃
单环芳烃 联苯和联多苯环芳烃
芳 香 烃
多环芳烃
多苯代脂肪烃环芳烃
非苯芳烃
稠环芳烃
一、苯的结构、命名
(一)结构
1.凯库勒式
(1)式中含有三个双键,但不能起 烯烃的加成反应。 (2)二元取代物应有两种,实际上 只有一种。 (3)式中有单、双键,事实上所有 键长都相等。
一、苯的结构、命名
1,2-二甲苯
邻-二甲苯
1,3-二甲苯 间-二甲苯
CH3 1,4-二甲苯 对-二甲苯
一、苯的结构、命名
(3)三元取代物
若取代基相同,有三种异构体,可用“连、 偏、均”表示。
CH3
CH3
CH3
CH3 CH3
H3C
CH3
CH3
CH3
1,3,5-三甲苯 均-三甲苯
1,2,3-三甲苯 连-三甲苯
1,2,4-三甲苯 偏-三甲苯
+ HNO3
H2SO4
NO2
NO2
85~100 ℃
CH3
如果增加硝酸的 浓度,并提高反 应温度,则可得 到间二硝基苯
CH3 CH3
NO2 + NO2
甲苯比苯易硝化, 生成邻硝基甲苯和 对硝基甲苯
+ HNO3
H2SO4
(二)化学性质
(3)磺化反应
SO3H
+ H2SO4
75~85 ℃
+ H2 O
CH3
(2)环上有多个取代基时,用小数字标示小基 团,并使取代基位置之和最小。 (3)不饱和环烃,从不饱和键开始编号,并使 取代基有较小位次。
C2H5
CH3
CH3 CH3 CH3
CH(CH3)2
3-甲基环戊烯
2,5-二甲基-1,3-环己二烯
1-甲基-2-乙基-5-异丙基环己烷
一、分类、命名
2.桥环
两个环共用两个或两个以上碳原子的化合 物称桥环化合物。
桥头碳:共用的C; 桥:两个桥头碳间的碳链或键。
一、分类、命名
2.桥环
一、分类、命名
2.桥环
双环〔各桥所含碳原子数〕某烃
编号
从桥头碳开始,绕最长的桥到另一个桥头, 再绕次长桥回来,最后再编最短的桥。
可能的情况下给取代基以尽可能小编号
Fe + HBr
CH3 CH3 + Br CH2Cl Br
(1)卤代反应
甲苯发生卤代反 应较苯容易 生成 邻对位产物 光照或加热时, 优先取代与苯环 直接相连的碳上 的氢原子
Fe
CH3
+ Cl2
日光
+ HCl
(二)化学性质
(2)硝化反应
NO2
+ HNO3
H2SO4
50~60℃
NO2
+ H2O
一、苯的结构
第四章 环烃
学习目标
1.掌握脂环烃和苯的同系物的命名方 法。 2.掌握脂环烃和苯及其同系物的化学 性质,了解其物理性质。 3.熟悉亲电取代反应的定位效应和应 用,了解亲电取代反应的机理。 4.了解环烷烃的稳定性。 5.了解苯环碳原子的杂化方式、结构 特点和同分异构现象。 6.了解致癌芳香烃的结构。
母 体 为 二 环 [3 .2 .1 ] 辛 烷 b ic y c lo [ 3 .2 .1 ] o c t a n e
8 1 7 5 4 3 2
全 名 : 2 ,8 ,8 - 三 甲 基 二 环 [ 3 .2 .1 ] 辛 烷 2 ,8 ,8 - t r im e th y lb ic y c lo [ 3 .2 .1 ] o c t a n e
一、苯的结构、命名 二、苯及其同系物的 性质
(一)物理性质 (二)化学性质 1.亲电取代反应 2.加成反应 3.氧化反应
三、苯环亲电取代反 应的定位规律 (一)定位效应 (二)定位效应的 理论解释 (三)定位效应的 应用 四 稠环芳烃
(一)萘C10H8 (二)蒽C14H10 (三)菲C14H10
定位基:苯环上原有的取代基
根据取代基的性质,可分为:
邻对位定位基(ortho/para directors) 间位定位基(meta directors)
一、苯的结构、命名
(4)取代基为不 饱和基团时,以不 饱和烃当作母体, 把苯环作为取代基。 (6)芳基
CH=CH2
苯乙烯
CH2-
苯甲基或苄基
苯基
一、苯的结构、命名
(7)对于芳烃衍生物:
按官能团优先次序
一、苯的结构、命名
例:
CH3
NO2
硝基苯 氯苯
Cl
NO2 间硝基甲苯
NH2
OH
SO3H
有机化学
“十二五”职业教育国家规划教材
主编
潘华英
化学工业出版社
目 录
第一章 绪论 第二章 烷烃 第三章 不饱和烃
第十章 立体化学基础 第十一章 含氮化合物 第十二章 杂环化合物和生物碱 第十三章 糖类 第十四章 氨基酸和蛋白质
第四章 环烃
第五章 卤代烃 第六章 醇、酚、醚 第七章 醛、酮、醌 第八章 羧酸、羟基酸和酮酸 第九章 羧酸衍生物
一、苯的结构、命名
2.苯分子结构的近代观点
六个碳原子和六个氢原子都在同一平面 上 六个碳原子组成一个正六边形 碳碳键长完全相等(0.140nm) 碳原子都是sp2杂化 所有键角都是120º
一、苯的结构、命名
苯分子大Л键的形成及电子云分布
H H
H
H
H
H
苯分子电子云分布
苯分子大Л键的形成 苯分子结构
CH3 3
KMnO KMnO 4 4
COOH
CH33
KMnO KMnO 4 4
COOH
C2 2H 5 5
COOH
(二)化学性质
2.氧化反应
氧化时,不论侧链是甲基或是其它烷 基,最后都被氧化成为羧基,生成苯 甲酸。
CH(CH3)2
KMnO KMnO 4 4
COOH
(三)加成反应
+ 3H2
催化剂
1800
二、脂环烃的稳定性
环丙烷三个碳原子共平面,相邻的两 个C上C-H键处于重叠式,能量高。
H2 C
H
114°
H
C
H 2C
CH2
1 0 5 .5 °
H 2C
CH2
