3-6金属氧化物解析
3-6金属氧化物详解

催化中重要的是非化学计量的N、P型半导体两大类!
非化学计量的氧化物定义:偏离正常分子式的化学计量 比组成. 差别一般<1% 非化学计量的成因:晶体和气相分子的相互作用, 由于金 属离子不足或非金属离子不足造成了晶体的非化学计量
例如:氧化物与气相中的氧的相互作用
当金属氧化物是:非化学计量,或引入杂质 产生 杂质能级(禁带)
MoO3-Bi2O3-Fe2O3 -CoO-K2O-P2O5-SiO2(丙烯腈催化
6
剂)
结构复杂:
组分与组分之间可能相互作用,作用的情况因条件不同而异;
复合氧化物(固熔体,杂多酸,混晶等);
常多相共存,有所谓的活性相概念
例如:Bi2O3-MoO3,就有α-,β-,γ-相,
催化作用与功能
禁带 EF △E
EC EV MgO 禁带较宽 △E > 5 eV
不能使满带电子激发到空带中
半导体
半导体的禁带很窄(0.2~3ev),
在绝对零度时,电子不发生跃迁,与绝缘体相似;
但当温度升高或接受光照时,部分电子从满带激发到空 带上去,空带变成导带, 而满带则因电子移去而留下空穴,在外加电场作用下能 够导电,故称半导体。
在受主能级上有空穴存在。 很容易接受满带中的跃迁的电子,使满带产生正电空穴关 进行空穴导电。又称空穴型半导体
例如单晶Si、单晶Ge、PbS等。
25
本征半导体能带结构
• 晶体中既无施主也无受主,具有电子和空穴两种载流子,其 准自由电子和准自由空穴是在外电场作用下,电子从价带迁
移到导带中产生。
本征半导体在催化领域并不重要,因为化学变化过
程的温度,一般在 300~700 ℃ ,不足以产生电子从 其价带到空带的跃迁。
专题06 金属及其化合物(讲)(学生版)

8.Na-K合金常温下呈液态,是原子反应堆的导热剂。
9.铝是活泼金属,但铝抗腐蚀性相当强,因为铝表面生成一层致密的氧化物薄膜。由于Al2O3的熔点高于Al的熔点,故在酒精灯上加热铝箔直至熔化,发现熔化的铝并不滴落。
10.铝热反应不仅仅是单质铝与Fe2O3反应,还包含制取其他难熔金属的反应,由于铝热剂是混合物,故铝热反应不能用于工业上冶炼铁。注意铝热反应是中学化学中唯一一类金属单质与金属氧化物在高温条件下的置换反应。
11.并不是Al与所有金属氧化物均能组成铝热剂,该金属氧化物对应的金属活泼性应比铝弱。
12.Al2O3、Al(OH)3与NaOH溶液的反应常用于物质的分离提纯。Al(OH)3不溶于氨水,所以实验室常用铝盐和氨水来制备Al(OH)3。
核心素养
宏观辨识与微观探析科学态度与社会责任
高频考点一金属单质的性质
1.常见金属的主要性质
(1)钠及其化合物
①等物质的量的金属钠被氧化成Na2O和Na2O2时转移的电子数相同。
②钠与酸反应时,先与酸反应,酸不足再与水反应。
③钠与盐的溶液反应:钠不能置换出溶液中的金属,钠直接与水反应,反应后的碱再与溶液中的其他物质反应。
和水的反应
与冷水剧
烈反应
与沸水缓
慢反应
高温与水
蒸气反应
—
不跟水反应
生成碱和氢气
生成氧化
物和氢气
和酸的
反应
剧烈反应
反应逐渐减缓
—
不能置换稀酸中的氢
与非氧化性酸反应放出H2;与浓硫酸、浓硝酸及稀硝酸反应,不放出H2,一般产物为:盐+水+成酸元素的低价化合物
元素铁化学知识点总结

元素铁化学知识点总结一、铁的基本性质1. 原子结构:铁的原子序数为26,原子结构为1s2 2s2 2p6 3s2 3p6 4s2 3d6。
它是一种过渡金属,具有6种价态:-2、-1、0、+2、+3、+6。
2. 物理性质:铁是一种银白色的金属,具有良好的延展性和导电性。
在常温下,铁的晶体结构为面心立方,熔点为1535°C,沸点为2750°C。
3. 化学性质:铁能够与许多元素发生化学反应,如氧气、水、卤素等。
它易氧化,因此常常需要进行防腐处理,以延长其使用寿命。
二、铁的化合物1. 氧化物:铁的氧化物包括FeO、Fe2O3和Fe3O4等。
其中,FeO是黑色的、可溶于酸的一种氧化物,Fe2O3是红色的、不溶于酸的氧化物,Fe3O4是黑色的磁性氧化物。
2. 氢化物:铁和氢的化合物包括FeH2和FeH3等。
这些化合物在高压高温条件下可以稳定存在,但在常温常压下会发生分解反应。
3. 氧化物:铁的氧化物包括FeO、Fe2O3和Fe3O4等。
其中,FeO是黑色的、可溶于酸的一种氧化物,Fe2O3是红色的、不溶于酸的氧化物,Fe3O4是黑色的磁性氧化物。
4. 硫化物:铁和硫的化合物包括FeS、FeS2等。
这些化合物在自然界中普遍存在,如闪锌矿、辰砂等就是铁的硫化物。
5. 卤化物:铁和卤素的化合物包括FeCl2、FeCl3、FeBr2、FeI2等。
这些化合物具有不同的颜色和溶解性质,可用于化学实验和工业生产中。
6. 碳化物:铁和碳的化合物主要是Fe3C,即碳化铁,也称为水钢。
它是一种硬度很高的物质,常用于制作工具和机械部件。
三、铁的化学反应1. 与氧气的反应:铁在高温条件下能够和氧气发生燃烧反应,生成氧化铁。
4Fe + 3O2 → 2Fe2O32. 与水的反应:铁在冷水中不发生反应,但在热水或蒸汽中能够发生还原反应,生成氢气和氢氧化铁。
3Fe + 4H2O → Fe3O4 + 4H23. 与酸的反应:铁在稀盐酸或稀硫酸中能够发生还原反应,生成氢气和铁离子。
2021届山东省青岛市黄岛区高三上学期期中考试化学试卷(解析版)

2021届山东省青岛市黄岛区高三上学期期中考试化学试卷(解析版)2020.11说明:1.本试卷分为选择题和非选择题两部分,考试时间90分钟,满分100分。
2.选择题答案用2B铅笔涂在答题卡上,非选择题用0.5mm黑色中性笔作答,答案必须写在答题卡各题目指定区域内的相应位置。
可能用到的相对原子质量:H 1 He 4 B 13 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Mn55 Fe 56 Cu 64 Ba 137 Pb 207 I 127一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合要求。
1. 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
下列叙述正确的是( )A. 胆矾的化学式为FeSO4·7H2OB. “熬之则成胆矾”是蒸发结晶、过滤C. 胆矾可用于配制波尔多液,以杀死细菌,其原理是利用了胆矾的强氧化性D. “熬胆矾铁釜,久之亦化为铜”该过程中既发生了化学腐蚀又有电化学腐蚀【答案】D【解析】【详解】A.胆矾的化学式为CuSO4·5H2O,A项不符合题意;B.由水溶液获得胆矾,涉及到的操作是蒸发浓缩,B项不符合题意;C.胆矾中Cu是重金属,可以使蛋白质变性,C项不符合题意;D.涉及到的反应是Fe+CuSO4=Cu+FeSO4,既有化学腐蚀,又有电化学腐蚀,D项符合题意;故正确选项为D2. 盐酸肼(N2H6Cl2)是一种化工原料,与NH4Cl类似,其溶液呈酸性。
下列说法正确的是( )A. N2H6Cl2属于共价化合物B. N2H6Cl2中含有非极性共价键C. N2H6Cl2中氮元素化合价为﹣3价N H+2Cl﹣D. 盐酸肼在水中电离方程式为N2H6Cl22+26【答案】B【解析】【详解】A.N2H6Cl2与NH4Cl结构类似,都属于离子化合物,A错误;B .在N 2H 6Cl 2中含有N-N 键属于非极性键,B 正确;C .在N 2H 6Cl 2中,Cl 是-1价,H 是+1价,根据化合物中元素化合价代数和等于0可知氮元素化合价为﹣2价,C 错误;D .盐酸肼(N 2H 6Cl 2)是强酸弱碱盐,在水中完全电离产生2+26N H 、Cl -,电离方程式为:N 2H 6Cl 2=2+26N H +2Cl -,D 错误; 故合理选项是B 。
部分含铁物质的分类与相应化合价

部分含铁物质的分类与相应化合价氧化铁氧化铁是一类含铁物质,其铁元素表现出不同的化合价,从而形成不同的氧化物。
常见的氧化铁包括:三氧化二铁 (Fe2O3):也称为赤铁矿,铁元素呈 +3 价态。
四氧化三铁 (Fe3O4):也称为磁铁矿,铁元素同时处于 +2 和+3 价态。
氧化亚铁 (FeO):铁元素呈 +2 价态。
氢氧化氧化物氢氧化氧化物是一类含铁物质,除氧化铁外,还含有氢氧根离子 (OH-)。
常见的氢氧化氧化物有:氢氧化铁 (Fe(OH)2):也称为绿锈,铁元素呈 +2 价态。
氢氧化铁 (Fe(OH)3):也称为褐铁矿,铁元素呈 +3 价态。
硫化物硫化物是一类含铁物质,其铁元素与硫离子 (S2-) 结合形成的化合物。
常见的硫化物包括:硫化铁 (FeS):铁元素呈 +2 价态。
硫化铁 (FeS2):也称为黄铁矿,铁元素呈 +2 价态。
碳酸盐碳酸盐是一类含铁物质,其铁元素与碳酸根离子 (CO32-) 结合形成的化合物。
常见的碳酸盐有:碳酸铁 (FeCO3):也称为菱铁矿,铁元素呈 +2 价态。
含铁矿物除了上述简单的化合物外,还有许多含铁矿物,它们的组成更复杂,通常含有不止一种铁化合价。
常见的含铁矿物包括:赤铁矿 (Fe2O3):铁元素呈 +3 价态。
磁铁矿 (Fe3O4):铁元素同时处于 +2 和 +3 价态。
褐铁矿 (Fe(OH)3):铁元素呈 +3 价态。
菱铁矿 (FeCO3):铁元素呈 +2 价态。
铁化合物在自然界中的作用铁化合物在地质学、生物学和工业等领域发挥着重要作用:地质学:含铁矿物是地球地壳的重要组成部分,有助于了解地球的历史和演化。
生物学:铁是多种酶和蛋白质的重要组成部分,参与细胞呼吸、氧气运输和红细胞生成。
工业:铁是一种具有广泛应用价值的金属,用于制造钢铁、磁性材料、颜料和催化剂。
氧化物的分类及性质金属活动顺序表常见酸碱盐物质溶解性表的解读

氧化物的分类及性质 金属活动顺序表 常见酸碱盐物质溶解性表的灵活应用一. 本周教学内容:1. 氧化物的分类及性质。
2. 金属活动顺序表、常见酸碱盐物质溶解性表的灵活应用。
二. 教学目的要求:1. 熟悉物质分类的原则及各种物质的概念。
2. 会运用金属活动顺序表来判断某些置换反应能否发生。
3. 根据复分解反应发生的条件,判断某些反应能否发生。
三. 重点、难点:氧化物的分类是教学难点,金属活动顺序表、常见酸碱盐物质溶解性表的灵活应用是重点。
四. 知识要点:(一). 氧化物的分类及性质。
(1)氧化物是指由两种元素组成,其中有一种是氧元素的化合物。
氧化物属于化合物,也一定是纯净物。
(2)按组成分类:⎩⎨⎧--属元素组成的氧化物。
由氧元素和另一种非金非金属氧化物素组成的氧化物。
由氧元素和某种金属元金属氧化物氧化物 (3)按性质分类:氧化物:① 成盐氧化物—能与酸或碱反应生成盐的氧化物。
a . 酸性氧化物—仅能与碱反应生成盐和水的氧化物。
如:CO 2、SO 2b . 碱性氧化物—仅能与酸反应生成盐和水的氧化物。
如Na 2O 、MgOc . 两性氧化物—既能与酸反应又能与碱反应生成盐和水的氧化物。
如:Al 2O 3、ZnO② 不成盐氧化物—既不能与酸反应生成盐也不能与碱反应生成盐的氧化物。
如:H 2O 、CO 等。
凡能跟酸起反应,生成盐和水的氧化物叫做碱性氧化物,如:Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O 、CuO+2HCl=CuCl 2+H 2O 。
金属氧化物大多数是碱性氧化物,例如:CuO 、CaO 、MgO 等都属于碱性氧化物。
在常见的碱性氧化物中,只有K 2O 、Na 2O 、BaO 、CaO 少数几种能跟水直接化合生成可溶性碱。
但碱性氧化物无论能否溶于水,一般均可跟酸反应生成盐和水。
凡能跟碱起反应,生成盐和水的氧化物叫做酸性氧化物,如:CO 2+2NaOH=Na 2CO 3+H 2O 。
高考化学一轮复习 第二章 第一讲 物质的组成性质和分类试题

回夺市安然阳光实验学校第一讲物质的组成、性质和分类[考纲展示]1.了解分子、原子、离子等概念的含义。
了解原子团的定义。
2.理解物理变化与化学变化的区别与联系。
3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
4.理解酸、碱、盐、氧化物的概念及其相互联系。
5.了解胶体是一种常见的分散系。
考点一物质的组成与分类[学生用书P25]一、元素、物质及微粒间的关系二、物质的分类1.概述(1)分类是学习和研究化学物质及其变化的一种常用科学方法。
(2)分类应依据一定的进行,不同,分类方法也不相同。
2.分类法常用的两种分类法是交叉分类法和树状分类法。
由于物质分类可以有不同的,那么对某一物质而言就可以按不同的分类分属于不同的物质类别。
三、常见无机化合物的分类无机化合物⎩⎪⎪⎨⎪⎪⎧氢化物:HCl、H2S、H2O、NH3等氧化物⎩⎪⎨⎪⎧不成盐氧化物:CO、NO等成盐氧化物⎩⎪⎨⎪⎧碱性氧化物:Na2O、CaO等酸性氧化物:CO2、P2O5等氧化物:Al2O3等过氧化物:Na2O2、H2O2等无机化合物⎩⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎧酸⎩⎪⎪⎪⎨⎪⎪⎪⎧按电离出的H+数⎩⎪⎨⎪⎧一元酸:HCl、HNO3等二元酸:H2SO4、H2S等三元酸:H3PO4等按酸根是否含氧⎩⎪⎨⎪⎧无氧酸:HCl、H2S等含氧酸:HClO4、H2SO4等按酸性强弱⎩⎪⎨⎪⎧强酸:HCl、H2SO4、HNO3等弱酸:CH3COOH、HF等按有无挥发性⎩⎪⎨⎪⎧挥发性酸:HNO3、HCl等难挥发性酸:H2SO4、H3PO4等碱⎩⎪⎨⎪⎧按水溶性⎩⎪⎨⎪⎧可溶性碱:NaOH、KOH、Ba(OH)2等难溶性碱:Mg(OH)2、Cu(OH)2等按碱性强弱⎩⎪⎨⎪⎧强碱:NaOH、Ba(OH)2、KOH等弱碱:NH3·H2O等盐⎩⎪⎨⎪⎧正盐:BaSO4、KNO3、NaCl等酸式盐:NaHCO3、KHSO4等碱式盐:Cu2(OH)2CO3等复盐:KAl(SO4)2·12H2O等正确理解“一定”、“不一定”,规避概念失分点(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为氧化物、Na2O2为过氧化物)。
无机化学-氧族元素-金属氧化物、金属硫化物
9
CdSe Nanocrystals
A. Paul Alivisatos et al J. Am. Chem. Soc., 2000, 122, 12700
10
沸石材料的半导体化: 一个跨世纪的合成难题
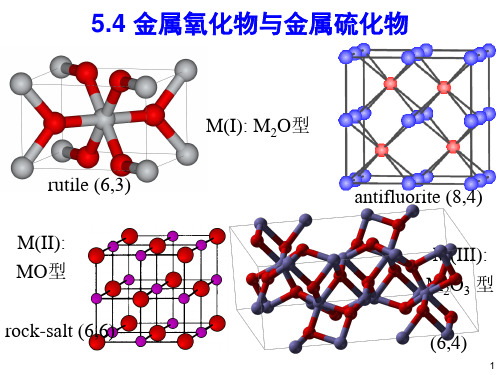
5.4 金属氧化物与金属硫化物
rutile (6,3)
M(II): MO型
rock-salt (6,6)
M(I): M2O型
antifluorite (8,4)
M(III): M2O3 型
(6,4)
1
金属氧化物
Osmium tetroxide, OsO4 分子型氧化物
2
金属氧化物
PbO
PbO2
3
Barrelanoid cage
5
Color of Semiconductors
CdS (Eg=2.42 eV)
CdTe (Eg=1.50 eV)
ZnS (Eg=3.6 eV)
ZnSe (Eg=2.58 eV)
As the band gap decreases as either electronegativity of the anion decreases (CdS →CdTe, ZnS → ZnSe) or the overlap decreases (ZnS →CdS). Colored compounds only result when 1.8 < Eg < 3.0. Larger gaps give white/transparent & smaller gaps give black.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)电子从满带跃迁后形成的空穴以与电子相反方向传递电流
(4)禁带宽度为Eg:
金属:Eg=0,
所以导电良好,无禁带。
半导体:Eg=0.2~3e.v.
绝缘体:Eg=5~10e.v. 所以导电— 空带最低能级 Ev — 满带最高能级 △E — 能量差
绝缘体
MoO3-Bi2O3-Fe2O3 -CoO-K2O-P2O5-SiO2(丙烯腈催化
6
剂)
结构复杂:
组分与组分之间可能相互作用,作用的情况因条件不同而异;
复合氧化物(固熔体,杂多酸,混晶等);
常多相共存,有所谓的活性相概念
例如:Bi2O3-MoO3,就有α-,β-,γ-相,
催化作用与功能
1. 概述
金属氧化物催化剂(复合氧化物)组成
金属氧化物催化剂主要是:
IVB-VIII族和IB,IIB族元素的氧化物
4
元素周期表
57La
镧
89A
58 Ce
59 Pr
60 Nd
61 62 Pm Sm
63 Eu
64 Gd
65 Tb
66 Dy
67 Ho
90
Th
91
Pa
92
U
93
Np
94
Pu
95
Am
10
应用
• 金属氧化物(硫化物)催化剂的应用:氧化还原反应 • 金属氧化物:
– 主要催化烃类的选择性氧化,主要应用于有氧参与的氧
化反应 – 部分应用于加氢、脱氢(在氢气中难于还原的氧化物) • 金属硫化物催化剂:主要用于重油的加氢精制,加氢脱硫 (HDS)、加氢脱氮(HDN)、加氢脱金属(HDM)等过 程
N型、P型半导体
杂质是以原子、离子或集团分布在金属氧化物晶体中,存
在于晶格表面或晶格交界处。
32
N型半导体: 如果杂质能级出现在靠近半导体导带下部称为施主能级。
施主能级的电子容易激发到导带中产生自由电子导电,又称 电子型半导体
E施主能级
33
P型半导体:
如果出现的杂质能级靠近满带上部称为受主能级。
催化中重要的是非化学计量的N、P型半导体两大类!
非化学计量的氧化物定义:偏离正常分子式的化学计量 比组成. 差别一般<1% 非化学计量的成因:晶体和气相分子的相互作用, 由于金 属离子不足或非金属离子不足造成了晶体的非化学计量
例如:氧化物与气相中的氧的相互作用
当金属氧化物是:非化学计量,或引入杂质 产生 杂质能级(禁带)
在受主能级上有空穴存在。 很容易接受满带中的跃迁的电子,使满带产生正电空穴关 进行空穴导电。又称空穴型半导体
22
半导体:禁带窄,满带电子可激发到空带而导电
0K时半导体不导电。
一定温度下,价带电子跃迁到
EF ee e 空带,空带有自由电子导电,价 带有空穴导电。
空带 满带
导带 满带
半导体分类
半导体分为三类: ⑴ 本征半导体 ⑵ n-型半导体 ⑶ p-型半导体
24
本征半导体
组成计量,不含杂质,具有理想的完整晶体结构、 有电子和空穴两种载流子传导的半导体,
氧化物催化剂的工业应用(1)
氧化物催化剂的工业应用(2)
作为氧化作用的氧化物催化剂的类型
① 过渡金属氧化物:晶格氧型,易从晶格中传递出氧给反应 物分子,含有2种以上价态可变的阳离子,且阳离子常交叉互溶, 为非计量化合物 ② 金属氧化物:化学吸附氧型,用于氧化的活性组分为化学 吸附型氧种(分子态、原子态或间隙氧) ③ 原态不是氧化物,是金属:表面吸附氧形成氧化层,如Ag 对乙烯甲醇的氧化,Pt对氨的氧化
96
Cm
97
Bk
98
Cf
99
Es
c 锕
6 69 70 71Lu 8 Tm Yb 镥 Er 10 10 10 103Lr 0 1 2 5铹
Fm Md No
1. 概述
金属氧化物催化剂组成
催化剂多由两种或多种氧化物组成,且组分中至少有
一种是过渡金属氧化物。
如:V2O5-MoO3,Bi2O3-MoO3, TiO2 -V2O5-P2O5,V2O5-MoO3-Al2O3,
例如单晶Si、单晶Ge、PbS等。
25
本征半导体能带结构
• 晶体中既无施主也无受主,具有电子和空穴两种载流子,其 准自由电子和准自由空穴是在外电场作用下,电子从价带迁
移到导带中产生。
本征半导体在催化领域并不重要,因为化学变化过
程的温度,一般在 300~700 ℃ ,不足以产生电子从 其价带到空带的跃迁。
上课回顾 金属催化剂化学键
能带模型— d带空穴 价键模型—d% 配位场模型—定域键模型
3.6 金属氧化物和硫化物催化剂及其催化作用
主要内容
1
2 3
概述 半导体的能带结构及其催化活性 氧化物表面的M=O性质与催化剂活 性、选择性的关联
4
5
复合金属氧化物催化剂的结构化学 金属硫化物催化剂及其催化作用
(1) 主催化剂组分,对化学反应起催化作用的根本性物质, 单独存在时就有催化活性;是催化剂的必须具备的主体成分;如 丙烯氨氧化制丙烯腈使用的MoO3-Bi2O3催化剂中的MoO3 ( 2 )助催化剂组分,具有提高催化剂活性、选择性和改善催 化剂耐热性、抗毒性、机械强度、寿命等性能的组分,其本身无 活性或者活性很小; MoO3-Bi2O3催化剂中的Bi2O3 (3)载体
14
二.半导体的能带结构及其催化活性
金属氧化物和硫化物催化剂,大部分是半导体型化合物; 与金属不同,它们的能带结构是不叠加的,形成分开的带(满带 /价带、禁带和空带)
15
能带结构几个概念:
满带、价带、空带→导带、禁带(能量宽度为Eg)。
满带:凡是能被子电子完全充满的能带;
价带:通常是指半导体或绝缘体中,在0K时能被电子占
禁带 EF △E
EC EV MgO 禁带较宽 △E > 5 eV
不能使满带电子激发到空带中
半导体
半导体的禁带很窄(0.2~3ev),
在绝对零度时,电子不发生跃迁,与绝缘体相似;
但当温度升高或接受光照时,部分电子从满带激发到空 带上去,空带变成导带, 而满带则因电子移去而留下空穴,在外加电场作用下能 够导电,故称半导体。
满的最高能带。
空带:没有填充电子的能带; 导带:凡是能带没有完全被电子充满的; 禁带:在导带(空带)和满带之间没有能级,不能填充 电子,这个区间叫禁带。
16
半导体能带特点:
(1)能带不迭加,形成分开的带
(2)电子(价带中)电子受热或辐射、跃迁到空带,带入的电
子在外电场作用下, 开始导电→导带(原来的空带)
