原子结构的模型啊
2.3 原子结构的模型

阴阳离子共同 构成物质
阴、阳离子
所带电 性情况
不显电性
不显电性
显电性
联
分子可以破裂成原子,原子重新组合成分子,原子
系
得失电子形成离子
在原子得失电子形成离子的过程中,质子数、 中子数、核电荷数和核外电子数中哪些发生了 改变?哪些没有?
质子数、中子数、 核电荷数没有发生 改变,核外电子数 发生了改变。
修正和完善了汤姆生的原子模型
玻尔的分层理论
电子只能在特定的轨道上运动
丹麦科学家玻尔
完善了卢瑟福的原子模型
道尔顿 实心球模型
汤姆生 枣糕或西瓜模型
卢瑟福 核式结构模型
玻尔 分层模型
从原子模型的建立过程看,一个模型 的建立需要经历怎样的过程?
建立模型需要不断地完善和修正,才能 使它更加接近事物的本质。 (说明:现在原子模型还在不断修正, 比玻尔的模型又有了很大的改进。)
下图中代表离子的是( D )
(说明:圆圈内数字代表质子数,“+”表 示原子核所带的电荷,黑点代表核外电子)
(1)A原子核中有_8__个质子, _8__个中子。 (2)B原子核中有 _8__个质子,__9_个中子。 (3)C原子核中有_8__个质子,_1__0_个中子。
具有相同核电荷数(即质子数)的一类原子总称为元素
20
核外电子数 1 2 6 7 8 13 16
17
读表:从下表中你能获得哪些规律?
针对原子 ✓ 质子数 = 核电荷数 = 核外电子数
✓ 质子数与中子数没有必然的联系
✓ 有的原子没有中子(如氢原子)
为什么说原子的质量集中在原子核上? 为什么原子呈电中性?
质子 带正电 1.6726×10-27kg
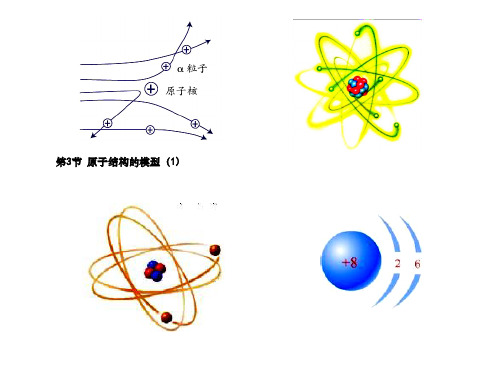
第3节 原子结构的模型

第3节原子结构的模型要点详解知识点1 原子结构模型的建立1.汤姆生的模型(又叫西瓜模型)1897年,英国科学家汤姆生发现了电子(电子带负电),而原子是呈电中性的,即原子内还有带正电的物质。
因此,他提出:原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌在其中。
有人形象地把该模型称为“枣糕模型”或“西瓜模型”。
2.卢瑟福的模型(又叫行星模型)1911年,英国科学家卢瑟福用带正电的α粒子轰击金属箔,实验发现多数α粒子穿过金属箔后仍保持原来的运动方向,但有α粒子发生了较大角度的偏转,甚至有极个别的α粒子被(如图所示)。
在分析实验结果的基础上,卢瑟福提出了原子的核式结构模型(即行星模型):在原子的中心有一个很小的,原子的全部正电荷和几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动,就像行星绕太阳运动那样。
3.玻尔的分层模型1913年,丹麦科学家玻尔改进了卢瑟福的原子核式结构模型,认为电子只能在原子内的一些特定的稳定轨道上运动(如图所示)。
4.原子的构成原子核相对于原子来说,体积很小,但质量却很大,它几乎集中了原子的全部质量。
由于原子核和核外电子所带电量相等,电性相反,所以整个原子不显电性。
例1 (绍兴中考)人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。
(1)卢瑟福核式结构模型是利用α粒子轰击金箔实验的基础上提出的。
下列能正确反映他的实验结果的示意图是(选填序号)。
(2)从原子结构模型建立的过程中,我们发现(选填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程B.模型在科学研究中起着很重要的作用C.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界D.人类借助模型的建立,对原子的认识逐渐接近本质知识点2 揭开原子核的秘密1.原子核的构成(1)原子核是由更小的两种粒子——和中子构成的。
(2)一个质子带一个单位的正电荷,中子,一个电子带一个单位的负电荷。
原子结构的模型(PPT课件(初中科学)26张)

金金属箔
[1]大多数粒子不改变本来的运动方向,原因是:
原子内有较大的间隙。
。
[2]有小部分改变本来的运动路径,原因是: α粒子受到了同种电荷互相排挤作用而改变了运动方向。。
[3]极少数被弹射了回来,原因是: α粒子撞击到了带正电荷、质量大、体积很小的核。 。
自从卢瑟福用α粒子轰击了金属箔后,使人 们对原子内部的结构有了更深入的了解,从而对 原子内部结构的认识更接近了它的本质。
2.汤姆生的原子结构模型
汤姆生模型 (西瓜模型)
探究:卢瑟福的α粒子散射实验
1911年,英国科学家卢瑟福 用带正电的α粒子轰击金属箔, α粒子源 实验发现多数α粒子穿过金属箔 后仍保持本来的运动方向,但有 少量的α粒子产生了较大的偏转。
金金属箔
探究:卢瑟福的α粒子散射实验
1911年,英国科学家卢瑟福 用带正电的α粒子轰击金属箔, α粒子源 实验发现多数α粒子穿过金属箔 后仍保持本来的运动方向,但有 少量的α粒子产生了较大的偏转。 问题思考:
在化学变化中可分的微粒是( B ) A.原子 B.分子 C.电子 D.原子核
6.下列叙述正确的是……………( B ) A.原子核都是由质子和中子构成的 B.原子和分子都是构成物质的一种粒子,它 们都是在不停地运动的 C.原子既可以构成分子,也可以构成物质 D.物质在产生物理变化时,分子产生了变化, 在产生化学变化时,原子产生了变化
原 子
原子核 (+)
质子:一个质子带一个单位的正电荷 中子: 中子不带电
电子: 一个电子带一个单位的负电荷
( —)
原子核所带的电荷数简称为核电荷数。
说一说:以氧原子为例解说原子的结构
电子:8个,带8个单位负电荷
原子的核式结构模型课件

原子的核式结构模型
5
预习交流 2
如何用原子的核式结构模型对 α 粒子散射实验结果进行解释?
答案:(1)当 α 粒子穿过原子时,如果离核较远,受到原子核的斥力
很小,α 粒子就像穿过“一片空地”一样,无遮无挡,运动方向改变很小,
因为原子核很小,所以绝大多数 α 粒子不发生偏转。
11
原子的核式结构模型
12
在α粒子散射实验中,我们并没有考虑α粒子跟电子碰撞,这是因
为(
)
A.电子体积非常小,以至于α粒子碰不到它
B.α粒子跟电子碰撞时,损失的能量很小,可以忽略
C.α粒子跟各个电子碰撞的效果相互抵消
D.电子在核外均匀分布,所以α粒子受电子作用的合外力为零
解析:α粒子与电子相碰就如同飞行的子弹与灰尘相碰,α粒子几
附近时的示意图,A、B、C 三点分别位于两个等势面上,则以上说法
正确的是(
)
A.α 粒子在 A 处的速度比在 B 处的速度小
B.α 粒子在 B 处的速度最大
C.α 粒子在 A、C 处的速度大小相等
D.α 粒子在 B 处的速度比在 C 处的速度小
原子的核式结构模型
21
解析:由能量守恒定律可知,对于 A、B、C 三点,A、C 位于原子
否定了。
原子的核式结构模型
2
预习交流 1
汤姆孙发现电子之后,人们立刻进行建立各种原子模型的尝试,
你都知道有哪些典型的模型呢?
原子是由质子、中子和电子组成的
原子的核式结构模型
3
答案:(1)勒纳德的动力子模型:原子内部的电子与相应的正电荷
组成一个中性的“刚性配偶体”,他取名为动力子,无数动力子漂浮于
原子结构的模型
实心球模型
2、汤姆生原子模型 1897年,英国科学家汤姆生发现了原子内有带负
电的电子。
而原子是电中性的。由此可见,原子内还有带正电的 物质。
西瓜模型
原子模型:原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌在 其中。
意义:电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。
A A.原子始终在做无规则的运动 B.原子核的体积只占整个原子体积的很小部分 C.构成原子核的粒子之间存在一种互相吸引的力 D.原子呈电中性
9、填表。
卢瑟福提出了原子的核式结构模型:在原子的中心有一个很小的原子核,原子的全部正电荷和 几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动,就像行星绕太阳运动那样。
意义:修正了汤姆生的原子模型,认识到原子核很小,居于原子中心,电子绕原子核运动。
4、波尔原子模型 1913年,丹麦科学家玻尔改进了卢瑟福的原子核式结构模型。
氦原子结构 氧原子的原子核就是由8个质子和8个中子紧密相连构成的。
碳原子结构
根据科学家们的测定:一个质子带一个单位正电荷,中子不带电,如氧原子核内有8个质子, 则氧原子核带8个单位正电荷(即+8)。科学上把原子核所带的电荷数称为核电荷数,氧原子的核 电荷数为8。
思考与讨论:为什么说原子的质量集中在原子核上?为什么原子呈电中性? 原子核中质子和中子的质量近似相等,都为一个电子的1836倍,故电子质量可忽略不计。 原子核所带的核电荷数与核外电子所带的电荷数相等,电性相反。
质子数
电子数
5、提出原子核结构模型的科学家是_______,发现原子里有卢电瑟子福的科学家是________。 汤姆生
6、在物质结构研究的历史上,首先提出原子是一个实心球体的是( ) A.汤姆生 B. 卢瑟福 C. 道尔顿 D. 玻尔 C
原子结构的模型课件

原子结构的模型
9.1176×10-31千克 1.6726×10-27千克
1.6748×10-27千克
原子结构的模型
思考:
在一个原子中哪些项目的数目总是相等的?
原子种类 氢原子 氦原子 碳原子 氮原子 铝原子 硫原子 氯原子 铁原子
核电荷数 1 2 6 7 13 16 17 26
质子数 1 2 6 7 13 16 17 26
中子数 0 2 8 7 14 17 20 30
核电荷数 = 质子数 = 核外电子数
原子结构的模型
核外电子数 1 2 6 7 13 16 17 26
结论:
• 1.原子中的质子数与核外电子数相等。 • 2.中子并不是所有的原子中都有。 • 3.在原子中,质子数与中子数并不都相等。 • 4.原子的种类不同,质子数一定不同。
结论和依据
(1)与原子相比,原子核很小,原子核带正电。依
据是上述实验现象 (2)(3) 和 同种电荷相互 的
原理。
排斥
(2)与原子核相比,核外空间很大,电子在核外绕 核运动。依据是实验现象 (1) 。
原子结构的模型
查找相关资料,了解氦原子的结构,如原 子核和核外电子数相等,并尝试建立一个 氦原子结构的模型。(用图表示)?
A. 汤姆生 B. 卢瑟福 C. 道尔顿 D. 玻尔
原子结构的模型
1、氯化钠的生成
1、取一瓶氯气,观察它的颜色
氯
黄绿色 。
气
2、用镊子在放有煤油的试剂瓶
中夹取一块钠,用刀切割成
一小块,观察颜色、状态。 质软、银白色光泽金属固体。
原子结构的模型
原子结构的模型

原子结构的模型1、原子模型的建立:原子内部结构模型的建立是一个不断完善、不断修正的过程。
②历程:道尔顿原子模型(1803年)――实心球模型汤姆生原子模型(1904年)――西瓜模型(汤姆生发现原子中有电子,带负电)卢瑟福原子模型(1911年)―行星绕太阳模型(α粒子散射实验:原子核的存在)波尔原子模型(1913年)――分层模型电子云模型(1927年—1935年)――电子云模型2、原子核的秘密:质子数=核电荷数=核外电子数所以整个原子不显电性(显电中性)3、原子的质量:主要集中在原子核上,原子核所占的质量很大,但占据的体积很小。
核内质子和中子的质量接近,电子的质量所占的比重极小,几乎可忽略。
4、对质子和中子的内部结构的研究还在继续,科学家认为质子和中子是由更小的粒子――夸克构成,对夸克的研究已成为科学上的一个热点。
5、元素:科学上不具有相同核电荷数(即质子数)的同一类原子总称为元素。
6、同位素:原子中原子核内质子数相同、中子数不相同的同类原子统称为同位素。
同位素在工业、农业、医疗、国防等方面由广泛的应用。
7、带电的原子――离子:原子得失电子形成带正、负电荷的离子。
带相反电荷的离子之间会相互作用,构成物质。
离子也是构成物质的微粒之一。
如:金属钠在氯气中燃烧时,金属钠原子失去形成带电荷的钠离子,氯原子得到形成带电荷的氯离子;带有相反电荷的钠离子和氯离子之相互,最终构成电的氯化钠。
可见氯化钠是由和构成的。
(离子像分子,原子一样也是构成物质的基本粒子)总结:物质可有分子、原子核离子构成例1.下列用语中,既能表示宏观意义,又能表示微观意义的是()A. 2ZnB. MoC. HD. 5S例2.在二氧化碳、二氧化硫、二氧化氮各一个分子中,含有一样多的是()A. 氧元素B. 氧原子C. 氧分子D. 氧元素的个数例3. 说出下列化学符号中数字“2”表示的意义:①2H ②2H2O ,。
例4. 用化学符号表示:④3个硫原子②氖气③氧气④n个水分子⑤5个氯分子⑥3个二氧化硫分子例5. 指出下列符号的含义:(1)O (2)2O2(3)CO2(4)5CO2(5)He例6、原子核经高能粒子撞击后是可以发生变化的。
第3节 原子结构的模型

第3节原子结构的模型一、原子模型的建立1.道尔顿:1803年,英国科学家道尔顿认为原子是一个坚硬的实心小球。
2.汤姆生模型:1897年,英国科学家汤姆生提出原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌其中。
3.核式模型:1911年,英国科学家卢瑟福提出原子的中心有一个很小的原子核,原子的全部正电荷和几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动,就像行星绕太阳运动一样。
4.分层模型:1913年,丹麦科学家玻尔认为电子只能在原子内的一些特定的稳定轨道上运动,即电子在原子核外空间的一定轨道上分层绕核做高速的圆周运动。
5.电子云模型:20 世纪20年代以来,科学家又建立了原子结构的电子云模型,即电子绕核高速运动时电子在核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”一样笼罩在核的周围,形成一个带负电荷的云团,在一个确定的时刻不能精确地测定电子的确切位置。
巩固基础1、卢瑟福在α散射实验中(α粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是( )A、α粒子受到金原子的作用,改变了原来的运动方向B、α粒子受到金原子内的电子吸引,改变了原来的运动方向C、α粒子中的绝大多数通过金箔并按原来的方向运动D、α粒子会激发盒原子释放出原子内的电子2、汤姆生最早发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。
汤姆生发现的这一粒子是( )A原子核B.质子C.电子D中子3、20世纪初,科学家先后提出了如图①、②、③所示的三种原子模型,依照提出时问的先后顺序正确的排列是( )A①②③ B. ③②①C.②③①D. ①③②4、为了探索原子内部的构造,科学家们进行了无数次实验。
他们使用原子模型来表示原子并用实验来校正模型。
其中提出“分层模型”的科学家是( )A汤姆生 B.卢瑟福C.波尔D道尔顿二、原子核内的秘密(质子、中子、电子)1.原子的结构(1)基本构成:原子是由一个居于中心的带正电荷的原子核和带负电荷的核外电子构成的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
提出: 提出:
卢瑟福模型
卢 瑟 福 模 型
碳原子结构的行星模型
历史
丹麦科学家玻尔( 丹麦科学家玻尔(1913) )
发现
电子不会掉到 原子核上
提出
分层理论
玻尔原子模型
历史
现代科学家的电子云模型
事实
原子结构
1.居原子中心的 居原子中心的 原子核(带正电) 原子核(带正电) 2.核外饶原子核高 核外饶原子核高 速运动的电子 带负电) (带负电)
科
基础 应用
现象 探究
问题
学
思路 评价
信 息
知 识 树
结构 结论
实验
问题
1.原子又是由什么构成的呢 原子又是由什么构成的呢? 原子又是由什么构成的呢 2.实心球的模型能否代表原子的 实心球的模型能否代表原子的 真实结构? 真实结构 3.科学家是怎样揭开原子结构秘 科学家是怎样揭开原子结构秘 密的呢? 密的呢
问题
原子核又是由什么构成的呢? 原子核又是由什么构成的呢? 用什么方法可以知道原子核 的结构? 的结构?
原子核的结构
物质 分子 原子核 原子 电子 质子 带1个单位的正电 1个单位的质量 不带电 中子 1个单位的质量
带1个单位的负电 质量几乎为0 质量几乎为0
历史
英国科学家汤姆生( 英国科学家汤姆生(1897) )
发现: 发现:
1.原子内有电子; 原子内有电子; 原子内有电子 2.电子带负电; 电子带负电; 电子带负电
提出: 提出:
汤姆生模型
汤 姆 生 模 型
历史
英国科学家卢瑟福( 英国科学家卢瑟福(1911) )
实验: 粒子轰击金属箔 实验: a粒子轰击金属箔 发现: 发现:
第3节 原子结构的模型 原子核的结构: 原子核的结构:
讨论
1.铜是由什么构成的? 铜是由什么构成的? 铜是由什么构成的
2.你知道铜有哪些性质吗? 你知道铜有哪些性质吗? 你知道铜有哪些性质吗 3.铜导线中的自由电荷是什么? 铜导线中的自由电荷是什么? 铜导线中的自由电荷是什么 4.你能够猜想到铜的原子结构吗? 你能够猜想到铜的原子结构吗? 你能够猜想到铜的原子结构吗
