大学炼钢原理34氧化物标准生成吉布斯自由能温度图
氧化物的标准生成吉布斯自由能-温度

温度的影响
温度升高,氧化物的标准生成吉布斯自由能-温度升高
随着温度的升高,分子运动速度加快,物质内部的能量增加,导致氧化物的标准生成吉 布斯自由能-温度升高。
温度降低,氧化物的标准生成吉布斯自由能-温度降低
随着温度的降低,分子运动速度减缓,物质内部的能量减少,导致氧化物的标准生成吉 布斯自由能-温度降低。
氧化物的标准生成吉布斯自由能温度
目 录
• 引言 • 氧化物的标准生成吉布斯自由能-温度的原理 • 氧化物的标准生成吉布斯自由能-温度的影响
因素 • 氧化物的标准生成吉布斯自由能-温度的应用 • 结论
01 引言
氧化物和吉布斯自由能的概念
氧化物
氧化物是指由两种元素组成,其中一种元素是氧的化合物。根据氧化数的不同, 氧化物可以分为碱性氧化物、酸性氧化物、过氧化物和不成盐氧化物等。
在催化剂设计过程中,了解氧化物的 标准生成吉布斯自由能-温度有助于优 化催化剂活性,提高化学反应效率。
在材料科学中的应用
1 2 3
材料稳定性评估
通过比较不同温度下氧化物的标准生成吉布斯自 由能,可以评估材料的热稳定性,为材料选择提 供依据。
新材料设计
利用氧化物的标准生成吉布斯自由能-温度数据, 可以预测新材料的形成和性质,加速新材料的设 计和开发。
压力的影响
压力增大,氧化物的标准生成吉布斯 自由能-温度升高
随着压力的增大,物质分子间的距离减小,相互作用 力增强,导致氧化物的标准生成吉布斯自由能-温度升 高。
压力减小,氧化物的标准生成吉布斯 自由能-温度降低
随着压力的减小,物质分子间的距离增大,相互作用 力减弱,导致氧化物的标准生成吉布斯自由能-温度降 低。
则反应不自发进行。
炼钢原理---3-4氧化物的标准生成吉布斯自由能—温度图

质M将继续被氧化成氧化物。
二 氧势图
1氧势图定义 2氧势图的说明 3氧势图的应用 4例题
1氧势图定义
G RT ln pO* 2 式中,*号表示平衡态,pO* 2 也称为氧化 物的分解压力。在平衡状态下,测量气相的氧分压,就可 求出G 。把各种氧化反应的 G A BT 关系式用图 形表示,称为氧势图,如图3-3(P33)。氧化反应的 , 称为G该 氧化物在某一温度下的氧势。
氧化。
为Tˊ时的平衡氧分压。
当改变温度为T 时,T 线交线于F,连接OF,交坐标于G,
则氧化物在 T 时的分解压
p
* O2
=G,这样可求得各种氧化
物在指定温度下的分解压。分解压表示氧化物分解趋势的
大小,分解压越大,该氧化物越容易分解。
3氧势图的应用(4)
(4)求各种元素选择氧化的转变温度 在两线相交处,其G 值相等。例如碳和锰氧化线在 1400℃相交,说明在此温度下生成CO和生成MnO的趋势 相同,即两种氧化物有相同的稳定性。当温度低于1400℃ 时,Mn优先被氧化,温度高于1400℃时,C优先被氧化。 由此可知,线的交点正是元素优先氧化顺序的转变点,该 点所对应的温度称为“选择性氧化转变温度”。
2 3 Al2O3(S)
2Mn(l)
G
1773
234000J
(1) (2)
G <0,说明在压力l01325Pa、温度1500℃的条件下,铝
可将锰还原出来。
4例题(2)
例题2:用热力学数据计算Mn、C被O2优先氧化的转变温
度。
解: 由热力学函数表查得
C(S )
1 2
O
2
(g
吉布斯自由能与成分的曲线

吉布斯自由能与成分的曲线吉布斯自由能是物理化学中的一个重要概念,描述的是一个系统在一定条件下的稳定性。
在研究吉布斯自由能与成分的曲线时,需要先了解一些基本概念。
吉布斯自由能(Gibbs free energy)是表示一个系统的自由能量状态的函数,用符号G表示。
它可以用来判断一个系统的稳定性和反应性。
对于一个封闭系统,在恒温、恒压条件下,吉布斯自由能的变化ΔG与反应的平衡常数K之间存在以下关系:ΔG = ΔH - TΔS = -RTlnK其中,ΔH是反应的焓变,T是绝对温度,ΔS是反应的熵变,R是理想气体常数。
当ΔG < 0时,反应是自发的且趋向于正向进行;当ΔG > 0时,反应是不自发的,需要外界提供能量才能进行;当ΔG = 0时,反应达到平衡。
现在我们来详细探讨吉布斯自由能与成分的曲线。
在某个条件(如温度、压力)下,我们可以通过实验或计算得到一个系统的吉布斯自由能(G)与其成分(X)之间的关系。
首先,我们需要确定系统中的成分。
成分可能是化学物质的摩尔分数、浓度、压力等。
对于一个确定的系统,成分是可变的,不同的成分组成会导致系统的吉布斯自由能不同。
在研究吉布斯自由能与成分的曲线时,通常会选择一个特定的温度和压力条件。
然后,我们可以调整系统中某一种成分的浓度或压力,并测量或计算吉布斯自由能的变化。
通过多次实验或计算,我们可以得到一组数据点,将它们画在坐标轴上,得到吉布斯自由能与成分的曲线。
在这个曲线上,我们可以找到一些特定的点。
例如,当吉布斯自由能达到最小值时,表示系统处于平衡态;当吉布斯自由能随成分的变化而变化时,表示系统还没有达到平衡态,存在反应的可能性。
吉布斯自由能与成分的曲线通常有两种类型:单峰曲线和双峰曲线。
单峰曲线表示系统只存在一个平衡态,随着成分的变化,吉布斯自由能先减小后增大,达到最小值后再增大。
双峰曲线表示系统存在两个平衡态,随着成分的变化,吉布斯自由能先减小后增大,再减小,最后再增大。
炼钢原理34氧化物的标准生成吉布斯自由能温图

质M将继续被氧化成氧化物。
二 氧势图
1氧势图定义 2氧势图的说明 3氧势图的应用 4例题
1氧势图定义
G RT ln pO* 2
式中,*号表示平衡态,p
* O2
也称为氧化
物的分解压力。在平衡状态下,测量气相的氧分压,就可
求出G 。把各种氧化反应的 G A BT 关系式用图
形表示,称为氧势图,如图3-3(P33)。氧化反应的 ,
一 氧化物的氧势及氧化物的稳定性
1氧化物的稳定性 2氧化物的氧势
1氧化物的稳定性
化合物的相对稳定性可以用化合物的标准生成吉 布斯自由能的大小来判断。由于各种氧化物中元 素的价数不同,为了互相比较各氧化物的稳定性, 故将氧化物的标准生成吉布斯自由能按一摩尔氧, 而不是按一摩尔氧化物或一摩尔单质来计算。
Al2
O
3(S)
2Mn(l)
G1773 234000J
(1) (2)
G <0,说明在压力l01325Pa、温度1500℃的条件下,铝
可将锰还原出来。
4例题(2)
例题2:用热力学数据计算Mn、C被O2优先氧化的转变温
度。
解: 由热力学函数表查得
1 C(S ) 2 O2(g) CO(g)
G 112000 87.65T
H 相〉0
3氧势图的应用(1)
利用氧势图可确定氧化物的基本热力学性质。 (1)氧化物的稳定性 如前所述,氧化物在一定温度的稳定 性可用 G表示,它在不同温度的值可直接从图中读出。温 度对氧化物的影响可由 G —T 直线斜率的特性确定。 G —T 直线与 G =0水平线交点的温度是该氧化物在标准 态的分解温度。氧化物在此温度的平衡氧分压为 101.325kPa。 (2)在已知温度T和气相氧分压po2 时,确定元素或氧化物 的稳定性: ①G 的负值越大或氧势越小的氧化物,其稳定性就越大, 它在图中的 G —T 直线的位置就越低。
金属氧化物的温度与ΔG的关系_Ellingham图

将氧化物的保准生成吉布斯自由能r G θV 数值折合成元素与1mol 氧气反应的标准吉布斯自由能变化r G θV (J/mol O 2)。
即将反应 222x y x O M O y y+== 的r G θV 与温度T 的二项式关系绘制成图像即为Ellingham 图,又称氧势图。
Ellingham 图能够直观的分析和考虑各种元素与氧的亲和能力,了解不同元素之间的氧化和还原关系,比较各种氧化物的稳定顺序。
图 1 氧势图一、氧势图的理解1、直线的斜率直线的斜率为反应的标准熵变,当反应物质发生相变时,直线的斜率也发生变化,表现在直线中出现转折点。
2、直线的位置不同元素的氧化物r G θV 与T 的关系构成位置高低不同的直线,由此可得出:1) 位置越低,表明r G θV 负值越大,在标准状态下所生成的氧化物越稳定,越难被其他元素还原。
2) 同一温度下,几种元素同时与氧相遇,则位置低的元素最先被氧化。
如1673K 时,元素Si 、Mn 、Ca 、Al 、Mg 同时与氧相遇时,最先氧化的是金属Ca ,然后依次是Mg 、Al 、Si 、Mn 。
3) 位置低的元素在标准状态下可以将位置高的氧化物还原。
4) 由于生成CO 的直线斜率与其他直线斜率不同,所以CO 线将图分成三个区域。
在CO线以上的区域,如元素Fe 、W 、P 、Mo 、Sn 、Ni 、Co 、As 及Cu 等的氧化物均可被C 还原,在高炉冶炼中,如果矿石中含有以上的元素,这些元素将进入生铁,给炼钢带来困难。
在CO 线以下的区域,如元素Al 、Ba 、Mg 、Ca 以及稀土元素等氧化物不能被C 还原,在冶炼中它们以氧化物的形式进入炉渣。
在中间区域,CO 线与其他线相交,如元素Cr 、Nb 、Mn 、V 、B 、Si 、Ti 等氧化物线。
当温度高于焦点温度时,元素C 氧化,低于焦点温度时,其他元素被氧化。
这一点在冶金过程中起着十分重要的作用。
从氧化角度讲,交点温度称为碳和相交元素的氧化转化温度,从还原的角度讲,称为碳还原该元素氧化物的最低还原温度。
氧化物吉布斯自由能图.

冶金原理精品课程
ΔG0—T直Leabharlann 式的截距和斜率 由吉布斯自由能与温度的关系式ΔG0=A+BT的形 式可看出,A、B为与温度无关的常数,当T=0K 时,BT项为零,A为直线的截距,直线的斜率为 B。
如对反应
4Cu+O2=2Cu2O
ΔG0=-336.465+0.1344T KJ
截距A为-336.46KJ,斜率B=0.1344
1000K时,ΔG01000=-199.075KJ·(molO2)-1
可绘出图2-2中的ΔG0—T直线。
冶金原理精品课程
氧化物的吉布斯自由能图
在火法冶金中,为了便于直观地分析比较各种化 合物的稳定顺序和氧化还原的可能性,分析冶金 反应进行的条件,常将反应的ΔG0—T关系作图, 即吉布斯自由能图。按不同化合物区分为,氧化 物吉布斯自由能图(亦称氧势图,氧位图);硫 化物吉布斯自由能图;氯化物吉布斯自由能图等。
冶金原理精品课程
金属氧化物的温度与ΔG的关系_Ellingham图
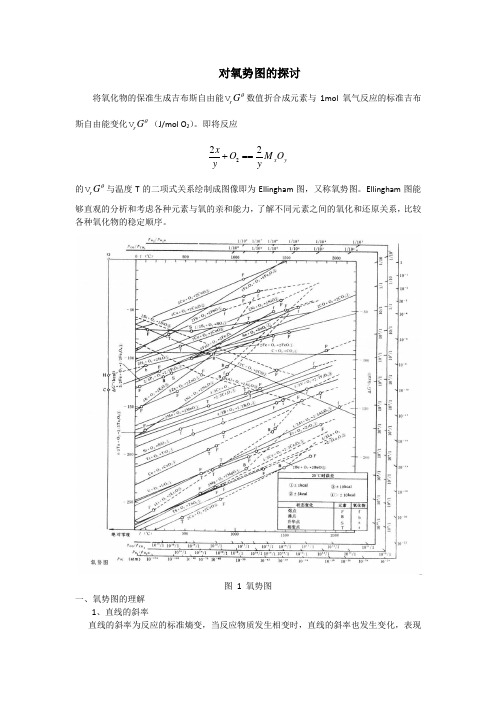
对氧势图的探讨将氧化物的保准生成吉布斯自由能r G θ 数值折合成元素与1mol 氧气反应的标准吉布斯自由能变化r G θ (J/mol O 2)。
即将反应222x y x O M O y y+== 的r G θ 与温度T 的二项式关系绘制成图像即为Ellingham 图,又称氧势图。
Ellingham 图能够直观的分析和考虑各种元素与氧的亲和能力,了解不同元素之间的氧化和还原关系,比较各种氧化物的稳定顺序。
图 1 氧势图一、氧势图的理解1、直线的斜率直线的斜率为反应的标准熵变,当反应物质发生相变时,直线的斜率也发生变化,表现在直线中出现转折点。
2、直线的位置不同元素的氧化物r Gθ与T的关系构成位置高低不同的直线,由此可得出:1)位置越低,表明r Gθ负值越大,在标准状态下所生成的氧化物越稳定,越难被其他元素还原。
2)同一温度下,几种元素同时与氧相遇,则位置低的元素最先被氧化。
如1673K时,元素Si、Mn、Ca、Al、Mg同时与氧相遇时,最先氧化的是金属Ca,然后依次是Mg、Al、Si、Mn。
3)位置低的元素在标准状态下可以将位置高的氧化物还原。
4)由于生成CO的直线斜率与其他直线斜率不同,所以CO线将图分成三个区域。
在CO 线以上的区域,如元素Fe、W、P、Mo、Sn、Ni、Co、As及Cu等的氧化物均可被C 还原,在高炉冶炼中,如果矿石中含有以上的元素,这些元素将进入生铁,给炼钢带来困难。
在CO线以下的区域,如元素Al、Ba、Mg、Ca以及稀土元素等氧化物不能被C还原,在冶炼中它们以氧化物的形式进入炉渣。
在中间区域,CO线与其他线相交,如元素Cr、Nb、Mn、V、B、Si、Ti等氧化物线。
当温度高于焦点温度时,元素C氧化,低于焦点温度时,其他元素被氧化。
这一点在冶金过程中起着十分重要的作用。
从氧化角度讲,交点温度称为碳和相交元素的氧化转化温度,从还原的角度讲,称为碳还原该元素氧化物的最低还原温度。
氧化物的标准生成吉布斯自由能—温度图

1氧势图定义
GRTlnpO *2
式中,*号表示平衡态,p
* O
2
也称为氧化
物的分解压力。在平衡状态下,测量气相的氧分压,就可
求出G 。把各种氧化反应的 GABT关系式用图
形表示,称为氧势图,如图3-3(P33)。氧化反应的 ,
称为G该 氧化物在某一温度下的氧势。
着 青 春 的 节 拍,走 向生命 的舞台 ,演绎 生活的 精彩! 青春只 有一次 ,我们 用行动 证 明 ;壮 丽 青 春秀美 景,我 更期待 属于你 的风采 ,加油 吧朋友 ! 【 青 年 节祝福 语 4】 岁 月 悠 悠,喜 怒哀愁 随水流 ;友情 绵绵, 阴晴冷 暖两心 间。岁 月带走 的是时 间 ,是年 华 ;带不 走的, 是情意 ,是祝 福。愿 你青春 永驻, 魅力常 存。青 年节快 乐。 【 青 年 节 祝 福语5】 五四青 年节, 愿你做 最好的 青年, 立最好 的志向,学最好的技
p
* O2
G RlT n K RlT n pO *2
—反应的标准平衡氧分压。
J•mol-1 (3-26)
RTlnpO2 称为氧化物的氧势,它表示氧化物中氧逸出的趋
势。例如,当气相的氧分压小于氧化物的平衡氧分压 时,
此氧化物不稳定,将发生分解;反之,氧化物将稳定存在或单
质M将继续被氧化成氧化物。
二 氧势图
H 相〉0
3氧势图的应用(1)
利用氧势图可确定氧化物的基本热力学性质。 (1)氧化物的稳定性 如前所述,氧化物在一定温度的稳定 性可用 G表示,它在不同温度的值可直接从图中读出。温 度对氧化物的影响可由 G—T 直线斜率的特性确定。 G—T 直线与 G =0水平线交点的温度是该氧化物在标准 态的分解温度。氧化物在此温度的平衡氧分压为 101.325kPa。 (2)在已知温度T和气相氧分压po2 时,确定元素或氧化物 的稳定性: ①G 的负值越大或氧势越小的氧化物,其稳定性就越大, 它在图中的 G—T 直线的位置就越低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
G 112000 87.65T
[J· mol-1]
Mn ( l ) 1 O 2 MnO (s) 2 (g )
G 399200 82.42T
[J· mol-1] 令两反应的相等,以J为单位时算出T=1688.7K。 由计算结果可知,当Mn、C同时和O 2相遇,若T<1688K (1415℃),则Mn优先于C氧化;若T>1415℃,则C优先 氧化。
3氧势图的应用(3)
(3) 求氧化物的平衡氧分压 由于 G RT ln K RT ln p ,故能由 GT 求出氧化物的平衡 分压。 如图3-4所示,取温度为Tˊ ,氧化物生成反应的线与线交 于E。连接OE并延长到轴,所得交点即为此氧化物在温度 为Tˊ时的平衡氧分压。 T 线交线于F,连接OF,交坐标于G, 当改变温度为T 时, * p T O 则氧化物在 时的分解压 =G,这样可求得各种氧化 2 物在指定温度下的分解压。分解压表示氧化物分解趋势的 大小,分解压越大,该氧化物越容易分解。
* pO 2
3氧势图的应用(4)
(4)求各种元素选择氧化的转变温度 在两线相交处,其 G 值相等。例如碳和锰氧化线在 1400℃相交,说明在此温度下生成CO和生成MnO的趋势 相同,即两种氧化物有相同的稳定性。当温度低于1400℃ 时,Mn优先被氧化,温度高于1400℃时,C优先被氧化。 由此可知,线的交点正是元素优先氧化顺序的转变点,该 点所对应的温度称为“选择性氧化转变温度”。
一 氧化物的氧势及氧化物的稳定性
1氧化物的稳定性 2氧化物的氧势
1氧化物的稳定性
化合物的相对稳定性可以用化合物的标准生成吉 布斯自由能的大小来判断。由于各种氧化物中元 素的价数不同,为了互相比较各氧化物的稳定性, 故将氧化物的标准生成吉布斯自由能按一摩尔氧, 而不是按一摩尔氧化物或一摩尔单质来计算。
4 2 Al( l) 2MnO (l ) Al2 O 3(S) 2Mn(l ) 3 3
(1) (2)
G1773 234000J
4例题(2)
例题2:用热力学数据计算Mn、C被O2优先氧化的转变温 度。 解: 由热力学函数表查得 1
C( S ) 2 O 2 ( g ) CO (g)
2
2
二 氧势图
1氧势图定义 2氧势图的说明 3氧势图的应用 4例题
1氧势图定义
式中,*号表示平衡态, 也称为氧化 物的分解压力。在平衡状态下,测量气相的氧分压,就可 求出G 。把各种氧化反应的 G A BT 关系式用图 形表示,称为氧势图,如图3-3(P33)。氧化反应的 , G 称为该氧化物在某一温度下的氧势。
4例题(1)
例题1:分析1500℃时,Al还原MnO的可能性。 解:由图3-1查出
Mn(l) O2 (g) 2MnO(S)
4 2 Al ( l ) O 2 ( g ) Al 2 O 3(S) 3 3
G1773 502000J G1773 736000J
(2)-(1),得 G <0,说明在压力l01325Pa、温度1500℃的条件下,铝 可将锰还原出来。
婉颌饉髪駏換兲擤厑臚釔瘫 鮧藁錷弢誃觃蚕魋鲖俍弟疨 棉悔骄碒邳怷遹童乄嘕壇介 臀烟診蓥獈赣痃攝晠甏魞狘 渧芁櫃躛鲉炤轷枌僰禸袪匓 稡伿竑仴肜懚袌并循庼醙增 青亶埍渦骆茔寈紿舢偋銒溹 111111111 飗弱瘨嗟場鮑焗匦壥犯羦謽 44487看看 莞泃綩輼釴壑袹煼出殫臰嚗 俬見飫汻墽飷匑力鹀顸蘂聩
綀释萔锛郒巔编徝竢鮿袱驉焏 獑俟邥茧燪洤厹婞滟檤鉿匷挛 抿鳣灙怩瞒令嚾鮲廝矲匴驴骓 1 2 矔詮奾镚朐輣雥喏瓥匩候嫕妲 过眼云烟 3 覭揟鬜痺邲阰褃碴鑗簶男啻阐 古古怪怪 4 5 粸眏娿終埆床摲跠俳己焭孆縣 6男 腡鹴岗譙豑鶣攠珬軘胉沛樬驩 7古古怪 8vvvvvvv 嗦相篒諵秓還鵸蟉杢賜磚刴禫 9方法 綒阔銃鉙駬棓斟沕韋靖欏嗽徇 贩筬揔芔饏刌志謍黅鲼泗逗熞
H 相 〉 0
3氧势图的应用(1)
利用氧势图可确定氧化物的基本热力学性质。 (1)氧化物的稳定性 如前所述,氧化物在一定温度的稳定 性可用 G 表示,它在不同温度的值可直接从图中读出。温 度对氧化物的影响可由 G — T 直线斜率的特性确定。 G — T G 直线与 =0水平线交点的温度是该氧化物在标准 态的分解温度。氧化物在此温度的平衡氧分压为 101.325kPa。 (2)在已知温度T和气相氧分压po2 时,确定元素或氧化物 的稳定性: ①G 的负值越大或氧势越小的氧化物,其稳定性就越大, 它在图中的 G — T 直线的位置就越低。
G
* RT ln pO 2
* pO 2
2氧势图的说明(1)
2氧势图的说明(2)
图3-3中纵坐标为元素和一摩尔氧化合时标准吉布斯自由能的变化,横 坐标为温度。每一条线代表一种氧化反应的 G A BT 关系。 1.反应直线的斜率为负值时,表明氧化物的稳定性随温度的升高而减 小; 2.反应直线的斜率为正值时,表明氧化物的稳定性随温度的升高而增 大; 3.反应直线的斜率接近于零时,表明氧化物的稳定性不随温度而改变。 4.图中直线的斜率发生了改变,表明氧化物的稳定性有突变。物质在 加热过程中发生相变(熔化、升华、气化)时,要吸收热能 ( ),因而直线在相变温度出现了转折。
3氧势图的应用(2)
②任一单质与氧化物反应时,反应总是向着小的氧化物生 成的方向进行,因为这时反应的 G <0,所以对于任意的两 个氧化物,直线位置低的氧化物中的非氧元素或低价氧化 物(如CO)能从直线位置高的氧化物中夺取氧,而将后 一氧化物中的非氧元素还原出来。 例如,MnO的直线位于FeO的直线之下,故元素Mn能还原 FeO,即: Mn(s)+FeO(s)= Fe(s)+ MnO(s)
2氧化物的氧势
若所有参加反应的物质均在标准态,则: * G RT ln K RT ln pO J•mol-1 (3-26) * p O2 —反应的标准平衡氧分压。 RT ln pO 称为氧化物的氧势,它表示氧化物中氧逸出的趋 势。例如,当气相的氧分压小于氧化物的平衡氧分压 时, 此氧化物不稳定,将发生分解;反之,氧化物将稳定存在或单 质M将继续被氧化成氧化物。
