物质结构第一章习题(上)
第一章习题

第一章物质结构:一、判断题:(×)1、多电子原子轨道的能级只与主量子数n有关。
(×)2、同族元素的氧化物CO2和SiO2,具有相似的物理性质和化学性质。
(√)3.氯原子的3P轨道能量高于3S轨道。
(√)4.正、负电荷中心重合的分子叫做非极性分子。
(×)5、HCN是直线型分子,所以它是非极性分子。
(×)6、凡是含有氢的化合物的分子之间都能形成氢键。
(×)7.原子轨道和电子云的图形完全一样。
(×)8.取向力存在于非极性分子和极性分子之间.(×)10、共价化合物呈固态时,均为分子晶体,因此溶、沸点都低。
如SiO2(×)11.BF3和NH3都具有平面三角形的空间构型。
(×)12.n=1时,有自旋相反的两个原子轨道。
只有1个S (×)13.当主量子数n=2时,角量子数l只能取1。
(0,1)(×)14.SO2和CS2都具有相同的空间构型。
(×)15、色散力仅存在于非极性分子之间。
(√)16、三个P轨道的能量、形状、大小相同,不同的是在空间的取向。
(×)17.BF3分子的空间的构型为三角锥。
(×)18、非极性分子中只有非极性共价键。
(×)19、形成离子晶体的化合物中不可能有共价键。
(×)20、相对分子质量越大,分子间力越大。
相同类型的物质(×)21.配合物中配体的数目称为配位数。
(×)22.配位化合物的中心原子的氧化态不可能等于零,更不可能为负值。
原子(√)23、共价化合物AB2分子为角形,则意味着A原子价电子层中至少有一对孤对电子。
(×)24.氢原子光谱不是线性光谱。
(×)25.角量子数等于2的亚层,原子轨道的符号是p。
(d)(√)26.氢原子的3P轨道能量高于3S轨道的能量。
(√)27.正、负电荷中心重合的分子叫做非极性分子。
物质结构基础练习题

第1章物质结构基础习题一、思考题1. 试述下列各名词的意义(1)量子化(2)物质波(3)波函数(4)原子轨道(5)几率密度(6)量子数(7)电子云2. 原子中的能级主要由哪些量子数来确定?3. 试述描述核外电子运动状态的四个量子数的意义和它们的取值规则。
4. 基态原子的核外电子排布应遵循哪些规律?5. s轨道、p轨道、d轨道分别对应的l值为多少?6. s,2s,2s1各代表什么意义?指出4s、3d、5p各能级相应的量子数及轨道数。
7. n =2时,电子有哪些可能的空间运动状态?8. l =2的轨道,空间伸展方向有几种?9. p轨道角度分布图和p电子云角度分布图形的区别是什么?10. 用原子轨道符号表示下列各套量子数。
(1)n =2,l = 1,m = -1(2)n = 4,l = 0,m = 0(3)n =5,l =2,m = 011. 为什么任何原子的最外层上最多只能有8个电子?次外层最多只能有18个电子?12. 指出下列各元素的基态原子的电子排布式的写法违背了什么原理并予以改正。
(1)Be 1s22p2 (2)B 1s22s3(3)N 1s22s22p x22p y113. 现行的周期表中有几个区?每一个区包括哪几个族?各区的外层电子构型有何特征?14. 什么叫共价键的饱和性和方向性?为什么共价键具有饱和性和方向性,而离子键无饱和性和方向性?15. 共价键的轨道重叠方式有哪几种?16. 举例说明什么是σ键,什么是π键?它们有哪些不同?17. 价键理论和分子轨道理论的基本要点是什么?18. s、p原子轨道主要形成哪几种类型的杂化轨道?中心原子利用上述杂化轨道成键时,其分子构型如何?19. 实验测定BF3为平面三角形,而[BF4]-为正四面体形。
试用杂化轨道的概念说明在BF3和[BF4]-中硼的杂化轨道类型有何不同?20. 试用分子轨道表示式写出O2+的电子构型。
21. 分子间力有几种?各种力产生的原因是什么?试举例说明极性分子之间、极性分子和非极性分子之间以及非极性分子之间的分子间力。
元素周期律复习习题

第一章物质结构元素周期律第一章物质结构元素周期律复习课学习目标1.理解原子的组成及同位素的概念。
掌握原子序数、核电荷数、质子数、中子数、核外电子数的概念,以及质量数与质子数、中子数之间的相互关系。
2.以第一、二、三周期的元素为例,掌握核外电子排布规律。
3.理解离子键、共价键的含义。
了解键的极性。
4.掌握元素周期律的实质及元素周期表(长式)的结构(周期、族)。
5.以第三周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅡA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
自主学习一、原子组成与结构[习题1]有关1735Cl-粒子,回答下列问题:(1)所含质子数;中子数,电子数;质量数。
(2)该粒子的结构示意图;电子式。
(3)它与1735Cl的半径大小的关系是。
[习题2]R原子的核内质子数为m,中子数为n,则下列叙述错误的是()A.这种元素的相对原子质量为m+nB.不能由此确定该元素的相对原子质量C.其原子质量与612C原子质量之比约为(m+n)∶12D.原子核内中子数为n的原子可能是R原子的同位素二、化学键[习题3]下列说法中正确的是()A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键B.含有共价键的物质一定是共价化合物C.HCl 溶于水只需克服分子间作用力D.干冰升华时,分子内共价键会发生断裂 [习题4]下列电子式书写正确的是( )A.∶N ∶∶∶N ∶B.H ∶∶HC.H +[∶O ··∶]2-H + D.Na +[∶Cl ····∶]-三、元素周期律和元素周期表[习题5]对于核电荷数为37的元素,下列描述正确的是( ) A.某单质在常温下跟水反应不如钠剧烈 B.其碳酸盐易溶于水C.其原子半径比钾原子半径小D.其氢氧化物不能使Al(OH)3溶解[习题6]下列各粒子半径依次增加的是( ) A.Cs +、K +、Mg 2+、Al 3+ B.F 、F -、Cl -、Br - C.Ca 2+、K +、Cl -、S 2- D.Al 、Al 3+、Mg 、K[习题7]下列关于元素周期表和元素周期律的说法中不正确的是( ) A.从氯到碘,生成的氢化物熔、沸点逐渐升高,稳定性逐渐增强 B.因为钠原子比铝原子容易失去电子,所以钠比铝的还原性强 C.从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 D.氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的氧化性强[习题8]已知X +、Y 2+、Z -、W 2-四种离子均具有相同的电子层结构。
物质结构第一章训练题
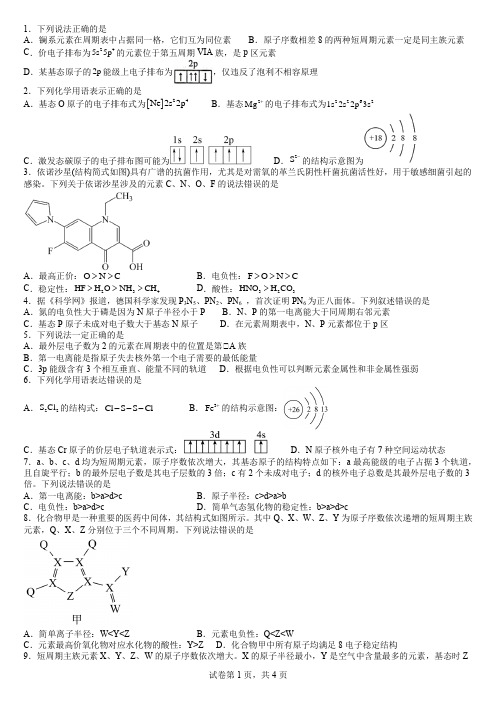
1.下列说法正确的是A .镧系元素在周期表中占据同一格,它们互为同位素B .原子序数相差8的两种短周期元素一定是同主族元素C .价电子排布为245s 5p 的元素位于第五周期VIA 族,是p 区元素D .某基态原子的2p 能级上电子排布为,仅违反了泡利不相容原理2.下列化学用语表示正确的是A .基态O 原子的电子排布式为[]24Ne 2s 2pB .基态2Mg +的电子排布式为22621s 2s 2p 3sC .激发态碳原子的电子排布图可能为D .2S -的结构示意图为3.依诺沙星(结构简式如图)具有广谱的抗菌作用,尤其是对需氧的革兰氏阴性杆菌抗菌活性好,用于敏感细菌引起的感染。
下列关于依诺沙星涉及的元素C 、N 、O 、F 的说法错误的是A .最高正价:O N C >>B .电负性:F O NC >>>C .稳定性:234HF H O NH CH >>>D .酸性:323HNO H CO >4.据《科学网》报道,德国科学家发现P 3N 5、PN 2、PN 6 ,首次证明PN 6为正八面体。
下列叙述错误的是A .氮的电负性大于磷是因为N 原子半径小于PB .N 、P 的第一电离能大于同周期右邻元素C .基态P 原子未成对电子数大于基态N 原子D .在元素周期表中,N 、P 元素都位于p 区5.下列说法一定正确的是A .最外层电子数为2的元素在周期表中的位置是第ⅡA 族B .第一电离能是指原子失去核外第一个电子需要的最低能量C .3p 能级含有3个相互垂直、能量不同的轨道D .根据电负性可以判断元素金属性和非金属性强弱6.下列化学用语表达错误的是A .22S Cl 的结构式:Cl S S Cl ---B .3Fe +的结构示意图:C .基态Cr 原子的价层电子轨道表示式:D .N 原子核外电子有7种空间运动状态7.a 、b 、c 、d 均为短周期元素,原子序数依次增大,其基态原子的结构特点如下:a 最高能级的电子占据3个轨道,且自旋平行;b 的最外层电子数是其电子层数的3倍;c 有2个未成对电子;d 的核外电子总数是其最外层电子数的3倍。
第一章第一节原子结构练习题(带答案)

一、原子的诞生1.在物质结构研究的历史上,首先提出原子内有原子核的科学家是( )解析:汤姆生最早提出了电子学说,道尔顿最早提出了原子学说,卢瑟福最早提出了原子核,玻尔最早提出了原子的行星模型。
答案:C2.下列说法中,不符合现代大爆炸宇宙学理论的是( )A.我们所在的宇宙诞生于一次大爆炸B.恒星正在不断地合成自然界中没有的新元素C.氢、氦等轻核元素是宇宙中天然元素之母D.宇宙的所有原子中,最多的是氢元素的原子答案:B3.据报道,月球上有大量3He存在。
下列关于3He的说法正确的是( )A.是4He的同分异构体B.比4He多一个中子C.是4He的同位素D.比4He少一个质子答案:C二、能层与能级1..M能层对应的电子层是( )A.第一能层B.第二能层C.第三能层D.第四能层答案:C2.下列各能层中不包含p能级的是( )答案:D3.下列各电子能层中含有3p能级的是( )能层能层能层能层答案:C能层具有的能级数为( )解析:每一个能层所具有的能级数等于能层序数,N能层为第四能层,故能级数为4。
答案:B5.下列各能层中不包含d能级的是( )能层能层能层能层答案:C6.下列能级中,不属于M能层的是( )答案:B7.在N能层中,最多能容纳的电子数为( )答案:D9.下列能级中可容纳电子数最多的是( )答案:D10.下列说法正确的是( )A.同一原子中,1s、2s、3s电子的能量逐渐减小B.同一原子中,2p、3p、4p电子的能量相等C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动D.各能层含有的能级数为n(n为能层序数)答案:D11.下列是关于多电子原子核外电子运动规律的叙述,其中叙述正确的是( )A.核外电子是分层运动的B.所有电子在同一区域里运动C.能量高的电子在离核近的区域运动D.同一能层的电子能量相同答案:A12.画出Be、N、Ne、Na、Mg这些元素的基态原子结构示意图,并回答下列问题:((1)只有K层与L层的元素有(2)含有M层的有(3)最外层电子数相同的有。
第一章 材料的结构 习题

第一章 材料的结构 习题1 解释以下基本概念空间点阵、晶体结构、晶胞、配位数、致密度、金属键、缺位固溶体、电子化合物、间隙相、间隙化合物、超结构、拓扑密堆相、固溶体、间隙固溶体、置换固溶体。
2 氧化钠与金刚石各属于哪种空间点阵?试计算其配位数与致密度。
3 在立方系中绘出{110},{111}晶面族所包括的晶面及(112),(021)晶面。
4 作图表示出<0112>晶向族所包括的晶向。
确定(1211),(021)晶面。
5 求金刚石结构中通过(0,0,0)和(414343,,)两碳原子的晶向,及与该晶向垂直的晶面。
6 求(121)与(100)决定的晶带轴与(001)和(111)所决定的晶带轴所构成的晶面的晶面指数。
7 试证明等径刚球最紧密堆积时所形成的密排六方结构的633.1/ a c 。
8 绘图说明面心立方点阵可表示为体心正方点阵。
9 计算面心立方结构的(111),(110),(100)晶面的面间距及原子密度(原子个数/单位面积)。
10 计算面心立方八面体间隙与四面体间隙半径。
11 计算立方系[321]与[120]夹角,(111)与(111)之间的夹角。
12 FeAl 是电子化合物,具有体心立方点阵,试画出其晶胞,计算电子浓度,画出(112)面原子排列图。
13 合金相VC ,Fe3C ,CuZn ,ZrFe2属于何种类型,指出其结构特点。
例题1. 何谓同位素?为什么元素的相对原子质量不总为正整数?答案在元素周期表中占据同一位置,尽管它们的质量不同,然它们的化学性质相同的物质称为同位素。
由于各同位素的含中子量不同(质子数相同),故具有不同含量同位素的元素总的相对原子质量不为正整数。
2. 已知Si 的相对原子质量为28.09,若100g 的Si 中有5×1010个电子能自由运动,试计算:(a)能自由运动的电子占价电子总数的比例为多少?(b)必须破坏的共价键之比例为多少? 答案 原子数=个 价电子数=4×原子数=4×2.144×1024=8.576×1024个a) b) 共价键,共有2.144×1024个; 需破坏之共价键数为5×1010/2=2.5×1010个;所以,。
北师大版无机化学习题答案(上、(下册))

第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
第一章物质结构与元素周期律巩固练习A卷

第一章《物质结构 元素周期律》巩固练习题班级 姓名学号 成绩一、选择题(每题3分,共48分)1.C 136-NMR (核磁共振)可用于含碳化合物的结构分析,C 136表示的含义错误的是( )A .表示碳元素的一种同位素B .表示碳元素的一种核素C .质量数是13,原子序数是6,核内有7个质子D .质量数是13,原子序数是6,核内有7个中子 2.下列物质的性质比较,正确的是( )A .酸性:H 2SO 4>HClO 4>HBrO 4B .碱性:NaOH >KOH >RbOHC .非金属性: P >S >ClD .气态氢化物稳定性:HF >HCl >H 2S 3.下列说法不符合...ⅦA 族元素性质特征的是 ( ) A .易形成-1价离子B .从上到下原子半径逐渐减小C .从上到下非金属性逐渐减弱D .从上到下氢化物的稳定性依次减弱4. 下列有关说法正确的是( )A .第三周期的元素的原子核外都有三个电子层B .第ⅠA 族元素都是典型的金属元素C .氟、氯、氧、氮四种元素都是第ⅦA 族的元素D .原子的最外层有两个电子的元素都在第ⅡA 族 5.下列各组粒子中属于同位素的是( ) A .16O 和18O B .H 2O 和D 2OC .H 2和D 2 D .24Mg 和24Na6.(双选)元素X 、Y 可组成化学式为XY 2的离子化合物,则X 、Y 的原子序数可能是( ) A .11和16 B .6和8 C .12和17 D .20和97. 下列叙述中能肯定说明金属A 比金属B 的活泼性强的是( ) A .A 原子最外层电子数比B 原子的最外层电子数少 B .A 原子电子层数比B 原子的电子层数多C .1molA 从酸中置换生成的H 2比1mol B 从酸中置换生成的H 2多D .常温时,A 能从酸中置换出氢,而B 不能8. 0.05 mol 某金属单质与足量的盐酸反应,放出1.12LH 2(标准状况),并转变为具有Ar 原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )A .第三周期第IA 族B .第四周期第IA 族C .第三周期第ⅡA 族D .第四周期第ⅡA 族 9.(双选)关于铯(Cs )及其化合物的性质,说法正确的是( ) A .金属铯的熔点比金属钠高 B .CsOH 比NaOH 的碱性强 C . Cs 与H 2O 能剧烈反应,甚至发生爆炸 D .碳酸铯难溶于水10. 某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键( ) A .一定是共价键 B .一定是离子键 C .可能是共价键,也可能是离子键 D .以上说法均不正确11.(双选) 同周期的X 、Y 、Z 三元素,它们最高价氧化物对应水化物是HXO 4、H 2YO 4、H 3ZO 4 ,则下列判断正确的是( )A .含氧酸的酸性H 3ZO 4>H 2YO 4>HXO 4,B .非金属性X>Y>ZC .元素的负化合价的绝对值按X 、Y 、Z 变大D .气态氢化物的稳定性按X 、Y 、Z 的顺序增强12. 已知A 、B 、C 、D 、E 是核电荷数依次增大的五种短周期元素,原子半径按D 、E 、B 、C 、A 的顺序依次减少,B 与E 同主族,则下列推断不.正确的是( ) A .D 位于第2周期 B .A 、B 、E 一定位于不同周期C .A 、D 可能属同一族 D .C 和D 的单质可能化合形成离子化合物 13.下列表达方式错误..的是( )A .H ∶ClB .C .O 188D .O =C =O 14.下列叙述正确的是( )A .非金属原子间以共价键结合的物质都是共价化合物B .含有共价键的化合物都是共价化合物C .凡是能电离出离子的化合物都是离子化合物D .凡是含有离子键的化合物都是离子化合物15.已知短周期元素的离子a A 2+ 、b B + 、c C 3- 、d D - 都具有相同的电子层结构,则下列叙述正确的是( )A . 原子半径: A >B >D >C B . 原子序数: d >c >b >a C .离子半径:C >D >B >A D .单质的还原性:A >B >D >C16.下列各组元素性质递变情况错误的是( )A .Li 、Be 、B 原子最外层电子数逐渐增多 B .N 、O 、F 原子半径依次增大C .P 、S 、Cl 最高正价依次升高D .Li 、Na 、K 、Rb 的金属性依次增强二、非选择题( 共52分)17.(15分)现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9.一个自由实物粒子的波长为λ,求其能量,须用哪个公式( )
(A) (B) (C) A,B都可以
10.对一个运动速率 的自由粒子,有人作了如下推导:
①②③④⑤
结果得出 的结论。问错在何处?说明理由。
11.测不准关系是_______,它说明了_____________________。
41.作为近似,苯可以视为边长为0.28 nm的二维方势阱,若把苯中电子看作在此二维势阱中运动的粒子,试计算苯中成键电子从基态跃迁到第一激发态的波长。
42.函数 是不是一维势箱中粒子的一种可能状态?如果是,其能量有没有确定值(本征值)?如有,其值是多少?如果没有确定值,其平均值是多少?
43.在长为l的一维势箱中运动的粒子,处于量子数为n的状态,求:①在箱的左端1/4区域内找到粒子的概率;②n为何值时,上述概率最大?③当n→∞时,此概率的极限是多少?④③的结果说明了什么?
55.对
56. ,故 是本征函数,本征值为-m
57.光子能量
58.
59.
60.
61. (C) (D)
62. (A)
63.光子:
自由电子:
小球:
64.计算下列各种情况下的de Bröglie波长。
①在电子显微镜中,被加速到1000kV的电子;
②在300K时,从核反应堆发射的热中子(取平均能量为kT/2)
(A)16.5×10-24J(B)9.5×10-7J(C)1.9×10-6J(D) 8.3×10-24J
30.一个在一维势箱中运动的粒子,
①其能量随着量子数n的增大( )
(A)越来越小(B)越来越大(C)不变
②其能级差 随着势箱长度的增大( )
(A)越来越小(B)越来越大(C)不变
31.立方势箱中粒子,E= 的状态的量子数 是( )
③以速率为1.0ms-1运动的氩原子(摩尔质量39.948gmol-1)
④以速率为10-10ms-1运动的质量为1g的蜗牛。
(1eV=1.60×10-19J,k=1.38×10-23J·K-1)
65.钠D线(波长为589.0nm和589.6nm)的光子质量各为多少?
66.已知K的逸出功是2.2eV,
44.试计算长度为l的一维势箱中的粒子从n=2跃迁到n=3的能级时,德布罗意波长的变化。
45.在长度为100 pm的一维势箱中有一个电子,问其从基态跃迁到第一激发态吸收的辐射波长是多少?在同样情况下粒子吸收的波长是多少?(已知me=9.109×10-31kg,m=6.68×10-27kg)
46.试问一个处于二维正方形势箱中的粒子第四个能级的简并度为多少?
49.试证明三维势箱中粒子的平均位置为(a/2,b/2,c/2)。
50.1927年戴维逊和革未的电子衍射实验证明了实物粒子也具有波动性。欲使电子射线产生的衍射环纹与Cu的K线(波长为154 pm的单色X射线)产生的衍射环纹相同,电子的能量应为___J。
51.一个以 速率运动的电子,相应的波长是多少?
③哪些是 和 的共同本征函数( )
21.在什么条件下, 成立?
【1-21答案】
1. (D)
2. ,
3. ,小
4.电子几率密度
5. ,
6.
7. ,
8.
9. (B)
10.①②两步都是对的。
是自由粒子的运动速率,它不等于物质波的传播速率u,③中用了=/,这就错了,因为=u/。
④中E=h是粒子的相对论能量,而⑤中E=m2/2仅为v<<c时粒子的动能(机械能),两个能量是不等的。
,于是
43.① ;
②n=3, ③
④说明随着粒子能量的增加,粒子在箱内的分布趋于平均化
44. ,
45.
对电子=11.00 nm,对粒子=8.07×104nm
46. 2,
47.①
② ,
故 的本征值为
③
④
48.试证明一维势箱中粒子的波函数 不是动量算符 的本征函数。另外,一维箱中粒子的能量算符是否与动量算符对易?
57.一个100 W的钠蒸气灯发射波长为590nm的黄光,计算每秒钟所发射的光子数目。
58.一个在一维势箱中运动的电子,其跃迁所吸收光子的最低频率是2.0×1014s-1,求一维势箱的长度。
59.用透射电子显微镜摄取某化合物的选区电子衍射图,加速电压为200kV,计算电子加速后运动时的波长。
60.金属锌的临阈频率为8.065×1014s-1,用波长为300nm的紫外光照射锌板,计算该锌板发射出的光电子的最大速率。
17.任何波函数 都能变量分离成 与 的乘积,对否?
18.下列哪些算符是线性算符( )
(A) (B)2(C)用常数乘(D) (E)积分
19.下列算符哪些可以对易( )
(A) 和 (B) 和 (C) 和 (D) 和
20.下列函数中(A) (B) (C) (D)
①哪些是 的本征函数( )
②哪些是的 本征函数( )
【48-63答案】
48.
;
故 (可对易)
49. ,
其中 都是正交归一的,故
同理, ,
50.
51.
52.能量最低状态(基态)
53.设f(x),g(x)是合格函数,则它们在x时为零。
故 是厄米算符。
同理可证, , 不是厄米算符。
54.否,德布罗意波长极短的情况下,可用经典力学处理(或者说,在普朗克常数可视为0的情况下,微观粒子的运动可以用经典力学处理)
(A):
(D):
23.
24. , ,故动量 有确定值
25.否。不是 的本征函数,而是 的本征函数(本征值为 )
26. ,
27.
28. (D).箱中粒子V=0,能量全为动能,即E=T,因此
=2 nm
29. (D).
30.①(B);②(A)
31. (C)
32. (E)
33. (B)
34.①
②5 (1,1); 8 (2,1); 13 (3,1); 17 (1,2); 20 (2,2)或(4,1);
因此,推导中的③⑤错。
11. 。微观物体的坐标和动量不能同时测准,其不确定度的乘积不小于 。
12.否,应该是位置和动量不能同时准确测定。
13.①平方可积(有限);②单值的;③连续的(除势能发生无限跳跃处,一级微商也连续)。
14.否,波函数包含了体系可以确定的全部知识(如物理可观测量的平均值)
15. ;
34.①一电子处于长为2l、宽为l的二维势箱中运动,其能量表示式为 =____________;②若以 为单位,粗略画出最低五个能级,并标出对应的能量及量子数。
35.质量为m的一个粒子在长为l的一维势箱中运动,
①体系哈密顿算符的本征函数为_________________;
②体系的能量本征值为_____________,最低能量为__________;
③体系处于基态时,粒子出现在0-l/2间的几率为________;
④势箱越长,电子从基态向激发态跃迁时光谱线的波长________;
⑤若该粒子在长l、宽为2l的长方形势箱中运动,则哈密顿算符的本征函数集为__________,本征值为___________。
【22-35答案】
22. (A) (D)。
40.
41.基态时,6个电子排布在能量最低的3个轨道上,填充轨道的量子数分别为(1,1),(1,2),(2,1),最低激发态时,一个电子跃迁到量子数为(2,2)的能级。
42.① ,其中 是能量本征函数,故 是一个可能状态(叠加态)。
②能量没确定值,因不是哈密顿算符的本征函数。
③ 是归一化的,设 是归一化的,则叠加系数满足
47.①写出一维势箱中粒子的能量表示式;②由上述能量表示式出发,求出 的本征值(写出过程);③写出一维势箱中运动粒子的波函数;④由上述波函数求 和 的平均值。
【36-47答案】
36.① ;
②由 ,
可得(a/4,a/2,a/2)、(3a/4,a/2,a/2);
③6
37. 3,4
38.否,应为最大。
39. 8个电子排布在能量最低的4个轨道上,最低激发能为
52.微观体系的零点能是指____________________的能量。
53.厄米算符的定义是 ,或 Fra bibliotek其中f,g为任意合格函数,问 和 哪个是厄米算符?
54.电子的运动状态是不是一定要用量子力学来描述?
55.测不准关系式可作为判别经典力学是否适用的标准,对吗?
56.函数 是否是算符 的本征函数,若是,求本征值。
5.求德布罗意波长为0.1 nm的电子的动量和动能。
6.波长λ=400 nm的光照射到金属铯上,计算金属铯所放出的光电子的速率。已知铯的临阈波长为600 nm。
7.光电池阴极钾表面的逸出功是2.26 eV。当波长为350 nm的光照到电池时,发射的电子最大速率是多少?
(1 eV=1.602×10-19J,电子质量me=9.109×10-31kg)
35.① (n=1,2,3…)② ;
③1/2④增长
⑤ ,
36.质量为m的粒子被局限在边长为a的立方箱中运动。波函数 = ____________;当粒子处于状态 时,几率密度最大处的坐标是____;若体系的能量为 ,其简并度是_____。
37.在边长为a的立方势箱中运动的粒子,能级E= 的简并度是_____,E'= 的简并度是______________。
判断满足下列关系式的算符中哪些是线性算符?( )
(A) (为常数)(B) (C)
(D) (E)
23.物理量 的量子力学算符在直角坐标系中的表达式是_____。
24.某粒子的运动状态可用波函数 表示,其动量 是否有确定值。
