物理化学(上)第四章总结
物理化学第四章-化学平衡

平衡 正向自发
ii (产物) ii (反应物) 逆向自发
自发变化的方向:反应总是从化学势较高的一边流向化 学势较低的一边。
1. 化学反应的限度
所有的化学反应既可以正向进行亦可以逆向进行, 且反应正向进行和逆向进行均有一定的程度,反应 物不会完全转化为产物。
典型例子:
H2(g)+I2(g)↔2HI C2H5OH(l)+CH3COOH(l)↔CH3COOC2H5+H2O
任意化学反应: rGm rGm RT ln Qa
rGm ii (产物) jj (反应物)
(化学反应的吉布斯自由能改变量)
rGm
i
i
(产物)
jj (反应物)
(化学反应的标准吉布斯自由能改变量)
1.rGm 是任意反应系统的吉布斯自由能变化
rGm 是任意反应系统的标准摩尔吉布斯自由能变化
rGm 指产物和反应物都处于标准态时,产物的吉布
斯函数与反应物的吉布斯函数总和之差,称为化学
反应的“标准摩尔Gibbs 自由能变化值”,只是温
度的函数。
平衡时Leabharlann gGhHa
A
b
B
r Gm
若上述反应在定温定压下进行,其中各分压是任意的而 不是平衡时的分压,此时反应的吉布斯函数变化为:
非平衡时
rGm gG hH (aA bB )
B
B
RT
ln( PB
/
P )
g[G
RT
ln(
pG
/
p
)]
h[
H
RT
ln(
pH
/
p
)]
a[
A
RT
ln(
物理化学 第4章化学平衡

当 B 0 时 K Kc Kn K y
1/31/2020
祝大家学习愉快,天天进步!
17/114
§4.2-3.有纯态凝聚相参加的理气反应 K
ΔrGm RTln K
J p
B (g)
pB p
(g)
νB(g)
K
B(g)
peq B(g) p
结论:化学反应方程中计量系数呈倍数关系,Δ r Gm
的值也呈倍数关系,而 K 值则呈指数的关系。
1/31/2020
祝大家学习愉快,天天进步!
15/114
§4.2-2.理想气体反应的 K K c K y Kn
气体的组成可用分压力,摩尔分数,浓度表 示,故平衡常数也有不同的表示方法.
K
B
2
(g)
CO
2
(g)
Δ G r m,2 RT lnK 2
(3) CO 2 (g) C(s) 2CO(g) Δ G r m,3 RT lnK3 例 4.5.1
因为: (3) = (1) 2(2)
pB p
B
e
pB yB p
K
B
pB p
B
e
B
yB p
p
B
e
B
y B B
e
B
p
p
B
Ky
p p
B
1/31/2020
祝大家学习愉快,天天进步!
16/114
§4.2—2.理想气体反应的 K K c K y Kn
物理化学:第4章_多组分系统热力学_
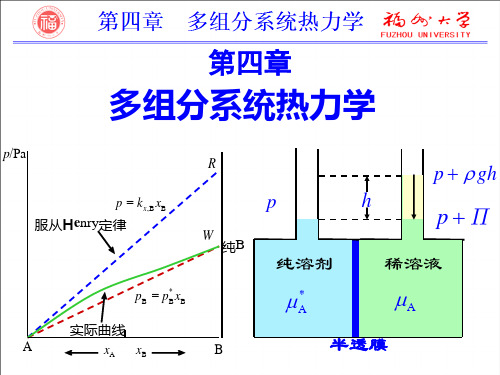
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
物理化学 第四章 多组分系统热力学

Vm
T,p一定
V*m,C VC
V*m,B VB
d c· b·
0 B
a xC
C
图4.1.2 二组分液态混合物的 偏摩尔体积示意图
若B,C形成真实液态混合物: 则混合物体积为由V*m,B至V*m,C的曲线。对于任一 组成a时,两组分的偏摩尔体积可用下法表示: 过组成点a所对应的系统体积点d作Vm-xC曲线的 切线,此切线在左右两纵坐标上的截距即分别 为该组成下两组分的偏摩尔体积VB,VC。
B
系统中各广度量的偏摩尔量: 对于多组分系统中的组分B,有: 偏摩尔体积: VB=(ƽV/ƽnB)T,p,n C 偏摩尔热力学能: UB=(ƽU/ƽnB)T,p,n C 偏摩尔焓: HB=(ƽH/ƽnB)T,p,n C 偏摩尔熵: SB=(ƽS/ƽnB)T,p,n C 偏摩尔亥姆霍兹函数:AB=(ƽA/ƽnB)T,p,n C 偏摩尔吉布斯函数: GB=(ƽG/ƽnB)T,p,n
C
几点说明: (1)偏摩尔量为两个广度性质之比,所以为强度 性质; (2)偏摩尔量的定义中明确是在恒温、恒压及系 统组成不变的条件下,偏导数式的下标为T,p 时才是偏摩尔量; (3)同一物质在相同温度、压力但组成不同的多 组分均相系统中,偏摩尔量不同; (4)若系统为单组分系统,则该组分的偏摩尔量 与该组分的摩尔量相等,即: XB=X*B,m
C
=VB (数学知识:二阶偏导与求导的顺序无关) 得证。
4.2化学势 4.2化学势
1.化学势的定义 混合物(或溶液中)组分B的偏摩尔吉布斯函数GB 定义为B的化学势,用符号μB表示:
μB = GB=(ƽG/ƽnB)T,p,n
def
C
对于纯物质,其化学势等于它的摩尔吉布斯函 数。
04-物理化学课程讲义-第四章1解析

杠杆规则(Lever rule)
液相和气相的数量借助于力学中的杠杆规则求算, 即以物系点为支点,支点两边连结线的长度为力矩,计 算液相和气相的物质的量或质量,这就是可用于任意两 相平衡区的杠杆规则。即
nl CD ng CE
或 ml CD mg CE
可以用来计算两相的相对量 (总量未知)或绝对量(总 量已知)。
p-x图 和 T-x图
对于二组分体系, C 2, f 4 F
F 至少为1,则 f 最多为3。这三个变量通
常是T,p 和组成 x。
所以要表示二组分体系状态图,需用三个坐标 的立体图表示。
(1) 保持温度不变,得 p-x 图 较常用 (2) 保持压力不变,得 T-x 图 常用 (3) 保持组成不变,得 T-p 图 不常用。
xA
pB
p* B
xB
p pA pB
理想的完全互溶双液系
(2) p-x-y 图
这是 p-x 图的一种,把液相组成 x 和气相组成 y 画
在同一张图上。A和B的气相组成 yA和 yB的求法如下:
yA
pA p
yB 1 yA
p pA pB pA* xA pB* xB
p* A
xA
p* B
(1
引言
气体,不论有多少种气体放 在一起,只有一个气相。因 为气体分子混合很均匀,分 子之间没有界面。
多种气体混合物
液体,按其互溶程度可以组成一相、两相或三 相共存。
固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。
引言
自由度(degree of freedom)
在单相区,物系点与相点重合;在两相区中, 只有物系点,它对应的两个相的组成由对应的相点 表示。
大学课程《物理化学》各章节知识点汇总

第一定律的数学表达式
U Q W
对微小变化: dU Q W
等容热效应
dU Q W W pdV 0
dU QV
CV
QV
dT
U T
V
U QV ,
U nB
S ,V ,n j B
H nB
S, p,nj B
F nB
T ,V ,n j B
B
G nB
T , p,n j B
n B
S ,V ,n j B
F f (T ,V , n1, n2 )
H f (S, p, n1, n2 )
组成可变系统的热力学基本关系式:
dU TdS pdV BdnB
Q和W都不是状态函数,其数值与变化途径有关。
§1-4 可逆过程和体积功
一、体积功
因系统的体积变化而引起的系统与环境之间交换的功称
为体积功。 pe
W Fedl ( pe A)dl
ped ( Al) pedV
A
dl
pi
二、功与过程
功不是状态函数,其数值与过程有关。系统由同一始态 经不同的过程变化到同一终态,则体统对环境或环境对 体系所作的功不同。
p2 dp
压缩
p1
p1
p2 , V2
p1, V1
p2
V1
V2
W
V1 V2
pedV
( p V1
V2
i
dp)dV
V1 V2
pi dV
三、可逆过程
某系统经一系列的过程后,如果系统回到初始状态叫做 系统的复原;环境在经历一些的变化后,如果既没有功 的得失也没有热的得失就叫做环境的复原。
第四章:化学平衡(物理化学)

从理论上讲,应该符合和气体相同的规则,增 大压强向体积减小的方向移动,但在压力不太大时, 因 值不VB*大,压力影响可以忽略不计。但压强足够 大时,就可以影响反应方向。
惰性气体对化学平衡的影响
惰性组份:不参加化学反应的组份。 不改变体积,直接冲惰性气体,平衡可能不发生 移动
K (3) K (1) K (2)
2.平衡常数的表示方法
dD(g) eE(g) hH(g) gG(g)
( p P )Hh ( p P )Gg 常数 ( p P )Dd ( p P )eE
pHh pGg pDd pEe
常数
cGg cHh cDd cEe
常数
标准平衡常数 经验平衡常数
经验平衡常数
当反应系统的总压力p保持不变(即反应在等 压条件下进行)时,充入惰性气体:可以看作减小 别的压强。
工程上的应用: 对于分子数增加的反应,加入水气或氮气,会使
反应物转化率提高,使产物的含量增加。
C6H5C2H5(g)=C6H5C2H3(g)+H2(g)
rGm (T ) RT ln K
G = H - T S
根据Le chatelier原理,增加压力,反应向体积 减小的方向进行。这里可以用压力对平衡常数的影 响从本质上对原理加以说明。
rGm BB (T ) RT ln K
B
( ln K p
)T 0
K 仅是温度的函数
压强不改变平衡常数,但能改变压强能改变压力商Jp N2(g)+3H2(g)=2NH3(g)
例如,求
C(s)
1 2
O2
(g)
CO(g)
的平衡常数
(1) C(s) O2 (g) CO2 (g)
物理化学第四章

• 但碳的相图中最多只能三相共存,不可能四相共存.
一.克-克方程(Clausius-Clapeyron equation)
• 当单组分体系两相共存时,自由度f=3-2=1, 体系只有一个自由度。 • 单组分的相变温度与压力之间存在一定的关 系, 此关系即为克-克方程. • 设一纯物质在T,p下达两相平衡:
相图:表示体系状态变化的图形
•
• 相(phase): 体系内物理性质和化学性质
完全均匀的部分. • 均匀的要求: •
均匀到分子水平
• 一个体系中可以含有多个相,这些相与相 之间一般存在明显的界面,界面处体系的 热力学性质是间断的.
气体:凡气体成一相.
气体体系无论有多少种气体,一般都达到分子水 平的混合,故为一相。
• (3)式称为克拉贝龙方程. • 克拉贝龙方程适用于纯物质任何平衡相变过 程,应用范围很广.
• 1. 气-液,气-固两相平衡:
• 纯物质的两相平衡中有一相为气相,另一相必为 凝聚相. 以气-液平衡为例,有: • dp/dT=Hm/TVm= Hm/T(Vm,g-Vm,l) (4) • ∵ Vm,g>>Vm,l • ∴ Vm,g-Vm,l≈ Vm,g=RT/p • 代入(4)式: • dp/dT= Hm/[T(RT/p)] •
• 体系的独立变量数f(即自由度)应该等于总变量 数减去关系式总数: • 总变量数:S+2 • 关系式数:+S(-1) • •
f = S+2--S+S
f = S- + 2
(1)
• (1)式就是相律的数学表达式. • 相律的物理含义是:
体系的自由度等于体系的物种数S减去相 数再加上环境变量数2(温度和压力).
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 主要公式及其适用条件一.偏摩尔量1.定义: B n p T BX nXBC =⎪⎪⎭⎫ ⎝⎛∂∂≠,, ,该式只适用于均相系统。
2. 偏摩尔量的集合公式:∑==kB m B B X n X 1,,该式只适用于均相系统平衡态。
3.吉布斯—杜亥姆公式:01,=∑=kB m B B dX n二.化学势 1.化学势的定义: 注意:(1)下标条件(2),只有用吉布斯自由能表示的化学势才是偏摩尔量。
2. 化学势(指)与各因素的关系(1) 化学势的集合公式:(2) 化学势在等温等压下的吉布斯—杜亥姆公式:(3) 化学势与压力、温度的关系:B ,,(c B)()cS V n BU n μ≠∂=∂,,(c B)()c T p n B G n ≠∂=∂,,(c B)()c S p n BH n ≠∂=∂)(,,)(B C C Bn V T n A≠∂∂=3. 多组分系统热力学基本方程适用条件:均相系统,W/=0的任意过程。
4. 化学势判据对多组分体系,三.气体化学势的表达式1.理想气体化学势的表达式(1)纯理想气体的化学势:理想气体的标准态化学势。
即温度为T,p=p0=100kPa 的纯理想气体。
(2)混合理想气体中某组分B的化学势(P B-理想气体B的分压,而不是混合理想气体的总压)2.非理想气体的化学势(1)纯实际气体对于纯实际气体,θθμμp pRT T p T ~*ln )(),(+= 或:θθϕμμp p RT T p T ln )(),(*+=。
逸度因子:p p~=ϕ。
(2)混合实际气体B 的化学势可表示为:θθμμp p RT T p T B B ~ln)(),(+= 路易斯-兰道尔规则:B B B y p p *~~=,(条件:*,B m B V V =) 四.溶液中各组分的化学势 1.稀溶液的两个经验定律 (1)拉乌尔定律,x A :溶剂在溶液中的摩尔分数。
(2)亨利定律, x B :溶质在溶液中的摩尔分数; ,b B :质量摩尔浓度,mol/kg ;,c B : 物质的量浓度,mol/L 。
2.理想液态混合物:任意组分B其化学势都可表示为:其标准态是。
3.稀溶液(1)溶剂的化学势(2)溶质的化学势是T ,P 的函数,可以看成x B =1且服从亨利定律的那个假想状态的化学势。
(因为当x B =1时,溶液不是无限稀释,溶质也不再遵守亨利定律,这也是一个假想标准态。
)相应的有:、分别是b B =1mol/kg 及C B =1mol/L ,溶液中溶质仍遵守亨利定律的化学势,这也是一假想状态的化学势,不是标准态的化学势。
4.实际溶液(1)实际溶液中溶剂A 的化学势:Ax A x f RT p T p T ln ),(),(**+=μμ(2)对实际溶液中溶质B 的化学势分别为:5.活度a 的求算公式 (1)蒸气压法溶剂:溶质:(2)凝固点下降法溶剂:6.逸度因子:B B B p p ~=ϕ活度因子:BB B B B B x p px a f *==,求法:普遍化逸度因子图。
溶质还用B γ或B y 表示 渗透因子:AAx a g ln ln =(溶剂);稀溶液渗透因子:ϕ分配定律:)()(βαB B b b K =;A B B b c ρ≈;)()(βαB B cc c K = 五.稀溶液的依数性 1.蒸气压下降:2.凝固点降低:B f f b K T •=∆,其中:3.沸点升高:B b b b K T •=∆,其中:4.渗透压:联系上面稀溶液的四个依数性之间的关系式是:。
六.液态理想混合物性质,>0, <0第四章 练习题1. 在恒温、恒压下,往无限大量的A 、B 混合物中加入1mol 纯组分B ,充分混合后,系统熵的增量等于( ):(A ) *m, B S (B )B S (C ) 两者都不是2. C 10o-、101.325kPa 的过冷水的化学势l μ( )同温同压下冰的化学势s μ。
(A )大于 (B )小于 (C )等于 (D )不能确定3. 在恒温、恒压下,理想液态混合物混合过程的G mix ∆( ) (A )< 0 (B )> 0 (C )= 0 (D )不能确定4. 下列几个偏导数式中,何者不为化学势( )(A )c ,,B ()BS V n n Un '≠∂∂ (B ) c B ,,B ()T p n n A n '≠∂∂(C )B C n n p T B n H≠∂∂/,,)((D) B C nn p S Bn G ≠∂∂/,,)(5.C 30o时,组成为A 0.40x =的A 、B 液态混合物中组分A 的蒸气压*A A 0.42p p =(其中*A p 为C 30o 时纯组分A 的饱和蒸气压)。
此液态混合物中组分A 的活度系数f =( ) (A )0.95 (B )1.24 (C )1.05 (D )0.576. T 、p 及组成一定的某二元液态混合物,系统的Gibbs 函数为( )(A )**A m,A B m,B n G n G + (B )A A B B n n μμ+(C )不能确定7.将蔗糖溶于纯水中形成稀溶液,与纯水比较,其沸点( ) (A )降低 (B )升高 (C )不能确定8.两只烧杯各有1kg 水,向A 杯中加入0.01mol 蔗糖,向B 杯中加入0.01molNaCl,待两种溶质完全溶解后,两只烧杯按同样速度冷却降温,则有 。
A. A 杯先结冰B. B 杯先结冰C.两杯同时结冰D.不能预测结冰的先后9.理想液态混合物中组分B 的化学势表达式*B ,B B ln x RT x μμ=+,其中*,B x μ对应的状态为( )(A )纯气态B 组分 (B )纯液态B 组分(C )标准压力下的纯液态B 组分10.恒T、p下A、B组成的二组分系统,若A的偏摩尔熵增大,则B的偏摩尔熵()(A)增加(B)减小(C)可能增大,也可能减小11.对二组分理想混合物,下面哪种说法不一定正确(A)任一组分都遵从Roault定律(B)溶液沸点一定升高(C)形成溶液过程无热效应(D)形成溶液过程ΔS一定大于零12.对于非电解质溶液,以下的说法正确的是:(A)溶液就是多种液态物质组成的混合物(B)理想溶液和理想气体一样,各分子间无作用力(C)在一定的温度下,溶液的蒸气压总小于溶剂的蒸气压(D)在一定浓度范围内,真实溶液的某些热力学性质与理想溶液相近似13.关于偏摩尔量,下面的叙述不正确的是:(A)偏摩尔量是强度性质,其值与物质的数量无关(B)偏摩尔量的值不能小于零(C)体系的强度性质无偏摩尔量(D)纯物质的偏摩尔量等于它的摩尔量答案14.摩尔沸点升高常数k b,其值只决定于:(A)溶剂的本性(B)溶质本性(C)溶液浓度(D)溶液温度答案15.在α、β两相中含A、B两种物质,当达平衡时,正确的是。
A. B. C.答案16.在373.15K,101325Pa下,与的关系是。
A.>;B.=;C.<; D.无法确定答案17.只做膨胀功的封闭体系,的值。
A.大于零;B.小于零;C.等于零;D.无法确定答案18.多组分体系中,物质B的化学势随压力的变化率,即的值。
A.>0 B.<0 C.=0 D.无法确定答案19.温度为T时,纯液体A的饱和蒸汽压为p A*,化学势为μA*,在1 p时,凝固点为,向A中加入少量溶质形成稀溶液,该溶质是不挥发的,则p A、μA、T f的关系是。
A.p A*<p A ,μA*<μA ,<T f ;B.p A*>p A ,μA*<μA ,<T f ;C.p A*>p A ,μA*<μA ,>T f ;D.p A*>p A ,μA*>μA ,>T f答案例1.液体A与B形成理想溶液。
现有一含A的物质的量分数为0.4的蒸气相,放在一个带活塞的汽缸内,恒温下将蒸气慢慢压缩。
已知和分别为0.4Pθ和1.2Pθ,计算:(1)当液体开始凝聚出来时的蒸气总压。
(2)该溶液在正常沸点T b时的组成。
解:(1)液体刚凝聚时呈现两相平衡,气相的总压与液相的组成的关系为:因:,所以:(2)在正常沸点T b 时:例2. 1.22×10-2kg 苯甲酸,溶于0.10kg 乙醇后,使乙醇的沸点升高了1.13K ,若将1.22×10-2kg 苯甲酸溶于0.10kg 苯中,则苯的沸点升高了1.36K 。
计算苯甲酸在两种溶剂中的摩尔质量。
计算结果说明了什么问题。
解:在乙醇中,K b =1.19K ·kg ·mol -1AB Bb B b b W M W K b K T =•=∆,所以:在苯中,K b =2.6K ·kg ·mol -1,上述计算结果说明,苯甲酸在苯中以双分子缔合。
例3. 三氯甲烷(A)和丙酮(B)所成的溶液,若液相的组成为x B=0.713,则在301.354K时的总蒸气压为29.39kPa,在蒸气中y B=0.818.已知在该温度时,纯三氯甲烷的蒸气压为29.57kPa,试求:(1)混合液中三氯甲烷的活度。
(2)三氯甲烷的活度系数。
解:(1)(2)例4. 在300K时,液态A的蒸气压为37.33kPa,液态B的蒸气压为22.66kPa,当2molA和2molB混合后,液面上蒸气的压力为50.66kPa,在蒸气中A的摩尔分数为0.60。
假定蒸气为理想气体,求:(1)求溶液中A和B的活度。
(2)求溶液中A和B的活度系数。
(3)求mix G。
(4)若溶液是理想溶液,则mix G id的值为多少?解:(1)(2),(3)(4)。
