2016高考化学二轮复习 专题13 钠、镁、铝及其化合物课件
高考化学一轮复习-镁、铝及其化合物课件(109张)

课
科 素 养
⑤_F_e_2_O_3_+__2_A_l_=_高=_=_温=_=__2_F_e_+__A_l_2O__3____
后 限
应
时
用 创 新
⑥_2_A_l_+__3_C_u__S_O_4_=_=_=_3__C_u_+__A__l2_(_S_O_4_)_3 __
集 训
·
返 首 页
24
3.铝热反应实验探究
真 题 验 收
__2_M_g_O__+__C__。现象为:剧烈燃烧,发出强烈的光,同时有白色固
学
课
科 素
体和黑色固体生成。
后
养
限
应 用
时
创
集
新
训
返 首 页
·
7
·
必 备
2.从海水中提取镁
课 堂
知
反
识 关
(1)工艺流程
·
馈 真
键
题
能
验
力
收
学
课
科 素
后
养
限
应 用
时
创
集
新
训
返 首 页
·
8
(2)基本步骤及主要反应
课 后
养
限
应 用 创 新
①2Mg+O2=点==燃==2MgO、②Mg+Cl2=点==燃==MgCl2、
时 集 训
③3Mg+N2=点==燃==Mg3N2。
返
首
页
·
5
·
必 备 知
(2)与水或酸的反应
课 堂 反
识
馈
关 键
①镁与水的反应:镁不易与冷水反应,能与沸水反应,反应的 真 题
·
【高考】化学二轮强化突破课件钠、镁、铝及其化合物ppt课件

5.(2018黑龙江齐齐哈尔五校期末联考,7)铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工 业上经过下列工艺可以冶炼金属铝:
铝土矿 a
b c d Al
下列说法中错误的是 ( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价不相同 C.③中需要通入过量的二氧化碳 D.④进行的操作是加热,而且d一定是氧化铝
SiO2,SiO2不与Ba(HCO3)2溶液反应,D不
2.(2018陕西西安中学期中,19)向含Na+、Al3+、Fe3+、Fe2+、Cl-、S O24 的水溶液中,加入足量的 Na2O2固体,充分反应后再加入过量的稀盐酸,所得溶液与起始溶液相比,上述离子数目没有变 化的有 ( ) A.2种 B.3种 C.4种 D.5种
答案 A Na2O2与水反应生成NaOH和O2,Na+数目增加;Al3+
Al
O
2
Al3+,
Al3+数目未变;Fe2+
Fe(OH)2
Fe(OH)3
Fe3+,Fe2+最终变成Fe3+,故Fe2+数目减少,Fe3+
数目增加;稀盐酸引入了Cl-,Cl-数目增加;S
O
2 4
未参与反应,数目未变,故A正确。
3.(2018内蒙古呼伦贝尔一模,11)下列说法中正确的是 ( ) A.在无色溶液中可能大量存在H+、Cl-、S2 O32 、K+ B.钠、钾、镁等活泼金属着火时,不能用泡沫灭火器灭火 2气体含有的氧原子数约为3.01×1023 D.NO2与H2O反应,氧化剂与还原剂的物质的量之比为2∶1
B组 2017—2019年高考模拟·专题综合题组
铝镁及其化合物优质课件 高三高考化学一轮复习ppt

明铝与这两种溶液不能发生化学反应。( × )
(5)Al既能溶于强酸,又能溶于强碱,所以说“Al既有金
属性,又有非金属性” 属于两性物质。( × )
铝镁及其 化合物 优质课 件 高三 高考化 学一轮 复习p t
随堂练习
金版学案P33第5题
1.(2019·福州质检)科技工作者提出用铝粉处理含亚 硝酸盐废水的思路:调节亚硝酸盐废水的酸碱性,使
随堂练习
除杂
2.(2018·四川眉山模拟)下列除去杂质的方法不正确的
是( B )
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,
过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液, 充分反应,过滤,向滤液中通入过量CO2后过滤 D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分 反应,过滤、洗涤、干燥得到MgO
铝镁及其 化合物 优质课 件 高三 高考化 学一轮 复习pp t
随堂练习
1.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为 原料冶炼铝的工艺流程如下:
下列叙述正确的是( D )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸 B.反应①过滤后所得沉淀为氢氧化铁 C.图中所示转化反应都不是氧化还原反应 D.反应②的化学方程式为NaAlO2+CO2+2H2O=
4.制备
2Al2O3(熔融冰)电=晶解=石4Al+3O2↑
5.铝的用途
纯铝用作导线,铝合金用于制造汽车、飞机、生活用 品等。
补充:铝热反应
引燃剂 助燃剂
反应现象:镁条剧烈燃烧, 放出大量热,发出耀眼白光, 纸漏斗内剧烈反应,纸漏斗 被烧穿,有红热的熔融物落 入沙中。
高考总复习《化学》钠、镁、铝及其化合物ppt课件

答案:
(1)Na2O2 O2 NaOH (2)NA(或 6.02×1023) (3)2Na2O2+2H2O===4Na++4OH-+O2↑ (4)1.12
考点二 碳酸钠、碳酸氢钠的性质与应用
[固基础——基础知识抓起来]
(一)碳酸钠与碳酸氢钠的性质及用途 1.物理性质
名称
碳酸钠
碳酸氢钠
化学式 __N_a_2_C_O__3 _
2.遇 KMnO4 等强氧化剂时,表现出还原性,氧化产物为_O__2 。 3.遇 CO2、H2O、H+时则会发生自身的氧化还原反应。
[提能力——重难知识强起来] 1.盐溶液与 Na 反应的思维流程
2.Na2O2 与 CO2、H2O 反应中有关量的关系 (1)物质的量关系 无论是 CO2 或 H2O(g)的单一物质还是二者的混合物,通过 足量的 Na2O2 时,CO2 或 H2O(g)与放出 O2 的物质的量之比均 为 2∶1,即气体减小的体积等于生成 O2 的体积。 (2)固体质量关系 相当于固体(Na2O2)只吸收了 CO2 中的“CO”,H2O 中的 “H2”;可以看作发生相应的反应:Na2O2+CO===Na2CO3、 Na2O2+H2===2NaOH(实际上两反应不能发生)。 (3)先后顺序关系 一定量的 Na2O2 与一定量 CO2 和 H2O(g)的混合物的反应, 解决问题时可视作 Na2O2 先与 CO2 反应,待 CO2 反应完成后, Na2O2 再与 H2O 发生反应。
6.下列对于过氧化钠的叙述中,正确的是
()
A.将过量 Na2O2 投入紫色石蕊溶液中,溶液变蓝 B.1 mol Na2O2 与 H2O 完全反应,转移 2 mol 电子
C.充分加热等物质的量的 Na2O2 和 NaHCO3 的混合物,剩
高考化学二轮复习专项测试十三考点二镁、铝及其化合物的性质(2)

2020届高考化学二轮复习专项测试专题十三考点二镁、铝及其化合物的性质(2)1、镁、铝能够在空气中稳定存在的原因是( )A.性质不活泼,不与空气中的成分反应B.镁、铝与氧气反应的速率极慢C.经过了特殊工艺处理D.与氧气反应在表面形成了氧化物保护膜2、将镁、铝、硅的混合物分为等质量的两份。
一份跟足量的NaOH溶液反应。
另一份跟足量H一样多。
则镁与硅物质的量之比为( )的盐酸反应,最终产生的2A.2:1 B.4:1 C.1:1 D.3:13、某兴趣小组在实验室用Al、稀H2SO4、NaOH溶液制备1摩尔Al(OH)3。
设计如下三种方案: 方案Ⅰ:向Al中加入NaOH溶液,至Al刚好完全溶解,得溶液①。
向溶液①中加硫酸至刚好沉淀完。
过滤、洗涤、干燥。
方案Ⅱ:向Al中加入硫酸,至Al刚好完全溶解,得溶液②。
向溶液②中加NaOH溶液至刚好沉淀完。
过滤、洗涤、干燥。
方案Ⅲ:将Al按一定比例分为两份,按前两方案先制备溶液①和溶液②。
然后将两溶液混和。
过滤、洗涤、干燥。
下列说法不正确的是( )A.三种方案转移电子数一样多B.方案Ⅲ所用硫酸的量最少C.方案Ⅲ比前两个方案更易控制酸碱的加入量D.采用方案Ⅲ时,用于制备溶液①的Al占总量的0.254、将镁铝合金溶于100mL稀硝酸中,产生1.12L NO气体(标准状况),向反应后的溶液中加入NaOH溶液,加入10mL时开始产生沉淀,加入60mL时沉淀最多,继续加入至70mL时沉淀量不再变化。
据此判断下列说法不正确的是( )A.沉淀最大质量为4.08gB.原溶液中c(HNO3)=2.6mol/LC.m(Mg):m(Al)=8:9D.氢氧化钠溶液浓度为3mol/L5、Al 2O 3是合成气直接制备二甲醚反应催化剂的主要成分之一。
工业上用铝土矿(含Fe 2O 3及其他不反应的杂质)制备较高纯度Al 2O 3的主要工艺流程有很多步骤,下列操作步骤中最恰当的组合是( ) ①加盐酸溶解 ②加烧碱溶液溶解 ③过滤④通入过量CO 2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液 ⑦洗涤并锻烧A.①⑥③④③⑦B.②③④③⑦C.②③⑤③⑦D.①③⑤③⑦ 6、将镁铝合金溶于100mL 稀硝酸中,产生1.12L NO 气体(标准状况),向反应后的溶液中加入NaOH 溶液,产生沉淀情况如图所示。
专题复习:钠镁铝及其化合物
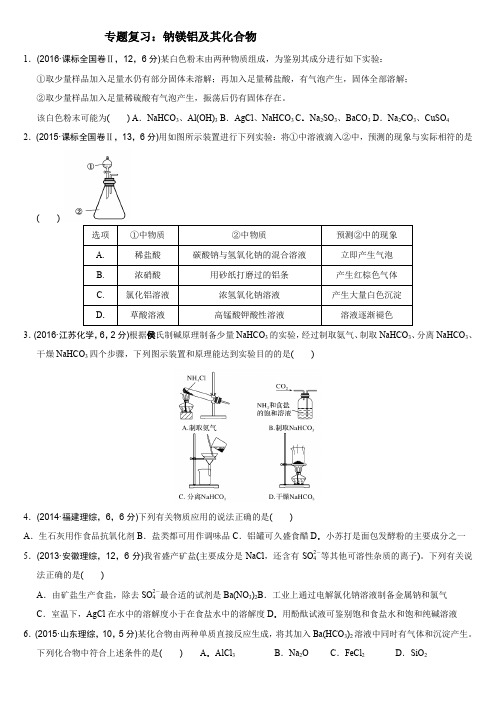
专题复习:钠镁铝及其化合物1.(2016·课标全国卷Ⅱ,12,6分)某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为() A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3 D.Na2CO3、CuSO4 2.(2015·课标全国卷Ⅱ,13,6分)用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是()3.(2016·江苏化学,6,2分)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是()4.(2014·福建理综,6,6分)下列有关物质应用的说法正确的是()A.生石灰用作食品抗氧化剂B.盐类都可用作调味品C.铝罐可久盛食醋D.小苏打是面包发酵粉的主要成分之一5.(2013·安徽理综,12,6分)我省盛产矿盐(主要成分是NaCl,还含有SO2-4等其他可溶性杂质的离子)。
下列有关说法正确的是()A.由矿盐生产食盐,除去SO2-4最合适的试剂是Ba(NO3)2B.工业上通过电解氯化钠溶液制备金属钠和氯气C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液6.(2015·山东理综,10,5分)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是() A.AlCl3B.Na2O C.FeCl2D.SiO27.(2013·山东理综,9,5分)足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是( )A .氢氧化钠溶液B .稀硫酸C .盐酸D .稀硝酸8.(2016·浙江理综,27Ⅰ,6分)化合物Mg 5Al 3(OH)19(H 2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg 5Al 3(OH)19(H 2O)4=====△27H 2O ↑+10MgO +3Al 2O 3(1)写出该化合物作阻燃剂的两条依据________。
高三化学高考备考一轮复习 镁、铝及其化合物 课件

2Al + 6HCl === 2AlCl3+3H2↑
6 mol
3 mol
3 mol·L-1×0.1 L 0.15 mol
则Al与NaOH反应生成的H2为0.15 mol×2=0.3 mol。 2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2×27 g
3 mol
5.4 g
0.3 mol
即投入的铝粉为5.4 g。
□△
16 Mg+2H2O=====Mg(OH)2+H2↑
与酸反应 与碱反应
①与H+:
□ □ 17 2Al+6H+===2Al3++3H2↑ 19 Mg+2H+===Mg2++H2↑,相同条 □ 件下,反应速率比Al 20 快
②在冷的浓硫酸、浓硝酸中
□18 钝化
与OH-:
□21 2Al+2OH-+2H2O
Mg2++H2O
Al2O3+2OH-===2AlO- 2 +H2O
(2)Mg(OH)2与Al(OH)3的比较
物理性质
Mg(OH)2 白色固体,
不溶于水
Al(OH)3 不溶于水的白色胶状固体,具有
吸附 性
化学性质
不稳定性 不稳定性:
△ 2Al(OH)3=====Al2O3+3H2O
两性: 碱性,溶于
延展 性、导电性和
(3)对比掌握镁、铝的化学性质
铝
①与空气中的氧气形成致
能与非 密的氧化膜
金属单 质反应
②与氯气加热反应:
□△
13 2Al+3Cl2=====2AlCl3
镁
①在空气中燃烧发出耀眼的 □14 白 光
②与氮气反应:
□ 点燃
15 沸水反应:
(4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分 别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2, 则加入铝粉的质量为____A____(填字母)。
2016高考化学专题12钠镁铝及其化合物

③与盐酸反应
2Na+2H+===2Na++H2↑。 离子方程式:________________________ (3)钠的制取及保存
电解 2NaCl( 熔融 )===== 2Na+Cl2↑ ①制取:化学方程式为:_________________________ 。
石蜡油或煤油中 。 ②保存:密封保存,通常保存在_______________
Na2O+2HCl===2NaCl 与酸反应 _____________________ (盐酸) 主要性质 主要用途
+ H2 O ________
具有碱性氧化物通性
用于制取少量Na2O2、
烧碱
强氧化剂、漂白剂、供
氧剂、消毒剂
核心要点突破
考纲考向分析
3.碳酸钠与碳酸氢钠 Na2CO3 俗名 颜色、 纯碱或苏打 ___________ 白色粉末,碳酸钠结 NaHCO3 小苏打 ________
考纲考向分析
核心要点突破
(4)用途 ①制取Na2O2等化合物。
②钠、钾合金(液态)可用于原子反应堆的导热剂。
③用作电光源,制作高压钠灯。 ④冶炼某些金属。 金属钠具有强的还原性,熔融状态下可以用于制取金属,如: 熔融 4NaCl+Ti。 4Na+TiCl4 =====
考纲考向分析
核心要点突破
2.氧化钠和过氧化钠
较剧烈,放出CO2的
+ HCO- 3 +H 速度快___________
反应
+ HCO- 3 +H ===CO2↑+H2O ________________________
===CO2↑+H2O __________________
NaHCO 3+NaOH=== __________________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
答案:C
化及它们在实际生活、生产中的应用为载体的综合实验题的趋 势较大。
考题引路
考例: (2015· 河北衡水模拟 ) 常温下,将一定量的钠铝合 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的
体积关系如图所示,则下列说法正确的是( )
g/mol+0.02 mol×27 g/mol=1.46 g,故A错误;
由 Al(OH)3 + 3HCl===AlCl3 + 3H2O 可知,溶解沉淀需要 0.06 mol HCl,其体积为60 mL,则V2为40 mL+60 mL=100 mL,故D错误;由上述计算可知,生成沉淀0.02 mol,其质量 为 0.02 mol×78g/mol = 1.56 g , C 正确;由 2Na + 2H2O === 2NaOH + H2↑ 、 2Al + 2H2O + 2NaOH===2NaAlO2 + 3H2↑ 可 知,生成氢气的物质的量为0.02 mol+0.03 mol=0.05 mol,在 标准状况下的体积为0.05 mol×22.4 L/mol=1.12 L,B错误。
解析:由图象可知,向合金溶解后的溶液中加盐酸,先发 生 反 应 NaOH + HCl===NaCl + H2O , 后 发 生 反 应 NaAlO2 + HCl + H2O===NaCl + Al(OH)3↓ , 最 后 发 生 反 应 Al(OH)3 + 3HCl===AlCl3 + 3H2O,合金溶解后剩余的氢氧化钠的物质的
A.原合金质量为0.92 g
B.产生氢气的体积为896 mL(标准状况下)
C.图中m的值为1.56 D.图中V2的值为60
立意与点拨:本题考查钠、铝及其化合物的性质,意在考
查考生根据化学图象分析、解决问题的能力。Na先与H2O反应 生成 NaOH , NaOH 再将 Al 溶解后有剩余,滴加盐酸时要考虑 反应的先后顺序。
第一部分
微专题强化练
第一部分 专题十三 钠、镁、铝及其化合物
1
考 向 分 析
2
考 题 引 路
3
强 化 训 练
考向分析
2016年高与对本专题内容的考查仍将以金属及其化合物的
性质在日常生活、生产中的应用为主,题型以选择题、综合推 断题、实验题为主,分值为4~15分。
2016年的高考中,考查以元素单质及其化合物之间相互转
量为0.02 L×1 mol/L=0.02 mol,则V1为0.02 mol÷1 mol/L=
0.02 L=20 mL,生成沉淀时消耗的盐酸为40 mL-20 mL=20 mL,其物质的量为0.02 L×1 mol/L=0.02 mol,生成沉淀的物 质的量为0.02 mol,合金中钠的物质的量为0.04 mol,铝的物质 的量为0.02 mol。由原子守恒可知,合金的质量为0.04 mol×23
