江苏省丹阳高级中学苏教版高中化学必修二课件:专题2 第三单元 化学能与电能的转化——化学电源
合集下载
苏教化学必修2专题2第三单元 化学能与电能的转化(共19张PPT)

病例分析
病例分析
病例分析
你能为她开一个药方吗?
H+ Zn2+ H+
SO42-
H2SO4 负极:电子流出
℮-
负极 【氧化反应】
正极【还原反应】
电解质溶液
阴离子
阳离子
实验探究-----原电池构成的条件之一
实验装置
能否产生 电流
不能
能
能
构成原电
池条件一 活泼性不同的两个电极
实验探究-----原电池构成的条件之二
实验序号
实验 4,5
实验装置
能否产生电 流
一、原电池
1、定义:把化学能转化为电能的装置
问题探究
该原电池的工作原理是怎样的?
2、工作原理: 氧化还原反应
I
氧化剂(H+)在铜极上 得到电子,发生还 原反应
G
e-
e-
2H+ + 2e- = H2
Cu
正极
还原剂(Zn)失去电 子,发生氧化反应
Zn - 2e- = Zn2+
Zn
负极
正极:电子流入
H2
2-3-1化学能转化为电能
活动与探究 实验1 实验2 实验3
实验现象
解释或结论
锌片表面有气泡产 生,锌片逐渐溶解 铜片表面没有气泡 产生,不溶解 锌片表面有气泡产 生,锌片逐渐溶解 铜片表面没有气泡 产生,不溶解
锌与稀硫酸反应 铜与稀硫酸不反 应
锌与稀硫酸反应 铜与稀硫酸不反 应
大量气泡从铜片逸 出,但不溶解。锌 片部分溶解。
(工作原理) 正极(Cu):电子流入的极(一般是较不活泼金
属或导电非金属)。
2H+ + 2e-=H2↑ 发生还原反应
苏教版高中化学必修2-专题二 第三单元 化学能转化为电能 课件 (共16张PPT)

负极:失去电子,发生氧化反应
锌片 Zn – 2e- = Zn2+
正极:得到电子,发生还原反应
铜片 2H+ + 2e- = H2↑
总反应:Zn + 2H+ = Zn2++H2↑
2、化学电池的反应本质:氧化还原反应
要形成原电池需要哪些条件呢?
分组实验探究二
实验3. 利用生活中常见物品:水果、小 刀、铅笔、牙签、铜片你能设计出原电 池吗?请写出实验方案。请大家展示
实验现象:
电流计指针发生偏 转,Cu片上有气泡 产生, Zn片溶解
探究讨论:
1.铜片上的气体是什么? H2 2.电流计发生偏转说明了什么问题? 有电子通过
3.电子从何而来?如何移动?
锌片: 锌失去电子 Zn – 2e- = Zn2+
铜片: H+得电子
2H+ + 2e- = H2↑
4.铜起到了什么作用?能否用碳棒代替?
专题2
第三单元
第1课时 化学能转化为电能
《寻秦记 》点击此处:下一张
分组实验探究一:
实验一 :将铜片和锌片分别插入稀硫酸溶液中, 观察实验现象
实验现象:
锌片溶解,锌片上有气 泡产生
2e-
Zn + 2H+ = Zn2++H2↑
铜片上没有明显变化
实验二:将铜片和锌片用导线相连插入稀硫酸中,观察铜片 现象;再在导线中间串联一个电流表,观察现象
分组实验探究二:探究原电池形成的条件
组
材料组合
别
1 小刀、苹果、石墨
2 小刀、苹果、牙签
3 小刀、香蕉、锌片
4 小刀、橙子、小刀 5 Cu、橙子、Cu 6 Cu、食用油、Zn
锌片 Zn – 2e- = Zn2+
正极:得到电子,发生还原反应
铜片 2H+ + 2e- = H2↑
总反应:Zn + 2H+ = Zn2++H2↑
2、化学电池的反应本质:氧化还原反应
要形成原电池需要哪些条件呢?
分组实验探究二
实验3. 利用生活中常见物品:水果、小 刀、铅笔、牙签、铜片你能设计出原电 池吗?请写出实验方案。请大家展示
实验现象:
电流计指针发生偏 转,Cu片上有气泡 产生, Zn片溶解
探究讨论:
1.铜片上的气体是什么? H2 2.电流计发生偏转说明了什么问题? 有电子通过
3.电子从何而来?如何移动?
锌片: 锌失去电子 Zn – 2e- = Zn2+
铜片: H+得电子
2H+ + 2e- = H2↑
4.铜起到了什么作用?能否用碳棒代替?
专题2
第三单元
第1课时 化学能转化为电能
《寻秦记 》点击此处:下一张
分组实验探究一:
实验一 :将铜片和锌片分别插入稀硫酸溶液中, 观察实验现象
实验现象:
锌片溶解,锌片上有气 泡产生
2e-
Zn + 2H+ = Zn2++H2↑
铜片上没有明显变化
实验二:将铜片和锌片用导线相连插入稀硫酸中,观察铜片 现象;再在导线中间串联一个电流表,观察现象
分组实验探究二:探究原电池形成的条件
组
材料组合
别
1 小刀、苹果、石墨
2 小刀、苹果、牙签
3 小刀、香蕉、锌片
4 小刀、橙子、小刀 5 Cu、橙子、Cu 6 Cu、食用油、Zn
苏教化学必修2专题2第三单元 化学能和电能的转化(共18张PPT)

我来归纳
根据刚才的实验探究你知道什么是电解池吗? 请归纳出电解池的反应原理和形成的条件?
小结 电解原理
电解的概念:使电流通过电解质溶液而在阴 阳两极发生氧化还原的过程。
电解池:借助氧化还原反应,把电能转化为 化学能的装置。
电极 阳极:与电源正极相连的一极 阴极:与电源负极相连的一极
电解池构成条件: 惰性电极: C、Pt、Au
溶液中的阴离子:Cl-、OH- Cl-> OH-
阳极:2Cl- - 2e- = Cl2 ↑
阴极:2H+ + 2e- = H2 ↑
总化学方程式:2NaCl
+
电解
2H2O== H2
↑
+
Cl2
↑
+
2NaOH
电解
离子方程式:2Cl- + 2H2O ==H2 ↑ + Cl2 ↑ + 2OH-
联系与 比较
电解池与原电池一字之差, 区别何在?
通电
Al 、 O2 2Al2O3 == 4Al +3 O2 ↑
激情互学
通过观察视频,完成P44观察与思考。 探究电解池的工作原理。
电 解 氯 化 铜 溶 液
交流与讨论
1.你是怎样判断电解池的阴阳极的?电子的流动方向如何? 与电源正极相连的为阳极,与电源负极相连的为阴极
电子:电源负极流向阴极,阳极流向电源正极
两个电极 活泼电极: Fe、Cu、Ag等
(两电极可同我来练习
若X、Y都是石墨棒,a是饱和NaCl溶液,请 同学们试着写出阴、阳两极的电极反应式?
阴极:
阳极:
总反应:
标出电极名称,并写出电解 NaCl溶液的方程式
江苏省丹阳高级中学苏教版高中化学必修二课件专题2第三单元化学能与电能的转化化学能转化为电能[可修改版

必修二课件专题2第 三单元化学能与电 能的转化化学能转
化为电能
厚德 明理 笃行
两颗假牙引发的病例
英国有一位贵妇人因蛀牙补过一颗黄金假牙, 后因车祸又补了颗不锈钢假牙。从此出现头痛, 失眠, 心情烦躁等症状, 四处求医总是找不到病 因。直到在一次舞会上巧遇一位著名化学家, 这 位化学家帮她找到病因, 病痛才得以解除。
A>B C>D A>C
B、D相连时, 电子由D经导线流向B, D>B
则此4种金属的活动性由强到弱的顺序为(② )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
3. 请指出原电池正负极名称, 并写出电极反应式.
负极(Fe): Fe-2e-=Fe2+ 正极(Ag): Cu2++2e-=Cu 总反应: Fe+Cu2+=Fe2++Cu
1、电解液:
。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极:
.
正极:
Cu+2FeCl3= 2FeCl2 +CuCl2
设计成一个原电池。
1、电解液:
。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极:
.
正极:
.
4. 原电池的设计
(3) 将氧化还原反应:2Al+6HCl=2AlCl3+3H2↑ 设计成一个原电池。
1.思考:下列装置能产生电流的是
Zn Cu
A
HCl
Zn
Cu
D
H 2SO 4 H 2SO 4
Zn
Cu
Zn
Zn
B
c
化为电能
厚德 明理 笃行
两颗假牙引发的病例
英国有一位贵妇人因蛀牙补过一颗黄金假牙, 后因车祸又补了颗不锈钢假牙。从此出现头痛, 失眠, 心情烦躁等症状, 四处求医总是找不到病 因。直到在一次舞会上巧遇一位著名化学家, 这 位化学家帮她找到病因, 病痛才得以解除。
A>B C>D A>C
B、D相连时, 电子由D经导线流向B, D>B
则此4种金属的活动性由强到弱的顺序为(② )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
3. 请指出原电池正负极名称, 并写出电极反应式.
负极(Fe): Fe-2e-=Fe2+ 正极(Ag): Cu2++2e-=Cu 总反应: Fe+Cu2+=Fe2++Cu
1、电解液:
。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极:
.
正极:
Cu+2FeCl3= 2FeCl2 +CuCl2
设计成一个原电池。
1、电解液:
。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极:
.
正极:
.
4. 原电池的设计
(3) 将氧化还原反应:2Al+6HCl=2AlCl3+3H2↑ 设计成一个原电池。
1.思考:下列装置能产生电流的是
Zn Cu
A
HCl
Zn
Cu
D
H 2SO 4 H 2SO 4
Zn
Cu
Zn
Zn
B
c
苏教版高中化学必修2-专题二 第三单元 化学能转化为电能 课件 (共16张PPT)

活动三:体会原电池原理的应用
1.金属的腐蚀和防护 2.设计化学电源 3.加快某些化学反应速率 4.判断金属的活动性强弱
课堂小结
通过本节课的学习,你有什么收获? 还有哪些疑惑?
B
稀硫酸
C
实验指导:
1.按图示进行实验操作。
2.观察:金属铜片上是否有气泡产生。
3.在导线中间连接一电流计,观察指针是否发生偏转。
活动一:分析原电池的工作原理
在原电池外电路中,电子的流动方向是怎样 的?在原电池溶液中,各离子如何移动?
Zn
Cu
H2SO4
我来归纳
你能分析出原电池的工作原理吗?
Zn
Cu
负极:较活泼的金属 正极:较不活泼的金属、石墨等
活动二:探究原电池的形成条件
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中活动二:探究原电池的形成条件
(不可以)
形成条件三:必须形成闭合回路
原电池的形成条件:
(2)有活泼性不同的两个电极 (3)两电极都接触电解质溶液 (4)形成闭合回路
我来判断
根据原电池形成的条件判断下列情况是否形成原电池?
Zn A Cu Zn A Cu Fe A C(石墨) Zn A Cu
稀H2SO4
A
Zn A Zn
CuSO4 溶液
稀H2SO4
B
C
Fe A Cu
稀H2SO4
D
Cu A Ag
稀H2SO4 E
酒精 F
稀H2SO4 G
我来设计
已知下列材料:Fe、Mg、Cu、石墨、硫酸铜 溶液、酒精、稀硫酸 请你自己设计原电池, 并写出正负极的电极反应式?
电动汽车
第三单元 化学能与电能的转化 课题1 化学能转化为电能
苏教化学必修2专题2第三单元 化学能和电能的转化(共17张PPT)

④能自发进行氧化还原反应
1、判断下列哪些装置构成了原电池?
练 若不是,请说明理由;若是,请指出正 习 负极名称,并写出电极反应式。
×①
×②
√③
×④
负极: Zn-2e-=Zn2+
正极: 2H++2e-=H2↑ 总反应:Zn+2H+=Zn2++H2↑
④ (∨)
CuCl2溶液
负极: Zn-2e-=Zn2+ 正极: Cu2++2e-=Cu 总反应:Zn+Cu2+=Zn2++Cu
活动探究 Zn
Cu
大量气泡从铜 实验现象 片逸出,锌片
部分溶解
稀H2SO4
离子方程式 Zn + 2H+ = Zn 2+ +H2↑
1、H2是怎么来的?
思考问题 寻找答案
2、H+得到的电子是哪种金属失去的呢? 3、锌失去的电子是否通过溶液流到铜片上的? 4、在这个过程中Cu起什么作用?
5、你怎样才能知道导线中有电子通过?
组内交流 列出想法
化学能直接转化为电能
3、电子和电流方向: 电子流向: 负极 →外线路→正极 电流方向: 正极→外线路→负极→溶液→正极
阳离子向正极移动
3、构成原电池的条件
①有两种活动性不同的金属(或非金属单 质)作电极 负:较活泼金属
正:较不活泼金属或非金属 ②有合适的电解质溶液
③形成闭合电路
2Fe3++Fe=3Fe2+
( Fe∣Fe2(SO4)3∣C )
5. 原电池的设计
(3) 将氧化还原反 应:2Al+6HCl=2AlCl3+3H2↑ 设计成一个原电池。
1、判断下列哪些装置构成了原电池?
练 若不是,请说明理由;若是,请指出正 习 负极名称,并写出电极反应式。
×①
×②
√③
×④
负极: Zn-2e-=Zn2+
正极: 2H++2e-=H2↑ 总反应:Zn+2H+=Zn2++H2↑
④ (∨)
CuCl2溶液
负极: Zn-2e-=Zn2+ 正极: Cu2++2e-=Cu 总反应:Zn+Cu2+=Zn2++Cu
活动探究 Zn
Cu
大量气泡从铜 实验现象 片逸出,锌片
部分溶解
稀H2SO4
离子方程式 Zn + 2H+ = Zn 2+ +H2↑
1、H2是怎么来的?
思考问题 寻找答案
2、H+得到的电子是哪种金属失去的呢? 3、锌失去的电子是否通过溶液流到铜片上的? 4、在这个过程中Cu起什么作用?
5、你怎样才能知道导线中有电子通过?
组内交流 列出想法
化学能直接转化为电能
3、电子和电流方向: 电子流向: 负极 →外线路→正极 电流方向: 正极→外线路→负极→溶液→正极
阳离子向正极移动
3、构成原电池的条件
①有两种活动性不同的金属(或非金属单 质)作电极 负:较活泼金属
正:较不活泼金属或非金属 ②有合适的电解质溶液
③形成闭合电路
2Fe3++Fe=3Fe2+
( Fe∣Fe2(SO4)3∣C )
5. 原电池的设计
(3) 将氧化还原反 应:2Al+6HCl=2AlCl3+3H2↑ 设计成一个原电池。
苏教化学必修2专题2第3单元 化学能和电能的转化(共16张PPT)
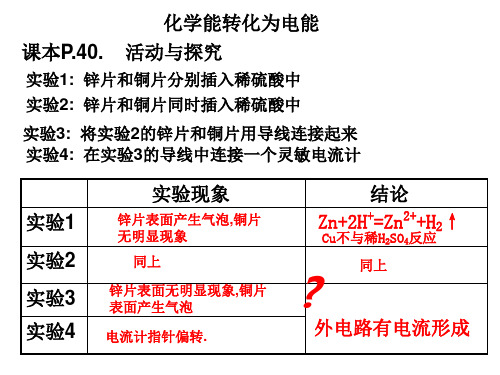
化学能转化为电能 课本P.40. 活动与探究
实验1: 锌片和铜片分别插入稀硫酸中 实验2: 锌片和铜片同时插入稀硫酸中
实验3: 将实验2的锌片和铜片用导线连接起来 实验4: 在实验3的导线中连接一个灵敏电流计
实验1 实验2 实验3 实验4
实验现象
锌片表面产生气泡,铜片 无明显现象
同上
锌片表面无明显现象,铜片 表面产生气泡
A.原电池是把电能转化为化学能的装置 B.原电池中电子流出的一极是正极,发生氧化反应 C.原电池两极均发生氧化还原反应 D.原电池中的阳离子向正极移动
2.把a、b、c三种金属片浸泡在稀H2SO4中。 若a、b相连 时,a为负极;b、c相连时,c 为负极;a、c相连时,
B c上有气泡冒出。 则这四种金属的活动性顺序( )
流入铜极.
正极 H+在铜极上得到电 子,发生还原反应 2H+ +2e-=H2
电流方向
总结
原电池的正负极的判断方法:
• (为1负)由极组,成活原泼电性池弱两的级金材属料或判能断导:电一的般非是金活属泼为的正金极属。
• (2)根据外电路电流方向和电子流动方向判断:
电流由正极流向负极;电子是由负极流向 正极。
若A、B相连时,A为负极;
A>B
C、D相连时,D上产生大量气泡; C>D
A、C相连时,电流由C经导线流向A; A>C
B、D相连时,电子由D经导线流向B, D>B
则此4种金属的活动性由强到弱的顺序为( ② )
① A>B>C>D
② A>C>D>B
③ C>A>B>D
④ B>A>C>D
【达标检测】 D 1.下列说法中正确的是 ( )
试 一
请说明理由;若是,请指出正负极名称,并 写出电极反应式和电池总反应.
实验1: 锌片和铜片分别插入稀硫酸中 实验2: 锌片和铜片同时插入稀硫酸中
实验3: 将实验2的锌片和铜片用导线连接起来 实验4: 在实验3的导线中连接一个灵敏电流计
实验1 实验2 实验3 实验4
实验现象
锌片表面产生气泡,铜片 无明显现象
同上
锌片表面无明显现象,铜片 表面产生气泡
A.原电池是把电能转化为化学能的装置 B.原电池中电子流出的一极是正极,发生氧化反应 C.原电池两极均发生氧化还原反应 D.原电池中的阳离子向正极移动
2.把a、b、c三种金属片浸泡在稀H2SO4中。 若a、b相连 时,a为负极;b、c相连时,c 为负极;a、c相连时,
B c上有气泡冒出。 则这四种金属的活动性顺序( )
流入铜极.
正极 H+在铜极上得到电 子,发生还原反应 2H+ +2e-=H2
电流方向
总结
原电池的正负极的判断方法:
• (为1负)由极组,成活原泼电性池弱两的级金材属料或判能断导:电一的般非是金活属泼为的正金极属。
• (2)根据外电路电流方向和电子流动方向判断:
电流由正极流向负极;电子是由负极流向 正极。
若A、B相连时,A为负极;
A>B
C、D相连时,D上产生大量气泡; C>D
A、C相连时,电流由C经导线流向A; A>C
B、D相连时,电子由D经导线流向B, D>B
则此4种金属的活动性由强到弱的顺序为( ② )
① A>B>C>D
② A>C>D>B
③ C>A>B>D
④ B>A>C>D
【达标检测】 D 1.下列说法中正确的是 ( )
试 一
请说明理由;若是,请指出正负极名称,并 写出电极反应式和电池总反应.
苏教化学必修2专题2第三单元 化学能和电能的转化(共16张PPT)(1)

相连)
相连)
现象
碳棒上有红色的固 有气泡产生,能使湿
体析出
润淀粉-KI试纸变蓝
结论
有Cu析出
有Cl2放出
电极反 Cu2++2e-=Cu 应式 (还原反应)
2Cl--2e- =Cl2↑
(氧化反应)
总反应式
CuCl2电解Cu + Cl2↑
交流讨论 实验探究 观察思考 整理归纳 拓展视野 问题解决
一、电解原理
实 例 被电解物质 电 解 产 物
电解水
电解食 盐水
水
H2O、NaCl
电解融熔 氯化钠
电解融熔 氧化铝
NaCl Al2O3
H2、O2 NaOH 、 H2 、 Cl2 Na、Cl2
Al 、O2
化学方程式
通电
2H2O==2H2 ↑ +O2 ↑
通电
2NaCl +2H2O == 2NaOH +H2 ↑ + Cl2 ↑
专题2 化学反应与能量转化
第三单元 化学能与电能的转化
电能转化为化学能
虽称之为金牌,却与纯金相差甚远。金牌至少 要镀金6克。只占总重的1.34%,92.5%都是银 合金,还掺有一些铜。银牌93%是白银;其余为 铜。铜牌几乎都是铜。
你知道吗?
在我们已经学过的化学课程里,你能举出几个通过电 解来制取新物质的例子吗?
离子的移向: 阳离子移向电解池阴极
阴离子移向电解池阳极
二、电解原理的应用:
电解在工业生产中有着广泛的应用。例如 对某些器件进行电镀;电解熔融氧化铝获 得铝;用电解法还可制备Na 、Mg 、F2等 活泼的金属和非金属。镀:金属表面装饰 工艺。
二、电解原理的应用: 铜的电解精炼
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
普通锌-锰干电池的结构
二、二次电池
1定义: 放电后可通过充电使其复原继续使用的 电池。 2举例: 铅蓄电池
银锌蓄电池
锂离子电池 3优点: 重复、稳定、方便、安全、廉价
4缺点: 笨重、废弃污染环境
三、燃料电池
1.定义: 一种连续地将燃料和氧化剂的化学能 直接转换成电能的装置。
碱性电解质 负极: 2H2-4e-+4OH- = 4H2O 正极: O2+2H2O+4e- = 4OH总反应: 2H2+O2 = 2H2O
正极 4.氢离子通过电解质向理示意图, 按照此图的提示, 下列叙述不正确的是 ( B )
A. a电极是负极 B. b电极的电极反应为: 4OH--4e- = 2H2O+O2↑ C. 氢氧燃料电池是一种具有应用前景的绿色电源 D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏 在电池内的新型发电装置
酸性电解质 负极: 2H2-4e- = 4H+ 正极: O2+4H++4e- = 2H2O 总反应: 2H2+O2 = 2H2O
练习1:
报道: 以氢氧燃料电池为动力的公交车即将在北京试运 行。该燃料电池以氢为燃料, 空气为氧化剂, 铂做催化 剂, 导电离子是H+, 该燃料电池 。 O2 + 4H+ + 4e-= 2H2O 1.正极反应为:_______________________; 2H2-4e-= 4H+ 2.负极反应为:_______________________; 2H2 + O2 = 2H2O 3.总的化学反应为:___________________;
形形色色的电池
化学电池的分类 普通锌锰干电池 一次电池 碱性锌锰电池
锌银纽扣电池
化学电池 铅蓄电池 二次电池 银锌蓄电池 锂离子电池 燃料电池 氢氧燃料电池
一、一次电池 1定义: 放电后不能再充电使其复原的电池 2举例: 普通锌锰干电池 碱性锌锰电池 锌银纽扣电池
锌筒 石墨棒 NH4Cl、ZnCl2 和 H2O等 MnO2和C
