罗氏性能验证报告模板
罗氏Cobas8000全自动生化分析仪配套试剂的性能验证

中图分类号:R446.1
文献标识码:A
文章编号:1004-2725(2019)1-0016-05
全自动生化分析仪是临床生化检验的主要设备,该 仪器和其配套试剂的性能直接影响我们日常标本的检 验质量。按照《医疗机构临床试验室管理方法》和《医学 实验室质量和能力认可准则》的规定咱1袁2暂,对临床实验室 的全自动生化分析仪进行安装后,首先应该根据安装和 使用环境的差异,对仪器进行性能验证,验证通过后对 其开展项目所使用的试剂进行性能分析评价,以保证检 验结果的可靠性咱3暂。生化检测项目所用试剂的性能评价 也是实验室认可的重要内容及要求咱4暂。结合本实验室的 情况,参照罗氏厂家提供的试剂性能验证方案,对该生 化分析仪检测的 36 个配套试剂的检验项目的正确度、 精密度、线性范围、最佳稀释倍数和参考区间进行性能 评价。现报告如下。
甘肃医药 2019 年 38 卷第 1 期 Gansu Medical Journal袁2019袁Vol.38袁No.1
窑17窑
偏倚作为该生化项目的正确度,评估平均偏倚与靶值之 间的偏离程度,完成正确度验证。每个水平样本检测 2次, 记录结果并取平均值,进而计算各项指标的偏倚程度,判 断其能否满足临床需求。若平均偏倚在合理偏倚范围内, 则可判断检测正确度良好。合理偏倚的判断依据为不超 过 NCCL 室间质量评价标准允许总误差的1/3。 1.6 线性范围验证 按照 CLSI EP6-A2 文件咱8暂要求,至 少检测 6 个浓度水平。选择高值浓度标本(H,高值标本 浓度尽量接近线性范围的上限)和低值浓度标本(L)各 1 份,浓度范围要覆盖仪器说明书给出的线性范围。将高 值浓度标本与低值浓度标本分别按 L、1H+4L、2H+3L、 3H+2L、4H+1L、H 的比例混合,配成 6 份不同浓度的标 本,随机排列,每份混合血清标本测定 2 次,记录结果。 将实测值与预期值进行回归分析。若所有实验点在坐标 纸上呈明显直线趋势,用直线回归对数据进行统计,得 直线回归方程 y越ax+b,同时计算相关系数 r。若 r2逸0.95,a 为 0.97耀1.03,则可判断其呈线性,同时需满足测定值与 理论值偏差约1/2 允许总误差。允许总误差参考美国 CLIA’88 能力验证计划和 NCCL 室间质量评价标准。 1.7 稀释倍数验证 取 1 个接近线性范围的高浓度样 本血清分装成两管,一管未稀释不做任何处理,一管进 行临床所需求的最佳倍数的稀释,稀释液为生理盐水, 随后分别测定两管样本的实际数值,同一水平重复测定 3 次后取平均值,并计算检测结果和理论结果的偏差值, 以约1/2 允许总误差为合格。允许总误差参考美国 CLIA’
URISYS 2400 (MJZ004)尿液分析仪性能验证报告

性能验证报告单位名称:AAA医院科室名称:检验科实验室:门急诊检验中心仪器名称:全自动尿液分析仪型号规格:URISYS 2400仪器编号:MJZ004验证人员:审核人:批准人:验证日期:2012年8月1日—2012年9月30日一、检测系统信息:项目:尿液干化学(pH、比重、潜血、中性粒细胞、蛋白质、葡萄糖、酮体、胆红素、尿胆原、亚硝酸盐)试剂及厂商:罗氏公司及原装配套试剂检测方法:干化学法二、验证过程1.精密度1.1批内精密度1.1.1方法及判定标准按常规方法连续检测20次尿液质控品(阴性和阳性),检测结果相差同方向不超过一个级别,但是阴性结果不能检测成阳性,阳性结果不能检测呈阴性。
1.1.2质控品批号:20116213;201162121.1.3测定日期:2012-8-28至2012-9-161.1.4样本号:(501-520);(601-620)1.1.5结果及数据1.1.5.1阴性质控标本测定结果1.1.5.2阳性质控标本测定结果1.2批间精密度1.2.1方法及判定标准选择室内质控作为衡量批间精密度的依据。
每天室内质控品按照常规标本的方法一样测定,连续收集同一批号室内质控品某一时间段(至少20天)的室内质控数据。
1.2.2质控品批号:20116213;201162121.2.3测定日期:2012-8-28至2012-9-161.2.4结果及数据1.2.4.1阴性质控20天测定结果1.2.4.2阳性质控测定结果2.正确度2.1比对实验由于临床血液学与体液学实验室的URISYS 2400尿液分析仪通过了卫生部的室间质评活动。
其检测结果的准确性可以进行传递,因此以URISYS 2400尿液分析为参照,将门急诊检验中心的URISYS 2400尿液分析仪与之进行了比对。
按照NCCLS EP15 A的相关规定,每日选择8个当日采集的、浓度分布状况比较具有代表性的病人样本,同时采用两台URISYS 2400尿液分析仪进行检测,每个样本在每台仪器上均检测一次,连续比对5天(最终共比对了40个样本)。
ROSE检验报告示范

用 IC/ISE 测定 Analyzed by IC/ISE
用用超纯水定容
Make up with ultra-purity water
转移样品溶液到容量瓶内
Transfer the sample solution into a volumetric flask
检测报告 Test Report
5.测定卤素含量 Test for Halogen Contents. 称量样品于燃烧瓶中
Weigh sample and place it in a combustion flask
充入氧气
Fill the flask with oxygen
第7页共8页 Page 7 of 8
在燃烧瓶中燃烧样品 Combust the sample in the
第3页共8页 Page 3 of 8
检测结果:
Test Results: 测试项目
含量
Tested Items
Contents
铅 Lead (Pb)
N.D.
镉 Cadmium (Cd)
N.D.
汞 Mercury (Hg)
N.D.
六价铬 Hexavalent Chromium (Cr6+)
N.D.
注:参考国际标准方法定量铅、镉、汞时,样品被完全消解。
样品信息:
Report on the submitted sample said to be:
样品名称
:聚酯
Sample Name 样品描述
:Polyester insulating varnish :棕黄色液体
Sample Description 样品型号
罗氏性能验证报告模板
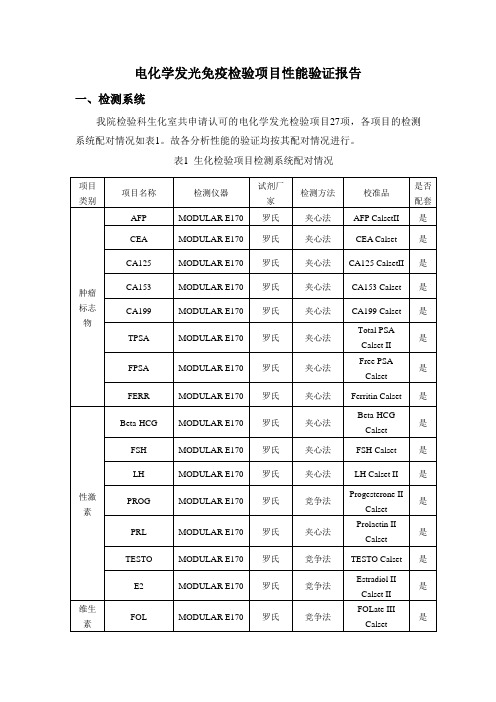
电化学发光免疫检验项目性能验证报告一、检测系统我院检验科生化室共申请认可的电化学发光检验项目27项,各项目的检测系统配对情况如表1。
故各分析性能的验证均按其配对情况进行。
表1 生化检验项目检测系统配对情况二、范围:2.1 精密度(包括批内及日间精密度)。
2.2 准确度2.3线性范围验证:2.4 稀释度(可报告范围)2.5 生物参考区间的验证三方法1、精密度评估1.1 批内精密度;仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。
评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,重复测定20次上述各质控品,计算出各项目的均值、标准差和变异系数。
变异系数即代表精密度。
统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。
结论:1. 2 批间精密度;仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。
评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,在5个工作日,测定2批,每次测定2次上述质控,计算出均值,标准差和变异系数。
变异系数即代表精密度。
统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。
罗氏血气分析仪B221校准报告

泰州人民医院南院检验科血气分析仪性能校准报告仪器型号: Cobas b 221仪器序列号: ****制造商: 罗氏公司鉴定结论: 合格鉴定人: *** 日期:20**年08月31日鉴定单位: *******生物科技有限公司罗氏Cobas b 221血气分析仪性能鉴定报告1.仪器工作环境:环境温度:15-31 ℃是否符合要求:②不符合环境气压:536-797 mmHg(-100~2500米) 是否符合要求:②不符合相对湿度:20-95%(无冷凝)是否符合要求:②不符合2.仪器的工作电源:100-240VAC(±10%), 50-60Hz(±5%)是否符合要求:②不符合3.各部件状况检测电极检查是否正常:②不正常温度检查是否正常:②不正常大气压检查是否正常:②不正常泵,阀工作是否正常:②不正常液体传感器工作是否正常:②不正常模块工作是否正常:②不正常打印机工作是否正常:②不正常PC显示屏工作是否正常:②不正常4.仪器的设置及维护仪器外观是否清洁:②否系统的时间设置是否正确:②否电极是否更换:②否试剂是否更换:②否进样口是否干净:②否5. 性能数据测定参数----------------------------------------------------------------------------------------------------------------------------B 全血Q 水状指控品(a)含水溶液(a)具有相似的生理离子基体和缓冲容量6. 精确性,重现性在Cobas b 221 POC system 上连续7天,每天运行两次,每次测量两次,由此得到的“重现性(S R)”和“设备内精密度(S I)”数据。
对于具有代表性或已经测定的S R和S I,其对应的测定值即为均值。
材料:Combitrol Plus B/LEVEL 1(水平1),n=28材料:Combitrol Plus B/LEVEL 2(水平2),n=287.线性经张力检测过的全血全血在37℃条件下采用高精密度混合气体进行张力测定。
酸性罗氏产品稳定性有效期验证方案

1.目的:本报告中的研究为了反映酸性罗氏培养基在不同效期内、不同储存条件下和运输条件下的稳定性及有效性。
2.培养基稳定性研究方法的确定依据:2.1酸性罗氏培养基自然(长期)存放效期后的稳定性试验:在酸性罗氏培养基在实际自然贮存条件下(2-8℃)以及室温存放条件下。
2.2 酸性罗氏培养基开封后稳定性研究资料。
2.3 运输过程中,运输条件下在1℃~29℃和30℃以上(添加冰袋)对酸性罗氏培养基的稳定性影响。
3. 培养基稳定性研究的具体方法和过程:选择三个批次的产品,分别在室温、2-8℃的条件下使用结核分枝杆菌标准株(H37Rv)为阳性质控菌株,对产品从外观、无菌检测、生长试验(敏感性检测)、抑制性试验(特异性检测)、批内重复性和批间重复性几个方面进行测试,并且培养基开封后的稳定性进行测试。
模拟运输过程中的在1℃~29℃和30℃以上(添加冰袋)运输条件下对酸性罗氏培养基的稳定性影响。
3.1室温保存1天、2天、3天、4天、5天、6天、7天、8天、9天、10天,11天,12天;3.2 在2-8℃保存30天、60天、90天、120天;3.3 从培养基开封后,在不同时间分别放置0.5小时,1小时,1.5小时,2小时和3小时,分别对其进行无菌检测。
3.4 模拟运输过程中在1℃~29℃和30℃以上(添加冰袋)运输条件下对其稳定性影响。
4.样品选取和试验时间4.1 酸性罗氏培养基选择批号:批号:P2******* 生产日期:20140324批号:P2******* 生产日期:20140428批号:P2******* 生产日期:201405134.2 试验时间:P2*******从2014年3月24日开始时间,P2*******从2014年4月28日开始时间,P2*******从2014年05月13日开始时间。
试验员:徐雪英,详见下列各记录表。
5.试验方法5.2.1外观:采用目视法,在自然光线明亮处目视。
5.2.2 无菌检测:酸性罗氏培养置36±1℃普通培养箱中,48小时,无细菌生长。
罗氏全自动生化分析仪ModularDPP模块性能验证

罗 氏原 装配套 离 子补偿液 ( 批号 127 0 ) 54 7 1 、罗 氏
原 装配 套 cek试 剂 。 he 1 2 2 其 他 试 剂 :5 L亚 硝 酸 钠 溶 液 一 套 、国 .. 0 家 一级 线 性 标 准 物 质 ( 1一C Y T05 08标 准进 行 仪器 性 能 验 证 。 验证 内容 包括 :杂 散光 、吸光度 线性 范 围 、吸 光度 准确 性 、吸光 度稳定 性 、吸光度 重复 性 、样 品携 带 污染 率 、加样 系统 准确性 与重 复性 、孵育池 温度 准
U / , U e . 6 mm |/ L ra 7 1 o L,T 4 5/ P 6 . g L,于 号 } [
146 0 )、高 值 质 控 品 (P U:A 14U/ 56 9 1 P 1 L,
Ue 5 9mm lL P4 . g L ra2 . o ,T 6 8 / ,批 号 1 6 8 0 ) / 7 27 1 、
s u e t h e 剂有 罗 氏公 司提 供 。 t m n eek试 r
密度 检测 。现将 验证 方法 、标准 及结 果等做 如下 总
结 汇报 。
1 材 料和 方法
11 仪器设 备 . 德 国罗 氏诊 断公 司生 产 Moua P dlr P全 自动 生 D
13 方法 .
素溶 液 O a g rneG原 液 一 瓶 。 以上 试 剂 购 自中 国计
量科 学 院北京 分 院 ,均为 安培包 装一 次性 使用 现成
商 品 试 剂 。 加 样 系 统 准 确 性 与 重 复 性 检 定 所 用 smpeslt n ( 定 吸 光 度 的 O a g a l o i uo 特 rn eG) 与 I. n
罗氏质控报告

生产批量
抽取样本数
生产批号
规格
取样时间
有效期
报检单号
检测时间
检验依据:
备注:
检验项目
标准要求
检验结果
外观和性状
外包装盒标识清晰、内容完整
罗氏培养管洁净、透明、无裂纹
培养基呈黄绿色斜面、表面光滑无泡
强度
接种环划线表面,不应划破
装量
复溶后装量为7±0.5ml
无菌试验
36±1℃,培养48小时,应无细菌生长。
生长试验
耻垢分枝杆菌,培养48小时,应生长良好,菌落呈乳白色
最终判定
不合格处理□报废
质管部经理批准日期:
备注
在检验结果栏中,有具体数值的填具体数值,若无,则合格的就打“√或符合
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学发光免疫检验项目性能验证报告
一、检测系统
我院检验科生化室共申请认可的电化学发光检验项目27项,各项目的检测系统配对情况如表1。
故各分析性能的验证均按其配对情况进行。
表1 生化检验项目检测系统配对情况
二、范围:
2.1 精密度(包括批内及日间精密度)。
2.2 准确度
2.3线性范围验证:
2.4 稀释度(可报告范围)
2.5 生物参考区间的验证
三方法
1、精密度评估
1.1 批内精密度;
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。
评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,重复测定20次上述各质控品,计算出各项目的均值、标准差和变异系数。
变异系数即代表精密度。
统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。
结论:
1. 2 批间精密度;
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。
评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,在5个工作日,测定2批,每次测定2次上述质控,计算出均值,标准差和变异系数。
变异系数即代表精密度。
统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。
结论
2、正确度评估
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪试剂:卫生部临床检验中心2012年全国肿瘤标志物测定室间质评质控物(批号),2013年卫生部内分泌测定室间质评质控物(批号)作为正确度评估的标本。
评估步骤:根据卫生部临床检验中心2013年室间质评回报结果,挑选以上质控物中相对高值及相对低值质控品进行检测,每个质控品测定3次,计算出均值,标准差和变异系数。
评价方法:将上述测定结果与卫生部临检中心回馈的质评报告中相应的“靶
值”和可接受限进行比对。
计算上报的数据和设定的靶值的回收率,Bias小于
1/2TEa则认为该项目正确度符合要求。
结论:
3、线性范围验证:
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪试剂:收集所有参加性能验证项目的低值及高值血清标本,高值标本越接近厂家声明的最高值最佳,低值越接近厂家声明的最低值最佳。
评估步骤:选取上述低值及高值血清标本,按如下方式稀释低值血清;5L、1H:4L、2H:3L、3H:2L、4H:1L、5H。
连续测定两次上述血清后取均值,做回归统计。
评价方法:依据EP6-A采取平均斜率方法来确定系列稀释样品含有的待测物的预期值(X),所有样品重复测定的均值为实测值(Y),将所有结果数据绘制于X-Y坐标图中。
计算回归方程:Y=bx+a , 斜率b在0.97-1.03并且r2 ≥0.95 , a 与0做t检验判断是否有差异性, 所有数据在范围内则认为线性通过验证。
结论:
4、稀释度(可报告范围)评价
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪试剂:实验室收集PRL、Beta-HCG、AFP、CEA、CA153、CA199、CA125、TPSA、FERR项目的接近检测线性上限的高值血清样本。
ROCHE提供的样品稀释液。
评估步骤:使用试剂厂商提供的稀释液, 按照厂商提供的可稀释倍数来稀释,按下表做3个系列稀释倍数最大稀释倍数为厂商推荐稀释倍数,重复3次检测。
评价方法:将检测值与预计值比较, 以美国CLIA'88能力验证计划的分析质量要求为标准判定结果是否可接受,如果在可接受范围内,证明验证了该稀释倍数可靠,验证通过。
a.如稀释后检测均值回收率在80%≤R≤120%,之间,则该稀释度通过验证。
b.检测值和预期值的偏差,以1/4 CLIA’88总允许误差范围为判断限。
符合该条件的最大稀释度为该项目的最大稀释倍数.
结论:
5、生物参考区间的验证
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪。
试剂:针对参加性能验证项目相应的参考区间人员分类标准选择体检合格的健康人标本,每个分类选取20份。
评估步骤:在检测系统上对上述标本进行测定,对结果进行统计并对仪器说明书提供的参考区间进行验证。
评价方法:若20份标本的检测结果均在试剂说明书提供或实验室建立的参考区间内或仅有2个标本超出,则验证通过。
否则,需进行参考区间确立实验。
结论:
三、性能验证结果
检验科生化室27项电化学发光检验项目各检测系统的性能验证结果如下表:表2 MODULAR E170检验系统各检测项目的精密度验证结果
表3 MODULAR E170检验系统各检测项目的准确度评估结果
表6 MODULAR E170检验系统各检测项目生物参考区间验证结果
四、结论:
罗氏MODULAR E170全自动电化学发光免疫分析仪检测系统的精密度、准确度、线性范围、稀释度验证实验均符合要求,生物参考区间通过验证。
通过以上各项性能验证实验的结论,罗氏MODULAR E170全自动电化学发光免疫分析仪检测系统达到检测要求,保证检测结果准确可靠,可以满足临床需求。
