华中科技大学工程热力学-第4章-气体热力过程PPT课件
合集下载
工程热力学与传热学_第4章_热力学第二定律(1)

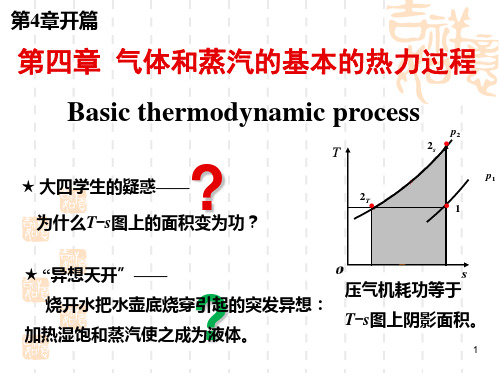
0 T T1 T2 0
1 2
v
0
T T1 T2
1 2
v
4 Δs
3
4
3
s
0
Δs
s
卡诺循环
逆向卡诺循环
卡诺制冷循环的制冷系数:
q2 w net q2 q 1 q 2 T
2 2
T 1 T
高温热源 T1
q1 wnet=q1-q2
制冷机 热泵
卡诺热泵循环的供热系数:
q1 w net q1 q 1 q 2 T
2 1
整理:
Q2 T2
Q1 T
1
Q1,Q2 改为代数值:
Q1 T1
Q T
2 2
0
对任意不可逆循环:
p
1
s
a
用一组可逆绝热线分割成 许多个微元不可逆循环。
对微元不可逆循环abcda:
Q1
T1
b
A
2
B 0
d
c v
Q
T
2
2
0
对全部不可逆循环积分:
Q1
T1
1A2
Q 2
4-3-3 闭口系统的熵方程
不可逆过程中的熵变:
dS dS
dS
Q
T
Q
T
Q
T
dS
g
令: 因此:
说明
dS
f
Q
T
f
dS dS
dS g
——闭口系统的熵方程。 适用:闭口系统的各种过程和循环。
熵流 dS
ห้องสมุดไป่ตู้
工程热力学第四章理想气体热力过程

详细描述
03
CHAPTER
等容过程
等容过程是指气体在变化的整个过程中,其容积保持不变的过程。
定义
特点
适用场景
气体在等容过程中,气体温度和压力会发生变化,但容积保持不变。
等容过程常用于高压、高温或低温等极端条件下的气体处理。
03
02
01
等容过程定义
在等容过程中,气体吸收的热量等于气体所做的功和气体温度升高所吸收的热量之和。
多变过程的具体形式取决于气体所经历的压力和温度的变化规律。
多变过程定义热力学第一定律 Nhomakorabea热力学第二定律
理想气体状态方程
热效率
多变过程的热力学计算
01
02
03
04
能量守恒定律,用于计算多变过程中气体吸收或释放的热量。
熵增原理,用于分析多变过程中气体熵的变化。
描述气体压力、体积和温度之间的关系,可用于多变过程的计算。
衡量多变过程能量转换效率的指标,通过比较输入和输出的热量来计算。
提高热效率的方法
优化多变过程参数,如压力和温度的变化规律,以减少不可逆损失和提高能量转换效率。
热效率与熵增的关系
根据熵增原理,不可逆过程会导致熵的增加,从而降低热效率。因此,减少不可逆损失是提高多变过程热效率的关键。
热效率计算公式
$eta = frac{Q_{out}}{Q_{in}}$,其中$Q_{out}$为输出热量,$Q_{in}$为输入热量。
计算公式
通过优化气体的初态和终态,以及选择合适的加热和冷却方式,可以提高等容过程的热效率。同时,也可以通过改进设备结构和操作方式来提高热效率。
提高热效率的方法
等容过程的热效率
04
CHAPTER
03
CHAPTER
等容过程
等容过程是指气体在变化的整个过程中,其容积保持不变的过程。
定义
特点
适用场景
气体在等容过程中,气体温度和压力会发生变化,但容积保持不变。
等容过程常用于高压、高温或低温等极端条件下的气体处理。
03
02
01
等容过程定义
在等容过程中,气体吸收的热量等于气体所做的功和气体温度升高所吸收的热量之和。
多变过程的具体形式取决于气体所经历的压力和温度的变化规律。
多变过程定义热力学第一定律 Nhomakorabea热力学第二定律
理想气体状态方程
热效率
多变过程的热力学计算
01
02
03
04
能量守恒定律,用于计算多变过程中气体吸收或释放的热量。
熵增原理,用于分析多变过程中气体熵的变化。
描述气体压力、体积和温度之间的关系,可用于多变过程的计算。
衡量多变过程能量转换效率的指标,通过比较输入和输出的热量来计算。
提高热效率的方法
优化多变过程参数,如压力和温度的变化规律,以减少不可逆损失和提高能量转换效率。
热效率与熵增的关系
根据熵增原理,不可逆过程会导致熵的增加,从而降低热效率。因此,减少不可逆损失是提高多变过程热效率的关键。
热效率计算公式
$eta = frac{Q_{out}}{Q_{in}}$,其中$Q_{out}$为输出热量,$Q_{in}$为输入热量。
计算公式
通过优化气体的初态和终态,以及选择合适的加热和冷却方式,可以提高等容过程的热效率。同时,也可以通过改进设备结构和操作方式来提高热效率。
提高热效率的方法
等容过程的热效率
04
CHAPTER
工程热力学第4章气体和蒸汽的基本热力过程
n 1 pv const. 定温过程
(isothermal process; constant temperature process)
n pv const. 定熵(可逆绝热)过程
(isentropic process; reversible adiabatic process)
n v const. 定容过程
1
1
T1 p1 T2 p2
理想气体,定比热,可逆绝热过程。
13
二、过程的 p – v 图及T - s 图
p v
p v
cp cV
p v
(n 0) 0
p n p v n v
p
(n 1)
(n )
n
p v
p
v
.
n=0
n↑
n=1
n=±∞ n=κ
o
v
T T s cs
h cp
T2 T1
T2 T1
2
Tds
1
w
2
pdv
1
2 1
pvdv v
RgT1 ln
v2 v1
wt
2
vdp
1
2 1
vpdv p
RgT1
ln
p2 p1
q u w h wt q w wt 12
4–3 理想气体等比熵(可逆绝热)过程
一、过程方程
Tds δq dh vdp 0 vdp dh cpdT
4–1 研究热力过程的目的及一般方法
一、基本热力过程 (fundamental thermodynamic process)
近似直线
在ln p-lnV 图上有 ln p = -nlnV + c pvn 常数 4
(isothermal process; constant temperature process)
n pv const. 定熵(可逆绝热)过程
(isentropic process; reversible adiabatic process)
n v const. 定容过程
1
1
T1 p1 T2 p2
理想气体,定比热,可逆绝热过程。
13
二、过程的 p – v 图及T - s 图
p v
p v
cp cV
p v
(n 0) 0
p n p v n v
p
(n 1)
(n )
n
p v
p
v
.
n=0
n↑
n=1
n=±∞ n=κ
o
v
T T s cs
h cp
T2 T1
T2 T1
2
Tds
1
w
2
pdv
1
2 1
pvdv v
RgT1 ln
v2 v1
wt
2
vdp
1
2 1
vpdv p
RgT1
ln
p2 p1
q u w h wt q w wt 12
4–3 理想气体等比熵(可逆绝热)过程
一、过程方程
Tds δq dh vdp 0 vdp dh cpdT
4–1 研究热力过程的目的及一般方法
一、基本热力过程 (fundamental thermodynamic process)
近似直线
在ln p-lnV 图上有 ln p = -nlnV + c pvn 常数 4
工程热力学4理想气体热力过程及气体压缩g

• 二、过程初,终状态参数间的关系p65
气态方程:
pv RT
过程方程 p1v1 p2v2 p1v1v1 1 p2v2v2 1
T1v1 1 T2v2 1
T1
p 1 1
T2
p2
1
p2 ( v1 )k (4-5) p1 v2
T2 ( v1 )k 1 4-6 T1 v2
研究热力学过程的依据
1) 第一定律: q du w dh wt
稳流:
q
h
1 2
c2
gz
ws
2) 理想气体: pv RT cp cv R u f (T ) h f (T )
k cp cv
3)可逆过程:
w pdv
wt vdp
2) ds δq T
s12
2
ds
1
2 δq ? 0
1T
上述两种结论哪一个对?为什么? 既然 δq 0 q 0 为什么熵会增加?(不可逆)
结论: 1)
ds δq TR
必须可逆
2)熵是状态参数,故用可逆方法推出的熵变 △s 公式也可用于不可逆过程。
3)不可逆绝热过程的熵变大于零。
pv RgT
p T
Rg v
2
s 1 ds
2
1 cV
dT T
Rg
ln
v2 v1
2
1 cp
dT T
Rg
ln
p2 p1
2
1 cp
dv v
2
1 cV
dp p
第4章-理想气体的热力性质和热力过程

由理想气体状态方 pV程mRgT 得冬夏两季室内空 量气 平质 均值之差:
m
pRgVT1w
1
Ts
0.098MPa36m3 0.28[7kJ/(kgK)]
2
1 73K
1 308K
5.117kg
9
第二节 理想气体的比热容
10
• 热容:指工质温度升高1K所需的热量。
C Q dT
• 比热容:1kg(单位质量)工质温度升高1K所
k
nn1n2n3 ni nk ni i 1
• 第 i 种组元气体的摩尔分数 (mole fraction of a mixture):
xi
ni n
(433)
xi nni nni 1
各组元摩 尔分数之
和为1
37
换算关系
mnM
mi niMi
• 根据热力学第一定律,任意准静态过程:
q d u p d v d h v d p
u是状态参数: uf(T,v)
du(T u)vdT(uv)Tdv
q( T u)vdT[p( u v)T]dv
单位物量的物质 在定容过程中温 度变化1K时热 力学能的变化值
q u
• 定容: dv0 cv (dT)v (T)v 12
3
第一节 理想气体及其状态方程
4
• 理想气体 ideal gas定义:
– 遵循克拉贝龙(Clapeyron)状态方程的气体,
即基本状态参数 p、v、T 满足方程
pv 常数 T 的气体称为理想气体。
理想气体的基本假设:
• 分子为不占体积的弹性质点 uu(T)
• 除碰撞外分子间无作用力
理想气体是实际气体在低压高温时的抽象
m
pRgVT1w
1
Ts
0.098MPa36m3 0.28[7kJ/(kgK)]
2
1 73K
1 308K
5.117kg
9
第二节 理想气体的比热容
10
• 热容:指工质温度升高1K所需的热量。
C Q dT
• 比热容:1kg(单位质量)工质温度升高1K所
k
nn1n2n3 ni nk ni i 1
• 第 i 种组元气体的摩尔分数 (mole fraction of a mixture):
xi
ni n
(433)
xi nni nni 1
各组元摩 尔分数之
和为1
37
换算关系
mnM
mi niMi
• 根据热力学第一定律,任意准静态过程:
q d u p d v d h v d p
u是状态参数: uf(T,v)
du(T u)vdT(uv)Tdv
q( T u)vdT[p( u v)T]dv
单位物量的物质 在定容过程中温 度变化1K时热 力学能的变化值
q u
• 定容: dv0 cv (dT)v (T)v 12
3
第一节 理想气体及其状态方程
4
• 理想气体 ideal gas定义:
– 遵循克拉贝龙(Clapeyron)状态方程的气体,
即基本状态参数 p、v、T 满足方程
pv 常数 T 的气体称为理想气体。
理想气体的基本假设:
• 分子为不占体积的弹性质点 uu(T)
• 除碰撞外分子间无作用力
理想气体是实际气体在低压高温时的抽象
工程热力学第4章

28
29
4-7 理想气体过程综述
一、各种过程在p-v图和T-s图上的相对位置
定容、定压、定温和定熵(可逆绝热)四个典型过 程都可以理解为多变过程的特例。其在p-v图上和T-s图 上的斜率如下:
( n 0)
0 p v
T cp 0 T cV
30
p p n v v n
Tc Tb
考虑过程等压 c
hc hb
a
q p ha hc 面积amnca
ha hb 面积amnca
38
p-v,T-s图练习(1)
压缩、升温、放热的过程,终态在哪个区域?
p
T
v
39
s
p-v,T-s图练习(2)
膨胀、降温、放热的过程,终态在哪个区域?
p
T
v
40
s
p-v,T-s图练习(3)
1 2
wt vdp 0
1
2
q p h wt h c
T2 p T1
T2 T1 1 Tds
2
四、Δu、 Δh、Δs和c
u c
T2 V T1
T2 T1
h c
T2 p T1
T2 T1
11
s
2
1
T2 dT cp s c p ln T T1
三、 定容过程的功量和热量
因为dv = 0,所以膨胀功为零,即
2
w pdv 0
1
注意和p-v 图对应
技术功: t vdp v( p1 p2 ) Rg (T1 T2 ) w
1
2
热量:
q Tds cV dT
29
4-7 理想气体过程综述
一、各种过程在p-v图和T-s图上的相对位置
定容、定压、定温和定熵(可逆绝热)四个典型过 程都可以理解为多变过程的特例。其在p-v图上和T-s图 上的斜率如下:
( n 0)
0 p v
T cp 0 T cV
30
p p n v v n
Tc Tb
考虑过程等压 c
hc hb
a
q p ha hc 面积amnca
ha hb 面积amnca
38
p-v,T-s图练习(1)
压缩、升温、放热的过程,终态在哪个区域?
p
T
v
39
s
p-v,T-s图练习(2)
膨胀、降温、放热的过程,终态在哪个区域?
p
T
v
40
s
p-v,T-s图练习(3)
1 2
wt vdp 0
1
2
q p h wt h c
T2 p T1
T2 T1 1 Tds
2
四、Δu、 Δh、Δs和c
u c
T2 V T1
T2 T1
h c
T2 p T1
T2 T1
11
s
2
1
T2 dT cp s c p ln T T1
三、 定容过程的功量和热量
因为dv = 0,所以膨胀功为零,即
2
w pdv 0
1
注意和p-v 图对应
技术功: t vdp v( p1 p2 ) Rg (T1 T2 ) w
1
2
热量:
q Tds cV dT
工程热力学4

对象 1) 参数 ( p, T, v, u, h, s ) 变化 2) 能量转换关系, q , w, wt
方法 1) 抽象分类
p vT s n
基本过程
2) 可逆过程 (不可逆再修正)
研究热力学过程的依据
1) 热力学第一定律 q du w dh wt
稳定流动能量方程
q
h
1 2
c2
gz
ws
cn cv
v
理想气体基本过程的p-v,T-s图
pT s v
T2
(
p2
)
k 1 k
T1 p1
T
sv
n0
p
n0 T
n 1
n 1 p
nk
n
n
v
nk s
u在p-v,T-s图上的变化趋势
u =T
u cvdT
pv RT
p u>0
T
u>0
n0 n 1
n0 n 1
nk
n
v
n
nk s
h在p-v,T-s图上的变化趋势
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
p-v,T-s图练习(2)
膨胀、降温、放热的过程,终态在哪个区域?
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
p-v,T-s图练习(3)
膨胀、升温、吸热的过程,终态在哪个区域?
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
理想气体基本过程的计算
方法 1) 抽象分类
p vT s n
基本过程
2) 可逆过程 (不可逆再修正)
研究热力学过程的依据
1) 热力学第一定律 q du w dh wt
稳定流动能量方程
q
h
1 2
c2
gz
ws
cn cv
v
理想气体基本过程的p-v,T-s图
pT s v
T2
(
p2
)
k 1 k
T1 p1
T
sv
n0
p
n0 T
n 1
n 1 p
nk
n
n
v
nk s
u在p-v,T-s图上的变化趋势
u =T
u cvdT
pv RT
p u>0
T
u>0
n0 n 1
n0 n 1
nk
n
v
n
nk s
h在p-v,T-s图上的变化趋势
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
p-v,T-s图练习(2)
膨胀、降温、放热的过程,终态在哪个区域?
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
p-v,T-s图练习(3)
膨胀、升温、吸热的过程,终态在哪个区域?
p
T
n0
n0
n
n 1 nk
v
n
n 1
nk s
理想气体基本过程的计算
《工程热力学》教学课件第4-5章

工程热力学 Thermodynamics 二、摩尔气体常数及其他形式
由阿伏伽德罗定律知:在同温同压下任何气体的摩尔
体积都相等。
pVm 常数 R T
pVm RT
摩尔气体常数R,与气体种类和气体状态无关。
R 8.31431J/(mol K)
其他形式还有 pV mRgT 或 pV nRT
Rg
c t2
c
t2 0C
t2
c
t1 0C
t1
t1
t2 t1
工程热力学 Thermodynamics
(3)平均比热容的直线关系式:
c t2 t1
a bt
a b(t2
t1)
(4)定值比热容:
定值比热容表
工程热力学 Thermodynamics
三、理想气体的热力学能和焓及熵
du cVdT
;u
T2 T1
cV
dT
dh cpdT ;h
T2 T1
c
p
dT
真实比热容 平均比热容
u
T2 T1
cV
dT
u
cV
t2 t1
(t2
t1)
平均比热容(表)
u
cV
t2 0C
t2
cV
t1 0C
t1
定值比热容
u cV T cV t
h
T2 T1
c
p dThcpt2 t1(t2
t1 )
工程热力学 Thermodynamics
第四章 理想气体的热力性质
第一节 理想气体及其状态方程式 一、概述 二、状态方程:
pv RgT 称为克拉珀龙状态方程。
理想气体定义:凡是遵循克拉贝珀状态方程的气体
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑴ 过程方程
定容过程的条件为dv = 0,由此,有过程方程 v = 常数 V = 常数 (CM)
2020/11/10
3
⑵ 定容过程中的参数关系
Pv RgT P Rg 常数 Tv
定容过程中,气体的压力与其温度成正比
对理想气体,不仅定容过程,任何过程均有
du cvdT dh cPdT u cv T h cP T
2020/11/10
2
无论是对于控制质量(CM)或控制容积(CV) ,如果所 发生的热力过程外部条件相同,譬如同为定温过程或绝 热过程等,工质的状态变化规律是一样的,不同的只是 系统与外界的能量交换情况。
本章基本上针对CM中的可逆过程进行讨论,个别情 况下也对CV的过程作附加说明
§4.2 定容过程
可逆的绝热过程为定熵过程
由
dscP
dv v
cv
dP P
定比热容时,对定熵过程可导得
Pvk conts
k cp cv
热容比,亦称为绝热指数
2020/11/10
13
⑵ 绝热过程中的参数关系
由
Pvk conts
Pv = RgT
P2 ( v1 )k P1 v2 T2 ( v1 )k1 T1 v2
(定比热容理想气体可逆绝热过程)
或
wk Rg T 1 1(1T T1 2)k Rg T 1 11(P P 1 2)kk 1
2020/11/10
15
由热力学第一定律第二表达式
qhwt
知绝热过程的技术功 wt h (任何工质) 对定比热容理想气体的绝热过程有技术功
2
qh1 cpdT
qcp(T2T1) (比热容为定值)
2020/11/10
8
⑷ 定压过程曲线
T
①T-s图
0
由热力学关系
ds
cpTdTRg
dP P
知定压线为指数函数曲线,且有
T ( s )P
T cP
0
定压线有正斜率,凹向上
P
知图中位置越高的定压线P 值越大
对气体恒有cp>cv
T-s图上定容线较陡于定压线
⑶ 定温过程的热量和功
由 du 0;
dh0
根据热力学第一定律
qduw
qdhwt
qwwt
对理想气体有
wPdvRgTdv
wRgTlnvv12 RgTlnP P12 (理v想气体可逆定温过程 )
2020/11/10
11
⑷ 定温过程曲线
①T-s图 定温过程在T-s图上为水平线段
②P-v图 由状态方程 PvRgT
2020/11/10
4
⑶ 定容过程的热量和功
对于气体的可逆定容过程
wPdv0
wt vdP
w0
wt v(P1P2)
根据热力学第一定律 qduPdv
有 qdu (所有气体)
可逆定容过程的热量等于工质的热力学能增量
对于可逆的定容过程,利用定容比热容计算热量
qcvdT 对有限定容过程
2
qu1 cvdT
qcv(T2T1) (比热容为定值)
2020/11/10
5
⑷ 定容过程曲线
①T-s图
0
由热力学关系
dscvdT T
Rg
dv v
知定容线为指数函数曲线,且有
T
va>vb
vb
va
dP>0
2
1 2'
dP<0
2
q 1 cvdT
u
(T s
)v
T cv
0
定容线有正斜率,凹向上
根据定熵情况下的T-v关系
知图中位置越高的定容线v 值越小
②P-v图 定容过程在P-v图上为一垂直线
②P-v图 定压过程在P-v图上为一水平线段
2020/11/10
Pb>Pa Pb
2' dv<0
dv>0 1
Pa 2 定容
2
q 1 cpdT h
s
12为定压加热过程 12'为定压冷却过程
2'
1
q<0 dT<0
2
q>0 dT>0
定压过程曲线 v
9
§4.4 定温过程
⑴ 过程方程
定温过程的条件为
dT0; Tconst
T2
(
P2
)
k 1 k
T1 P1
2020/11/10
14
⑶ 绝热过程的热量和功
对绝热过程有 q 0
q0
由热力学第一定律 对任何工质绝热过程均有
wu(任何工质绝热过程)
对定比热容理想气体的绝热过程有过程功
w c v (T 1 T 2 ) k R g 1 (T 1 T 2 ) k 1 1 (P 1#39;为定容冷却
P 2 q>0 dT>0
1
q<0 dT<0 2'
2020/11/10
定容过程曲线 v
6
§4.3 定压过程
⑴ 过程方程
定压过程的条件为dP = 0,由此,有过程方程
P = 常数
⑵定压过程中的参数关系
Pv RgT v Rg 常数 TP
定压过程中,气体的比体积与其温度成正比
第4章 气体的热力过程
1
§4.1 理想气体热力过程分析的内容
分析热力过程的方法和内容一般为: • 将实际过程典型化,理想化; • 利用状态方程、热力学第一定律,以及过程的外部 条件,建立过程方程;
• 建立过程中基本状态参数间的变化关系 ; • 在有关状态参数坐标图上绘制过程曲线 ; • 导出过程中的热量、功量计算式。 讨论分析典型的可逆过程,目的是为分析和评价相近 的实际气体过程提供基础。
q>0
1
2
w=wt= q
v
定温过程曲线
12
§4.5 绝热过程
水蒸气在汽轮机中的膨胀作功过程;燃气在燃气轮机
和内燃机中的膨胀作功过程;流体在压缩机中被压缩的
过程;流体在良好包覆热绝缘层的管道中流动的过程等,
常被抽象成绝热过程来分析
⑴ 过程方程
绝热过程的外部条件为 q 0 由熵定义式 ds (Tq)可逆 ,知
2020/11/10
7
⑶ 定压过程的热量和功
对于气体的可逆定压过程
wPdv
wP(v2v1)
根据热力学第一定律
wt vdP0
wt 0
qdhvdP
q dh (任何气体,不仅理想气体)
定压过程的热量等于过程中工质的焓增量
对于可逆的定压过程,利用定压比热容计算热量
qcpdT (任何气体,不仅理想气体)
对有限定压过程
对理想气体,有
Pvconst
上式为理想气体定温过程方程
⑵ 定温过程中的参数关系
由
Pv RgT
有
P2 v1 P1 v 2
定温过程中,气体的压力与其比体积成反比
2020/11/10
10
对理想气体的定温过程,有
ducvdT0; uconst dhcPdT0; hconst
理想气体的定温过程即定热力学能和定焓过程
求导,得
P
P
( v)T v
P-v图上理想气体定温过程 为等腰双曲线,有负斜率
离坐标原点愈远的定温线 其温度值愈高
2020/11/10
T
2' 1 dv<0 dP>0 w<0
dv>0 dP<0 w>0
2
q=w=wt
s
12为定温吸热、膨胀过程 12'为定温压缩、放热过程
2' P
Tb Ta Tb>Ta
q<0
定容过程的条件为dv = 0,由此,有过程方程 v = 常数 V = 常数 (CM)
2020/11/10
3
⑵ 定容过程中的参数关系
Pv RgT P Rg 常数 Tv
定容过程中,气体的压力与其温度成正比
对理想气体,不仅定容过程,任何过程均有
du cvdT dh cPdT u cv T h cP T
2020/11/10
2
无论是对于控制质量(CM)或控制容积(CV) ,如果所 发生的热力过程外部条件相同,譬如同为定温过程或绝 热过程等,工质的状态变化规律是一样的,不同的只是 系统与外界的能量交换情况。
本章基本上针对CM中的可逆过程进行讨论,个别情 况下也对CV的过程作附加说明
§4.2 定容过程
可逆的绝热过程为定熵过程
由
dscP
dv v
cv
dP P
定比热容时,对定熵过程可导得
Pvk conts
k cp cv
热容比,亦称为绝热指数
2020/11/10
13
⑵ 绝热过程中的参数关系
由
Pvk conts
Pv = RgT
P2 ( v1 )k P1 v2 T2 ( v1 )k1 T1 v2
(定比热容理想气体可逆绝热过程)
或
wk Rg T 1 1(1T T1 2)k Rg T 1 11(P P 1 2)kk 1
2020/11/10
15
由热力学第一定律第二表达式
qhwt
知绝热过程的技术功 wt h (任何工质) 对定比热容理想气体的绝热过程有技术功
2
qh1 cpdT
qcp(T2T1) (比热容为定值)
2020/11/10
8
⑷ 定压过程曲线
T
①T-s图
0
由热力学关系
ds
cpTdTRg
dP P
知定压线为指数函数曲线,且有
T ( s )P
T cP
0
定压线有正斜率,凹向上
P
知图中位置越高的定压线P 值越大
对气体恒有cp>cv
T-s图上定容线较陡于定压线
⑶ 定温过程的热量和功
由 du 0;
dh0
根据热力学第一定律
qduw
qdhwt
qwwt
对理想气体有
wPdvRgTdv
wRgTlnvv12 RgTlnP P12 (理v想气体可逆定温过程 )
2020/11/10
11
⑷ 定温过程曲线
①T-s图 定温过程在T-s图上为水平线段
②P-v图 由状态方程 PvRgT
2020/11/10
4
⑶ 定容过程的热量和功
对于气体的可逆定容过程
wPdv0
wt vdP
w0
wt v(P1P2)
根据热力学第一定律 qduPdv
有 qdu (所有气体)
可逆定容过程的热量等于工质的热力学能增量
对于可逆的定容过程,利用定容比热容计算热量
qcvdT 对有限定容过程
2
qu1 cvdT
qcv(T2T1) (比热容为定值)
2020/11/10
5
⑷ 定容过程曲线
①T-s图
0
由热力学关系
dscvdT T
Rg
dv v
知定容线为指数函数曲线,且有
T
va>vb
vb
va
dP>0
2
1 2'
dP<0
2
q 1 cvdT
u
(T s
)v
T cv
0
定容线有正斜率,凹向上
根据定熵情况下的T-v关系
知图中位置越高的定容线v 值越小
②P-v图 定容过程在P-v图上为一垂直线
②P-v图 定压过程在P-v图上为一水平线段
2020/11/10
Pb>Pa Pb
2' dv<0
dv>0 1
Pa 2 定容
2
q 1 cpdT h
s
12为定压加热过程 12'为定压冷却过程
2'
1
q<0 dT<0
2
q>0 dT>0
定压过程曲线 v
9
§4.4 定温过程
⑴ 过程方程
定温过程的条件为
dT0; Tconst
T2
(
P2
)
k 1 k
T1 P1
2020/11/10
14
⑶ 绝热过程的热量和功
对绝热过程有 q 0
q0
由热力学第一定律 对任何工质绝热过程均有
wu(任何工质绝热过程)
对定比热容理想气体的绝热过程有过程功
w c v (T 1 T 2 ) k R g 1 (T 1 T 2 ) k 1 1 (P 1#39;为定容冷却
P 2 q>0 dT>0
1
q<0 dT<0 2'
2020/11/10
定容过程曲线 v
6
§4.3 定压过程
⑴ 过程方程
定压过程的条件为dP = 0,由此,有过程方程
P = 常数
⑵定压过程中的参数关系
Pv RgT v Rg 常数 TP
定压过程中,气体的比体积与其温度成正比
第4章 气体的热力过程
1
§4.1 理想气体热力过程分析的内容
分析热力过程的方法和内容一般为: • 将实际过程典型化,理想化; • 利用状态方程、热力学第一定律,以及过程的外部 条件,建立过程方程;
• 建立过程中基本状态参数间的变化关系 ; • 在有关状态参数坐标图上绘制过程曲线 ; • 导出过程中的热量、功量计算式。 讨论分析典型的可逆过程,目的是为分析和评价相近 的实际气体过程提供基础。
q>0
1
2
w=wt= q
v
定温过程曲线
12
§4.5 绝热过程
水蒸气在汽轮机中的膨胀作功过程;燃气在燃气轮机
和内燃机中的膨胀作功过程;流体在压缩机中被压缩的
过程;流体在良好包覆热绝缘层的管道中流动的过程等,
常被抽象成绝热过程来分析
⑴ 过程方程
绝热过程的外部条件为 q 0 由熵定义式 ds (Tq)可逆 ,知
2020/11/10
7
⑶ 定压过程的热量和功
对于气体的可逆定压过程
wPdv
wP(v2v1)
根据热力学第一定律
wt vdP0
wt 0
qdhvdP
q dh (任何气体,不仅理想气体)
定压过程的热量等于过程中工质的焓增量
对于可逆的定压过程,利用定压比热容计算热量
qcpdT (任何气体,不仅理想气体)
对有限定压过程
对理想气体,有
Pvconst
上式为理想气体定温过程方程
⑵ 定温过程中的参数关系
由
Pv RgT
有
P2 v1 P1 v 2
定温过程中,气体的压力与其比体积成反比
2020/11/10
10
对理想气体的定温过程,有
ducvdT0; uconst dhcPdT0; hconst
理想气体的定温过程即定热力学能和定焓过程
求导,得
P
P
( v)T v
P-v图上理想气体定温过程 为等腰双曲线,有负斜率
离坐标原点愈远的定温线 其温度值愈高
2020/11/10
T
2' 1 dv<0 dP>0 w<0
dv>0 dP<0 w>0
2
q=w=wt
s
12为定温吸热、膨胀过程 12'为定温压缩、放热过程
2' P
Tb Ta Tb>Ta
q<0
