第十章电化学基础和氧化还原平衡修改
氧化还原反应和电化学反应

氧化还原反应和电化学反应氧化还原反应是化学反应中最为重要和常见的反应之一。
它涉及到物质中的电子转移过程。
在氧化还原反应中,物质可以同时发生氧化和还原。
与之相伴随的是电化学反应,电化学反应是指在化学反应中涉及电子的转移和电流的流动的反应。
一、氧化还原反应氧化还原反应中,氧化和还原是同时进行的。
氧化是指物质失去电子;还原则是指物质获得电子。
这一过程中,电子从一个物质转移到另一个物质。
氧化和还原总是同时发生,因为电子不能独立存在。
例如,当铁和氧气发生反应时,铁原子(Fe)失去两个电子,被氧(O2)接受,生成氧化铁(Fe2O3)。
这里,铁原子发生了氧化,而氧气发生了还原。
氧化还原反应在日常生活中非常常见。
例如,金属的生锈、水的电解、电池的工作原理等都是氧化还原反应的例子。
二、电化学反应电化学反应是指在化学反应中涉及电子的转移和电流的流动的反应。
它是由氧化还原反应导致的。
电化学反应可以分为两种类型:电解反应和电池反应。
1. 电解反应电解反应是指在电解池中,通过外加电压使化学反应发生。
在电解过程中,正极(阳极)接受电子,发生氧化反应;负极(阴极)释放电子,发生还原反应。
电解反应在工业生产和实验室中广泛应用。
例如,电解盐水时,氯离子(Cl-)在阳极上接受电子,发生氧化反应生成氯气(Cl2),而阳离子(Na+)在阴极上释放电子,发生还原反应生成氢气(H2)。
2. 电池反应电池反应是指在电化学电池内,将化学能转化为电能的反应。
电池由两个半电池组成,每个半电池都有一个氧化反应和一个还原反应。
半电池之间通过电子流进行电荷平衡。
常见的电池包括干电池、蓄电池和燃料电池等。
干电池是通过将氧化剂和还原剂隔离,以阻止反应直接进行,并通过电子在电路中流动来提供电能。
蓄电池是通过可逆的氧化还原反应来存储和释放电能。
燃料电池是通过将燃料和氧气直接反应生成电能。
总结:氧化还原反应和电化学反应密切相关,涉及到电子转移和电流的流动。
氧化还原反应是物质中的电子转移过程,分为氧化和还原。
氧化还原反应及电化学基础

2)标准电极电势的测定
将待测的标准电极与标准氢电极组成原电池,在 25ºC下,用检流计确定
电池的正极(+)、负极(–) ,然后用电位计测定电池的电动势E来决定。 IUPAC 规定: E = (+) – (–)
International Union of Pure and Applied Chemistry 国际理论和应用化学联合会
(由稳定态单质生成1mol化合物的Gibbs自由能变)
对于电极反应:
ClO3-(aq) + 6 H+(aq) + 5e =
1 2
Cl2(g) + 3H2O(l)
查表f G (kJ/mol) - 3.3
0
0 -237.18
该反应的 rG = 3 × (-237.18) - (-3.3) = -708 (kJ/mol)
反应式(1): 2 Fe3+ + Sn2+ = 2 Fe2+ + Sn4+
lg K nE20.622 0.9 06 0.0590 1.075917
K9.1 21200
反应式(2): Fe3+ +
1 2
Sn2+ = Fe2+ +
1 2
Sn4+
lg K nE 0.62010.48 0.05917 0.05917
0 .0 n 5 9 1lg ( (氧 还 化 原 型 型 )) m q (2 5C )
电极反应式一般写为:m 氧化型 + n e = q 还原型
例 写出以下电极反应 的 Nernst 方程式:
O2(g) + 4H+ + 4e = 2H2O(l) = 1.229 (V)
[指南]上大 无机化学b 第十章氧化答复中兴
![[指南]上大 无机化学b 第十章氧化答复中兴](https://img.taocdn.com/s3/m/dfcef1260b4e767f5acfceb1.png)
2019年4月2日8 时11分
3. 半电池、电极和电极反应 原电池是由2个半电池组成。每一个半电池称为一个电极, 由同一元素的氧化型与还原型物质构成。 如铜锌电池中锌电极为: Zn | Zn2+ ; 铜电极为 Cu2+| Cu 。 如果,电极中的反应物都是离子或气体,这时就要人为再 加进惰性电极来导电。 如: Pt | Fe3+, Fe2+ Pt | H2 | H+ OH- | O2 | Pt
请思考:电对与电极有什么不同?
2019年4月2日8 时11分
5、电池符号
原电池用符号表示如下; 负极写左边,正极写在右边,‖表示盐桥, ∣表示相界面。如铜锌电池可如下表示: (-) Zn∣ZnSO4(1mol· L-1)‖CuSO4 (1mol·L-1) ∣Cu (+)
例1:5Fe2+ + MnO4- + 8H+ == 5Fe3+ + Mn2+ + 4H2O 气体要注明其分压,溶液要注明其浓度。 MnO4-/ Mn2+ MnO4- + 8H+ +5e == Mn2+ + 4H2O Fe3+ / Fe2+ Fe2+ - e == Fe3+ (-)Pt |(-) Fe2+(c1),Fe3+(c2) Fe2+(c1),Fe3+(c2) || MnO4-(c3),Mn2+(c4),H+(c5) || MnO4-(c3),Mn2+(c4),H+(c5) | Pt(+) (+)
6、加和,消 e,整理 2P4+12H2O +20OH- →4PH3+4HPO32-+12OH-+ 8H2O P4+2H2O +4OH- →2PH3+2HPO32-
氧化还原反应和电化学基础

8
⑷ 离子型化合物中,元素的氧化数等于该 ⑸ 离共子价所型带化的合电物荷中数,,共如用:电N子aC对I。偏向于电负性大 的原子 ,两原子的形式电荷数即为它们的氧化数, 如:HCI。 ⑹ 中性分子中,各元素原子氧化数的代数和为9 零。
S4O62- 4x+(-2)×6=-2 x=2.5 H5IO6 I:+7 ; S2O32- S:+2 例:求MnO4-中Mn的氧化值
2×3
0
+5
Zn+ HNO3
+2
+2
Zn(NO3)2+ NO + H2O
3 ×2
56
配系数
先配变价元素,再用观察法配平其 它元素原子的系数。
15
用氧化数表示氧化还原的状态 对于离子化合物的氧化还原反应来说,电 子是完全失去或完全得到的。但是,对于共价化 合物来说,在氧化还原反应中,有电子的偏移, 但还没有完全的失去或得到,因此用氧化数来表 示就更为合理。
16
例如:
H2+Cl2=2HCl 这个反应的生成物是共价化合物,氢原子的电子 没有完全失去,氯原子也没有完全得到电子,只是形成 的电子对偏离氢,偏向氯罢了。用氧化数的升降来表示 就是氯从0到-1,氢从0到+1。这样,氧化数的升高就是 氧化,氧化数的降低就是还原。在氧化还原反应里,一 种元素氧化数升高的数值总是跟另一种元素氧化数降低 的数值相等的。
11
一、氧化值的定义
在氧化还原反应中,电子转移引起某些原子的价 电子层结构发生变化,从而改变了这些原子的带电状 态。为了描述原子带电状态的改变,表明元素被氧化 的程度,提出了氧化态的概念。表示元素氧化态的的 数值称为元素的氧化值,又称氧化数。
氧化还原平衡电化学基础

拓展电化学技术的应用领 域
将电化学技术应用于其他领域 ,如生物医学、传感器、电子 器件等,可以开拓新的应用领 域并促进相关领域的发展。
THANKS
感谢观看
保持实验室通风良好
注意电源安全
在实验过程中,可能会产生有毒或刺激性 气体,因此应保持实验室通风良好,及时 排出有害气体。
在接通电源进行实验时,应注意电源安全 ,避免电极短路或过载,以免发生意外事 故。
实验结果分析
记录实验数据
在实验过程中,应认真观察并 记录电极反应的现象、电流的
变化情况等数据。
整理数据
电解过程
电解池
电解过程是在外加电源的作用下,在电解池中发生的氧化还 原反应。
电解产物
电解过程中,根据电解质的性质和电解条件的不同,会产生 不同的电解产物。
电镀过程
电镀原理
电镀过程是通过电解方法,在金属表 面沉积金属或合金的过程。
电镀应用
电镀广泛应用于工业、电子、航空航 天、汽车、建筑等领域,用于提高材 料表面的耐磨性、耐腐蚀性和美观度 等。
深入研究反应机理和动力 学过程
通过理论计算和实验手段,深 入揭示氧化还原反应的微观机 制和动力学过程,有助于优化 电化学反应过程和提高能源转 换效率。
发展新型电化学储能技术
针对可再生能源的间歇性特点 ,发展高效、长寿命、低成本 的新型电化学储能技术,如锂 硫电池、钠离子电池等,对于 实现可再生能源的高效利用具 有重要意义。
还原态
表示某元素被还原的状态,通常用负 号“-”表示,例如Fe0的还原态为0。
氧化还原反应的方向
氧化反应
物质失去电子的反应,通常需要外界提供能量。
还原反应
物质得到电子的反应,通常释放能量。
氧化还原反应电化学基础N
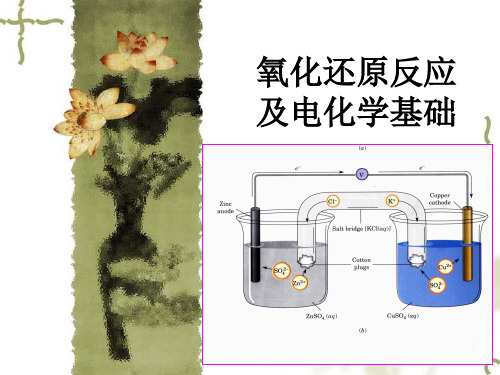
这一反应可在下列装置中分开进行
盐桥:在U型管中装 满用饱和KCl溶液和 琼胶作成的冻胶。 盐桥的作用:使Cl向锌盐方向移动, K+向铜盐方向移动, 使Zn盐和Cu盐溶液 一直保持电中性, 从而使电子不断从 Zn极流向Cu极。
这种装置能将化学能转变为电能,称为原电池。
正极(铜电极): Cu2+ + 2eCu 负极(锌电极): Zn Zn2+ + 2e正、负两极分别发生的 反应,称为电极反应。 电池反应:Zn + Cu2+ = Cu + Zn2+(总反应)
例:
H5I O6 S2 O S4 O
2 3 2 6
I的氧化值为 7 S的氧化值为 2 S的氧化值为 2.5 8 Fe的氧化值为 3
Fe3O 4
2、氧化还原半反应和氧化还原电对
氧化还原反应的方程式可分解成两个“半反应”。 反应中,氧化剂(氧化型)在反应过程中氧化数降 低生成氧化数较低的还原型; 还原剂(还原型)在反应 过程中氧化数升高转化为氧化数较高的氧化型。 由一对氧化型和还原型构成的共轭体系称为氧化还 原电对,可用“氧化型/还原型”表示。
Fe3+
溶液中,另一铂片插入到含有MnO4- 、Mn2+ 及H+ 的溶液
正极反应: MnO4- + 8H+ + 5e- = Mn2+ + 4H2O 电池反应: MnO4- + 8H+ + 5Fe2+ = Mn2+ + 5Fe3+ + 4H2O
电池符号:
(-)Pt|Fe2+(c1),Fe3+(c2)||MnO4-(c3),H+(c4),Mn2+(c5)|Pt (+)
华东理工大学现代基础化学课后习题解答第10章

2
= -0.700 V 9、求下列电极在 25℃时的电极反应的电势。
(1) 101.3 kPa 的 H2(g)通入 0.10 mol⋅L −1的 HCl 溶液中;
(2) 在 1L 上述(1)的溶液中加入 0.1 mol 固体 NaOH; (3) 在 1L 上述(1)的溶液中加入 0.1 mol 固体 NaAc。(忽略加入固体引起的溶液体积变化)。
− 3
+
H
+
→Zn
2+
+
NH
+ 4
+ H2O
(4) Ag +
+
NO
− 3
+
H
+
→Ag
+
+
NO
+
H2O
(5) Cl2 + OH − →Cl − + ClO − + H2O
(6)
Al
+
NO
− 3
+
OH
−
+
H2O→[Al(OH)4]
−
+
NH3
解: (1) 2KMnO4 + 5K2SO3 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3H2O (2) 5NaBiO3(s) + 2MnSO4 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 2Na2SO4 + NaNO3 + 7H2O
7、根据电对 Cu 2+ /Cu、Fe 3+ /Fe 2+ 、Fe 2+ /Fe 的电极反应的标准电势值,指出下列各 组物质中哪些可以共存,哪些不能共存,并说明理由。
第十章 氧化还原滴定法

(三)氧化还原指示剂 Ox1 + ne Red2
CIn (O )
Red1 Ox2 + ne
1 从 ~ 10 指示剂颜色从R O CIn ( R ) 10
CIn (O )
1 从10 ~ 指示剂颜色从O R CIn ( R ) 10
常用氧化还原指示剂
指示剂
次甲基蓝
In(O) In( R) (V)
避 光 光 催 化 空 气 氧 化
→
HSO3-,S↓
→
二、标准溶液的配制与标定 2.Na2S2O3溶液 B.标定
Cr2O72-+ 6I- (过量)+ 14H+ 2Cr3++ 3I2 + 7H2O (酸度高) I2 + 2S2O322I-+ S4O62- (加水稀释→弱酸性)
I2 + 2S2O32-
5C2O42-+2MnO4-+16H+ ⇌10CO2+2Mn2++8H2O
碘量法
一、碘量法的基本原理 利用I2的氧化性和I-的还原性建立的滴定分析方法 电对反应: I2 + 2e 2II2 + I I3- + 2e II3- (助溶) 3
中强还原剂
弱氧化剂
直接碘量法 间接碘量法
(一)直接碘量法
'
[H+]=1mol· L-1 0.52
颜色变化 还原形 氧化形 无色 天蓝色
二苯胺磺酸钠
邻苯氨基苯甲酸
0.85
0.89
无色
无色
紫红色
紫红色
邻二氮菲亚铁
1.06
红色
浅蓝色
氧化还原滴定法应用示例
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2) 根据氧化剂所获得的电子总数和还原剂失去的电子总 数必须相等的原则,配平离子反应方程式。
MnO−4 + 8H+ + 5e = Mn2+ + 4H2O ×2 +) SO32− + H2O = SO24− + 2H+ + 2e ×5
2MnO
− 4
+ 5SO32−
+ 6H+
=
2Mn 2+
+
5SO
2− 4
10.1.2 氧化还原反应方程式的配平 离子电子法
配平原则:电子得失总数必须相等
KMnO4+ Na2CM2On4O+4-H+2SOC42O42-
MnSO4 + Na2SO4 + K2SO4 + CO2
Mn2++ CO2
半反应:
M
n
O
4
C 2O 42-
+5e
M n2+
-2e
2CO2
得电子 失电子
配平半反应: MnO4-+ 8H+ + 5e
作业:P223:习题 4,5,6,7, 8 ,9,
10,12,14,16, 17,19,20
预习内容:P 211-216
第十章 电化学基础和氧化还原平衡
10.1 氧化还原反应与方程式的配平 10.2 电解质溶液的导电机理 10.3 原电池和电极反应的标准电势 10.4 能斯特方程和电极反应的电势 10.5 电极反应的电势的应用
饱和甘汞电极(SCE) 饱和溶液 0.2412
3. 电极反应的标准电势
将指定标准电极与标准氢电极组成如下原电池:
-)标准氢电极 待测电极(+
人为指定:标准氢电极的电势为0.000V。则此时电 池的电动势就等于该待测电极的电极反应的标准电势。
电极和电对的书写规定:
桥, “|”表示两相界面,c表示溶液浓度,若是气体用分 压(p)表示。 例如 对电池反应:
a Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+ 电池符号:(-)Pt |Sn2+(c1) ,Sn4+(c2) ⎪⎪ Fe3+(c3) ,Fe2+(c4) | Pt(+)
b Zn+2H+=H2+Zn2+ 电池符号: (-) Zn | Zn2+ (c1) ⎪⎪ H+ (c2) | H2 (p) | Pt (+)
nB = Q (zBF )
第十章 电化学基础和氧化还原平衡
10.1 氧化还原反应与方程式的配平
10.3 原电池和电极反应的标准电势 10.4 能斯特方程和电极反应的电势 10.5 电极反应的电势的应用
10.6 电动势与 ∆rGm及 K o的关系
10.7 元素电势图及其应用
电化学研究内容:
1)利用能进行的氧化还原反应,产生电流
10.6 电动势与 ∆rGm及 K o的关系
10.7 元素电势图及其应用
10.1 氧化还原反应与方程式的配平
10.1.1 氧化还原反应 10.1.2 氧化还原反应方程式的配平(氧化值法不要求)
10.1.1 氧化还原反应
1.氧化数: 提出目的:
2Mg+O2=2MgO Mg+Cl2=MgCl2 2P+3Cl2=2PCl3
化学能
电能
原电池
2)利用电能促使氧化还原反应的进行
电能
化学能
电解池
10.3 原电池和电极反应的标准电势
10.3.1 原电池 10.3.2 电极反应的标准电势
10.3.1 原电池
正极
铜半电池
负极
锌半电池
Cu2+ ⎜Cu
Zn2+ ⎜Zn
Cu2++2e →Cu Zn → Zn2+ + 2e
原电池反应:
标准Fe3+/Fe2+电极示意图
甘汞电极
表示方法:
Pt| Hg (1) Hg2Cl2 (s) Cl- (2.8 mol L-1) 电极反应:
Hg2Cl2 (s) + 2e标准甘汞电极:
2Hg (l) + 2 Cl- (aq)
oθ
c (Cl- ) = 1.0 mol L-1 EӨ(Hg2Cl2 / Hg) = 0.2681 V 饱和甘汞电极:
M
标准氢电极 是最重要的标准 电极,其结构如右图所示:将铂 片先镀上一层蓬松的铂(称为铂 黑),再把它放入H+ 离子浓度为 1.0 mol·L-1的稀硫酸中。然后通 入压力为100 kPa的纯净氢气,并 使它不断地冲打铂片。
H+(1mol·L-1) ⎜H2 (100kPa) ⎜ Pt
标准氯电极示意图
c (Cl- ) = 2.8 mol L-1(KCl饱和溶液)
E(Hg2Cl2 / Hg) = 0.2412 V
甘汞电极(参见左图)和氯化银电极都 是微溶盐电极,它们制备简单、使用方便、 性能稳定,是最常用的参比电极。
表2 298K时甘汞电极的电极电势
名称
KCl的浓度 E/V
0.1 mol·L-1甘汞电极 0.1 mol·L-1 0.3365 标准甘汞电极(NCE) 1.0 mol·L-1 0.2681
为了统一表示氧化还原反应中各元素在化合物中所 处的化合状态
定义:( “国际理论和应用化学联合会”(IUPAC)) 化合物中各原子的形式电荷数或表观电荷数
2. 氧化、还原 (Oxidation, Reduction)
特征:
OR
(1) 由两个半反应组成
例:Zn + Cu2+
Zn2+ + Cu
Zn - 2 e Zn2+ 分子(或离子)失电子 Zn 的氧化值 ,氧化反应,还原剂
Cu2+ + 2e
Cu
C u2+/C u
Zn2+ + Cu
电池符号:
(- ) Z n Z n 2+(c) C u 2+(c) C u (+ )
负极
盐桥 正极
基本概念
(1)氧化态:同一元素氧化数高的物质叫氧化态物
质,简称氧化态,可作为氧化剂。
(2)还原态:同一元素氧化数低的物质叫还原态物质, 简称还原态,可作为还原剂。
Zn
电极符号
Zn2+ (aq,c )∣ Zn (s)
● 气体-离子电极 电极反应
2H+ (aq)+ 2e- H2(g) 电极符号 H+ (aq,c) ∣ H2(g,p) ∣Pt
● 金属-金属难溶盐电极
电极反应 AgCl(s)+ e- AgCl- (aq) ∣ AgCl (s) ∣ Ag
Cu2+ + 2 e Cu 分子(或离子)得电子,
Cu2+的氧化值 ,还原反应,氧化剂
(2) 氧化反应和还原反应同时发生,相互依存
氧化剂(1) + 电子
还原产物 (1)
+ 还原剂(2) – 电子
氧化产物 (2)
总反应:
氧化剂(1) + 还原剂(2)
还原产物(1) + 氧化产物(2)
(3) 氧化剂,还原剂的强弱是相对而言的 ( 本性、分子结构、反应条件 ) 以得失电子能力强弱衡量
10.2.2 法拉第定律 大科学家 法拉第
法拉第出身在英国的一个铁 匠家庭,从小生活就很贫困,12 岁时开始当报童。
富有上进心和热爱科学的法 拉第在友人的帮助下从1810年开 始常去英国皇家学院听取科学家 的演讲,后来成了大科学家戴维 的助手,并最终成为一名伟大的 科学家。1834年发表了著名的以 他名字命名的电解定律:
Cu2+ + Zn → Zn2+ + Cu
原电池符号:
-) Zn ⎜Zn2+(c1) ⎜⎜Cu2+ (c2) ⎜Cu (+
盐桥
铜锌原电池的结构示意图
盐桥的作用:
1.使溶液保持电中性 2.消除液体的接界电势
原则上,对于任何 一个氧化还原反应,都 可设计成一个原电池。 但并非所有的原电池反 应都是氧化还原反应!
10.3.2 电极反应的标准电势
2. 标准电极的概念 什么是标准还原电势?
标 离子浓度(活度)为1.0 mol⋅L-1
准 状
所有气体分压为 100 kPa
态 固体和液体都是100 kPa下纯净物质
电极的电极电势称为标准电极电势。现以还原电势 形式表示,则为标准还原电势。( 一般T=298K)
Mn++ne-
M活泼: 溶解 > 沉积
+-- -+ +-- -+ +-- -+ +-- -+
M不活泼: 沉积 > 溶解
- + +- + +- + +- + +-
( ) 电极电势:E Mn+/M 电池电动势:EMF = E(+) − E(−)
影响电极电位差的因素有电极的本性、温度、介 质、离子浓度等。 当外界条件一定时,电极电位的高低就取决于电 极的本性。对于金属电极,则取决于金属离子化倾向 的大小。 金属越活泼,溶解成离子的倾向越大,离子沉积 的倾向越小。达成平衡时,电极的电位越低;反之, 电极的电位越高。
10.3 原电池和电极反应的标准电势
10.3.1 原电池 10.3.2 电极反应的标准电势
10.3.2 电极反应的标准电势 1. 电极反应的电势的产生 — 双电层理论
