大学无机化学第7章 氧化还原反应 电化学基础(大连理工版)
无机化学(化学工程)课程教学大纲

无机化学课程教学大纲课程名称:无机化学英文名称:Inorganic Chemistry课程编号:x2030471学时数:56其中实践学时数:0 课外学时数:0学分数:3.5适用专业:化学工程一、课程简介本课程是化学工程专业学生的专业基础课。
本课程讲授了化学反应原理、物质结构的基础理论、元素、单质及无机化合物的基本知识;是后续化学课程及相关专业课程学习的基础。
通过对本课程的学习,学生掌握化学反应原理、物质结构的基础理论、元素、单质及化合物的基本知识;培养学生自学能力,使之具有自学无机化学书刊的能力;培养学生学以致用的能力,使之具有解决一般无机化学问题的能力。
二、课程目标与毕业要求关系表三、课程教学内容、基本要求、重点和难点(一)气体及热化学基础1.要求学生熟练掌握理想气体状态方程式及其应用、气体分压定律及其应用、盖斯定律及其应用;了解分压、体系、环境、状态、功、热及热力学能等概念;理解热力学第一定律,理解焓、焓变的概念,掌握状态函数和标准摩尔生成焓的概念。
2.重点:状态函数的概念及特点,标准生成焓的概念,理想气体状态方程式和分压定律的应用,运用盖斯定律和标准生成焓计算反应热。
3.难点:状态函数、焓及标准生成焓的理解。
(二)化学反应速率和化学平衡1.要求学生了解化学反应速率,基元反应和反应级数的概念,理解浓度对反应速率的影响和温度对反应速率的影响,熟练掌握质量作用定律,了解速率理论,并能用活化能和活化分子的概念说明浓度、温度和催化剂对反应速率的影响,了解影响反应速率的因素。
要求学生理解可逆反应与化学平衡的概念,掌握标准平衡常数ΘK 及其应用,掌握化学平衡的移动的规律,掌握热力学第二定律及热力学第三定律,掌握有关化学平衡组成的计算。
要求学生熟练掌握标准摩尔反应焓变、标准摩尔反应熵变和标准摩尔反应吉布斯函数变的关系,熟练掌握ΘK 与Θ∆m r G 的关系,熟练掌握Θ∆mr G 和m r G ∆的计算方法,熟练掌握转变温度的计算方法,熟练掌握吉布斯函数判据,熟练掌握通过计算判断反应方向和反应程度的方法。
氧化还原反应和电化学基础

8
⑷ 离子型化合物中,元素的氧化数等于该 ⑸ 离共子价所型带化的合电物荷中数,,共如用:电N子aC对I。偏向于电负性大 的原子 ,两原子的形式电荷数即为它们的氧化数, 如:HCI。 ⑹ 中性分子中,各元素原子氧化数的代数和为9 零。
S4O62- 4x+(-2)×6=-2 x=2.5 H5IO6 I:+7 ; S2O32- S:+2 例:求MnO4-中Mn的氧化值
2×3
0
+5
Zn+ HNO3
+2
+2
Zn(NO3)2+ NO + H2O
3 ×2
56
配系数
先配变价元素,再用观察法配平其 它元素原子的系数。
15
用氧化数表示氧化还原的状态 对于离子化合物的氧化还原反应来说,电 子是完全失去或完全得到的。但是,对于共价化 合物来说,在氧化还原反应中,有电子的偏移, 但还没有完全的失去或得到,因此用氧化数来表 示就更为合理。
16
例如:
H2+Cl2=2HCl 这个反应的生成物是共价化合物,氢原子的电子 没有完全失去,氯原子也没有完全得到电子,只是形成 的电子对偏离氢,偏向氯罢了。用氧化数的升降来表示 就是氯从0到-1,氢从0到+1。这样,氧化数的升高就是 氧化,氧化数的降低就是还原。在氧化还原反应里,一 种元素氧化数升高的数值总是跟另一种元素氧化数降低 的数值相等的。
11
一、氧化值的定义
在氧化还原反应中,电子转移引起某些原子的价 电子层结构发生变化,从而改变了这些原子的带电状 态。为了描述原子带电状态的改变,表明元素被氧化 的程度,提出了氧化态的概念。表示元素氧化态的的 数值称为元素的氧化值,又称氧化数。
大连理工大学2024年硕士招生考试自命题科目考试大纲 630 无机化学及无机化学实验

大连理工大学2024年硕士研究生入学考试大纲科目代码:630 科目名称:无机化学及无机化学实验具体复习大纲如下:一、气体和溶液1、理想气体的概念、理想气体状态方程、理想气体状态方程的应用.2、混合气体中组分气体、分压的概念,分压定律、分体积定律.3、真实气体与理想气体的差别.4、液体的蒸发及饱和蒸汽压.5、稀溶液的依数性.二、热化学1、系统、环境、相、热、功、热力学能和焓等概念.2、热力学第一定律.3、热化学方程式、化学反应的标准摩尔焓变(Δr H mӨ).4、物质的标准摩尔生成焓(Δf H mӨ)、物质的标准摩尔燃烧焓(Δc H mӨ).5、Hess定律及有关计算.三、化学反应速率1、化学反应速率、(基)元反应、复合反应等概念.2、反应速率方程、速率系数、反应级数的确定.3、活化分子、活化能等概念、阿伦尼乌斯方程.4、用碰撞理论和活化络合物理论说明浓度、温度和催化剂对反应速率的影响.四、化学平衡熵和Gibbs函数1、化学平衡、标准平衡常数、平衡组成的计算、多重平衡规则.2、反应商判据、Le Chaterlier原理.3、浓度、压力、温度对化学平衡移动的影响及相关计算.4、熵的概念、吉布斯函数的概念,物质的标准摩尔熵S mӨ、物质的标准摩尔生成Gibbs函数、反应的Δr S mӨ和Δr G mӨ的简单计算,Δr G mӨ与Δr H mӨ和Δr S mӨ的关系、Δr G mӨ与KӨ的关系.5、介绍反应的Δr G m,用Δr G m和Δr G mӨ判断反应进行的方向和程度.五、酸碱平衡1、酸碱质子理论、水的解离平衡、水的离子积常数、常见酸碱指示剂的变色范围.2、强酸、强碱溶液有关离子浓度和pH的计算.3、一元(多元)弱酸(碱)的解离平衡、解离常数和平衡组成的计算.4、一元弱酸强碱盐和一元强酸弱碱盐的水解平衡、水解常数和平衡组成的计算.5、多元弱酸强碱盐的分步水解及其平衡组成的计算、酸式盐溶液pH的近似计算.6、同离子效应、缓冲溶液、缓冲能力、缓冲溶液pH的计算.7、酸碱电子理论、配合物的基本概念、配合物的命名、配合物的不稳定常数和稳定常数、配体过量时配位平衡组成的计算、酸碱反应与配合反应共存时溶液平衡组成的计算.六、沉淀-溶解平衡1、难溶电解质的沉淀-溶解平衡、标准溶度积常数、标准溶度积常数与溶解度之间的关系和有关计算.2、溶度积规则、用溶度积规则判断沉淀的生成和溶解.3、pH对难溶金属氢氧化物沉淀-溶解平衡的影响及有关计算、沉淀的配位溶解及其简单计算.4、分步沉淀和两种沉淀间的转化及有关计算.七、氧化还原反应电化学基础1、氧化还原反应的基本概念、氧化反应方程式的配平.2、原电池的基本概念、电池电动势的概念.3、电极电势的概念及其影响因素、Nernst方程式及其相关计算、电极电势的应用.4、元素电势图及其应用.八、原子结构和元素周期律1、氢原子光谱、Bohr原子结构理论、电子的波粒二象性、量子化和能级、原子轨道、概率密度、概率、电子云.2、四个量子数的名称、符号、取值和意义.3、s、p、d原子轨道与电子云的形状和空间伸展方向.4、多电子原子轨道能级图和核外电子排布的规律、写出常见元素原子的核外电子排布、根据核外电子排布确定它们在周期表中的位置.5、周期表中元素的分区、结构特征.6、原子半径、电离能、电子亲和能和电负性的变化规律.九、分子结构1、化学键的分类、共价键价键理论的基本要点、共价键的特征和类型.2、杂化轨道理论的概念和类型、用杂化轨道理论解释简单分子和离子的几何构型.3、价层电子对互斥理论的要点、用价层电子对互斥理论推测简单分子或离子的几何构型.4、分子轨道的概念、第二周期同核双原子分子的能级图、电子在分子轨道中的分布、推测第二周期同核双原子分子(离子)的磁性和稳定性(键级).5、键级、键能、键长、键角等概念.十、晶体结构1、晶体的类型、特征和组成晶体的微粒间的作用力.2、金属晶体的三种密堆积结构及其特征、金属键的形成和特征.3、三种典型离子晶体的结构特征、晶格能的概念、离子电荷和半径对晶格能的影响、晶格能对离子化合物熔点、硬度的影响、晶格能的热化学计算方法.4、离子极化及其对键型、晶格类型、溶解度、熔点、颜色的影响.5、键的极性和分子的极性、分子的偶极矩和变形性及其变化规律、分子间力的产生及其对物质性质的影响.6、氢键形成的条件、特点及对物质某些性质的影响.7、过渡性晶体结构(如:层状晶体).十一、配合物结构1、配合物价键理论的基本要点、配合物的几何构型与中心离子杂化轨道的关系、内轨型和外轨型配合物的概念、中心离子价电子排布与配离子稳定性和磁性的关系.2、配合物晶体场理论的基本要点、八面体场中d电子的分布、高自旋和低自旋配合物、推测配合物的稳定性和磁性、配合物的颜色与d-d跃迁的关系.十二、s区元素1、碱金属和碱土金属的通性、单质的重要物理性质和化学性质.2、碱金属和碱土金属的重要氢化物、氧化物、过氧化物、超氧化物的生成和基本性质.3、碱金属和碱土金属氢氧化物碱性强弱的变化规律、重要盐类的溶解性和稳定性.4、锂和铍的特殊性、对角线规则.十三、p区元素(一)1、硼族元素的通性、缺电子原子和缺电子化合物的概念、乙硼烷的结构和重要性质、硼酸的晶体结构和性质、硼砂的结构和性质、硼的卤化物的结构和水解.2、铝及其重要化合物的性质.3、碳族元素的通性、碳单质的结构、碳的氧化物、碳酸及其盐的重要性质、用离子极化理论说明碳酸盐的热稳定性.4、硅单质、硅的氢化物、硅的氧化物、硅酸及其盐的重要性质.5、硅的卤化物的结构和水解.6、锡和铅的氧化物和氢氧化物的酸碱性及其变化规律、Sn(Ⅱ)的还原性、Pb(Ⅳ)的氧化性、锡和铅硫化物的颜色、生成和溶解性.十四、p区元素(二)1、氮族元素的通性、氮分子的结构和特殊稳定性、铵盐的性质、氮的氧化物的结构、硝酸的结构和性质、硝酸盐和亚硝酸盐的性质.2、磷的单质、氢化物、氧化物、卤化物的结构和性质.3、磷酸及其盐的性质、亚磷酸、次磷酸、焦磷酸、聚磷酸、聚偏磷酸的结构和性质.4、砷、锑、铋氧化物及其水合物的酸碱性及其变化规律.5、砷、锑、铋化合物氧化还原性的变化规律和重要反应.6、砷、锑、铋硫化物的颜色、生成和溶解性及砷、锑的硫代酸盐.7、氧族元素的通性、氧单质的结构和性质、过氧化氢的结构和性质及其重要反应.8、硫单质的结构和性质、硫化氢的性质、金属硫化物的溶解性、多硫化物的性质、二氧化硫和三氧化硫的结构、亚硫酸及其盐的性质、硫酸及其盐的性质、硫代硫酸盐的结构和性质、过二硫酸盐的结构和性质、焦硫酸盐和连二亚硫酸盐的性质.十五、p区元素(三)1、卤素的通性、卤素单质的制备和性质、卤化氢的制备及其性质(还原性、酸性、稳定性)的变化规律、氯的含氧酸及其盐的性质及其变化规律、溴和碘的含氧酸的基本性质.2、稀有气体的重要性质及其变化规律、稀有气体化合物及其几何构型.3、p区元素的氢化物、氧化物及其水合物性质的递变规律.4、p区元素化合物的氧化还原性递变规律、p区元素含氧酸盐的热稳定性递变规律.十六、d区元素(一)1、过渡元素的原子结构特征和通性.2、钛单质的性质和用途.3、铬单质的性质、Cr(Ⅲ)和Cr(Ⅵ)化合物的酸碱性和氧化还原性及其相互转化,杂多酸盐磷钼酸铵.4、Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的性质.5、Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)重要化合物的性质及其变化规律.6、Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)重要化合物的性质及其变化规律.7、铁、钴、镍的重要配合物.十七、d区元素(二)1、铜族元素的通性.2、铜的氧化物、氢氧化物、重要铜盐的性质.3、Cu(Ⅰ)和Cu(Ⅱ)相互转化、铜的重要配合物、水溶液中Cu2+的重要反应.4、银的氧化物和氢氧化物的性质、银的重要配合物、水溶液中Ag+的重要反应.5、锌族元素的通性、氢氧化锌的性质、水溶液中Zn2+的重要反应、锌的重要配合物.6、镉的重要化合物的性质.7、汞的重要化合物的性质、Hg(Ⅰ)和Hg(Ⅱ)间的相互转化、水溶液中Hg2+和Hg22+的重要反应.十八、无机化学实验1.实验基本操作:加热、洗涤、过滤等无机化学实验操作。
天津理工大学2024年硕士研究生招生考试复试大纲 材料:《材料综合》复试大纲

材料综合复试大纲(复试分为三部分内容,考生可以选择其中任一部分作答。
)第一部分无机化学参考书目:《无机化学》,大连理工大学无机化学教研室编,高等教育出版社。
第三章化学动力学基础掌握活化分子和活化能的概念,并能用其说明浓度、温度、催化剂对化学反应速率的影响;掌握化学反应速率、反应速率方程、反应级数等概念;熟悉Arrhenius 方程。
第五章酸碱平衡掌握酸碱质子理论基本要点;掌握同离子效应和缓冲溶液的概念、一元强弱酸、Lewis酸碱的相关内容;掌握配位化合物的基本概念。
第六章沉淀溶解平衡掌握相关理论并解释沉淀析出的实验现象。
第七章氧化还原反应电化学基础掌握电极电势的基本概念及应用;熟悉氧化还原反应的基本概念。
第八章原子结构掌握核外电子排布的基本原理;掌握周期表中元素的分区、结构特征;熟悉原子半径、电离能、电子亲和能和电负性的变化规律。
第十章固体结构熟悉晶体的类型、特征和组成晶体的微粒间的作用力;能用相关知识点解释结构对物性的影响。
元素部分(s、p、d区元素),掌握性质递变规律。
第二部分物理学参考书目:《物理学》上、下册,东南大学等七所工科院校编,马文尉改编,高等教育出版社。
第五章静电场理解电场强度,掌握场强叠加原理,了解电荷连续分布的带电体的场强,理解电场线、电通量,掌握高斯定理,理解环路定理,了解电势,电势差及电势叠加原理。
第六章静电场中的导体与电介质了解静电场中加入导体和电解质后电场发生的变化,了解电容器的概念。
第七章恒定磁场理解磁感应强度,掌握毕奥-萨伐尔定律,理解磁感线、磁通量,掌握磁场中的高斯定理和安培环路定理;理解洛沦兹力,了解霍尔效应。
第八章电磁感应电磁场理解电动势的概念,掌握法拉第电磁感应定律,理解动生电动势、感生电动势的本质。
第十一章光学理解光的相干条件及获得相干光的基本原理和一般方法;了解光程概念以及光程差与相位差的关系,了解反射时产生半波损失的条件;了解杨氏双缝干涉的基本装置和实验规律;了解干涉条纹的分布特点及其应用;了解薄膜干涉原理在实际中的应用。
无机化学知识点摘要大连理工大学第五版

第一章气体1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:(1)气体没有固定的体积和形状。
(2)不同的气体能以任意比例相互均匀地混合。
(3)气体是最容易被压缩的一种聚集状态。
气体的密度比液体和固体的密度小很多。
2、理想气态方程:pV=nRT,其中p、V、T分别为一定量气体的体积、压力和热力学温度。
R为摩尔气体常数。
在国际单位制中,p以Pa、V以m3、T以K为单位,则R=8.314J·mol-1·K-1。
3、理想气体是一种假想的模型,它忽略了气体本身的体积和分子之间的相互作用。
对于真实气体,只有在低压高温下,分子间作用力比较小,分子间平均距离比较大,分子自身的体积与气体体积相比,完全微不足道,才能把它近似地看成理想气体。
4、理想气体混合物:当两种或两种以上的气体在同一容器中混合时,相互间不发生化学反应,分子本身的体积和它们相互间的作用力都可以忽略不计,这就是理想气体混合物。
其中每一种气体都称为该混合气体的组分气体。
5、混合气体中某组分气体对器壁所施加的压力叫做该组分气体的分压。
对于理想气体来说,某组分气体的分压力等于在相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
6、Dalton分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
7、Amage分体积定律:混合气体中组分B的分体积V B是该组分单独存在并具有与混合气体相同温度和压力时占有的体积。
8、气体分子动理论的基本要点:(1)气体是由分子组成的,分子是很小的粒子,彼此间的距离比分子的直径大许多,分子体积与气体体积相比可以略而不计。
(2)气体分子以不同的速度在各个方向上处于永恒地无规则运动之中。
(3)除了在相互碰撞时,气体分子间相互作用是很弱的,甚至是可以忽略的。
(4)气体分子相互碰撞或对器壁的碰撞都是弹性碰撞。
碰撞时总动能保持不变,没有能量损失。
(5)分子的平均动能与热力学温度成正比。
9、气体的压力是由气体分子对器壁的弹性碰撞而产生的,是“分子群”对器壁碰撞作用的统计平均的结果。
2024年度无机化学第六版电子教案大连理工大学

研究化学反应的方向、限度以及能量变化,包括热力学第一定律 、热力学第二定律等基本原理。
热化学方程式
表示化学反应中能量变化的化学方程式,包括反应热、焓变等参 数。
2024/2/3
19
化学反应速率理论简介
反应速率
表示化学反应快慢的物理量,与反应物浓度、温 度等因素有关。
速率方程
描述反应速率与反应物浓度之间关系的数学表达 式。
应用
通过控制溶液的pH值和沉淀物的溶 解度,可以实现沉淀溶解平衡的移动 ,从而分离和提纯化学物质。
22
05
无机化合物分类及性质
2024/2/3
23
金属元素单质和重要化合物性质
2024/2/3
01
碱金属和碱土金属
介绍锂、钠、钾、铷、铯、钫等碱金属以及铍、镁、钙、锶、钡等碱土
金属的单质性质,包括物理性质和化学性质,以及它们的重要化合物如
4
教学目标与要求
知识与技能
掌握无机化学的基本概念和原理,了 解物质结构的基础知识和元素化学的 基本规律,培养学生的实验技能和动 手能力
过程与方法
通过理论讲解、实验演示、课堂讨论 等方式,引导学生自主学习、合作学 习和探究学习,提高学生的思维能力 和创新能力
情感态度与价值观
培养学生对无机化学的兴趣和爱好, 激发学生的科学探索精神和实践能力 ,树立学生的科学世界观和价值观
化学平衡的移动
结合实例,分析浓度、温度、压力等因素对化学平衡的影响。
溶解度与溶度积
通过实例计算,帮助学生掌握溶解度与溶度积的换算及应用。
2024/2/3
35
拓展阅读材料推荐
《无机化学》(第六版)教材配套习题集
巩固和加深对知识点的理解。
9氧化还原反应
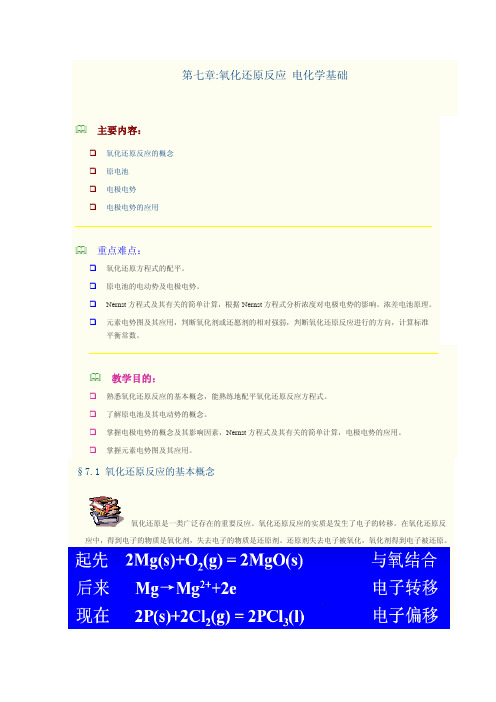
第七章:氧化还原反应 电化学基础主要内容:氧化还原反应的概念原电池 电极电势电极电势的应用重点难点:氧化还原方程式的配平。
原电池的电动势及电极电势。
Nernst 方程式及其有关的简单计算,根据Nernst 方程式分析浓度对电极电势的影响。
浓差电池原理。
元素电势图及其应用,判断氧化剂或还愿剂的相对强弱,判断氧化还原反应进行的方向,计算标准平衡常数。
教学目的:熟悉氧化还原反应的基本概念,能熟练地配平氧化还原反应方程式。
了解原电池及其电动势的概念。
掌握电极电势的概念及其影响因素,Nernst 方程式及其有关的简单计算,电极电势的应用。
掌握元素电势图及其应用。
§7.1 氧化还原反应的基本概念应中,得到电子的物质是氧化剂,失去电子的物质是还原剂。
还原剂失去电子被氧化,氧化剂得到电子被还原。
7.1.1 氧化值在氧化还原反应中,由于发生了电子转移,导致某些元素带电状态发生变化。
为了描述元素原子带电状态的不同,人们提出了氧化值的概念。
氧化值也叫做氧化数。
氧化:氧化数增加的过程;还原:氧化数降低的过程1970年,国际纯粹与应用化学联合会(IUPAC)对氧化值的定义是:氧化值是某元素一个原子的荷电数,这个荷电数是假设把每个化学键的电子指定给电负性更大的原子而求得的。
例如,在NaCl中,钠的氧化值为+1,氯的氧化值为-1。
在SO2中,硫的氧化值为+4,氧的氧化值为-2。
由此可见,氧化值是元素在化合状态时人为规定的形式电荷数。
确定氧化值的规则:★在单质中,元素的氧化值为零。
★在单原子离子中,元素的氧化值等于离子所带的电荷数。
★在大多数化合物中,氢的氧化值为+1,只有在活泼金属的氢化物(如NaH,CaH2)中,氢的氧化值为-1。
★通常,在化合物中氧的氧化值为-2;但在过氧化物(如H2O2,Na2O2,BaO2)中氧的氧化值为-1;而在OF2和O2F2中,氧的氧化值分别为+2和+1。
★在所有氟化物中,氟的氧化值为-1。
氧化还原反应 电化学基础

电池反应 Sn2++ 2Fe3+ = Sn4+ + 2Fe2+
(-) (Pt) H2(pθ)H+(1mol·dm-3) Fe3+(1mol·dm-3) , Fe2+ (1 mol·dm-3) Pt(+) 负极,氧化反应: 负极,氧化反应: H2 - 2e = 2H+ 正极,还原反应: 正极,还原反应: Fe3+ + e = Fe2+ 电池反应: 电池反应: H2 + 2 Fe3+ = 2H+ + 2 Fe2+
(Pt)H2(p)H+(1 mol·dm-3) Cl2(p)Cl– (c mol·dm-3)Pt
负极,氧化反应: 负极,氧化反应: H2 - 2e = 2H+ 正极,还原反应: 正极,还原反应: Cl2 + 2 e = 2Cl– 电池反应: 电池反应: H2 + Cl2 = 2H+ + 2Cl–
二、确定氧化态的规则 (the rules for the determination of oxidation state) 1. 离子型化合物中,元素的氧化数等于该离子所 离子型化合物中, 带的电荷数 2. 共价型化合物中,共用电子对偏向于电负性大 共价型化合物中, 的原子 ,两原子的形式电荷数即为它们的氧化数 3. 单质中,元素的氧化数为零; 离子 n-氧化数为 单质中,元素的氧化数为零; 离子X n4. 中性分子中,各元素原子的氧化数的代数和为 中性分子中, 零 ,复杂离子的电荷等于各元素氧化数的代数和
Zn + Cu2+ = Zn2+ + Cu 氧化反应 Zn = Zn2+ + 2e Cu2+ + 2e = Cu 还原反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3
小结:
酸性介质:
多n个O+2n个H+,另一边 +n个H2O 碱性介质: 多n个O+n个H2O,另一边 +2n个OH-
§ 7.2 电化学电池
7.2.1 原电池的构造
* 7.2.2 电解池与Faraday定律 7.2.3 原电池电动势的测定 7.2.4 原电池的最大功与Gibbs函数
7.2.1 原电池的构造
7.3.1 标准氢电极和甘汞电极
7.3.2 标准电极电势
7.3.3
*7.3.4
Nernst方程式 E-pH图
7.3.1 标准氢电极和甘汞电极
1. 标准氢电极(SHE) 电极反应: + 2 H (aq) + 2e 电对: H /H 2
+ +
H 2 g
E H /H 2) 解:⑴ O2 (g) + 4H (aq) + 4e + 14 1 pH = 14,即 c(H ) = 1.0× 10 mol L
E (O2 /H2O)
+
0.0592V + 4 = EA (O2 /H2O) + lg[ p(O2 ) / p ] [c(H ) / c ] 4 0.0592V 14 4 = 1.229V + lg(1.0× 10 ) 4 = 0.400V
c (还原型 ) E 或 , 则: c (还原型 ) , c (氧化型 )
c (氧化型 ) ,
② 介质的酸碱性
例: 已知 EA (ClO /Cl ) = 1.45V 求:当c(ClO ) = c(Cl ) = 1.0mol L , /Cl ) = ? c(H ) = 10.0mol L 时,EA ( 解: 3 (aq) + 6H+ (aq) + 6e ClO Cl (aq) + 3H2O(l)
电功(J)=电量(C)×电势差(V)
Wmax = zFEMF
电池反应: r Gm = Wmax r Gm = zFEMF EMF — 电动势(V)
F — 法拉第常数 96485(C· -1) mol
Z — 电池反应中转移的电子的物质的量
标准状态: r Gm = zFE MF
§7.3 电极电势
Cu-Zn原电池装置
2+ 2e Zn(s) Zn (aq) 氧化反应 负 极 (电子流出 ) : 2+ + 2e Cu(s) 还原反应 Cu (aq) 正 极 (电子流入 ) : + Cu 2 + (aq) Zn 2 + (aq) + Cu(s) Zn(s) 电池反应:
氧化型
+ Ze
2+
Cl 2.0mol L1 ‖
2Cl (aq ) 3+ Fe (aq )
() Pt Fe2+ 1.0mol L1 , Fe3+ 0.1mol L1
Cl 2 101325Pa | Pt (+)
* 7.2.2 电解池与Faraday定律
1.电解池 利用电能发生氧化还原反应的装置被称 为电解池。 2. Faraday定律 1834年,M. Faraday 提出电化学过程 的定量学说: ①在电化学电池中,两极所产生或消耗 的物质B的质量与通过电池的电量成正比。 m∝Q
表示为: Pt H2 (g) H+
或
H+ H2(g) Pt 标准氢电极装置图
2. 甘汞电极(SCE)
L1 ) Pt Hg 表示方法: , (l) Hg2Cl2 (s) Cl (2.8mol : 电极反应:Hg2Cl2 (s) + 2e
2Hg(l)+ 2 Cl (aq)
= 1.0mol L1 c 标准甘汞电极: (Cl ) E (Hg2Cl2 /Hg) = 0.268V = 2.8mol L1 ( KCl 饱和溶液 ) c 饱和甘汞电极: (Cl )
m=KQ=KIt
②当给定的电量通过电池时,电极上所产生 或消失B的质量正比于它的摩尔质量被相应转移 的电子数除的商。
例如,铜电极,Z = 2,析出铜的质量
63 .55 g mol 1。 m∝ 2 1mol电子所带电量: F=1.6021773×10-19C ×6.022137 ×1023mol-1 =9.648531×104Cmol-1 F被称为Faraday常数。 即:电解1mol的物质,所需用的电量都是1个 “法拉第”(F),等于96500 C
+ 1 ClO3 3 1 3
EA (ClO /Cl )
3
3
0.0592V {c(ClO )}{c(H )} = EA (ClO /Cl ) + lg 6 {c(Cl )} 0.0592V =1.45V + lg10.06 = 1.51V 6
3
+
6
已知 298K ,EA (O2 /H2O) = 1.229V, 例: 求: ⑴ 若 p(O2 ) = p ,pH = 14 时,E(O2 /H2O) = ? ⑵ EB (O2 /OH ) = ?
例:将下列反应设计成原电池并以原电池 符号表示。
2Fe 1.0mol L + Cl 2 101325Pa
2+ 1 3+
2Fe 0.1mol L + 2Cl 2.0mol L
1
1
解: 正 极 Cl 2 (g ) + 2e 2+ e 负 极 Fe (aq )
4
+ 8H 2 O
+ 5H 2 O = 5SO
2 3 +
2 4
+ 10H + 10e
2+ 2 4
+
2MnO + 5SO + 6H = 2Mn + 5SO + 3H2O 2KMnO + 5K 2SO3 + 3H2SO4 4 = 2MnSO4 + 6K2SO4 + 3H2O
例2:配平
Cl2 (g) + NaOH(aq) NaCl(aq) + NaClO3 (aq)
2+ 2+ 2+
+
1
1
Cu + 2H
2+
+
+
EMF = E (Cu /Cu) E (H /H2 ) = 0.340V 则 E (Cu /Cu) = 0.340V
3.标准电极电势表
① 采用还原电势;
② E 小的电对对应的还原型物质还原性强; E 大的电对对应的氧化型物质氧化性强。
③ E 无加和性 + 2e Cl2 (g) 2Cl (aq)
E(Hg2Cl2/Hg) = 0.2415V
7.3.2 标准电极电势
1.标准电极电势和标准电动势
E 电对的标准电极电势: (电对) E 原电池的标准电动势: MF = E+ E
2.电极电势的测定
() Pt , H 2 ( p ) H (1.0mol L )
Cu (1.0mol L ) Cu (+) Cu + H 2
7.2.3 原电池电动势的测定
( ) Zn Zn (1.0mol L ) ‖ Cu (1.0mol L ) Cu ( + )
2+ 1 2+ 1
EMF — 电动势,可以由数字电压表或 电位差计来测定。
EMF — 标准电动势,例如,铜 锌原电池 EMF = 1.10V。
7.2.4 原电池的最大功与Gibbs函数
值分别为+2和+1。
⑤中性分子中,各元素原子的氧化值的
代数和为零 ,复杂离子的电荷等于各元
素氧化值的代数和。
例: H 5 I O6
I的氧化值为+ 7
S2 O S4 O
2 3 2 6
S的氧化值为+ 2 S的氧化值为+ 2.5
8 Fe的氧化值为 + 3
Fe 3 O 4
7.1.2 氧化还原反应方程式的配平
E = 1.36V
1 Cl2 (g) + e Cl (aq) E = 1.36V 2 ④ 一些电对的 E 与介质的酸碱性有关
E E 酸性介质: A ;碱性介质: B
7.3.3 Nernst方程式
1.Nernst方程式
电池反应: rGm = △ rGm+ 2.303RTlgJ △
ZFEMF = ZFEMF + 2.303RTlgJ 2.303RT EMF = EMF lgJ ZF = 298.15K时 , 将 R = 8.314J mol1 K 1 , 当T 1 F = 96485C mol 代入得: : 0.0592V EMF (298K ) = EMF (298K ) lgJ Z
还原型
2+
电对: Zn
电极
/Zn ,Cu
/Cu
金属导体如 Cu、Zn 惰性导体如 Pt、石墨棒
原电池符号(电池图示):
() Zn Zn 2+ (1.0mol L1 ) ‖ 2+ (1.0mol L1 ) Cu (+) Cu
书写原电池符号的规则: ①负极“-”在左边,正极“+”在右边, 盐桥用“‖”表示。 ②半电池中两相界面用“ ”分开,同 相不同物种用“,”分开,溶液、气体要注明 cB,pB 。
酸性溶液中
