福建教师招聘考试化学知识点《键能、键角、键长》
第二章 第一节 第2课时 键参数——键能、键长与键角-2024版化学高三总复习

第2课时键参数——键能、键长与键角题组一键参数——键能、键长与键角1.下列说法错误的是()A.键能是衡量化学键稳定性的参数之一,键能越大,则化学键就越牢固B.键长与共价键的稳定性没有关系C.键角是两个相邻共价键之间的夹角,说明共价键有方向性D.共价键是通过原子轨道重叠并共用电子对而形成的,所以共价键有饱和性2.下列说法正确的是()A.在分子中,两个原子间的距离叫键长B.非极性键的键能大于极性键的键能C.键能越大,表示该分子越容易受热分解D.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可说明HCl分子比HI分子稳定3.(2022·长沙高二检测)下列关于键参数的说法错误的是()A.双键的键能比单键的键能大B.一般来说,原子半径越小的原子形成的共价键键长越短C.H—F的键长是H—X中最短的D.可以利用X射线衍射实验测定共价键的键长等参数4.(2022·海南国兴中学高二检测)NH3分子的空间结构是三角锥形,而不是正三角形的平面结构,解释该事实的充分理由是()A.NH3分子中的共价键为极性键B.分子内3个N—H的键长相等,键角相等C.NH3分子内3个N—H的键长相等,3个键角都等于107°D.NH3分子内3个N—H的键长相等,3个键角都等于120°题组二键参数的应用5.(2022·西安高二检测)关于键长、键能和键角,下列说法不正确的是()A.通过反应物和生成物分子中键能数据可以粗略预测反应热的大小B.键长越长,键能越小,共价化合物越稳定C.键角是确定多原子分子空间结构的重要参数D.同种原子间形成的共价键键长长短总是遵循:三键<双键<单键。
键参数——键能、键长与键角

§2-2 键参数——键能、键长与键角【学习目标】1、初步了解键能、键长、键角的概念,能根据其数据认识共价键的强弱;2、了解键能的应用—与反应热、分子稳定性的关系。
【重、难点】键参数及其应用一、键参数包括____________、____________、________________1.键能(1)定义:___________原子形成________mol化学键释放的______能量。
(2)单位:_____________ 通常取_________如H—H键的键能是436.0kJ·mol-1,表示_______________________________________。
(3)意义①表示共价键的强弱:原子形成共价键时,轨道重叠程度______,体系能量降低______,释放出的能量_______,形成的共价键的键能_______,共价键__________。
②表示分子的稳定性:键能_________,分子越_________。
-1分解为气态原子时,需要(填)能量;2(2)1mol H2在2 mol Cl2中燃烧,放出的热量kJ;(3)由表中所列化学键形成的单质分子中,最稳定的是,最不稳定是,形成的化合物分子中,最稳定的是,最不稳定的是;(4)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是__________________________________;(5)预测1mol H2在足量F2中燃烧比在Cl2中放热。
【归纳】键能的应用——反应热与键能的关系由键能求反应热的公式为:△H =____________的键能总和—____________的键能总和2.键长:(1)概念:形成共价键的两个原子之间的________________相同原子的共价键键长的一半称为_____________(2)意义:一般来说,键长______,键能就_______,键就_______,分子就_________,受热时就________,热稳定性_________。
学案 键参数——键能 键长与键角

第二章分子结构与性质第一节共价键第2课时键参数——键能、键长与键角学习目标1.知道共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。
2.能根据共价键的结构特点说明简单分子的某些性质。
核心素养宏观辨识与微观探析:通过键参数对共价键的描述以及对物质化学性质、结构的影响,探析微观结构对宏观性质的影响,从宏观和微观相结合的视角分析解决实际问题。
证据推理与模型认知:结合键参数对物质结构与性质的影响,运用模型解释化学现象,揭示现象的本质和规律。
知识梳理一、共价键的三个键参数1.键能(1)概念:气态分子中1 mol化学键解离成所吸收的能量。
单位是kJ·mol-1。
(2)条件:键能通常是298.15 K,101 kPa条件下的标准值。
(3)实例:气态氢原子形成1 mol H—H释放的最低能量为436.0 kJ,则H—H的键能为。
(4)应用:下表中是H—X的键能数据①若使2 mol H—Cl断裂为气态原子,则发生的能量变化是吸收的能量。
②表中共价键最难断裂的是,最易断裂的是。
③由表中键能数据大小说明键能与分子稳定性的关系:HF、HCl、HBr、HI的键能依次,说明四种分子的稳定性依次,即HF分子很稳定,最分解,HI分子最不稳定,最分解。
2.键长(1)概念:构成化学键的两个原子的核间距。
如在Cl2分子中,两个氯原子的核间距就是Cl—Cl的键长。
(2)应用①判断共价键的稳定性键长越短,往往键能,表明共价键越。
②判断分子的空间结构键长是影响分子空间结构的因素之一。
如CH4分子的空间结构是正四面体形,而CH3Cl的空间结构是四面体形,即不是正四面体形,其原因是。
(3)实例:下列三种分子:①H2、②Cl2、③Br2,共价键的键长最长的是,键长最短的是,键能最大的是。
3.键角(1)概念:在多原子分子中,两个相邻共价键之间的夹角。
(2)意义:键角可反映分子的空间结构,是描述分子空间结构的重要参数,多原子分子的键角一定,表明共价键具有。
键参数----键能、键长与键角

某些共价键的键能
•[观察分析]键能大小与化学键稳定性的关系?
键能越大,化学键越稳定
2. 键长:形成共价键的两个原子之间的核间距
某些共价键键长
•1pm=10-12 m
[观察分析]键长与键能的关系?
键长越短,键能越大,共价键越稳定。
3. 键角:两个共价键之间的夹角称为键角。
键参数——键能、 键长与键角
二、键参数:键能、键长、键角
1. 键能: 气态基态原子形成l mol化学键释放的最低能量。 通常取正值。单位:kJ/mol
如,形成l mol H—H键释放的最低能量为436.0 kJ,
则 H—H键能为436.0 kJ/mol
形成1 molN N键释放的最低能量为946 kJ
现代化学常利用质谱仪测定分子的结构。它的基本 原理是在质谱仪中使分子失去电子变成带正电荷的分子 离子和碎片离子等粒子。由于生成的分子离子、碎片离 子具有不同的相对质量,它们在高压电场加速后,通过 狭缝进入磁场分析器得到分离,在记录仪上呈现一系列 峰,化学家对这些峰进行系统分析,便可得知样品分子 的结构。例如,图2—7的纵坐标是相对丰度(与粒子的 浓度成正比),横坐标是粒子的质量与电荷之比(m/e) ,简称质荷比。化学家通过分析得知,m/e=92的峰是 甲苯分子的正离子(C6H5CH3+),m/e=91的峰是丢失一 个氢原子的的C6H5CH2+ ,m/e=65的峰是分子碎片…… 因此,化学家便可推测被测物是甲苯。
3.通过上述例子,你认为键长、键能对分子的 化学性质有什么影响?
汇报
1.形成2 mo1HCl释放能量: 2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ 形成2 mo1HBr释放能量: 2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ HCl释放能量比HBr释放能量多,因而生成的HCl更
键参数——键能、键长与键角
归纳总结
共价键稳定性强弱的判断方法 (1)根据原子半径和共用电子对数目判断:成键原子的原子半径 越小,共用电子对数越多,共价键越牢固,含有该共价键的分 子越稳定。 (2)根据键能判断:共价键的键能越大,共价键越牢固,破坏共 价键消耗的能量越多。 (3)根据键长判断:共价键的键长越短,共价键越牢固,破坏共 价键所消耗的能量越多。
2.N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化 学事实。(利用课本P37表2-1的相应数据分析)
已 知 N—N 、 N==N 和 N≡N 的 键 能 之 比 为 1.00∶2.17∶4.90 , 而 C—C 、 C==C、C≡C的键能之比为1.00∶1.77∶2.34。如何用这些数据理解氮分 子不容易发生加成反应而乙烯和乙炔容易发生加成反应?
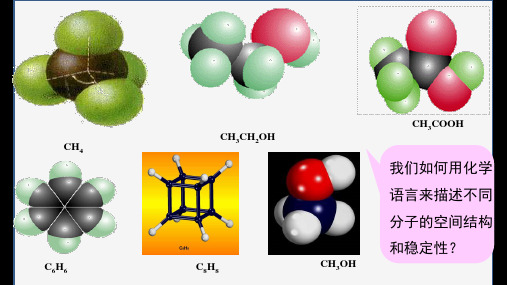
CH4 C6H6
CH3CH2OH C8H8
CH3OH
CH3COOH
我们如何用化学 语言来描述不同 分子的空间结构 和稳定性?
第二章
键参数——键能、键长与键角
1Байду номын сангаас键能
一、键参数——键能、键长与键角
键能是气态分子中断裂1 mol化学键解离成气态原子所吸收的能量。 或气态基态原子形成1 mol化学键释放的最低能量。键能通常取正值,单 位是kJ/mol。键能通常是298.15 K、101 kPa条件下的标准值。
键能可用于估算化学反应的热效应,如H—H键、F—F键、H—F键的 键能分别为436 kJ·mol-1、157 kJ·mol-1、568 kJ·mol-1,则H2与F2反应是放热 反应。
2.键长
键长是指形成共价键的两个原子之间的核间距。因此原子半径决定化 学键的键长,原子半径越小,共价键的键长越短。 化学键的键长与键能是相关的。例如,C—C键、C=C键、C≡C键的键长分 别为154 pm、133 pm、120 pm,键长越来越小,它们的键能分别为347.7 kJ·mol-1、615 kJ·mol-1和812 kJ·mol-1,越来越大。 共价键的键长越短,往往键能越大,表明共价键越稳定。
学案1:2.1.2 键参数——键能、键长与键角

第2课时键参数——键能、键长与键角目标导航1.通过认识共价键的键能、键长和键角,从微观角度模型化解释分子的空间结构。
2.结合共价键的键长、键能和键角等数据,理解分子的性质与键参数的关系,培养证据推理与模型认知的核心素养。
3.掌握用共价键的强弱解释物质稳定性的方法。
【课前初探】知识铺垫1.甲烷分子为结构,键角是。
2.F、Cl、Br、I原子半径逐渐,F2、Cl2、Br2、I2与氢气反应越来,HF、HI、HBr、HI的稳定性逐渐。
必备知识1.键参数——键能、键长与键角(1)键能。
键能是分子中断裂化学键解离成气态原子所的能量。
键能可用于估算化学反应的热效应,如H—H键、F—F键、H—F键的键能分别为436 kJ·mol-1、157 kJ·mol-1、568 kJ·mol-1,则H2与F2反应是反应(填“放热”或“吸热”)。
(2)键长。
键长是指形成共价键的两个原子之间的。
化学键的键长与键能是相关的。
例如,C—C 键、C=C键、C≡C键的键长分别为154 pm、133 pm、120 pm,键长越来越,它们的键能分别为347.7 kJ·mol-1、615 kJ·mol-1和812 kJ·mol-1,越来越。
(3)键角。
键角是指在多原子分子中,两个相邻共价键之间的。
如CO2的结构式为,键角为,是一种分子;H2O分子中的H—O—H键角是105°,是一种形(或称角形)分子。
多原子分子中的键角一定,表明共价键具有。
键长和键角的数值可以通过晶体的实验获得。
2.键参数的应用(1)分子的热稳定性。
参照教材37页表2-1中的键能数据。
计算1 mol H2分别与1 mol Cl2、1 mol Br2(蒸气)反应生成2 mol HCl和2 mol HBr时,分别(填“放出”或“吸收”)kJ和(填“放出”或“吸收”)kJ的热量。
则2 mol HBr分解需要吸收的能量比2 mol HCl (填“高”或“低”),故更易分解。
教师招聘面试答辩化学知识

教师招聘面试答辩化学知识一、化学知识的重要性化学作为自然科学的一门学科,研究的是物质的组成、结构、性质、变化规律以及与能量的关系。
化学知识在日常生活中无处不在,涉及到我们的衣食住行,甚至是环境保护、新材料研发等重大领域。
作为教师,掌握扎实的化学知识,不仅可以提高教学效果,还能培养学生的科学素养和创新能力。
二、化学基础知识1.原子结构与元素周期表:–原子核由质子和中子组成,电子环绕在原子核外部。
–元素周期表是根据原子序数和元素性质排列的表格,可以帮助我们了解元素的基本性质和周期规律。
2.原子与化学键:–原子通过化学键结合成分子或离子,常见的化学键包括共价键、离子键和金属键。
–共价键是原子间电子的共享,离子键是电子的转移,金属键是金属中的电子云。
3.化学反应与化学方程式:–化学反应是物质发生变化的过程,分为合成反应、分解反应、置换反应、还原反应等。
–化学方程式是用化学符号和化学式表示化学反应的过程,包括反应物、生成物和反应条件等。
4.酸碱中和反应:–酸是指具有产生H+离子的性质,碱是指具有产生OH-离子的性质。
–酸碱中和反应是酸和碱在适当条件下反应生成盐和水的反应。
三、常见化学实验与实验知识1.酸碱中和滴定:–酸碱中和滴定是通过滴定法确定溶液中酸碱物质浓度的方法,常用的指示剂有酚酞、溴酸亚铁等。
2.氧化还原反应:–氧化还原反应是指物质在电子转移过程中发生的反应,常见的氧化还原反应有金属与酸反应、金属与非金属氧化物反应等。
3.气体的制备与性质:–气体的制备方法包括实验室制备和工业制备,常见的气体有氧气、氢气、氮气等。
4.溶液的浓度计算:–溶液的浓度可以通过溶质质量与溶液体积的比值、溶质的摩尔浓度等方式来计算。
四、化学知识在教学中的应用1.生活化学知识的教学案例:–利用化学知识解析日常生活中的现象和问题,如洗衣粉的选择、酸雨的原因等。
2.实验教学的重要性与方法:–实验教学能够让学生更深入地理解化学知识,培养其实验技能和科学思维能力。
化学键能与键长

化学键能与键长化学键是化学反应中原子之间的相互作用力,它们在分子和晶体中起着关键的作用。
化学键能和键长是描述和衡量化学键强度和键的长度的重要指标。
本文将介绍化学键能与键长的概念、影响因素以及它们在化学研究和应用中的重要性。
一、化学键能化学键能是指在分子中相邻原子之间的相互吸引力所存储的能量。
它是描述化学键强度的重要参数。
化学键能的大小直接影响着化学反应的速率和平衡。
在化学反应中,化学键能被破坏或形成,从而释放或吸收能量。
一般来说,化学键能越大,反应越稳定,反应速率越慢。
不同类型的化学键有不同的键能,比如离子键、共价键和金属键等。
化学键能的计算方法很多,其中最常用的是通过实验测定反应热(焓变)来计算化学键能。
反应热是指反应前后体系的焓差,它可以通过燃烧热计或热量计等实验设备进行测定。
化学键能还可以通过理论计算方法,如量子化学方法、密度泛函理论等进行估算。
这些计算方法基于一些假设和近似,能够提供较为准确的化学键能数值。
二、化学键长化学键长是指在分子结构中连接两个原子之间的距离。
化学键长的大小直接关系到化学键的强度。
通常来说,化学键越长,键能越弱。
在同一种化学键中,原子半径较小的原子间的化学键长一般较短,键能较大。
化学键长的测定一般通过X射线衍射、电子衍射、红外光谱等实验方法进行。
化学键长不仅受到原子半径的影响,还受到其他因素的影响,如键的性质、分子的结构和对称性等。
在一些特殊的化学键中,如双键、三键、氢键等,由于键的性质不同,化学键长可能会有较大的变化。
三、化学键能与键长的影响因素化学键能与键长受到多种因素的影响,下面将介绍一些重要的影响因素:1. 原子特性:化学键的强度和长度与原子的电子结构(电负性和电子排布)密切相关。
原子的电负性差异越大,化学键能越强,键长越短。
例如,离子键中,金属原子失去电子形成阳离子,非金属原子接受电子形成阴离子,离子之间的相互吸引力较强,键能较大,键长较短。
2. 分子结构和对称性:分子的几何结构和对称性对化学键的强度和长度有重要影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中学化学知识点很细,需要整理的地方非常多,本文根据福建教师招考中考试大纲对中学化学的要求,梳理了键能、键角、键长知识点,方便大家更加顺利地开展学习。
一、定义
(1)键能:断裂1mol化学键所吸收的能量。
(或气态基态原子形成l mol化学键释放的最低能量。
通常取正值。
单位:kJ/mol。
)(键能越大,即形成化学键时放出的能量越多,说明这个化学键越稳定,越不容易被打断。
是衡量共价键稳定的参数之一。
)
(2)键长:两个成键原子A和B的平衡核间距离。
(形成共价键的两个原子之间的核间距。
)(键长越短,键能越大,表明共价键越稳定。
是衡量共价键稳定性的另一个参数)
(3)键角:两个共价键之间的夹角称为键角。
二、共价键
键角是描述分子立体结构的重要参数。
多原子分子的键角是一定的,表明共价键具有方向性。
说明:键长、键能决定共价键的强弱和分子的稳定性。
原子半径越小,键长越短,键能越大,分子越稳定。
例如,HF、HCL、HBr、HI分子中:
X原子半径:F<CL<Br<I
H—X键的键长:H—F<H—CL<H—Br<H—I
H—X键的键能:H—F>H—CL>H—Br>H—I
HX分子稳定性:HF>HCL>HBr>HI
三、其他
键角一定,表明共价键具有方向性。
键角是描述分子立体结构的重要参数,分子的许多性质与键角有关
键长、键能对分子的化学性质的影响:一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
相同原子的共价键键长的一半称为共价半径。
以上就是福建教师招考为您整理推荐的键能、键角、键长知识归纳梳理,希望给同学们带来帮助。
