小鼠肺癌原位瘤接种方法
小鼠皮下荷瘤标准操作规程

小鼠皮下荷瘤标准操作规程小鼠皮下荷瘤(或称移植瘤)实验是一种常用的动物实验方法,用于研究肿瘤生长、药物疗效等方面。
为了保证实验操作的准确性和动物福利的最大化,下面是一份小鼠皮下荷瘤标准操作规程。
一、实验动物1. 鼠种选择:建议使用常用的实验动物品系(如BALB/c、C57BL/6等)。
2. 年龄选择:选择6-8周龄的小鼠,确保其免疫系统和器官发育成熟。
3. 处理:在实验之前,将小鼠隔离一段时间,以适应新环境,并遵循动物实验伦理和相关法规进行处理。
二、荷瘤动物的准备1. 荷瘤细胞株的选择:根据实验目的选择合适的肿瘤细胞株。
细胞株应来源于可靠且经验证的来源,如细胞库、研究机构合作实验。
2. 细胞培养:在符合无菌条件下,将细胞培养在合适的培养基中,保持其活性和稳定性。
3. 细胞计数:使用细胞计数仪准确计算细胞数目,并调整细胞浓度。
4. 细胞检测:定期检测细胞的纯度、鉴定和验证细胞的肿瘤特性。
5. 注射剂量:根据实验需求和细胞特性,确定荷瘤细胞的注射剂量。
三、手术准备1. 操作间的准备:在符合无菌条件下进行手术,准备好所需的实验器具和仪器。
2. 麻醉与镇痛:使用适合的麻醉方法对小鼠进行麻醉,并在手术中给予镇痛以减轻小鼠的疼痛。
3. 无菌操作:实施手术之前,用适当的方法消毒手术台和手术器械。
四、手术操作1. 注射位置选择:选择合适的部位进行皮下注射(如腹部、背部),确保容易观察和测量肿瘤的生长。
2. 手术操作流程:(1) 麻醉小鼠并进行镇痛。
(2) 将小鼠定位到手术台上,以固定小鼠的身体。
(3) 使用酒精棉球消毒注射部位。
(4) 使用规格合适的针头将预定剂量的荷瘤细胞注入小鼠的皮下组织中。
(5) 注意注射的角度和深度,避免插入过深或过浅。
(6) 注射完毕后轻轻拍打注射部位以防止荷瘤细胞漏出。
(7) 小鼠苏醒后放回适宜的养护环境。
五、术后护理1. 观察:术后密切观察小鼠的行为和健康状况,特别是对于术后48小时内的小鼠,要加强监测,以及记录并报告任何异常情况。
肝胆胰脾裸鼠皮下成瘤及原位瘤动物实验方案

裸鼠皮下成瘤及原位瘤动物实验方案分组:正常细胞组、EGFR1转染无关siRNA组、EGFR1转染目的基因(每组6只)。
细胞准备及注射裸鼠方法:到动物室准备实验。
取出未作处理的小鼠和处理后小鼠用鼠笼,顺序摆放在超净台中。
选体形较大的小鼠称重,以3μl/g剂量,腹腔注射10%水合氯醛麻醉小鼠。
约5分钟,小鼠开始进入安静状态,将其仰卧固定。
切忌麻醉剂过量使用。
(1)铺白布于鼠板上,仰卧位固定小鼠四爪,碘伏棉球消毒腹侧面上至颈部、下至腹股沟、后至腋后线。
消毒两次。
铺手术巾于小鼠上,在其左侧剪口(4*4cm),暴露其左侧腹部, 用碘伏消毒一次。
在左侧肋弓下缘1cm处向下剪开2cm皮肤,暴露腹壁肌肉,镊子牵拉腹壁肌肉,避开腹腔内脾脏,剪开腹壁肌肉,暴露内脏。
用棉签蘸PBS,拨出脾脏下极,切忌牵拉,以免损伤脾脏和胰腺。
(2)找到脾脏同时,用25微升Matrigel混合于细胞管中,打悬细胞沉淀,使细胞分散均匀成单细胞悬液。
用BD针吸净EP管中的单细胞悬液,稍退针芯,打出气泡,在脾脏下极内侧(凹面)进针向脾门方向约2mm开始注射细胞,注射完毕停留约30秒钟,缓慢退出针,以防细胞渗出。
同时用蘸PBS的棉球压迫周围出血点止血。
(3)用注射器吸取庆大霉素注射液(用生理盐水250:1稀释)约400微升,注入腹腔,棉球蘸干皮缘渗出的抗生素。
开始缝合腹壁肌肉(连续缝合4针)。
再次用注射器吸取庆大霉素注射液约400微升冲洗缝合口,棉球蘸干。
缝合皮肤(间断缝合4针)。
碘伏棉球消毒缝合口。
撤除固定,使小鼠处于自然体位,放于鼠笼中。
(4)所有细胞注射完毕,剪耳标记,记录剪耳标记及分组情况。
Day5-7:注意小鼠的状态,及时发现小鼠是否有因手术刺激、胰腺损伤、感染等死亡的情况。
Day42:颈椎离断,处死小鼠,解剖尸体,观察脾脏肿瘤生长状况,肝脏、肺脏及其他器官是否有转移瘤形成。
所有可疑组织均做好标记,拍照,若有表面结节,计数后,冻于液氮中。
小鼠肿瘤模型

小鼠肿瘤模型肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。
其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。
小鼠模型分三大类:第一类是以S180、EAC、H22等为代表的,他们的宿主小鼠多选用KM,可产生腹水,也可在皮下成瘤。
多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药7到10天,接种10天后结束试验,剥取肿瘤称瘤重。
1. 关于构建瘤种可以用体外细胞株培养后,用PBS悬浮至1~3×106/0.1ml/mouse,i.p接种即可,最好用6号左右的针头,就是常用的2ml一次性注射的针头。
2. 关于腹水传代观察到第一代的种鼠肚子较大后(一般约8~9天左右),可以传代,传代时取1 ml注射器,用2ml注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个0.5ml就可以了,不用离心,直接用PB S3~6倍稀释后,接种到新的老鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整,第二代以后,尽量6~7天的时候传代,不要等的时间太久,否则腹水容易血性。
三代后可用于试验。
3. 关于接种进行试验这个时候抽取的腹水需要量比较多,一般需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。
然后进过一定的稀释后,接种到小鼠的腋下。
关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的时候可以适当的计数,但是要用台盼兰染色后计活细胞数。
接种部位在小鼠腋下,但是不要深入到腋窝里面,会给以后的操作带来麻烦。
接种时的进针处离接种处远一点,让针头在皮下多走一段,不容易污染。
两种方法建立小鼠原位肝癌模型的比较

两种方法建立小鼠原位肝癌模型的比较摘要】目的比较建立小鼠原位肝癌模型的两种方法的优劣。
方法分别采用肝脏原位注射细胞法和尾静脉高压水流动力学注射法建立小鼠原位肝癌模型,对两组小鼠肝脏的成瘤情况进行比较。
结果两组小鼠均能在短期内成瘤,且成瘤率高。
结论尾静脉高压水流动力学注射法比原位注射细胞法更容易操作,小鼠存活率高,肝脏成瘤更均匀。
【关键词】原位肝癌模型高压水流动力学注射【中图分类号】R73-3 【文献标识码】A 【文章编号】2095-1752(2013)14-0382-02原发性肝细胞肝癌是我国乃至全球范围内的研究热点,而原位肝癌小鼠模型是进行原发性肝细胞肝癌基础研究和临床研究的重要工具。
目前原位肝癌模型主要采用化学诱导法(DEN),但是该方法建立模型成瘤的时间比较长,大概需要6-8个月,导致研究的周期很长。
本文尝试了两种比较快速地建立小鼠原位肝癌模型的方法--肝脏原位注射细胞法和尾静脉高压水流动力学注射法,并对这两种方法建立的小鼠模型进行了比较。
1 实验材料及方法1.1 实验动物与试剂C57BL/6小鼠7-8周,雄性,20只,购自上海斯莱克实验动物有限公司。
Hepa1-6细胞株购自中科院上海细胞库。
DMEM高糖培养基,胎牛血清,购自上海英潍捷基公司。
水合氯醛、碘伏购自国药集团。
注射器,手术器械、缝合线、针领自苏州大学材料供应中心。
1.2 方法1.2.1 细胞悬液制备 Hepa 1-6在37℃、5 % CO2 的细胞培养箱中培养,取对数生长期细胞,0.25%胰蛋白酶消化后,收集于15mL离心管中,用PBS调整细胞悬液浓度至5×107/mL用于原位注射细胞法,每只小鼠注射20uL。
用PBS调整细胞悬液浓度至5×105/mL 用于尾静脉高压水流动力学注射法每只小鼠注射2mL。
1.2.2 小鼠分组 20只7-8周龄的C57BL/6雄性小鼠分为2组,第1组10只进行肝脏原位注射细胞建立模型,第2组10只采用尾静脉高压水流动力学注射的方法建立模型。
肺原位注射模型
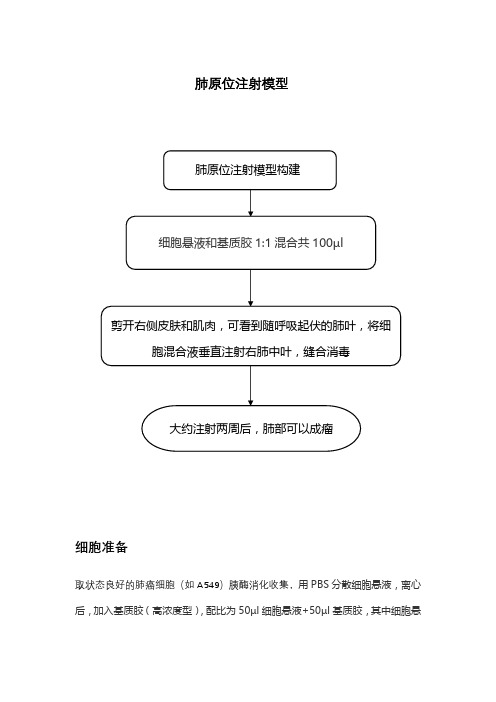
肺原位注射模型
细胞准备
取状态良好的肺癌细胞(如A549)胰酶消化收集,用PBS分散细胞悬液,离心后,加入基质胶(高浓度型),配比为50µl细胞悬液+50µl基质胶,其中细胞悬液中的细胞量为3*106个。
裸鼠准备
选取5-8周龄健康裸鼠
操作步骤
1.裸鼠100µl水合氯醛麻醉后右侧卧位固定,右侧胸部皮肤用酒精消毒。
2.确定小鼠肺部位置,位于小鼠左侧肋骨下缘以上约1cm处,有两条纵向较粗的血管,肺部位于这两条血管之间。
3. 用手术剪剪开右侧胸部皮肤,一般可以看见颜色浅于肌肉的随呼吸运动上下起伏的肺叶,如视野不明朗,可以用镊子钝性分离肌肉组织暴露目标视野。
4. 用胰岛素针将准备好的细胞混合液,垂直进针,打入右肺中叶,进针深度在3-5mm,推针速度尽量慢,全部推进去后可以轻轻压住进针处。
5.缝合皮肤,消毒,待小鼠苏醒后放回动物房继续饲养
注意事项
基质胶要注意使用温度,保证在冰上进行,不要让它凝固。
小鼠肺癌模型

小鼠肺癌模型
小鼠肺癌模型
小鼠肺癌模型
将小鼠平放,与左右侧腋下中部以碘伏消毒并备皮,剪开膈肌,沿 两侧肋骨剪开胸腔暴露肺脏、心脏
首先观察肺脏是否存在出血或充血,其次观察是否存在水肿或 气肿,剪开上下俩端气管,将部分肺组织置在离心管中,注入 PBS缓冲液并密封标记,随后存放在冰箱中
取部分肺组织进行常规组织石蜡包埋步骤,最后进行HE 染色
小鼠肺癌模型
4、 病理学报告:形态与原代体外细胞形态相似 ,程 长梭形 ,核幼稚 ,细胞核深染 ,核异型性明显 ,排列
杂乱紧密 ,与邻近肺组织特征完全不同
5、 评估肺癌模型:通过观察肿瘤的生长情况、组织学 检测、免疫组化染色等方法对肺癌小鼠模型进行评估
-
谢
谢
小鼠肺癌模型
小鼠肺癌模型
目录
小鼠肺癌模型
1、 实验动物 :无特定病原体(SPF) 级 C57BL/6 小鼠 ,6 ~8 周 ,雌 性 ,体重约 22 g ,共10只。实验 动物使用的 3R原则给予人道主义 关怀
1
2、 体内移植肺癌细胞:将 体外培养的肺癌细胞注射到 小鼠体内,形成移植瘤模型
2
小鼠肺癌模型
3、 实验方法 细胞复苏 1、 将水浴锅预热至37℃,准备好干净的一次性PE手套,置于含 10%血清、 1%双抗的 DMEM/HIGHGLUCOSE 基础培养基中 2、 将细胞从液氮罐中取出放入PE手套中,迅速没入水浴锅,摇晃冻存管加速溶解,以1 分钟内全部溶解为宜 3、 在超净台中将复苏好的细胞液加入到装有新鲜培养基的离心管内,1200rpm/min 离 心3分钟,离心完毕去掉上清 4、 用适量与细胞对映的完全培养基重悬细胞,接入到无菌容器中(培养瓶或培养皿), 补充培养基到适宜,放入培养箱培养 5、每天镜下观察细胞生长状态,每 2 天换液处理,约每 3 d 进行消化传代一次。细胞汇 合率达 80%进行传代培养
小鼠 Lewis肺癌原位模型的建立
小鼠 Lewis肺癌原位模型的建立李宁;张晓晔;蒋中秀;刘洋;李雪娇【摘要】目的:利用Matrigel与Lewis制备细胞混悬液注射于小鼠左肺内,建立小鼠Lewis肺癌原位模型,评价其肿瘤生长情况、转移情况,以期建立更稳定、更接近于人肺癌生长情况的小鼠肺癌原位模型。
方法将处于对数生长期的Lewis 肺癌细胞混悬于Matrigel中,接种于C57BL/6近交系小鼠左肺内。
分别于第4、7、10、13、16天各处死5只小鼠,观察其局部成瘤率、肿瘤生长情况、中位生存期及肿瘤转移情况,并对各阶段小鼠行肺部,肝脏,肾脏,脾脏病理切片检查。
结果术后第7天解剖的5只小鼠中,3只小鼠肺上可见小的瘤结节形成,其余2只肺上未见肉眼成瘤,行病理HE染色检查在显微镜下可见2只小鼠肺脏有小的瘤结节形成。
术后第10天以后处死的所有小鼠肺上均有肉眼成瘤,术后第13天,所有小鼠肺原位成瘤并伴有血性胸腔积液、胸腔内转移。
术后第25天,有1只小鼠出现上述转移的同时还出现了心包膜转移及肾脏远处转移。
5只小鼠生存期分别为17 d、20 d、22 d、22 d、25 d,小鼠中位生存期为21.2 d(17~25 d)。
成瘤率100%。
结论利用Matrigel法成功建立小鼠Lewis肺癌原位模型,稳定性好,成瘤率高,并具有远处转移的特性,更接近于人肺癌的发生、发展过程。
%Objective To establish a mouse model of orthotopic Lewis lung carcinoma using Matrigel, to evaluate the tumor growth and metastasis, and to provide a more stable mouse model of orthotopic lung cancer, which is more similar to human lung cancer.Methods Logarithmic phase of cultured Lewis lung cancer cells were suspended in Matrigel, vac-cinated into the left lung of inbred C57BL/6 mice.Five mice were killed on the 4th, 7th, 10th, 13th, and 16th days, re-spectively, and to observe the mediansurvival, tumor formation rate, tumor growth, and metastasis.Pathological changes of the mouse lung, liver, kidney and spleen were examined.Results In 5 mice killed on the 7th postoperative day, small tumor nodules were observed on the lung in three mice and no tumor was visible by gross inspection in the other two mice, but small tumor nodules were observed under the microscope.For all the mice killed on the 10th postoperative day, tumors were visible to the naked eye on the lung of all the five mice.On the 13th day, orthotopic tumor was observed on the lung with bloody pleural effusion and pleural metastasis in all the five mice.On the 25th day, in addition to the pleural metasta-sis, one mouse had pericardial metastasis and renal metastasis.The survival periods of the 5 mice were 17 d, 20 d, 22 d, 22 d, and 25 d, respectively, with a median survival period of 21.2 d (17-25 d), and the tumor formation rate was 100%.Conclusions Mouse models of orthotopic Lewis lung carcinoma is successfully established using injection of tumor cells suspended in Matrigel.This model is more similar to the growth of human lung cancer, with good stability, high tumor formation rate and characteristics of distant metastasis, therefore, is worthy of further application.【期刊名称】《中国实验动物学报》【年(卷),期】2014(000)005【总页数】5页(P79-83)【关键词】小鼠;肺癌;动物模型;Matrigel;Lewis细胞【作者】李宁;张晓晔;蒋中秀;刘洋;李雪娇【作者单位】中国医科大学附属盛京医院,沈阳 110004;中国医科大学附属盛京医院,沈阳 110004;中国医科大学附属盛京医院,沈阳 110004;中国医科大学附属盛京医院,沈阳 110004;中国医科大学附属盛京医院,沈阳 110004【正文语种】中文【中图分类】Q95-33目前,在肺癌的动物实验中,大多使用小鼠皮下种植肺癌细胞系,在皮下形成肺癌肿瘤结节的动物模型,如孙秋艳等[1]用体外培养的Lewis细胞悬液注射于小鼠左侧腋下,形成皮下肿瘤;Xu等[2]应用A549肺癌细胞悬液加入等量的Matrigel 中,注射至裸鼠的皮下组织亦可形成肿瘤模型。
小鼠原位移植瘤模型造模方法
小鼠原位移植瘤模型造模方法
为了更好的模拟肿瘤的生长情况选择发生肿瘤的器官为移植点。
常用的小鼠仍为 NOD-SCID 鼠。
采取开放手术打开暴露相应的发生肿瘤的对应的小鼠器官,将肿瘤组织或肿瘤细胞种植到器官内。
此方式因不易操作,且小鼠手术后死亡率较高,一般不常选用。
小鼠实验分组一般5 只以上为一组,分别设置实验组和对照组。
术前将小鼠于动物房饲养一周适应环境,术前术后称量记录体重。
小鼠移植瘤一般2 w 左右即可形成,可用游标卡尺记录瘤体长短径,每周 3 次记录。
一般待瘤体体积为 1 cmx1 cm 时处死小鼠,收集肿瘤接着在小鼠身上传代处理或进行其他实验验证。
小鼠实验肿瘤动物模型构建关键要细心,尤其是肿瘤细胞选择,肿瘤组织块处理上要仔细认真,这是影响模型成功建立的关键,还有移植手术时更要耐心细致,不要还没有建立就已经失败。
一处瘤内注射疫苗,消除小鼠全身肿瘤
一处瘤内注射疫苗,消除小鼠全身肿瘤“癌症疫苗”可消除肿瘤已经进入临床阶段斯坦福大学医学院(StanfordUniversitySchoolofMedicine)的研究人员进行的一项研究表明,将两种免疫刺激因子直接注射到小鼠体内的实体肿瘤中,可以消除动物体内所有的癌症痕迹,包括远处的、未经治疗癌细胞的转移。
研究发现,这种方法适用于许多不同类型的癌症,包括自发产生的癌症。
研究人员认为,局部应用少量的药物可以作为一种快速且相对廉价的癌症治疗方法,这种疗法不太可能引起全身免疫刺激的副作用。
“当我们一起使用这两种药剂时,我们看到了全身肿瘤的消除,”肿瘤学教授罗纳德·莱维(RonaldLevy)说。
“这种方法绕过了识别肿瘤特异性免疫靶点的需要,不需要对免疫系统进行大规模激活,也不需要对患者的免疫细胞进行定制。
”目前已经批准一种药物用于人体;另一项已在几项无关的临床试验中进行人体试验。
1月开始进行临床试验,以检验治疗对淋巴瘤患者的影响。
莱维是这项研究的资深作者,他将于1月31日发表在《科学转化医学》杂志上。
CpG诱导CD4 T细胞中OX40的表达“惊人的全身效应”Levy是癌症免疫疗法领域的先驱,研究人员试图利用免疫系统来对抗癌症。
在他的实验室里进行的研究导致了利妥昔单抗的发展,利妥昔单抗是第一个被批准用于人类抗癌治疗的单克隆抗体。
一些免疫疗法依赖于刺激全身的免疫系统。
其他的目标是自然出现的检查点,限制免疫细胞的抗癌活性。
还有一些人,比如最近批准用于治疗某些类型的白血病和淋巴瘤的t细胞疗法,要求患者的免疫细胞从身体中移除,并通过基因改造来攻击肿瘤细胞。
这些方法很多都很成功,但它们都有一些缺点——从难以处理的副作用到高成本和冗长的准备或治疗时间。
“所有这些免疫疗法的进步都在改变医疗实践,”Levy说。
“我们的方法是一次性使用非常少量的两种药剂,只在肿瘤内部刺激免疫细胞。
在老鼠身上,我们看到了神奇的、全身的效果,包括在动物身上清除肿瘤。
一种成功率高的小鼠肿瘤细胞系建系方法
一种成功率高的小鼠肿瘤细胞系建系方法
小鼠肿瘤细胞系建系是肿瘤研究的基础,成功率至关重要。
本文介绍了一种成功率高的小鼠肿瘤细胞系建系方法。
将小鼠肿瘤组织切片,然后将其放入细胞培养皿中,添加适量的培养液,并在37℃恒温水浴中培养。
接着,可以使用0.25%的胰蛋白酶去清除培养液中的细胞外残留物,并在37℃恒温水浴中培养,以促进细胞的生长和分化。
可以使用抗体特异性的免疫细胞染色来鉴定细胞,以确保细胞的质量。
本方法可以有效地建立小鼠肿瘤细胞系,具有较高的成功率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠Lewis肺癌,用C57BL/6小鼠。
分组:正常组,模型组,阳性药组,中药组,中西药联用组
方法:采用原位接种法。
操作:
1麻醉:戊巴比妥钠溶液50mg/kg腹腔内注射,将戊巴比妥钠配成10 mg/mL的工作液,按0.05 mL/10 g体重剂量对小鼠进行麻醉。
2接种:小鼠麻醉后,将其仰卧固定在操作台上,对小鼠前胸壁进行酒精消毒,在左腋前线肋弓上约1.5cm处作一约5mm的小切口,分离皮肤及皮下组织暴露至胸壁,将50μL细胞悬液与50μL Matrigel 混匀,在快凝固之前以胰岛素注射针将3LL细胞与Matrigel混悬液共100μL注入小鼠左肺,进针约3mm,注射完后停针5s,拔针后缝合切口。
建议细胞浓度10*6较好,10*6最先成瘤,但具体浓度选择要看你实验的安排及实验的内容,浓度低,成瘤时间稍长。
如果是要接种NCI-H460、A549这些人源的肺癌细胞,建议使用免疫缺陷的BALB/C-nude或者NOD/SCID小鼠,每只老鼠尾静脉注射10*6个细胞(0.1ml)。
