大学化学_课后题答案1.doc1汇总
大学普通化学(第七版)课后答案

普学第五版第一章习題答案1. 答案(1-) (2-) (3+) (4-)2. 答案(lc) (2d) (3a) (4d) (5abd) (6ad) (7d) (8d)3. 答案(1)燃烧前后系统的温度(2)水的质量和比热(3)弹式量热计热容Cb=849J. mol-13&5•答案:获得的肌肉活动的能量」Eg"。
/" 6.答案:设计一个循环 3X ^26>3(^)^2F^(5)X3I t2Fe 3O A (s)->3FeO(s)x2。
q p = 3(-27.6)-(-58.6)-2(38.1) 一 】禹小価(-58.6 ) +2 (3& 1)+6 ,p=3(-27. 6)67 •答案:由已知可知 AH=39.2 kJ. mol-1 AH=AU+A (PV) =AU+PAV w 4=-PAV= -1XRXT = -8. 314X351J = -2. 9kJ AU=AH-PAV=39. 2-2. 9=36. 3kJ&下列以应(或过程)的qp 与qv 有区别吗?简单说明。
(1) 2. OOmol NH4HS 的分解NH4HS (s) 25\ NH3 (g) +H2S (g) (2) 生成 1. OOmol 的 HC1H2(g)+C12(g) 25c 2HC1 (g) (3) 5. 00 mol C02fF^ 干冰)的升华 C02(s) -7晋 C02 (g) (4) 沉淀2. OOmol AgCl(s)Ag\03 (aq) +NaCl (aq)AgCl (s) +NaN03 (aq)9•答案:AU-AH= -A (PV) =-AngRT ( A ng 为反应发生变化时气体物质的量的变化)(1) A U- A H=-2 X (2-0) X 8. 314 X 298. 15/1000= - 9. 9kJ(2) AU-AH=-2X (2-2) XRXT= 0(3) AU-AH=-5X (1-0) X8. 314X(273. 15-78)/1000= -8. llkJ (4) AU- AH=-2X (0-0) XRXT= 010. (1) 4NH3(g)+302(g) = 2N2(g) +6H20(l) 答案 -1530. 5kJ. mol-1 (2) C2H2(g) + H2(g) = C2H4 (g)答案 -174. 47kJ ・ mol-1(3) NH3(g) +稀盐酸答案 -86. 32kJ. mol-1写出离子反应式。
大学普通化学(第七版)课后答案

普通化学第五版第一章 习题答案 1. 答案(1-)(2-)(3+)(4-) 2. 答案(1c )(2d )(3a )(4d )(5abd )(6ad )(7d )(8d )3. 答案(1)燃烧前后系统的温度(2)水的质量和比热(3)弹式量热计热容4..答案:根据已知条件列式K C g K g J g mol g mol J b )35.29659.298](120918.4[5.0122100032261111-+⨯⋅⋅-=⨯⋅⋅⨯-----Cb=849J.mol-15.答案:获得的肌肉活动的能量=kJ mol kJ mol g g8.17%3028201808.311=⨯⋅⨯⋅--6. 答案:设计一个循环 3× )(2)(32s Fe s O Fe →×3→)(243s O Fe )(3s FeO ×2(-58.6)+2(38.1)+6pq =3(-27.6)17.166)1.38(2)6.58()6.27(3-⋅-=----=mol kJ q p7.答案:由已知可知 ΔH=39.2 kJ.mol-1 ΔH=ΔU+Δ(PV )=ΔU+P ΔVw ‘=-P ΔV= -1×R ×T = -8.314×351J = -2.9kJ ΔU=ΔH-P ΔV=39.2-2.9=36.3kJ8.下列以应(或过程)的qp 与qv 有区别吗? 简单说明。
(1)2.00mol NH4HS 的分解NH4HS(s) NH3(g)+H2S(g)(2)生成1.00mol 的HCl H2(g)+Cl2(g) 2HCl(g) (3)5.00 mol CO2(s)(干冰)的升华 CO2(s) CO2(g) (4)沉淀出2.00mol AgCl(s)AgNO3(aq)+NaCl(aq) AgCl(s)+NaNO3(aq)9.答案:ΔU-ΔH= -Δ(PV )=-ΔngRT (Δng 为反应发生变化时气体物质的量的变化) (1)ΔU-ΔH=-2×(2-0)×8.314×298.15/1000= - 9.9kJ (2)ΔU-ΔH=-2×(2-2)×R ×T= 0(3)ΔU-ΔH=-5×(1-0)×8.314×(273.15-78)/1000= -8.11kJ (4)ΔU-ΔH=-2×(0-0)×R ×T= 010.(1)4NH3(g)+3O2(g) = 2N2(g) +6H2O(l) 答案 -1530.5kJ.mol-1 (2)C2H2(g) + H2(g) = C2H4(g) 答案 -174.47kJ.mol-1 (3)NH3(g) +稀盐酸 答案 -86.32kJ.mol-1 写出离子反应式。
大学化学课后复习题解答

第二篇习题与习题解答第一章1.用作消毒剂的过氧化氢溶液中过氧化氢的质量分数为0.030,这种水溶液的密度为1.0g mL1,请计算这种水溶液中过氧化氢的质量摩尔浓度、物质的量浓度和摩尔分数。
解:1L溶液中,m( H2O2) = 1000mL 1.0g mL10.030 = 30gm( H2O) = 1000mL 1.0g mL1(10.030) = 9.7102gn( H2O2) = 30g/34g moL1=0.88moln( H2O) = 970g/18g.mol1=54molb( H2O2)= 0.88mol /0.97kg = 0.91mol kg1c( H2O2)= 0.88mol/1L = 0.88mol L1x( H2O2) = 0.88/(0.88.+54) = 0.0162.计算5.0%的蔗糖(C12H22O11)水溶液与5.0%的葡萄糖(C6H12O6)水溶液的沸点。
解:b(C12H22O11)=5.0g/(342g.mol10.095kg)=0.15mol kg 1b(C6H12O6)=5.0g/(180g.mol10.095kg)=0.29mol kg1蔗糖溶液沸点上升T b=K b b(C12H22O11)= 0.52K kg mol10.15mol kg1=0.078K蔗糖溶液沸点为:373.15K+0.078K=373.23K葡萄糖溶液沸点上升T b=K b b(C6H12O6)= 0.52K kg mol10.29mol kg1=0.15K葡萄糖溶液沸点为:373.15K + 0.15K = 373.30K3.比较下列各水溶液的指定性质的高低(或大小)次序。
(l)凝固点: 0.1mol kg 1 C12H22O11溶液,0.1mol kg 1 CH3COOH溶液,0.1mol kg 1 KCl 溶液。
(2)渗透压:0.1mol L 1 C6H12O6溶液,0.1mol L1CaCl2溶液,0.1mol L 1 KCl溶液,1mol L 1 CaCl2溶液。
大学化学课后习题答案解析(第四章)

第四章电化学与金属腐蚀1.是非题(对的在括号内填“+”,错的填“-”号)(1)取两根铜棒,将一根插入盛有0.1mol·dm-3CuSO4溶液的烧杯中,另一根插入盛有1mol·dm-3CuSO4溶液的烧杯中,并用盐桥将两只烧杯中的溶液连结起来,可以组成一个浓差原电池。
( )(2)金属铁可以置换Cu2+,因此三氯化铁不能与金属铜反应。
( )(3)电动势E(或电极电势φ)的数值与反应式(或半反应式)的写法无关,而标准平衡常数Kθ的数据,随反应式的写法(即化学计量数不同)而变。
( )(4)钢铁在大气的中性或弱酸性水膜中主要发生吸氧腐蚀,只有在酸性较强的水膜中才主要发生析氢腐蚀。
( )(5)有下列原电池(-)Cd|CdSO4(1.0mol·dm-3)||CuSO4(1.0mol·dm-3)|Cu(+) 若往CdSO4溶液中加入少量Na2S 溶液,或往CuSO4溶液中加入少量CuSO4·5H2O晶体,都会使原电池的电动势变小。
( )解:(1)+;(2)–;(3)+;(4)+;(5)–。
2.选择题(将所有正确答案的标号填入空格内)(1)在标准条件下,下列反应均向正方向进行:Cr2O72 - +6Fe2++14H+=2Cr3++6Fe3++7H2O2Fe3++Sn2+=2Fe2++Sn4+它们中间最强的氧化剂和最强的还原剂是______。
(a)Sn2+和Fe3+(b)Cr2O72 -和Sn2+(c)Cr3+和Sn4+(d)Cr2O72 -和Fe3+(2)有一个原电池由两个氢电极组成,其中有一个是标准氢电极,为了得到最大的电动势,另一个电极浸入的酸性溶液[设p(H2)=100kPa]应为(a)0.1mol·dm-3HCl (b)0.1mol·dm-3HAc+0.1mol·L-1NaAc(c)0.1mol·dm-3Hac (d)0.1mol·dm-3H3PO4(3)在下列电池反应中Ni(s)+Cu2+(aq)→Ni2+(1.0mol·dm-3)+Cu(s)当该原电池的电动势为零时,Cu2+浓度为(a)5.05×10-27mol·dm-3(b)5.71×10-21mol·dm-3(c)7.10×10-14mol·dm-3(d)7.56×10-11mol·dm-3(4)电镀工艺是将欲镀零件作为电解池的();阳极氧化是将需处理的部件作为电解池的()。
(完整版)大学化学习题与答案

第一章化学反应基本规律1、在标准态的规定中,下述表达不正确的是( )A、标准压力PӨ=100.00KPaB、T=298.15KC、bӨ=1.00mol·kg-1D、纯固体或纯液体处于标准压力。
2、在标准条件下,下列反应式中能表示CO2的Δf H mӨ(298.15K)的反应式为( )A、C(金刚石)+ O2(g)= CO2(g)B、C(石墨)+O2(g)= CO2(g)C、CO(g)+1/2O2(g)= CO2(g)D、CO2(g)=CO(g)+1/2O2(g)3、已知下列反应在一定温度下的热效应:4Fe2O3(s)+Fe(s)=3Fe3O4(s), Δr H mӨ=-74 kJ·mol-14Fe(s)+3O2(g)=2Fe2O3(s), Δr H mӨ=-1664kJ·mol-1则可计算出Fe3O4(s)的标准摩尔生成焓等于( )4、等压过程,高温非自发,低温自发的条件是( )5、等温条件下,某反应Δr G mӨ=10kJ·mol-1,这表示该反应在标准状态下( )A、自发进行B、非自发进行C、自发与否,需具体分析6、汽车尾气中的CO,可用加入催化剂催化其热分解的方法消除。
已知热分解反应CO(g)= C(s)+O2(g)的Δr H mӨ=110.5kJ·mol-1,Δr S mӨ=-0.089kJ·mol-1·K-1这一方法正确与否?解释其原因:7、(1)U,S,H,G均为( )(2)Δr H m>0为( )(3)Δr G m <0为( )(4)KӨ为( )8、反应的Δr H mӨ <0,温度升高时(T2>T1)则平衡常数( )当Δr H mӨ>0,温度升高时则( )9、碳燃烧反应为基元反应,其方程式为C(s)+O2 (g)→CO2 (g)则其反应速率方程式为( )A、υ=kc(C)c(CO2)B、υ=kc(O2)c(CO2)C、υ=kc(CO2)D、υ=kc(O2)10、升高温度,可增加反应速度,主要因为( )A、增加了分子总数B、增加了活化分子百分数C、降低了活化能D、促进平衡向吸热方向移动11、已测得高温时焦炭与二氧化碳反应C+CO2→2CO的活化能为167kJ·mol-1。
大学化学课后题答案
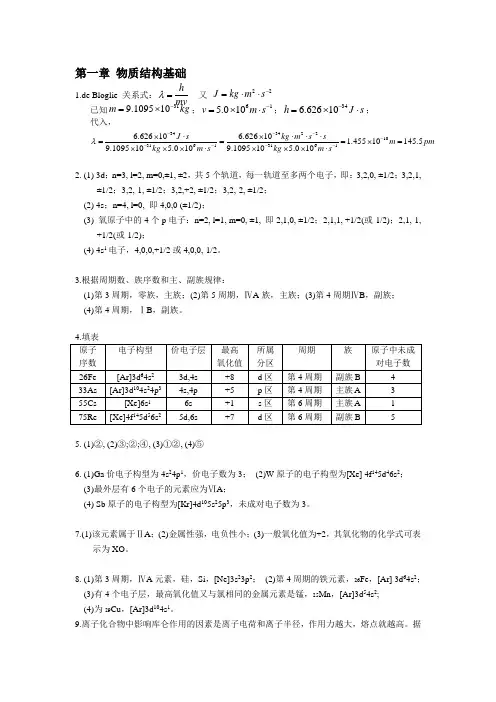
第一章 物质结构基础1.de Bloglie 关系式:hmv λ=又 22J kg m s -=⋅⋅ 已知319.109510m kg -=⨯;615.010v m s -=⨯⋅;346.62610h J s -=⨯⋅;代入,34342210316131616.62610 6.62610 1.45510145.59.109510 5.0109.109510 5.010J s kg m s sm pm kg m s kg m sλ--------⨯⋅⨯⋅⋅⋅===⨯=⨯⨯⨯⋅⨯⨯⨯⋅2. (1) 3d ;n=3, l=2, m=0,±1, ±2,共5个轨道,每一轨道至多两个电子,即:3,2,0, ±1/2;3,2,1,±1/2;3,2,-1, ±1/2;3,2,+2, ±1/2;3,2,-2, ±1/2; (2) 4s ;n=4, l=0, 即4,0,0 (±1/2);(3) 氧原子中的4个p 电子:n=2, l=1, m=0, ±1, 即2,1,0, ±1/2;2,1,1, +1/2(或-1/2);2,1,-1,+1/2(或-1/2);(4) 4s 1电子,4,0,0,+1/2或4,0,0,-1/2。
3.根据周期数、族序数和主、副族规律:(1)第3周期,零族,主族;(2)第5周期,ⅣA 族,主族;(3)第4周期ⅣB ,副族; (4)第4周期,ⅠB ,副族。
5. (1)②, (2)③;②;④, (3)①②, (4)⑤6. (1)Ga 价电子构型为4s 24p 1,价电子数为3; (2)W 原子的电子构型为[Xe] 4f 145d 46s 2; (3)最外层有6个电子的元素应为ⅥA ;(4) Sb 原子的电子构型为[Kr]4d 105s 25p 3,未成对电子数为3。
7.(1)该元素属于ⅡA ;(2)金属性强,电负性小;(3)一般氧化值为+2,其氧化物的化学式可表示为XO 。
大学化学普通化学习课后题答案
普通化学 马家举 第一章 物质结构基础习题4 假定有下列电子的各套量子数,指出哪几套不可能存在,并说明原因。
(1)3,2,2,1/2;(2)3,0,-1,1/2;(3)2,2,2,2;(2)当角量子数l 取0时,磁量子数m 不能取-1。
(3)当主量字数取2时,角量子数不能取2;自旋量子数不能取2,只能取+1/2或-1/2。
5写出原子序数为47的银原子的电子分布式,并用四个量子数表示最外层电子的运动状态。
Ag :1s 22s 22p 63s 23p 63d 104s 24p 64d 105s 1 5,0,0,+1/2。
试用杂化轨道理论解释:(1) H 2S 分子的键角为920,而PCl 3的键角为1020。
(2) NF 3分子为三角锥形构型,而BF 3分子为平面三角形构型。
(1) H 2S 分子与H 2O 分子一样,中心原子采取sp 3不等性杂化,在两个孤电子对的作用下,两个H-S键键角减小。
之所以键角小于H 2O 分子中两个H-O 键的键角104045’,是因为H-S 键的成键电子对更靠近H 原子,两个H-S 键之间的斥力小,被压缩的程度更大。
PCl 3分子与NH 3分子一样,也是中心原子采取sp 3不等性杂化,同理Cl-P 键的成键电子对更靠近Cl 原子,所以两个P-Cl 键的键角小于NH 3分子中两个N-H 键的键角。
(2) NF3分子与NH 3分子一样中心原子采取sp 3不等性杂化,使分子产生三角锥形构型;BF 3分子中心原子B 采用sp 2等性杂化,使分子产生平面三角形构型。
7 为什么(1)室温下CH 4为气体,CCl 4为液体,而CI 4为其固体?(2)水的沸点高于H 2S ,而CH 4的沸点低于SiH 4?(1) 从CH 4→CCl 4→CI 4分子量增加,分子间色散力增大,而色散力在范德华力中占较大比例,即分子间力是增大的,而分子间力越大,熔沸点越高。
(2) H 2O 分子与H 2S 分子相比,水中H 2O 分子之间存在氢键,虽然H 2O 分子间的色散力较小,氢键的存在却使沸点更高一些。
大学化学课后习题答案第123章
第1章化学反应基本规律习题及详解一.判断题1. 状态函数都具有加和性。
(×)2. 系统的状态发生改变时,至少有一个状态函数发生了改变。
(√)3. 由于CaCO3固体的分解反应是吸热的,故CaCO3的标准摩尔生成焓是负值。
(×)4. 利用盖斯定律计算反应热效应时,其热效应与过程无关,这表明任何情况下,化学反应的热效应只与反应的起,始状态有关,而与反应途径无关。
(×)5. 因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的ΔS大大增加。
(×)6. ΔH, ΔS受温度影响很小,所以ΔG受温度的影响不大。
(×)7. 凡ΔG大于零的过程都不能自发进行。
(×)8. 273K,下,水凝结为冰,其过程的ΔS<0, ΔG=0。
(√)9.反应Fe3O4(s)+4H2(g) → 3Fe(s)+4 H2O(g)的平衡常数表达式为。
(√)10.反应2NO+O2→2NO2的速率方程式是:,该反应一定是基元反应。
(×)二.选择题1. 某气体系统经途径1和2膨胀到相同的终态,两个变化过程所作的体积功相等且无非体积功,则两过程( B )A.因变化过程的温度未知,依吉布斯公式无法判断ΔG是否相等B.ΔH相等C.系统与环境间的热交换不相等D.以上选项均正确2. 已知CuCl2(s)+Cu(s)→2CuCl(s) Δr H mΘ(1) =170KJ?mol-1Cu(s)+Cl2(g) → CuCl2(s) Δr H mΘ(2) =-206KJ?mol-1则Δf H mΘ(CuCl,s)应为( D )B. -363. 下列方程式中,能正确表示AgBr(s)的Δf H mΘ的是( B )A.Ag(s)+1/2Br2(g)→ AgBr(s)B.Ag(s)+1/2Br2(l)→AgBr(s)C.2Ag(s)+Br2(l)→ 2AgBr(s)D.Ag+(aq)+Br-(aq)→ AgBr(s)4. 298K下,对参考态元素的下列叙述中,正确的是( C )A.Δf H mΘ≠0,Δf G mΘ=0,S mΘ=0B.Δf H mΘ≠0,Δf G mΘ≠0,S mΘ≠0C.Δf H mΘ=0,Δf G mΘ=0,S mΘ≠0D.Δf H mΘ=0,Δf G mΘ=0,S mΘ=05. 某反应在高温时能自发进行,低温时不能自发进行,则其( B )A.ΔH>0, ΔS<0 ;B. ΔH>0,ΔS>0C.ΔH<0, ΔS<0 ;D.ΔH<0, ΔS>06. 1mol气态化合物AB和1mol气态化合物CD按下式反应:AB(g)+CD(g)→AD(g)+BC(g),平衡时,每一种反应物AB 和CD都有3/4mol转化为AD和BC,但是体积没有变化,则反应平衡常数为( B )9 97. 400℃时,反应3H2(g)+N2(g)→2NH3(g)的K673Θ=×10-4。
《大学化学》课后习题答案大全
第一章课后作业答案1-4.判断下列几种说法是否正确,并说明理由。
(1)原子是化学变化中最小的微粒,它由原子核和核外电子组成;正确原子是化学变化中的最小粒子。
原子是由居于原子中心的原子核和核外电子构成,原子核又由质子和中子两种粒子构成的。
构成原子的基本粒子是电子、质子、中子。
(2)相对原子质量就是一个原子的质量;错误相对原子质量是指以一个碳-12原子质量的1/12作为标准,任何一个原子的真实质量与一个碳-12原子质量的1/12的比值。
(3)4g H2和4g O2所含分子数目相等;错误4g H2含有2mol氧气分子。
氢气相对分子质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧气分子。
氧气相对分子质量32,4g/(32g/mol)=0.125mol。
所以分子数目不相等。
(4)0.5mol的铁和0.5mol的铜所含原子数相等;正确铁和铜都是由原子构成的金属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表示原子数相同。
(5)物质的量就是物质的质量;错误物质的量:表示物质所含微粒数(N)(如:分子,原子等)与阿伏加德罗常数(NA)之比,即n=N/NA。
物质的量是一个物理量,它表示含有一定数目粒子的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置而改变,是物质的基本属性之一,通常用m表示物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最高?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最高,所以尿素的肥效最高。
大学《有机化学》课后习题答案
第一章绪论2. (1) (2) (5)易溶于水;(3) (4) (6)难溶于水。
4.80*45%/12=3 80*7.5%/1=6 80*47.5%/19=2 C3H6F2第二章有机化合物的结构本质及构性关系1.(1) sp3(2) sp (3) sp2(4) sp (5) sp3(6)sp2第四章开链烃1.(1) 2-甲基-4,5-二乙基庚烷(2) 3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷(4) (顺)-3-甲基-3-己烯or Z-3-甲基-3-己烯(12) 3-甲基-1-庚烯-5-炔2.7.11.14. (5) > (3) > (2) >(1) > (4) 即: CH 2=CHC +HCH 3 >(CH3)3C +>CH 3CH 2C +HCH 3 >CH 3CH 2CH 2C +H 2> (CH 3)2CHC +H 216. (1)(2)(3)17.21AB.10.(1)CH 3-CH=CH 2−−−−−→−+H /KMnO 4CH 3COOH(2)CH 3-C ≡CH+HBr (2mol ) CH 3CBr 2CH 3(3)CH 3-C ≡3-C=CH 2−−→−2Br CH 3CBr 2CH 2Br Br第四章 环 烃 2.1-戊烯 1-戊炔 戊 烷Br 2/CCl 4室温,避光√ 溴褪色√ 溴褪色× × √灰白色1-丁炔 2-丁炔 丁 烷Br 2/CCl 4 室温,避光√溴褪色 × Ag(NH 3)2+√灰白色↓ × × 1,3-丁二烯 1-己炔 2,3-二甲基丁烷Br 2/CCl 4√ 溴褪色 √ 溴褪色 × Ag(NH 3)2+×√ 灰白色↓C(CH 3)3CH 3(1)(2)(3)3.(1)反式CH 3Br(3)顺式4.C H 3B rC lC l +C l C lC O O HH 3CO 2N (C H 3)3C C O O H(1)(2)(3)(4)(5)(6)(7) B rC 2H 5C 2H 5B r +C H 3C O C H 3(C H 3)2C C H (C H 3)2B r(8) 1molCl 2 / h , 苯/无水AlCl 3N H C O C H 3N O 2C H 3C H 3S O 3H (9) (10)7. (2)有芳香性 10.第六章 旋光异构6-32. (1)× (2)× (3)× (4)√ (5)√ (6)√7.2.66120678.58.18][20+=⨯÷+=⨯=l c Dαα第七章 卤 代 烃2、C l C lC l (2)4、第八章 醇、酚、醚1. (1) 3-甲基-3-戊烯-1-醇 (2) 2-甲基苯酚 (3) 2,5-庚二醇 (4) 4-苯基-2-戊醇 (5) 2-溴-1-丙醇 (6) 1-苯基乙醇(7) 2-硝基-1-萘酚 (8) 3-甲氧基苯甲 (9) 1,2-二乙氧基乙烷(乙二醇二乙醚)(1)(2)3、4. (1) 甲醇 分子间氢键 (6) 邻硝基苯酚 分子内氢键、分子间氢键 5、(1)CH 2IH 3COOH(5)(6)HOOCH 3H(7)6、AgNO 3/乙醇,室温白↓× ×AgNO 3/乙醇,加热白↓×OH+OHBrBr(1)(2)10、OH O ClA B C D第九章醛、酮、醌一、命名下列化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章 化学反应原理1.今有一密闭系统,当过程的始终态确定以后,下列各项是否有确定值?Q , W , Q -W , Q +W , ΔH , ΔG答: Q +W , ΔH , ΔG 有确定值,Q , W , Q -W 无确定值。
2.下列各符号分别表示什么意义?H ,ΔH ,ΔH θ,Δf θ298H (B ),θ298S (B ), Δf θ298G (B )答:H :焓;ΔH :焓变;ΔH θ:标准焓变;Δf θ298H (B ):298K 时B 物质的标准生成焓;θ298S (B ):298K 时B 物质的标准熵; Δf θ298G (B ):298K 时B 物质的标准生成吉布斯函数。
3.下列反应的Q p 和Q V 有区别吗?(1)2H 2(g)+O 2(g)=2H 2O(g)(2)NH 4HS(s)=NH 3(g)+H 2S(g)(3)C(s)+O 2(g)=CO 2(g)(4)CO(g)+H 2O(g)=CO 2(g)+H 2(g)答:(1)、(2)有区别。
4.已知下列热化学方程式:(1)Fe 2O 3(s)+3CO(g)=2Fe(s)+3CO 2(g);Δθ298H =-27.6kJ/mol ;(2)3Fe 2O 3(s)+CO(g)=2Fe 3O 4(s)+CO 2(g);Δθ298H =-58.6kJ/mol ;(3)Fe 3O 4(s)+CO(g)=3FeO(s)+CO 2(g);Δθ298H =38.1kJ/mol ;不用查表,计算下列反应的Δθ298H :(4)FeO(s)+CO=Fe(s)+CO 2(g)5.查表计算下列反应的Δθ298H :(1)Fe 3O 4(s)+4H 2(g)=3Fe(s)+4H 2O(g)(2)4NH 3(g)+5O 2(g)=4NO(g)+6H 2O(l)(3)CO(g)+H 2O(g)=CO 2(g)+H 2(g)(4)S(s)+O 2(g)=SO 2(g)6.查表计算下列反应的Δθ298H :(1)Fe(s)+Cu 2+(aq)=Fe 2+(aq)+Cu(s)(2)AgCl(s)+I -(aq)=AgI(s)+Cl -(aq)(3)2Fe 3+(aq)+Cu(s)=2Fe 2+(aq)+Cu 2+(aq)(4)CaO(s)+H 2O(l)=Ca 2+(aq)+2OH -(aq)7.查表计算下列反应的Δθ298S 和Δθ298G :(1)2CO(g)+O 2(g)=2CO 2(g)(2)3Fe(s)+4H 2O(l)=Fe 3O 4(s)+4H 2(g)(3)Zn(s)+2H +(aq)=Zn 2+(aq)+H 2(g)(4)2Fe 3+(aq)+Cu(s)=2Fe 2+(aq)+Cu 2+(aq)8.已知反应 4CuO(s)=2Cu 2O(s)+O 2(g) 的Δθ298H =292.0kJ/mol,Δθ298S =220.8J ·K -1·mol -1,设它们皆不随温度变化。
问:(1)298K 、标准状态下,上述反应是否正向自发?(2)若使上述反应正向自发,温度至少应为多少?9.对于合成氨反应:N 2(g)+3H 2(g)=2NH 3(g),查表计算:(1)298K 、标准状态下,反应是否自发?(2)标准状态下,反应能够自发进行的最高温度是多少?设反应的ΔH 和ΔS 不随温度变化。
(3)若p (N 2)=10p θ,p (H 2)=30p θ,p (NH 3)=1p θ,反应能够自发进行的温度又是多少?设反应的ΔH 和ΔS 仍不随温度变化。
10.已知 CaCO 3(s)=CaO(s)+CO 2(g) 的Δθ298H =178.4 kJ/mol, ΔS θ298 =160.5 J ·K -1·mol -1。
试计算CaCO 3(s)在空气中(CO 2体积分数为0.033%)开始分解的近似温度。
11.写出下列各反应平衡常数K θ的表达式(不计算):(1)2NO(g)+O 2(g) 2NO 2(g)(2)C(s)+H 2O(g) CO(g)+H 2(g)(3)HAc(aq) H+(aq)+Ac-(aq)(3)Pb(s)+2H+(aq) Pb2+(aq)+H2(g)12. 973K时,反应:CO(g)+H2O(g) CO2g)+H2(g) 的Kθ=1.56,问:(1)973K,标准状态下,反应是否自发?(2)若p(CO2)=p(H2)=1.27×105Pa,p(CO)=p(H2O)=0.76×105Pa,反应是否自发?13.已知N2O4(g) 2NO2(g)的ΔθG=4836 J/mol。
现将盛有3.176gN2O4的1L密闭容器置于25℃的恒298温槽中,问:平衡时容器内的总压力为多少?14.523K时,将0.70mol PCl5(g)注入2.0dm3的密闭容器中,反应:PCl5(g) PCl3(g)+Cl2(g)达平衡时,有0.5mol的PCl5被分解了。
求523K时反应的Kθ。
15.740K时,Ag2S(s)+H2(g) 2Ag(s)+H2S(g) 的Kθ=0.36。
该温度下,将一密闭容器中的1.0 mol Ag2S完全还原,至少需要多少mol的H2?16.反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g)的ΔHθ>0。
请根据吕·查德里原理判断下列左方操作对右方平衡数值的影响。
(1)升高温度Kθ↑,O2物质的量↑(2)加H2O H2O物质的量↑,Cl2物质的量↓(3)加Cl2Kθ不变,HCl物质的量↑(4)增大容器体积Kθ不变,O2物质的量↑(5)加压Kθ不变,O2物质的量↓17.判断正错(-)(1)反应C(s)+H2O(g)=CO(g)+H2(g) 两边的摩尔数相等,所以Q p=Q V。
(+)(2)可逆反应达平衡后,若平衡条件不变,则各反应物和生成物的浓度(或分压)为定值。
(-)(3)由反应式2NH3=N2+3H2可以知道,这是一个二级反应。
(+)(4)对于给定的T2、T1来说,活化能越大的反应受温度的影响越大。
18.选择填空(1)等温等压条件下,某反应的ΔθG=10 kJ/mol,则该反应。
298A.一定不能进行B.一定不能自发进行C. 一定能自发进行D.能否自发进行还须具体分析(2)下列反应的热效应等于ΔfθH(CO2,g)的是。
298A.C(金刚石)+O2(g)=CO2(g) B.C(石墨)+O2(g)=CO2(g)1O2(g)=CO2(g) D.CaCO3(s)=CaO(s)+CO2(g)C. CO(g)+2(3)若正向反应活化能大于逆向反应活化能,则关于该反应叙述正确的是。
A.一定是放热反应 B.一定是吸热反应C. 吸热还是放热应具体分析D. 反应热与活化能无关(注意曲线形式)(4)升高温度可以增加反应速率,是因为。
A.降低了反应的活化能 B.增加了反应的活化能C. 增加了分子总数D.增加了活化分子的百分数19.实验发现,反应2NO+Cl2=2NOCl 是基元反应。
(1)写出该反应的反应速率表达式。
反应级数为多少?(2)其他条件不变,将容器体积增加到原来的2倍,反应速率变化多少?(3)若容器体积不变,仅将NO的浓度增加到原来的3倍,反应速率又如何变化?(4)若某瞬间,Cl2的浓度减小了0.003mol·L-1·s-1,请用三种物质浓度的变化分别表示此时的反应速率。
20.28℃时,鲜牛奶变酸约需4小时,在5℃的冰箱内冷藏时,约48小时才能变酸。
已知牛奶变酸的反应速率与变酸时间成反比,求牛奶变酸反应的活化能。
第二章 溶液1. 溶液的蒸气压为什么下降?如何用蒸气压下降来解释溶液的沸点升高和凝固点下降?答:部分溶质离子占据了原由溶剂粒子占据的表面,使可蒸发的粒子数减少。
2. 对具有相同质量摩尔浓度的非电解质溶液、AB 型 及A 2B 型电解质溶液来说,凝固点高低的顺序应如何判断?答:非电解质溶液>AB 型电解质溶液>AB 2型电解质溶液3. 下列说法是否正确?若不正确,请改正。
(1)稀溶液在不断蒸发中,沸点是恒定的。
(2)根据稀释定律cK θi =α,一元弱酸浓度越小,电离度越大,因而溶液酸性也越强。
(3)将一元弱酸溶液稀释十倍,则其pH 值增大一个单位。
(4)由HAc —Ac -组成的缓冲溶液,若溶液中c (HAc )>c (Ac -),则该缓冲溶液抵抗外来酸的能力大于抵抗外来碱的能力。
(5)PbI 2和CaCO 3的溶度积均近似为10-8,则两者的溶解度近似相等。
4. 往氨水中分别加入下列物质,氨水的离解度和溶液的pH 值将发生什么变化?(1)NH 4Cl (s ) (2)NaOH (s ) (3)HCl (aq ) (4)H 2O5. 如何从化学平衡的观点理解溶度积规则?并用该规则解释下列现象:(1)CaCO 3溶于稀HCl 溶液中,而BaSO 4则不溶。
(2)Mg(OH)2溶于NH 4Cl 溶液中。
6. 选择题(1)欲使乙二醇(C 2H 6O 2)水溶液的凝固点为-0.93℃,需在200g 水中加入乙二醇 克。
A 3.2B 12.4C 6.2D 22.4(2)下列水溶液沸点最高的是 。
A 0.03m 甘油B 0.02mH 2SO 4C 0.02mNaClD 0.02m 蔗糖(3)25℃时,PbI 2的溶解度为1.52×10-3mol ·L -1,其溶度积常数为 。
A 2.8×10-8B 1.4×10-8C 4.71×10-6 (4)下列溶液中pH 值最高的是 ,最低的是 。
A 0.1mol ·L -1HAcB 0.1mol ·L -1HAc+等体积水C 0.2 mol ·L -1HAc 与0.2 mol ·L -1NaAc 等体积混合D 0.2 mol·L-1HAc与0.6 mol·L-1NaAc等体积混合7. 将下列溶液按凝固点由高到低的顺序排列:(6)0.1 mol·kg-1HAc (5)0.1 mol·kg-1NaCl (4)0.1 mol·kg-1CaCl2(3)1 mol·kg-1C6H12O6 (2)1 mol·kg-1NaCl (1)1 mol·kg-1 H2SO48. 20℃时,将15.0克葡萄糖(C6H12O6)溶于200克水中,计算:(1)溶液的凝固点;(2)在101325Pa下,该溶液的沸点。
9. 在1升水中加多少克甲醛(CH2O),才能使水在-15℃不结冰?10. 取0.1mol·L-1的甲酸(HCOOH)溶液50ml,加水稀释至100ml,求稀释前后溶液的H+浓度、pH值和离解度。
