(完整word版)免疫组化常见问题
免疫组化技术要点与常见问题

免疫组化技术要点与常见问题在免疫组化过程中,为了更好的说明问题和查找原因,最好设置阳性对照片(已知的高表达相应抗原的组织)和阴性对照组织片(不加一抗但是加二抗系统/不加任何抗体两组),所有操作过程应完全一致。
染色弱或者没有染色(按照先后顺序,先排除一些简单的原因):可能原因解决办法试剂使用顺序错误或者漏加试剂重复实验,保证每一步均正确二抗和一抗不匹配选择匹配的二抗底物和酶不匹配选用匹配的底物酶失活换用新的酶(将酶和底物混合,看是否显色?)组织中没有待测抗原表达或者表达水平低使用阳性对照片抗体浓度太低增加抗体浓度.最好使用不同浓度的抗体,决定最佳浓度抗体孵育时间不充分延长抗体孵育时间底物孵育不充分延长底物孵育时间抗体储存不当,导致失效将抗体分装,低温保存 (-20 to -70 C) ,避免反复冻溶。
稀释抗体在4保存1-2周,避免时间过长。
或者根据说明书进行恰当的保存一抗失效换用新的一抗二抗失效换用新的抗体(能否成功与其它一抗配合?)脱石腊不充分延长脱腊时间或者换用新的二甲苯组织固定不充分或者不当增加固定时间或者改用不同的固定方法组织固定过度减少固定时间。
若已固定过度,则需使用正确的或者推荐的抗原修复方法复染试剂与底物系统不匹配选择正确的复染试剂(不加复染剂,看是否有组织染色?)封片剂不正确选择正确的封片剂染色背景高:可能原因解决办法洗片不充分每步之间至少洗片3次组织含有内源性的酶,如HRP/AP 在加入一抗之前使用3%的H2O2甲醇封闭内源性HRP 活性,使用左旋咪唑(levamisole)溶液阻断内源性AP活性。
或者换用葡萄糖氧化酶系统组织含有内源性生物素(尤其是肾脏、肝和脾)在加入一抗之前,血清封闭之后使用avidin/biot in阻断试剂。
或者避免使用biotin-avidin系统或改用IF方法(直接将酶和底物加到组织片上,看是否显色?)一抗的非特异性结合或者抗体浓度过高增加一抗的稀释度二抗和组织非特异性结合使用与二抗来源相同的正常动物血清(一般是1 0%)封闭,必要时可以将血清浓度加大组织固定不充分,抗原扩散Increase duration of postfixation使用小鼠来源的二抗检测小鼠组织在加一抗之前使用MouseOnMouse封闭试剂干片染色过程中避免出现干片现象染色强度过大:可能原因解决办法一抗或者二抗浓度过高降低抗体浓度。
免疫组化技术常见问题及处理方法

免疫组化技术常见问题及处理方法
Envision系统的优点
敏感性高 背景干净(消除内源性生物素的干扰) 步骤简单
免疫组化技术常见问题及处理方法
石蜡切片标本的固定
1、组织离体后尽快固定,切开固定效果好 2、固定液以10%中性福尔马林缓冲液为佳 3、固定时间在4h-24h之间,长时间固定会影响抗
免疫组化技术常见问题及处理方法
SP法
1. 石蜡切片脱蜡和水化后,用PBS(pH7.4)冲洗3次,每次3分钟。 2. 根据每一种抗体的要求,对组织抗原进行相应的修复。 3. 每张切片加1滴或50μl过氧化酶阻断溶液(试剂A),室温下孵育
10分钟,以阻断内源性过氧化物酶的活性。PBS冲洗3次,每次3分 钟。 4. 除去PBS液,每张切片加1滴或50μl正常非免疫动物血清(试剂B), 室温下孵育10分钟。 5. 除去血清,每张切片加1滴或50μl的第一抗体(用户自选),室温 下孵育60分钟或4℃过夜,建议参见每种抗体的说明书。 4度过夜和从冰箱拿出后37度复温45min, PBS冲洗3次,每次3分 钟。
免疫组化技术常见问题及处理方法
Western blotting、ELISA 与免疫组化的异同
• Western blotting:蛋白质免疫印迹,检查组织 或细胞样品内蛋白含量的检测方法,与免疫组化 技术相比,定量可能更加准确;也可定性和定位, 但敏感性远远低于免疫组化技术
• ELISA :酶联免疫吸附试验,检查体液或组织匀 浆中蛋白含量的检测,与免疫组化技术相比,定 量最准确,是分泌性蛋白检测首选方法之一
化物酶,PBS 或TBS 冲洗。 • 4)滴加一抗,室温或 37℃孵育30-60分钟,或 4℃过夜,PBS或
免疫组化实验常见问题及解决方案

解决办法
通透作用破坏了膜
去除缓冲液中的通透剂
固定的方法对抗原不合适
尝试不同的固定剂,关于固定剂的使用选择见补充材料
没有及时固定引起抗原扩散
取材后立即固定
可能原因
解决办法
缺乏抗原
做Western blot检测目标蛋白是否有表达或原位杂交检测mRNA是否有表达
抗体无效
避免反复冻融;用阳性片子进行检测
抗原修复无效
改进抗原修复方法
抗原-抗体结合不足
加大一抗浓度,增加孵育时间
抗体不能穿过细胞
加Triton x-100到封闭液中,通透组织
2,高背景
下图样本是小鼠皮下移植瘤组织,目标蛋白LYVE1,A图是我们想得到的结果,B图是做出来的实验结果,与A图相比,B图背景高。
可能原因
解决办法
脱蜡不足
适当延长二甲苯浸泡次数和时间
干片,组织过于干燥
避免干片
抗原修复过度
减少修复时间
内源性酶干扰
添加淬灭操作
Fc受体干扰
用二抗来源的血清取代BSA封闭
抗体浓度过高
适当增加稀释比例
染色时间过长
镜检观察显色,合膜组织,目标蛋白IL-10,A图是我们想得到的结果,B图是做出来的实验结果,在与A图相同位置的B图中没有检测到抗原,反而在组织边缘检测到组织表达。
下图样本是人小肠粘膜组织目标蛋白il10a图是我们想得到的结果b图是做出来的实验结果在与a图相同位置的b图中没有检测到抗原反而在组织边缘检测到组织表达
免疫组化实验常见问题及解决方案
1,缺乏染色
下图样本是正常人肝血管组织,目标蛋白是α-平滑机动蛋白,A图是我们想得到的结果,B图是做出来的实验结果,与A图相比,在红圈处并没有检测到抗原。
免疫组织化学常见问题和解决方法
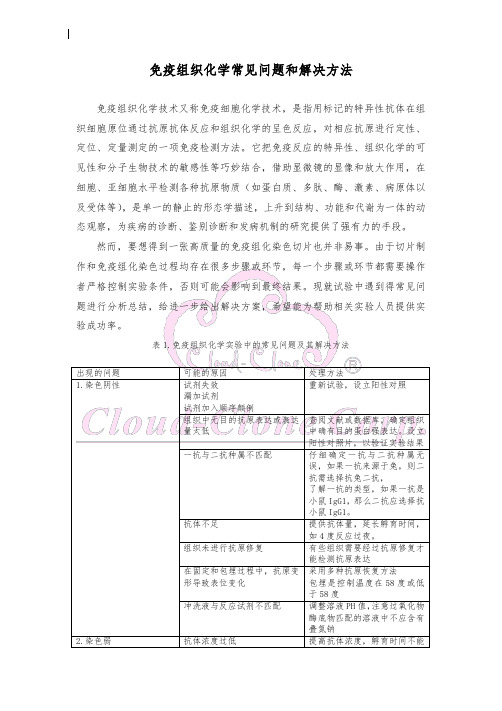
巨噬细胞吞噬各种抗原物质或 Fc 片断而出现胞浆着色 内源性生物素的着色
组织在缓冲液(如二甲苯)中 浸泡时间太长 组织变干 不适当的修复方式
较多的切片 如果制片过程中,因丙酮逐渐 挥发而胶变浓时可适当加入一 些丙酮。 加一抗前的血清封闭避免非特 异型的结合
将抗体分装在小管中,冻存于 -20 度,每次使用取一管,避 免抗体反复冻融及交叉污染。 可用过氧化氢封闭去除内源酶 导致的非特异性着色 通过形态学辨认出巨噬细胞
余的缓冲液(但防止切片干燥)
孵育时切片未放平,导致抗体 孵育时,注意切片应水平放置
流失
蛋白封闭过度
封闭时间不要超过 10 分钟
不适当的标本固定方式
选择合适的固定方法
不适当的抗原修复方式
延长抗原修复时间,或者调整
抗原修复体系,建议参照生产
厂家的说明,同时结合标本的
具体情况来确定
抗体浓度过高
降低抗体滴度(一般只浓缩性
3. 非 特异 性背 景染 色
全片着色
切片边缘着色
“阴阳脸”着色 灶片状着色
少于 60 分钟
抗体孵育时间过短
抗体孵育时间不能少于 60 分
钟
标本中目的蛋白表达量低
查阅文献或数据库,确定组织
中确有目的蛋白强表达。设立
阳性对照片,以验证实验结果
操作中,切片遗留太多冲洗液, 每步滴加试剂前沥干切片中多
导致试剂稀释
免疫组织化学常见问题和解决方法
免疫组织化学技术又称免疫细胞化学技术,是指用标记的特异性抗体在组 织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、 定位、定量测定的一项免疫检测方法。它把免疫反应的特异性、组织化学的可 见性和分子生物技术的敏感性等巧妙结合,借助显微镜的显像和放大作用,在 细胞、亚细胞水平检测各种抗原物质(如蛋白质、多肽、酶、激素、病原体以 及受体等),是单一的静止的形态学描述,上升到结构、功能和代谢为一体的动 态观察,为疾病的诊断、鉴别诊断和发病机制的研究提供了强有力的手段。
免疫组化(IHC)常见问题解析

免疫组化(IHC)常见问题解析2162 人阅读发布时间:2020-10-22 15:54免疫组化,是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究。
然而理想是丰满的,实际操作起来却是骨感的,作为一种分析方法,常常会存在非特异着色的背景问题。
下图中靶点均为胞膜定位,左边背景着色严重,右边染色效果优良。
01 抗体质量问题抗体本身在靶点设计上如果特异性不够,会导致非特异着色。
一般来说,单抗在特异性上相比多抗是具有优势的,但多抗由于识别任一抗原上的多个表位,多抗可放大低表达水平靶蛋白的信号,对微小抗原变化(例如多态性、糖基化异质性或者轻微变性)的包容性更强,可用于非免疫原物种的靶蛋白的检测实验。
具体实验时,还应根据实际需要选择合适的抗体。
另外,抗体保存也应注意防腐及防止反复冻融。
02 内源性酶和生物素当选用肝、肾,脾组织作为样本时,由于这些组织本身含有较高含量的过氧化酶和生物素,对于使用Hrp或生物素-亲和素显色系统的实验都会造成非特异性染色。
对于内源性过氧化物酶,可以用0.9% 的双yang水来灭活。
对于内源性生物素,染色前将切片浸于25 μg/mL 亲和素溶液中15 分钟,PBS 清洗15 分钟后即可染色。
也可以24 mg/mL 的卵白素封片15 分钟。
03 抗体浓度过高获得良好的染色结果,一般应优化一抗的使用浓度,可参考供应商提供的说明书,但预实验也是必不可少的,摸索出最理想的工作浓度。
04 DAB 染色时间太长/变质DAB 的作用时间过长,同样会造成背景。
DAB 的显色时间不是一成不变的,实验时应及时镜检,出现浅棕色时,马上冲洗。
出现棕色的时间过短,表明抗体浓度过高;出现棕色的时间过长,表明抗体有效浓度过低。
DAB 要保存于避光干燥的地方,现用现配,临用前才加入H2O2。
免疫组化(IHC)│常见问题及解析集锦

免疫组化(IHC)│常见问题及解析集锦重要通知:近期有读者反映不能每天准时收到我们的推送,原因在于微信公众号平台改变了推送方式。
为了避免类似情况,请为“科研人直通车”设置星标,文章点一下“在看”,保持互动热度,就能及时收到每期推送啦!免疫组织化学(简称免疫组化)是组织化学的一种,它是利用已知的特异性抗体或抗原能特异性结合的特点,通过化学反应使标记于结合后的特异性抗体上的显示剂,如酶、金属离子、同位素等,显示一定的颜色,并借助显微镜观察其颜色的变化,从而在抗原抗体结合部位确定组织、细胞结构的化学成份或化学性质。
实验过程包括切片制作(固定,脱水,透明,包埋,切片,贴片,烤片),脱蜡,水化,阻断,抗原修复,封闭,一抗孵育,二抗孵育,显色,复染,封片,分析。
实验过程常见问题如检测结果阴性,非特异性染色,染色强度不够,着色不均,脱片,干片等。
一起来看案例解析,助您高效做出准确实验结果。
1 标本的固定常见问题:组织固定不及时或不完全固定,HE染色细胞核发灰模糊,对比不鲜明;免疫组化染色结果不理想,通常组织离体2h后抗原完全丢失。
01范例1检测组织:人淋巴结组织石蜡切片检测:CD45染色问题:组织固定不充分,淋巴结边缘淋巴细胞CD45染色强阳性,组织内部淋巴细胞CD45染色弱阳性,染色不均。
02范例2检测组织:肾脏组织石蜡切片检测:HE染色问题:固定不及时或固定不完全,细胞核模糊,对比不鲜明。
建议:1、组织离体后尽快固定,组织块大小为15×15×5mm,切开固定效果好;2、固定液以10%中性福尔马林缓冲液为佳;3、固定时间在4h-24h之间,长时间固定会影响抗原决定簇的暴露,产生阴性结果;4、固定液的量要超过组织体积5倍以上。
2 标本的取材,脱水,浸蜡常见问题:如果组织脱水、浸蜡不充分,蜡块会出现组织收缩凹陷,而且在免疫组化热抗原修复操作时会容易脱片。
建议:1 梯度酒精脱水尽量彻底充分;2 二甲苯透明时间不宜长,1~3h为佳,透明过度会导致组织发硬发脆;3 浸蜡应选择低熔点的石蜡,浸蜡应充分。
免疫组化技术常见问题及处理方法

染色弱或无信号问题可能是由于抗体浓度过低、孵育时间不 足、组织抗原量少等原因所致。为解决这一问题,可以增加 抗体浓度、延长孵育时间、增强组织抗原的暴露等措施,以 提高染色强度。
染色背景问题
总结词
染色背景是指染色结果中除了目标蛋白外的其他染色,通常表现为整个视野的弥漫性着 色。
详细描述
染色背景问题可能是由于抗体与组织中其他蛋白的交叉反应、组织内源性酶活性、组织 处理过程中产生的物质等所致。为解决这一问题,可以采取使用阻断剂、降低抗体浓度、
定期对仪器设备进行校准,确保 其性能稳定、准确可靠。同时, 对设备进行日常维护,及时排除 故障,保证实验的正常进行。
试剂储存和有效期问题
总结词
试剂的储存和有效期直接关系到实验 结果的可靠性。
详细描述
严格按照试剂说明书进行储存,避免 试剂受潮、光照、高温等不利因素的 影响。关注试剂的有效期,避免使用 过期试剂。
详细描述
固定和保存组织的目的是为了保持组织结构 和抗原性。不同的组织需要不同的固定液和 固定时间,以确保抗原的完整性和稳定性。 同时,组织的保存条件也需严格控制,以防
抗原丢失或降解。
04
仪器设备和试剂问题
仪器设备校准和维护问题
总结词
仪器设备校准和维护是确保免疫 组化实验准确性的关键环节。
详细描述
详细描述
为了促进免疫组化技术的数据共享和交流,需要建立 统一的数据库和平台,以便研究人员能够共享数据、 交流经验和技巧。此外,应鼓励研究人员在学术会议 和期刊上发表研究成果,促进技术的传播和应用。通 过加强数据共享和交流,可以推动免疫组化技术的进 步和创新,提高其在医学研究中的应用价值。
THANK YOU
感谢聆听
免疫组化实验步骤及常见问题分析

免疫组化实验步骤及常见问题分析免疫组化实验步骤及常见问题分析免疫组化实验流程1.样品制备2.组织固定:根据要求收集人或动物的组织用于IHC分析,冲洗并用固定剂(一般用甲醛)进行固定3.组织包埋:将经甲醛固定的组织嵌入石蜡,以长期保持其天然形状和组织结构4.切片安装:将组织样品在切片机上切片,并转移至载玻片上干燥保持其形态5.脱蜡水化:因切片上的石蜡会妨碍染色,所以需将切片上的石蜡溶出,并水化。
脱蜡或水化不全容易造成非特异性背景着色(一般的脱蜡水化步骤是:将切片依次浸入二甲苯Ⅰ10min-二甲苯Ⅱ10min-无水乙醇5min-95%无水乙醇5min-90%无水乙醇5min-80%无水乙醇5min-70%无水乙醇5min-50%无水乙醇5min-蒸馏水5min×3,进行脱蜡水化)。
6.抗原修复:由于组织在甲醛固定过程中,蛋白之间发生了交联及醛基的封闭从而掩盖抗原决定簇。
可以通过高压加热修复抗原,使细胞内抗原决定族暴露,从而提高抗原检测率。
7.非特定位点封闭:为了防止一抗的非特异性结合造成假阳性,可以选用BSA、羊血清等封闭非特异性结合位点。
封闭血清来源一般与二抗保持一致,室温封闭10-30min。
8.样品染色一抗、二抗孵育:抗体孵育时间、温度及浓度等因素对染色结果都存在很大影响。
在4℃下反应缓慢,背景较浅;37℃反应较快时间较短;而室温介于两者之间,选择室温有利于实验的进行。
二抗一般室温孵育30min。
底物显色:基于与酶缀合的二抗,抗原通过生色或荧光方式直接检测。
复染封片:组化染色后进行复染可以衬托出组织形态结构,常用的复染剂有苏木精、曙红、甲基绿、DAPI和Hoechst荧光染色。
观察结束后使用中性树胶进行封片,可以长久保存。
免疫组化实验常见问题分析1. IHC实验结果显色过深一抗浓度过高或孵育时间过长——降低一抗浓度或减少孵育时间孵育温度过高——选择4℃或室温孵育2. 实验结果存在非特异性显色石蜡切片脱蜡不够——延长脱蜡时间蛋白封闭不充分——增加蛋白封闭时间组织富含内源性生物素与过氧化物酶——使用相关试剂进行封闭3. 实验结果显色弱或无染色一抗浓度过低或孵育时间过短——增加一抗浓度或延长孵育时间组织中无目的抗原的表达:一抗种属来源与二抗不匹配免疫组化实验注意事项切片脱蜡和水化要充分,加反应液时要覆盖组织充分;每次加液前甩干洗涤液,同时防止干片。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫组化常见问题与回答集锦一、石蜡切片和冰冻切片的比较?1. 要求做冰冻切片的不一定能做石蜡切片,这是我向一老师请教得出的结论。
因为作石蜡切片时要高温烤片,可能会破坏组织的抗原性,如果组织的抗原性较稳定,则可作石蜡切片;但是要求做石蜡切片的,可作冰冻切片。
2. 冰冻切片的优点是能够较好的保存组织的抗原免疫活性,做免疫组化时不需抗原修复这一步。
缺点是细胞内易形成冰晶而破坏细胞结构,可能会使抗原弥散;切片厚度较石蜡的厚,做的片子没石蜡的漂亮。
当你买一抗时,目录上都写着做什么样的切片,如果它写着只能做冰冻,就不能做石蜡,如写着两者都可,那就都能做。
3. 石蜡切片的优点是可以保持组织细胞的形态结构,且容易存放在室温,而冰冻切片比较麻烦,一定要存在-80oC 的低温冰箱中,尤其是用来做原位杂交的切片,为了防止RNA降解,保存一贯很重要。
由于石蜡切片可以切到 4 口左右,所以原位杂交探针容易渗透到组织中去,容易成功,而且得到的颜色/形态都较冰冻切片好。
二、一抗的选择要点和技巧是什么?1. 单克隆和多克隆抗体的选择。
由一种克隆产生的特异性抗体叫做单克隆抗体。
单克隆抗体能目标明确地与单一的特异抗原决定簇结合,就像导弹精确地命中目标一样。
另一方面,即使是同一个抗原决定簇,在机体内也可以由好几种克隆来产生抗体,形成好几种单克隆抗体混杂物,称为多克隆抗体。
在抗原抗体反应中,一般单克隆抗体特异性强,但亲和力相对小,检测抗原灵敏度相对就低;而多克隆抗体特异性稍弱,但抗体的亲和力强,灵敏度高,但易出现非特异性染色(可以通过封闭等避免)。
2. 应用范围的选择。
有的一抗只能用于WB ( Western blotting )或免疫组化、免疫荧光、免疫沉淀等;甚至表明石蜡切片或冰冻切片。
3. 种属反应性的选择。
这一点很重要,表明这种抗体可能存在种属差异,且这种抗体适合检测哪种种属动物体内的抗原。
4. 种属来源,一般兔来源的多是多克隆;而小鼠来源的多是单克隆,但也有另外。
根据此来源来选择相应的二抗。
5. 生产厂家的选择。
如santa Cruz 公司抗体一般1 ml ,价格2100 元左右;而chemicon公司一抗一般100卩,1价格2800元左右。
这两个厂家的同一种抗体,它的实际效价稳定是不同的,我一般用后者抗体做免疫组化效果较好,而前者做WB 效果还可以。
三、在什么情况下使用Triton-X100 ?1. Triton X-100 化学名称为聚乙二醇辛基苯基醚,是一种去污剂。
在免疫组织化学(10ym以上厚切片)和免疫细胞化学中一般用Triton X-100作为细胞通透剂,在膜上打孔。
2. 其作用原理:Triton X-100 可以溶解细胞膜、细胞核膜、细胞器膜上的脂质而使抗体及大分子结构的物质进入胞浆和胞核内,故在细胞免疫组化时尤为推荐使用,这样抗体就能顺利进入胞内与相应抗原结合。
3. Triton X-100 既是一种表面活性剂,也有抗氧化作用。
四、封闭血清的选择原则是什么?1. 膜上或切片上有剩余的位点可以非特异性吸附抗体,造成后续结果的假阳性。
2. 封闭血清一般是和二抗同一来源的,血清中动物自身的抗体,预先能和组织中有交叉反应的位点发生结合,否则在后面的步骤中如果和二抗发生结合,会造成背景。
3. 也可以用小牛血清、BSA、羊血清等,但不能与一抗来源一致。
五、抗体孵育条件的比较?1. 一抗孵育温度有几种:4oC、室温、37oC,其中4oC效果最佳;孵育时间:这与温度、抗体浓度有关,一般37oC 1-2 h,而4oC过夜和从冰箱拿出后37oC 复温45 min 。
2. 二抗一般室温或37oC 30 min - 1 h ,具体时间需要摸索。
六、一抗4 C孵育后为什么要进行37 T复温?1. 一方面,防止切片从4oC 直接放入PBS 易脱片。
2. 另一方面,使抗原抗体结合更稳定。
一般不需要,但对表达较弱的抗原可能有用,4oC 和37oC 时分子运动方式不同,前者分子碰撞机率和运动速度小于后者,后者结合更快,但敏感性也提高了并易造成非特异染色。
3. 其实,我更赞同后一种说法,因为我尝试把肝脏或睾丸片子从 4 C过夜拿出后,直接用PBS 洗没发生过脱片现象。
事实胜于雄辩。
七、DAB 显色时间如何把握?1. DAB 显色时间不是固定的,主要由显微镜下控制显色时间,到出现浅棕色本底时即可冲洗。
2. DAB 显色时间很短(如几秒或几十秒)就出现很深的棕褐色,这很可能说明你的抗体浓度过高或抗体孵育时间过长,需要下调抗体浓度或缩短抗体孵育时间。
3. 若很短时间就出现背景很深,还有可能是你前面的封闭非特异性蛋白不全,需要延长封闭时间。
4. DAB 显色时间很长(如超过十几分钟)才出现阳性染色,一方面可能说明你的抗体浓度过低或孵育时间过短(最好一抗4oC 过夜);另一方面就是封闭时间过长。
八、免疫组化结果如何分析?1. 阳性着色细胞计数法。
在40 * 光镜下,随机选择不重叠的10 个视野,人工或机器计数阳性着色细胞,每组3-6 张不同动物组织切片,然后进行组间比较即可。
2. 灰密度分析法。
通过在不同组别和不同动物组织切片上选择相同区域、相同条件下用image j 进行灰密度分析,然后进行统计分析即可。
3. 评分法。
通过在光学显微镜下对组织切片分别按染色程度(0-3 分为阴性着色、淡黄色、浅褐色、深褐色)、阳性范围进行评分(1-4 分为0-25% 、26- 50% 、51-75% 、76-100% ),最终可以分数相加,再进行比较。
对于以上这几种方法,各有利弊,请细心选择。
要想得到正确结果的前提是你要做出着色均匀、背景很浅的高质量切片。
九、在什么情况下进行组织抗原修复,抗原修复的条件是什么?1. 由于组织中部分抗原在甲醛或多聚甲醛固定过程中,发生了蛋白之间交联及醛基的封闭作用,从而失去抗原性。
通过抗原修复,使得细胞内抗原决定族重新暴露,提高抗原检测率。
2. 修复方法从强到弱一般分为三种,高压修复、微波修复、胰酶修复。
修复液也分为若干种(具体的可以查阅相关资料,大量的:中性的、高pH 的等)。
3. 微波修复,我们一般用6 min * 4 次,效果不错。
十、内源性过氧化物酶的灭活时间和浓度是什么?1. 一般3% 过氧化氢灭活时间短点,可以10 min 左右;而0.3% 过氧化氢则可以适当延长封闭时间,一般10-30 min 。
2. 用甲醇配置过氧化氢比双蒸水或PBS 好在保护抗原和固定组织作用,过氧化氢孵育时间过长易引起脱片。
3. 现用现配,配好后4oC 避光保存。
十一、如何才能充分脱蜡?1. 蜡不溶于水,如果脱蜡不干净,少许蜡存留于切片上,将会引起染色不均匀、阳性物时隐时现、真假难辨、背景染色增加等。
为了解决上述的问题,切片在染色前必须彻底脱蜡,目前用于脱蜡的试剂主要是二甲苯,因它脱蜡力强,脱蜡时间较短;2. 脱蜡的时间要根据季节,室温和试剂的新鲜谋面是在不同。
如果在夏天,室温较高,脱蜡试剂也新鲜,则脱蜡时间不需很多,3-5 min 就已足够。
如果在冬天,室温较低,脱蜡试剂也较陈旧,则脱蜡时间需要延长,10-20 min 或更长。
3. 当天切的切片,烧烤2 小时后进行染色,切片带有温度进行脱蜡这将可加速脱蜡的过程,如果预先切好烤好的切片,在染色前,还必须对切片进行加温10-20 min ,然后再行脱蜡,这样脱蜡速度加快,效果会更好。
总之,操作时应根据不同的季节,不同的室温,不同的试剂来决定,脱蜡的时间,原则上是要彻底、干净、完全地脱去切片上的蜡。
十二、如何最大限度地降低组织非特异性染色?1. 缩短一抗/二抗孵育时间、稀释抗体来控制。
这是最重要的一条;2. 一抗用多克隆抗体易出现非特异性着色,建议用单克隆抗体看看;3. 内源性过氧化物酶和生物素在肝脏、肾脏等组织含量很高(含血细胞多的组织),需要通过延长灭活时间和增加灭活剂浓度来降低背景染色;4. 非特异性组分与抗体结合,这需要通过延长二抗来源的动物免疫血清封闭时间和适当增加浓度来加强封闭效果;5. 缩短DAB 孵育时间或降低DAB 浓度/过氧化氢浓度等;6. 适当增加PBS 冲洗次数和浸洗时间,在一抗、二抗或SP 孵育之后的浸洗尤为重要;7. 防止标本染色过程中出现干片,这容易增强非特异性着色。
十三、苏木素复染时间的把握?1. 苏木素复染时间要看当时的室温、溶液的新旧、目标抗原的定位等情况,一般数秒-数分钟。
不过这个如果染色不理想可以补救的。
即:染色深则分化时间稍长些即可;染色浅则再置于苏木素中染色即可。
2. 盐酸酒精是分化,氨水是返兰。
作用不同。
片子复染完后流水振洗,然后置于盐酸酒精中数秒(动作一定要快)后拿出流水振洗,在放入氨水中返兰即可。
3. 如果分化的颜色过浅,可以复置于苏木素中染色。
十四、PBS 的清洗方式选择、次数和时间的选择?1. 单独冲洗,防止交叉反应造成污染。
临床上每天检测的病例很多,所用的抗体种类及项目也多,如果在加入一抗孵育完后,将它们在一个缸内洗,这样就会造成交叉污染,影响最后的结果。
正确的做法是单独地进行冲洗,冲洗的PBS 为一次性,保证切片没有相互交叉污染的机会。
2. 温柔冲洗,防止切片的脱落。
冲洗切片,取出切片,将PBS 从上轻轻地冲洗,让PBS 自上而下流下来,不要拿起切片将PBS 对准切片冲洗,这样由于冲出的PBS 有一定的冲击力,很容易使切片周边引起松动,导致切片的脱落。
3. 冲洗的时间要足够,才能彻底洗去结合的物质。
冲洗切片有人提出用微振荡器振染,振下未结合的各种物,使之不产生背景,此种做法一是浪费时间,二是很容易导致切片的脱落。
切片的冲洗据实践认为,用一小烧杯柔和地于切片上冲洗,就能彻底冲洗去未结合的物质,无需附加其它条件,冲洗好于切片上再注入PBS ,持续2 min 左右就完全足够了。
4. PBS 的pH 和离子强度的使用和要求。
刘彦仿指出:中性及弱硷性条件(pH7-8 )有利于免疫复合物的形成,而酸性条件则有利于分解;低离子强度有利于免疫复合物的形成,而高离子强度则有利于分解。
我们目前常用的PBS 的pH 在7.4-7.6 ,浓度是0.01 M ,根据本室十几年来的使用情况,认为该溶液价格便宜配制方面,使用效果好。
5. 常用试剂的配制和使用在免疫组织化学的染色过程中,用得最多的试剂就是缓冲液,因为切片在整个染色中,抗体的加、换、切片的冲洗,DAB 的配制都离不开缓冲液。
可见缓冲液在整个染色中都起至关键的作用,缓冲液的过酸或偏碱,都将影响染色的结果。
十五、脱片产生的原因和如何防止脱片?1. 多聚赖氨酸玻片质量的问题。
我原先是买的,后面补做第二批时用的病理科老师自己做的片子,要好一点。
2. 组织切的不好,切片机的问题例如比较老的旧的机器切得厚或者不均匀,或者切片者手法不好等。
