化学课程之相对原子质量ppt(共34页)
合集下载
人教课标版 初中化学九年级上册第三单元课题2 2.3相对原子质量(共32张PPT)

•
15、一年之计,莫如树谷;十年之计 ,莫如 树木; 终身之 计,莫 如树人 。2021年8月2021/8/112021/8/112021/8/118/11/2021
•
16、提出一个问题往往比解决一个更 重要。 因为解 决问题 也许仅 是一个 数学上 或实验 上的技 能而已 ,而提 出新的 问题, 却需要 有创造 性的想 像力, 而且标 志着科 学的真 正进步 。2021/8/112021/8/11August 11, 2021
• 其中正确的是(B )
• A.③④⑤B.③④⑥C.②③④D.①③⑤
• 3.镉是人类的朋友,如制造“镍-镉”充电 电池。镉(Cd)原子的核电荷数为48,相对 原子质量是112。下列有关说法正确的是C ()
• A.镉原子的质子数为64
• B.镉原子的质量为112g
• C.镉原子核外电子数为48
• D.镉原子的中子数为48
• C.26,56 D.23,46
2.阳离子R2+中含有18个电子,R的
相对原子质量为40,则一个R原子中 所含中子数为( D)
A.40 C.18
B.22 D.20
• 3.已知一个碳12原子的质量为1.993×1026kg,镁原子的相对原子质量是24.305,则 一个镁原子的质量是( C )
• A.24.305
• 5、You have to believe in yourself. That's the secret of success. ----Charles Chaplin人必须相信自己,这是成功的秘诀。-Thursday, June 17, 2021June 21Thursday, June 17, 20216/17/2021
人教版化学九年级上册3.2.1《原子的构成 相对原子质量》课件(共25张PPT)

质子
m(某原子) 原子 中子 Ar = m(碳–12)×1/12
电子
m(某原子)≈m(质子)总+m(中子)总 = m(质子)×质子数+m(中子)×中子数
Ar(某原子)≈
m(质子)×质子数+m(中子)×中子数 m(碳–12)×1/12
1.6726×10–27kg×质子数+1.6749×10–27kg×中子数
相对原子质量为( C )
A.72
B.60
C.40
D.18
2. 紫薯中含有被誉为“抗癌大王”的硒元素,已知硒原子的核电荷数为34,中子数为44,
则硒原子的核外电子数为( B )
A.10
B.34
C.44
D.78
3. 已知某碳12原子的相对原子质量为12,镁原子的相对原子质量为24 。若该碳原子的质量为m,
第三单元 物质构成的奥秘 课题2 原子的结构
课时1 原子的构成 相对原子质量
一、原子的构成
提出原子论
发现电子
α粒子散射实验
实心球模型
葡萄干布丁模型
行星式模型
现代电子云模型
玻尔模型
核外电子 原子核
核外电子
原子核:小而重,集中了原子几乎 全部质量和所有正电荷。
原子核
核外电子:高速运动,每个都带一个单位负电荷。
m(氧原子)≈ 2.657 × 10-26kg m(碳-12)≈ 1.993 × 10-26kg
m(碳–12)
Ar(碳–12)=
= 12
m(碳–12)× 1/12
m(氧原子)
2.657 × 10-26kg
Ar(氧原子)=
=
≈ 16
m(碳–12)×1/12
化学课程之相对原子质量PPT课件( 34页)

3、质量分数的计算
化学式中某元素所占的质量百分含量
某元素的质量分数=
该元素的相对原子质量X该原子个数
——————————————————————————
X100%
化学式的式量
如: 求H2O中H元素的质量分数
H%= HX2 X100% H2O
= 1X2 X100% 1X2+16
=11.1%
练习:
CaCO3
16×3 100
× 100%
= 48%
选择题:
1、下列关于原子的说法中,错误的是( ) A、原子都在不停的运动 B、原子是构成分子的微粒 C、原子是化学变化中的最小微粒 D、原子在化学变化中可以再分 2、氧的相对原子质量约等于( ) A、16 B、16克 C、2.657×10-26 D、2.657×10-2克
•
7、生命的美丽,永远展现在她的进取之中;就像大树的美丽,是展现在它负势向上高耸入云的蓬勃生机中;像雄鹰的美丽,是展现在它搏风击雨如苍天之魂的翱翔中;像江
河的美丽,是展现在它波涛汹涌一泻千里的奔流中。
•
8、有些事,不可避免地发生,阴晴圆缺皆有规律,我们只能坦然地接受;有些事,只要你愿意努力,矢志不渝地付出,就能慢慢改变它的轨迹。
已知下列元素的相对原子质量分别为:
H:1 S:32 O:16 则H2SO4: (1)由__3___种元素组成
(2)一个H2SO4分子中含有_2_:_1_:_4个原子 (3)各元素的原子个数比为__7_______ (4)各元素的质量比为__1_:_1_6_:_3_2_ (5)式量为___9_8_______
与8克NH4NO3中所含氮元素质量相等。
在(NH4)2SO4中, 1、含___N_,H_,_S_,O___元素 2、含___4___种元素 3、一个分子中含有__8__个氢原子 4、一个分子中含__1_5__个原子 5、各元素的原子个数比为____2_:_8_:1_:_4 ______ 6、各元素的原子个数比为N:S:O:H=__2_:1_:4_:_8 7、各元素的质量比为__7_:2_:_8_:1_6____ 8、所占质量分数最大的元素是__O____ 9、相对分子质量(式量)为___1_3_2_____ 10、氮元素的质量分数为___2_1_.2_%_ 11、26.4克该物中含氮元素__5_.6__克 12、__6_60___克该物质中含氮元素140克
(PPT课件)离子与相对原子质量知识讲解

相对原子质量≈质子数+中子1数6
23 24 56
原子
质子(+) a
原子核(+) 中子(不带电) b
核外电子(-) a 推论:相对原子质量≈质子数+中子数
m原子 == a X m质子 + b X m中子 + a X m电子
填 表:
8
8
16
11 12 11
26
30 26
练一练
1 .铁原子的相对原子质量是( B )
≈ 1.66×10-27Kg
氧原子质量
氧的相对原子质量=
注意:
2.657×10-26Kg 1.66×10-27Kg 标准
≈ 16
1、相对原子质量不是原子的实际质量,是一个比值。
2、单位:为1(一般不写)
原子的质量与相对原子质量的比较
一个原子的真实质量 小 kg
相对质量(比值) 大
单位为1
1 12
书写:电荷数标注在 元素符号的右上角 (先写数字;后写电 性“+”“-”符号)。
离子结构示意图
+12 2 8
5、离子符号的意义:
2 Mg2+
表示一个镁离子带2个单位的正电荷 一个镁离子
表示2个镁离子(离子符号前面的系数只表 示离子的个数。)
小结与归纳
离子与原子区别
阳离子 失电子
失电子
原子
阴离子
得电子
1.离子的概念:带电荷的原子(或原子团) 叫做离子。
2.阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、
阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+
23 24 56
原子
质子(+) a
原子核(+) 中子(不带电) b
核外电子(-) a 推论:相对原子质量≈质子数+中子数
m原子 == a X m质子 + b X m中子 + a X m电子
填 表:
8
8
16
11 12 11
26
30 26
练一练
1 .铁原子的相对原子质量是( B )
≈ 1.66×10-27Kg
氧原子质量
氧的相对原子质量=
注意:
2.657×10-26Kg 1.66×10-27Kg 标准
≈ 16
1、相对原子质量不是原子的实际质量,是一个比值。
2、单位:为1(一般不写)
原子的质量与相对原子质量的比较
一个原子的真实质量 小 kg
相对质量(比值) 大
单位为1
1 12
书写:电荷数标注在 元素符号的右上角 (先写数字;后写电 性“+”“-”符号)。
离子结构示意图
+12 2 8
5、离子符号的意义:
2 Mg2+
表示一个镁离子带2个单位的正电荷 一个镁离子
表示2个镁离子(离子符号前面的系数只表 示离子的个数。)
小结与归纳
离子与原子区别
阳离子 失电子
失电子
原子
阴离子
得电子
1.离子的概念:带电荷的原子(或原子团) 叫做离子。
2.阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、
阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+
沪教版九年级上册化学 3.1.3 原子结构示意图、相对原子质量 课件 (共22张PPT)
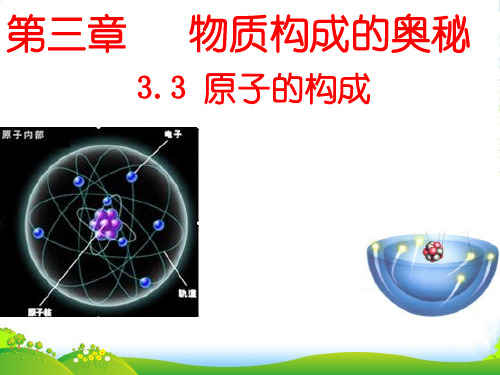
二、相对原子量
氧
2.657×10-26 kg
碳
1.993×10-26 kg
2.657×10-26 kg
氧原子的相对原子质量=
(Ar)
1.993×10-26 kg × 1/12
练习一:
氢原子的质量 = 1.67×10-27 kg 铁原子的质量 = 9.288×10-26 kg 碳原子质量的1/12 = 1.66×10-27kg 求:氢原子和铁原子的相对原子质量。
思考和识记之母。”2021年11月9日星期二8时43分33秒20:43:339 November 2021 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。下午8时43分33秒
下午8时43分20:43:3321.11.9
原子核的半径大 约是原子半径的 十万分之一
原子核比原子小得多
原子
构成原子的粒子的电性和质量
粒子 种类
电性
质子
1个单位 正电荷
质量 1.6726×10-27 kg
中子 不带电 1.6749×10-27 kg
电子
1个单位 负电荷
质子量的1/1836
从下表中你能总结出什么规律?
原子 名称
氢 碳 氧 钠 铁
核电 荷数
1 6 8 11 26
原子核
学完本课题你知道什么
1.原子的构成
核外电子(带负电)
原子
原子核 质子(带正电) 中子(不带电)
2.原子里:质子数=核电荷数=核外电子数 相对原子质量(近似)=质子数+中子数
3.相对原子质量:以一种碳原子质量的1/12作为标准, 其它原子的质量跟它相比较所得的比,就是这种原子 的相对原子质量。
3.2.1 原子的构成 相对原子质量(课件)九年级化学上册(人教版)

跟它相比较所得到的比,作为这种原子的相对原子
质量(符号Ar)。
表达式: 相对原子质量 =
该原子的实际质量 一个C-12原子质量的 1
12
观察与思考: 相对原子质量与原子实际质量的关系
(1)相对原子质量不等于原子的实际质量, 是个比值 。 (2)原子实际质量越大,它的相对原子质量数值 越大 。
(3)相对原子质量的单位: “1”(书写时一般不写出)。
关
B.所有的原子核都是由质子和中子构成的
C.液化石油气须加压后贮存在钢瓶中,说明分子之间有间隙
D.原子的质量基本上等于原子核的质量
3.某元素R和氧元素形成的化合物的化学式为RO,已 知m克该物质中含有n克的R元素,则R的相对原子质 量为( C )
m-n
16m
16n
m-n
A.16n
B.m-n
C.m-n D.16m
4.法国里昂的科学家发现一种只由四个中子构成的粒
子,这种粒子称为“四中子”,也有人称之为“零号元素”
。它与天体中的中子星构成类似。有关该粒子的说法 正确的是(D )
A.带四个单位的正电荷 B.相当于一个氦(He)原子的质量 C.失去一个中子后显+1价 D.在周期表中与氢元素占同一位置
直击中考
1.(2023年四川省成都市中考)化学家张青莲主持测定了铟、铱 、锌等元素相对原子质量的新值。碳12原子的质量为1.99310-26kg , 一种锌原子的质量为 1.09610-25kg,该锌原子的相对原子质量是(C) A.12 B.64 C.66 D.
第三单元 课题2 原子的结构 课时1 原子的结构 相对原子质量
问题导入
分子在化学变化中可 以分成原子,原子是 不是在任何情况下都 不可再分?
人教九年级化学上册附录Ⅱ 相对原子质量表(共24张PPT)

核辐射危害
1986年的苏联切尔诺贝利核电站核泄漏事故被定义为最严重的7级。 当年4月26日,位于今乌克兰境内的切尔诺贝利核电站4号反应堆发生 爆炸,造成30人当场死亡,8吨多强辐射物泄漏。这次核泄漏事故使 电站周围6万多平方公里土地受到直接污染,320多万人受到核辐射侵 害,造成人类和平利用核能史上最大一次灾难。事故后的7年中,有 7000名清理人员死亡,其中1/3是自杀。参加医疗救援的工作人员中, 有40%的人患了精神疾病或永久性记忆丧失。时至今日,参加救援工 作的83.4万人中,已有5.5万人丧生,7万人成为残疾,30多万人受 放射伤害死去。
于是一个为世界公认的新原子基准诞生了。
现代测定原子量主要方法:
质谱法所用仪器 —质谱仪。
现代原子量几乎都是由质谱法测定的。这种方法的 最大优点是精度高。
注:
1、相对原子质量录自国际纯粹 与应用化学联合会( IUPAC)公 布的“标准相对原子质2009”, 以C=12为基准。
2、相对原子质量加方括号的为 放射性元素半衰期最长的同位 素的质量数。
采用方法:
首先要确立一个相对标准,既以谁为参照基准。人为规定氢的相 对原子质量为1,其他的元素都以这个元素质量的多少多少倍来标记;
其次要有准确的定量分布手段,在当时是很难做到明确分子中元 素原子的数目,所以道尔顿只能采用主观武断的方法规定不同元素的 原子化合形成化合物的原子数目比
道尔顿的设想与方法:
我国测定的相对原子质量新值的一 些情况
“( )”内数宇为末位数的误差范围
注:
1、相对原子质量录自国际纯粹 与应用化学联合会( IUPAC)公 布的“标准相对原子质2009”, 以C=12为基准。
2、相对原子质量加方括号的为 放射性元素半衰期最长的同位 素的质量数。
(人教版)九年级上化学:3.2.1《原子的构成、相对原子质量》ppt课件

(来自《点拨》)
初中生物课件
知1-练
1 (2015·荆州)原子核中一定含有的粒子是( ) A.中子 B.质子 C.电子 D.质子和中子
(来自《典中点》)
初中生物课件
知1-练
2 知识梳理有助于我们对已学知识的巩固,如图是某同 学学习物质结构层次后以氧气为例进行的梳理,下列 选项中与a、b、c对应的分别是( ) A.原子、原子核、核外电子 B.原子核、原子、核外电子 C. 原子、核外电子、原子核 D.核外电子、原子核、原子
(来自《点拨》)
初中生物课件
5 (2015·绵阳)下列各种粒子,不带电的是(
知2-练
)
A.原子核 B.质子 C.中子 D.电子
(来自《典中点》)
6 (2016·重庆)同一原子中,下列说法错误的是( )
A.质子和电子的数目相同
B.原子和中子的电性不同
C.原子核和电子的质量不同
第三单元 物质构成的奥秘
3.2 原子的结构
第1课时 原子的构成 相对原子质量
初中生物课件
1 课堂讲解 构成原子的粒子、原子中各粒子之间
的关系及带电情况、相对原子质量
2 课时流程
逐点 导讲练
课堂 小结
课后 作业
初中生物课件
原子的构成 相对原子质量 1911年,卢瑟福用一束带正电的、质量比电子大得 多的高速运动的α 粒子轰击金箔,发现: ①大多数α 粒子能穿透金箔而不改变原来的运动方 向; ②一小部分α 粒子改变了原来的运动方向; ③有极少数α 粒子被弹了回来。
初中生物课件
知1-导
道尔顿“原子论”模型简介 (播放视频) 原子的结构(播放视频)
初中生物课件
【投影展示】
知1-导
初中生物课件
知1-练
1 (2015·荆州)原子核中一定含有的粒子是( ) A.中子 B.质子 C.电子 D.质子和中子
(来自《典中点》)
初中生物课件
知1-练
2 知识梳理有助于我们对已学知识的巩固,如图是某同 学学习物质结构层次后以氧气为例进行的梳理,下列 选项中与a、b、c对应的分别是( ) A.原子、原子核、核外电子 B.原子核、原子、核外电子 C. 原子、核外电子、原子核 D.核外电子、原子核、原子
(来自《点拨》)
初中生物课件
5 (2015·绵阳)下列各种粒子,不带电的是(
知2-练
)
A.原子核 B.质子 C.中子 D.电子
(来自《典中点》)
6 (2016·重庆)同一原子中,下列说法错误的是( )
A.质子和电子的数目相同
B.原子和中子的电性不同
C.原子核和电子的质量不同
第三单元 物质构成的奥秘
3.2 原子的结构
第1课时 原子的构成 相对原子质量
初中生物课件
1 课堂讲解 构成原子的粒子、原子中各粒子之间
的关系及带电情况、相对原子质量
2 课时流程
逐点 导讲练
课堂 小结
课后 作业
初中生物课件
原子的构成 相对原子质量 1911年,卢瑟福用一束带正电的、质量比电子大得 多的高速运动的α 粒子轰击金箔,发现: ①大多数α 粒子能穿透金箔而不改变原来的运动方 向; ②一小部分α 粒子改变了原来的运动方向; ③有极少数α 粒子被弹了回来。
初中生物课件
知1-导
道尔顿“原子论”模型简介 (播放视频) 原子的结构(播放视频)
初中生物课件
【投影展示】
知1-导
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CaCO3
16×3 100
× 100%
= 48%
选择题:
1、下列关于原子的说法中,错误的是( ) A、原子都在不停的运动 B、原子是构成分子的微粒 C、原子是化学变化中的最小微粒 D、原子在化学变化中可以再分 2、氧的相对原子质量约等于( ) A、16 B、16克 C、2.657×10-26 D、2.657×10-2克
相对原子质量和式量 建平实验学校
原子是真实存在的
原子很小,原子有一定质量
1个氢原子质量为1.6710-27Kg 1个碳原子质量为1.99310-26 Kg 1个氧原子质量为2.65710-26 Kg
一、相对原子质量:
以一种碳原子的质量的1/12为标准, 其他原子的质量与它相比所得数值,就 是这种原子的相对原子质量
已知相对原子质量:Cu-64 C-12 O-16 H-1, 在Cu2(OH)2CO3中 该物质由____种元素组成;一个该物质的分子中含有 ____个氧原子;一个该物质的分子中含有____个原子; 该物质的分子中的原子个数比为:Cu:C:H:O= _ ;
该物质的式量为_______________
已知下列元素的相对原子质量分别为:
H:1 S:32 O:16 则H2SO4: (1)由__3___种元素组成
(2)一个H2SO4分子中含有_2_:_1_:_4个原子 (3)各元素的原子个数比为__7_______ (4)各元素的质量比为__1_:_1_6_:_3_2_ (5)式量为___9_8_______
相对原子质量和式量的相关计算
1、式量பைடு நூலகம்相对分子质量)
已知相对原子质量为Ca-40 C-12 O-16 求 CaCO3 和 Ca (OH)2的式量 2、在上述两种化合物中各元素的原子个数比
3、求上述两种物质中各元素的质量比
4、在CaCO3 中O元素的质量百分含量(质量分数)
O%= =
O×3 × 100%
1、求CO2中氧元素的质量分数 2、求NH4HCO3中N的质量分数
158克该物质中含有氮元素多少克? 某元素质量=整体的质量×该元素含量
4.求Fe2O3中Fe 元素的质量分数是多少? 50克氧化铁中含铁元素多少克?
15、已知相对原子质量:Cu-64 C-12 O-16 H-1, 在Cu2(OH)2CO3中 该物质由_4_种元素组成;一个该物质的分子中含有 _5_个氧原子;一个该物质的分子中含有_10_个原子; 该物质的分子中的原子个数比为:Cu:C:H:O=
3、质量分数的计算
化学式中某元素所占的质量百分含量
某元素的质量分数=
该元素的相对原子质量X该原子个数
——————————————————————————
X100%
化学式的式量
如: 求H2O中H元素的质量分数
H%= HX2 X100% H2O
= 1X2 X100% 1X2+16
=11.1%
练习:
__2:1:2:5_;
该物质的式量为__222
该物质中各元素的质量比为:Cu:C:H:O=
C
O
氧的相对原子质量= —————— = 16
=
2.657×10-26 kg
= 16
1.6608×10-27 kg
即:氧的相对原子质量为16
原子的质量(m)
︳
是真实质量, 有单位,克或千克
相对原子质量(Ar)
︳
是比值,没单位
如: 1个氧原子质量为2.65710-26 Kg
氧元素的相对原子质量为16
=12×2+1×4+16×2=60
巩固练习:
1、磷酸的化学式为H3PO4,则该物质由___种 种元素组成;该物质中各元素原子的个数比为 ____________;该物质的一个分子中含有 _____个原子;其式量为_______。 2、碳酸氢铵的化学式NH4HCO3,一个碳酸氢 铵 分子中含_____个氢原子,各元素的原子个数比 为相_对__原_子,质N量H4:HCC-O132的式O-量16__N__-1_4_。H-1 P-31
如: H2O 式量=1×2+16=18
化学式:C2H4O2
式量=12×2+4×1+16×2=60
练习:计算式量
已知相对原子质量:
H--1 C--12
O--16 Ca--40
1、CO2
=12+16×2=44
2、Ca(OH)2 =40+(16+1)×2=74
3、CH3COOH
或
=12+3+12+16+16+1=60
3、已知一个作为相对原子质量标准的碳原子质量为 a克,一个铁原子的质量为b克,求铁的相对原子质量
4、已知一个作为相对原子质量标准的碳原子质量为 a克,铁的相对原子质量为b ,求一个铁原子的质量
二、式量 化学式中各原子相对原子质量之和
1、式量计算
已知相对原子质量:
H--1 C--12
O--16
Ca--40
查阅方法:
从元素周期表或P129 附录Ⅲ
Main Idea
中查阅,一般取近似整数值
(Cl取35.5)
选择题:
1、下列关于原子的说法中,错误的是( ) A、原子都在不停的运动 B、原子是构成分子的微粒 C、原子是化学变化中的最小微粒 D、原子在化学变化中可以再分 2、氧的相对原子质量约等于( ) A、16 B、16克 C、2.657×10-26 D、2.657×10-2克
2、化学式中各元素的质量比: 例:MgO中镁元素与氧元素的质量比
=24:16 =3:2
CO2中碳元素与氧元素的质量比 =12:16×2 =12:32 =3:8
相对原子质量:C—12 H—1 O—16
碳酸氢铵的化学式是NH4HCO3,一个碳酸氢铵 分子中所含原子总数是__1_0__,N、C、O、H的 原子个数比__1_:__1_:__3_:_5__ 其式量是__7_9____。 碳酸氢铵由__4___种元素组成。
1、已知1个铝原子的质量为4.482 ×10-26kg,1个作为相 对原子质量标准的碳原子的质量为1.993×10-26kg,列 式计算铝的相对原子质量
2、一个作为相对原子质量标准的碳原子的质量为a克, 一个氧原子的质量b克,则氧的相对原子质量为______
常见元素的相对原子质量:
H--1 C--12 N--14 O--16 Na—23 Mg--24 Al--27 S--32 K--39 Ca--40 Cu—64 Zn—65 ……
