2018高考化学大一轮复习课件:第七单元+化学反应速率和化学平衡 (2)
合集下载
高考化学一轮复习 第七章 化学反应速率和化学平衡 第二节 化学平衡状态 化学平衡移动课件 新人教版
(2)等价标志 ①体系中各组分的质量、物质的量浓度、体积分数、 物质的量分数保持不变。 ②对同一物质而言,断裂的化学键的物质的量与形成 的化学键的物质的量相等。 ③对于有有色物质参加或生成的可逆反应,体系的颜 色不再随时间而变化。例如,2NO2(g) N2O4(g)。 ④体系中某反应物的转化率或某生成物的产率达到最 大值且不再随时间而变化。 ⑤全部是气体参加的气体体积可变的反应,体系的压 强、平均相对分子质量不再随时间而变化。例如,N2(g)+ 3H2(g) 2NH3(g)。
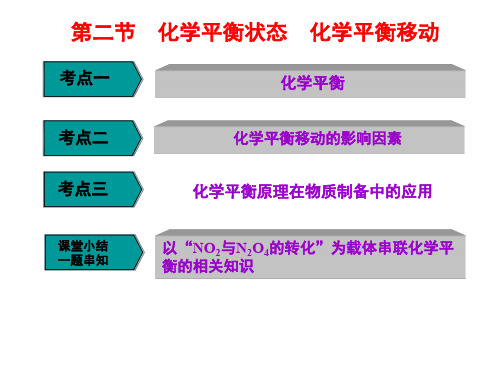
第二节 化学平衡状态 化学平衡移动
考点一
化学平衡
考点二 考点三
化学平衡移动的影响因素
化学平衡原理在物质制备中的应用
课堂小结 一题串知
以“NO2与N2O4的转化”为载体串联化学平 衡的相关知识
1.了解化学反应的可逆性。 2.了解化学平衡建立的过程。 3.理解外界条件(浓度、温度、压强、催化剂等)对化学 平衡的影响,认识并能用相关理论解释其一般规律。
[注意] 以下几种情况不能作为可逆反应达到化学平衡状态 的标志:
①某一时刻,各物质的浓度(或物质的量或分子数)之比等于 化学计量数之比的状态。
②恒温、恒容条件下气体体积不变的反应,混合气体的压强 或气体的总物质的量不随时间而变化,如 2HI(g) I2(g)+H2(g)。
③全部是气体参加的体积不变的反应,体系的平均相对分子 质量不随时间而变化,如 2HI(g) I2(g)+H2(g)。
[考向合作探究]
化学平衡状态的判断 1.化学平衡状态判断的“两审” 一审题干条件:是恒温恒容还是恒温恒压。 二审反应特点: ①全部是气体参与的等体积反应还是非等体积反应; ②有固体参与的等体积反应还是非等体积反应。 2.化学平衡状态判断的“两标志” (1)本质标志 v 正=v 逆≠0。对于某一可逆反应来说,正反应消耗掉某 反应物的速率等于逆反应生成该反应物的速率。
2018届高考化学大一轮复习课件:第七章化学反应速率与化学平衡第二讲

栏目 导引
第七章
化学反应速率与化学平衡
2.在一定条件下发生反应:3A(g)+2B(g) xC(g)+2D(g),在 2 L 密闭容器中,把 4 mol A 和 2 mol B 混合,2 min 后达到平衡 时生成 1.6 mol C,又测得反应速率 vB=0.2 mol· L-1·min-1, 则下列说法中正确的是( D ) A.x=3 B.B 的转化率为 20% C.平衡时气体压强是原来的 0.94 倍 D.达到平衡时 A 的浓度为 1.4 mol· L-1
18
O 组成的氧气一段时间后,18O 存在于下列物质中的( D )
A.多余的氧气中 B.生成的三氧化硫中 C.氧气和二氧化硫中 D.二氧化硫、氧气和三氧化硫中
栏目 导引
第七章
化学反应速率与化学平衡
解析:化学平衡是动态平衡,18O2 的加入一定会与 SO2 结合生 成含 18O 的 SO3,同时含 18O 的 SO3 又会分解得到 SO2 和 O2, 使 SO2 中也含有 18O,因此 18O 存在于 SO2、O2、SO3 这三种物 质中。
不变的状态。 2.特点
可逆
正反应速率=逆反应速率 浓度或百分含量
栏目 导引
第七章
化学反应速率与化学平衡
[自我检测] 1.向含有 2 mol SO2 的容器中通入过量氧气发生反应:2SO2+ 催化剂 < O2 2SO3 ,充分反应后生成 SO3 的物质的量 ________2 △
> mol(填“<”“>”或“=”, 下同), SO2 的物质的量________0 mol, < 转化率________100%。
栏目 导引
第七章
化学反应速率与化学平衡
2018高考化学一轮复习第7章化学反应速率化学平衡第1课时化学反应速率及其影响因素课件

3.数学表达式及单位
Δc mol ·L-1·s-1或mol·L-1·min-1 Δt , 单 位 : v = _______ ________________________________ ,如密闭容器
中,合成氨的反应N2+3H22NH3,开始时c(N2)=8 mol·L-1,2 min后c(N2)= 2 mol·L-1·min-1 。 4 mol·L-1,则用N2表示该反应的反应速率为__________________
-1·s-1 0.2 mol · L ____________________。
判断正误(正确的打“√”,错误的打“×”) 导学号 25470920 (1)对于任何化学反应来说,反应速率越大,反应现象就越明显( × ) (2)化学反应速率为 5 mol· L-1· s-1 是指瞬时速率( × ) Δc (3)由 v= 计算平均速率, 用反应物表示为正值, 用生成物表示为负值( × ) Δt (4)同一化学反应, 相同条件下用不同物质表示的反应速率, 其数值可能不同, 但表示的意义相同( √ ( × ) ) (5)化学反应速率为 0.8 mol· L-1· s-1 是指 1 s 时某物质的浓度为 0.8 mol· L-1
精准高考
化 学
人教版
必考内容
第七章 化学反应速率 化学平衡
第一课时 化学反应速率及其影响因素
考 纲 解 读
考纲要求
命题趋势
1.了解化学反应速率的概念、化学反应
速率的定量表示方法。
化学反应速率的计算与图象判
断是历年高考的必考内容之一,预
2.了解催化剂在生产、生活和科学研 计2018年高考仍会在化学反应速率
[解析] 起始浓度/(mol· L 1):
化学反应速率与化学平衡复习(ppt)

知可逆反应CO + H2O(g) 已知可逆反应CO 平衡时, 平衡时,
CO2 + H2,达到
830K 若起始时: mol/L, (1)830K时,若起始时:c (CO) = 2 mol/L, c (H2O) = 3 mol/L , 平衡时 CO 的转化率为 60% , mol/L, 平衡时CO 的转化率为60 CO的转化率为 60% 水蒸气的转化率为 ;K值 为 。
化学反应速率与化学平衡复习
• • • • 掌握三部分内容: 一、化学反应速率 二、化学平衡 三、化学反应进行的方向
一、化学反应速率
1、定义:用单位时间内反应物或生成物 定义: 的物质的量变化来表示。 的物质的量变化来表示。 2、数学表达式: V == △C/ △ t 数学表达式: 数学表达式
mol/( min min) 3、单位:mol/(L·s) 或 mol/(L·min) 单位:mol/( s mol/( h 或 mol/(L·h) 简单计算: 4、简单计算:公式法 化学计量数之比法
5、影响因素
• 内因: 内因: 反应物本身的性质 • 外因: 浓度越大, 浓度越大,速率越大 浓度: 压强越大, 压强: 压强越大,速率越大 温度: 温度越高,速率越大 温度越高, 催化剂: 其他因素:
二、化学平衡
• 定义:一定条件下,可逆反应里,正反应速 一定条件下,可逆反应里,
率和逆反应速率相等, 率和逆反应速率相等,反应混合物中各组分的 浓度保持不变的状态 化学平衡的特征: 化学平衡的特征: 可逆反应( 可逆反应 或可逆过程) 逆 ——可逆反应(或可逆过程) 不同的平衡对应不同的速率) 等 ——V正 =V逆(不同的平衡对应不同的速率) 动态平衡。 动态平衡 达平衡后, 动 ——动态平衡。达平衡后,正逆反应仍在进行 (V正=V逆≠0) ) 平衡时, 平衡时 各组分浓度、含量保持不变(恒定) 定 ——平衡时,各组分浓度、含量保持不变(恒定) 条件改变, 条件改变 变——条件改变,平衡发生改变
CO2 + H2,达到
830K 若起始时: mol/L, (1)830K时,若起始时:c (CO) = 2 mol/L, c (H2O) = 3 mol/L , 平衡时 CO 的转化率为 60% , mol/L, 平衡时CO 的转化率为60 CO的转化率为 60% 水蒸气的转化率为 ;K值 为 。
化学反应速率与化学平衡复习
• • • • 掌握三部分内容: 一、化学反应速率 二、化学平衡 三、化学反应进行的方向
一、化学反应速率
1、定义:用单位时间内反应物或生成物 定义: 的物质的量变化来表示。 的物质的量变化来表示。 2、数学表达式: V == △C/ △ t 数学表达式: 数学表达式
mol/( min min) 3、单位:mol/(L·s) 或 mol/(L·min) 单位:mol/( s mol/( h 或 mol/(L·h) 简单计算: 4、简单计算:公式法 化学计量数之比法
5、影响因素
• 内因: 内因: 反应物本身的性质 • 外因: 浓度越大, 浓度越大,速率越大 浓度: 压强越大, 压强: 压强越大,速率越大 温度: 温度越高,速率越大 温度越高, 催化剂: 其他因素:
二、化学平衡
• 定义:一定条件下,可逆反应里,正反应速 一定条件下,可逆反应里,
率和逆反应速率相等, 率和逆反应速率相等,反应混合物中各组分的 浓度保持不变的状态 化学平衡的特征: 化学平衡的特征: 可逆反应( 可逆反应 或可逆过程) 逆 ——可逆反应(或可逆过程) 不同的平衡对应不同的速率) 等 ——V正 =V逆(不同的平衡对应不同的速率) 动态平衡。 动态平衡 达平衡后, 动 ——动态平衡。达平衡后,正逆反应仍在进行 (V正=V逆≠0) ) 平衡时, 平衡时 各组分浓度、含量保持不变(恒定) 定 ——平衡时,各组分浓度、含量保持不变(恒定) 条件改变, 条件改变 变——条件改变,平衡发生改变
2018届高考化学大一轮复习课件第七章化学反应速率和化学平衡7-2-2

②恒温、恒压条件 充入惰性气体 原平衡体系 ――→ 容器容积增大,各反应气体的分压减 小 ―→体系中各组分的浓度同倍数减小 (等效于减压 )
7.恒容时,同等程度地改变反应混合物中各物质的浓度时, 应视为压强的影响,增大(减小 )浓度相当于增大 (减小 )压强。 8.绝热体系的化学平衡分析方法 在绝热条件下,体系与外界不进行热交换,若反应放热,体系 内温度升高,平衡就会向吸热反应的方向移动,从而影响平衡常数 和反应物的转化率,对吸热反应,会使体系内温度降低,也会使平 衡发生移动。
答案 1. v 正=v 逆≠0 2.正反应方向 3.增大 正向 v 正≠ v 逆 不发生 减小 逆反应方向 逆向 增大 逆向 减小 正向 不 不移 b′ 增
大 逆向 减小 正向 4.减弱 动
乙
增大 减小
不 增大 减小 (2)向右
(1)向左 向左
向右 高
不移动
p 甲 <p′甲 <2p 甲动原理解释的是(
)
A.
解析:本题考查化学平衡移动原理的应用。A 项中 NO2 球中 存在 2NO2 N2O4,ΔH<0,正反应放热,NO2 球放入冷水,颜 色变浅,NO2 球放入热水, 颜色变深, 可以用平衡移动原理解释, A 项错误;根据 B 中表格的数据,温度升高,KW 增大,则水的 电离是吸热反应,能用平衡移动原理解释,B 项错误;H2O2 溶液 加 MnO2 是为了加快化学反应速率,MnO2 作催化剂,C 项正确;
平衡体系
条件变化 增大反应 物的浓度 减小反应 物的浓度
速率变化 v 正、v 逆均 ____,且 v 正 ′>v 逆′ v 正 、 v 逆均 ________,且 v 逆 ′ > v 正′ v 正 、 v 逆均 ________,且 v 逆 ′ > v 正′ v 正 、 v 逆均 ________,且 v 正 ′ > v 逆′
高考化学总复习 第7章 化学反应速率和化学平衡 第2节 化学平衡状态 化学平衡的移动课件

12/11/2021
第三页,共三十八页。
②一小:任一组分的转化率都___小__于_____100%。 (3)表示方法:在化学方程式中用“ ”表示。
12/11/2021
第四页,共三十八页。
2.化学平衡状态 (1)概念:一定条件下的可逆反应,当反应进行到一定程度时, 正反应速率和逆反应速相率等_(x_iā_n_gd_ěn_g_) ____,反应物的浓度和生 成物的浓度不_再__(b_ù_z_ài_)改__变__,我们称为“化学平衡状态”,简 称化学平衡。 (2)建立过程:在一定条件下,把某一可逆反应的反应物加入 固定容积的密闭容器中。反应过程如下:
12/11/2021
第五页,共三十八页。
12/11/2021
第六页,共三十八页。
以上过程可用如图表示:
12/11/2021
第七页,共三十八页。
(3)特征
12/11/2021
第八页,共三十八页。
1.2H2O
电解 点燃
2H2↑+O2↑为可逆反应(
×
)
2.Pb+PbO2+2H2SO4
放电 充电
2PbSO4+2H2O
12/11/2021
第三十三页,共三十八页。
解析:选 B。当气体体积缩小到原来的12时,假设平衡未发 生移动,则 C 的浓度为原平衡时的 2 倍,而事实上平衡发 生了移动,平衡移动的结果是 C 的浓度变为原平衡时的 1.9 倍,则可认为由虚拟中间状态向逆反应方向发生了移动。
12/11/2021
第三十四页,共三十八页。
3.在体积为 V L 的恒容密闭容器中盛有一定量 H2,通入 Br2(g)发生反应:H2(g)+Br2(g) 2HBr(g) ΔH<0。当温度 分别为 T1、T2 平衡时,H2 的体积分数与 Br2(g)的物质的量 的变化关系如图所示。下列说法正确的是( )
高考化学一轮复习第七章化学反应速率和化学平衡第二节

- -
ቤተ መጻሕፍቲ ባይዱ
0 mol· L 1;反应为可逆反应,反应物不能完全转化,所以,
-
0<c(SO2)<0.4 mol· L
-
-1,
0<c(O2)<0.2 mol· L 1,0<c(SO3)<
- -
0.4 mol· L 1,由 S 原子守恒可知 c(SO2)+c(SO3)=0.4 mol· L 1。
知识点 二 化学平衡的移动
对点练习
1.判断正误(正确的打“√”,错误的打“×”)。 (1)化学平衡发生移动,速率一定改变;速率改变,化学平 衡一定发生移动 (× ) (2)改变反应体系的温度,化学平衡一定发生移动 (√ ) (3)改变反应体系的压强,化学平衡一定发生移动 (× ) (4)向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加KCl 固体,平衡将向逆反应方向移动,溶液颜色将变浅 (× ) (5)合成氨反应需使用催化剂,说明催化剂可以促进该平衡 向生成氨的方向移动 (× ) (6)对于2NO2 N2O4平衡体系,加压后颜色加深 (√ ) (7)C(s)+CO2(g) 2CO(g) ΔH>0,其他条件不变时,升 高温度,反应速率v(CO2)和CO2的平衡转化率均增大 (√ ) (8)CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,在其他条件 不变的情况下改变压强,平衡不发生移动,反应放出的热 量不变 (√ )
2.1 教材复习
——打牢基础,基稳才能楼高
目 录
01 02 03
可逆反应与化学平衡状态
化学平衡的移动
基础过关练
可逆反应与化学 知识点 一 平衡状态
1.可逆反应 在相同条件下,既能向 正反应 方向进行,同时又能向
逆反应 方向进行的反应。可逆反应中,反应物不能完全转
ቤተ መጻሕፍቲ ባይዱ
0 mol· L 1;反应为可逆反应,反应物不能完全转化,所以,
-
0<c(SO2)<0.4 mol· L
-
-1,
0<c(O2)<0.2 mol· L 1,0<c(SO3)<
- -
0.4 mol· L 1,由 S 原子守恒可知 c(SO2)+c(SO3)=0.4 mol· L 1。
知识点 二 化学平衡的移动
对点练习
1.判断正误(正确的打“√”,错误的打“×”)。 (1)化学平衡发生移动,速率一定改变;速率改变,化学平 衡一定发生移动 (× ) (2)改变反应体系的温度,化学平衡一定发生移动 (√ ) (3)改变反应体系的压强,化学平衡一定发生移动 (× ) (4)向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加KCl 固体,平衡将向逆反应方向移动,溶液颜色将变浅 (× ) (5)合成氨反应需使用催化剂,说明催化剂可以促进该平衡 向生成氨的方向移动 (× ) (6)对于2NO2 N2O4平衡体系,加压后颜色加深 (√ ) (7)C(s)+CO2(g) 2CO(g) ΔH>0,其他条件不变时,升 高温度,反应速率v(CO2)和CO2的平衡转化率均增大 (√ ) (8)CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,在其他条件 不变的情况下改变压强,平衡不发生移动,反应放出的热 量不变 (√ )
2.1 教材复习
——打牢基础,基稳才能楼高
目 录
01 02 03
可逆反应与化学平衡状态
化学平衡的移动
基础过关练
可逆反应与化学 知识点 一 平衡状态
1.可逆反应 在相同条件下,既能向 正反应 方向进行,同时又能向
逆反应 方向进行的反应。可逆反应中,反应物不能完全转
全国版高考化学一轮复习第7章化学反应速率和化学平衡第2节化学平衡状态化学平衡的移动课件

B.v 正(N2)=v 逆(NH3) D.v 正(N2)=3v 逆(H2)
第二十二页,共98页。
(2)在一定温度下的恒容密闭容器中,可逆反应达到平 衡状态时,一些宏观物理量恒定不变:a.反应容器中生成物 的浓度不变;b.反应物的生成速率与生成物的消耗速率之比 等于化学计量数之比;c.混合气体的压强不变;d.混合气体 的密度不变;e.混合气体的平均相对分子质量不变;f.混合 气体的总物质的量不变;g.混合气体的颜色不变;h.各反应 物和生成物的浓度之比等于化学计量数之比;i.某种气体的 质量分数不变。
第二页,共98页。
命题规律 本节内容是高考的重点与热点,主要考点有两个:一是 化学平衡状态的判断;二是化学平衡移动原理,它往往以化 学图像为载体,结合化学反应速率的变化、化学平衡常数, 一起进行考查,同时考查观察图表、数据处理、分析问题的 能力。
第三页,共98页。
板块(bǎn kuài)一 主干层 级突破
第十六页,共98页。
2 . 在 一 个 密 闭 容 器 中 发 生 如 下 反 应 : 2SO2(g) + O2(g) 2SO3(g),反应过程中某一时刻测得 SO2、O2、SO3 的浓度分别为:0.2 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,当 反应达到平衡时,可能出现的数据是( )
2H2↑+O2↑为可逆反应。(
×
)
(2)对于反应 2A(g)+B(s) 3C(g),在恒温恒容密闭容
器中反应,当混和气体的密度或压强保持不变时,都说明反
应已达平衡状态。( √ )
第十二页,共98页。
(3)由 2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol -1 知,2 mol SO2 与 1 mol O2 在恒压密闭容器中充分反应, 可放出 196.6 kJ 的热量。( × )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点二 基础梳理 考点突破
考点三
对点演练
-4-
特别提醒(1)化学反应速率一般指反应的平均反应速率而不是瞬 时反应速率,且无论用反应物表示还是用生成物表示均取正值。 (2)同一化学反应,相同条件下用不同物质表示的反应速率,其数 值可能不同,但表示的意义相同。 (3)不能用固体或纯液体来表示化学反应速率。
0.04
解析
答案
考点二 基础梳理 考点突破
考点三
对点演练
-10-
答题模板某一物质(不能是固体或纯液体)的物质的量变化 Δnx 某一物质的浓度变化 Δcx vy、vz 等。 某一物质的反应速率 vx
������ ������ ������������ ������������ b������ ������
则:v(A)=
考点二 基础梳理 考点突破
考点三
对点演练
-8-
2.化学反应速率的比较方法 (1)看单位是否统一,若不统一,换算成相同的单位。 (2)换算成用同一物质表示的反应速率,再比较数值的大小。 (3)比较化学反应速率与化学计量数的比值,即对于一般反应 aA+bB cC+dD,比较 率比 B 大。
考点二 基础梳理 考点突破
考点三
对点演练
-3-
化学反应速率的概念和定量表示方法 1.表示方法 通常用单位时间内反应物浓度的 减小或生成物浓度的 增大来表 示。 2.数学表达式及单位 Δ������ L-1· min-1 或 mol· L-1· s-1 等。 v= Δ������ ,单位为 mol· 3.化学反应速率与化学计量数的关系 对于已知反应:mA(g)+nB(g)==pC(g)+qD(g),在同一段时间内,用 不同物质来表示该反应速率,当单位相同时,反应速率的数值之比 化学计量数 等于这些物质在化学方程式中的 之比。即 m∶n∶p∶q v(A)∶v(B)∶v(C)∶v(D)= 。如在一个2 L的容 器中发生反应:3A(g)+B(g)==2C(g),加入2 mol A,1 s后剩余1.4 mol, L-1· s-1 。 L-1· s-1 ,v(B)= 0.1 mol· 则v(A)= 0.3 mol· L-1· s-1 ,v(C)= 0.2 mol·
������
考点二 基础梳理 考点突破
考点三
对点演练
-6-
1.化学反应速率计算 (1)公式法: ②同一反应速率,用不同的物质表示时,反应速率之比等于各物 质的化学计量数之比。
Δ������(A) ①v(A)= Δ������
=
Δ������(A) 。 ������· Δ������
考点二 基础梳理 考点突破
考点二
考点三
对点演练
考点二
考点三
对点演练
考纲要求: 1.了解化学反应速率的概念和定量表示方法。 2.了解反应活化能的概念,了解催化剂的重要作用。 3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响, 能用相关理论解释其一般规律。 4.了解化学反应速率的调控在生活、生产和科学研究领域中的重 要作用。
考点三
对点演练
-7-
(2)“三段式”法: ①写出有关反应的化学方程式。 ②找出各物质的起始量、转化量、某时刻量。 ③根据已知条件列方程式计算。 例如,反应 mA+ nB pC t0 s/mol· L-1 a b 0 ������������ ������������ 转化/mol· L-1 x t1 s/mol· L-1
-1 A.0~ t1 时间段内 ,平均反应速率 v(B)=mol,容器容积为 mol· L-1· min 项错误 ;若起始时 ,n(D)=0,0~ t2 时 Δn(D)=0.2 1 L,故 0~t2 ������1 0.2mol 0.2 -1 0.20 -1 时间内 : v (D)= = mol · L · min ,mol· 又因为反应速率为平均反 B.若起始时 n (D)=0, 则 t 时 v (D)= L-1· min-1 1 L× ������2 min ������22 ������2 应速率 ,升高温度 而不是瞬时反应速率 项错误 ;升高温度,B、C、D 的反应速率 C. ,v(B)、v(C),B 、v (D)均增大 关闭 均增大 ,C 项正确 ;t1 、 1~t2 时间段内,B 和 D 的物质的量变化分别为 0.06 mol D. b∶ d=6∶ 0.1 mol,所以 b∶d=3∶5,D 项错误。 C
������ ������1 -������0 ������������ v(B)= ������(������1 -������0 ) ������������ v(C)= ������(������1 -������0 )
a-x mol· L-1· s-1、 mol· L-1· s-1、 mol· L-1· s-1。
考点二 基础梳理 考点突破
考点三,正确的画“√”,错误的画“×”。 (1)对于任何化学反应来说,反应速率越大,反应现象就越明显 ( × ) Δ������ (2)由 v= 计算平均反应速率,用反应物表示为正值,用生成物表 示为负值 ( × ) (3)同一化学反应,相同条件下用不同物质表示的反应速率,数值 越大,表示化学反应速率越大 ( × ) (4)反应速率一般是指某段时间内的平均反应速率,而不是瞬时 反应速率 ( √ ) (5)对于反应 N2+3H2 3 2NH3,v(N2)∶v(H2)一定等于 1∶ ( √ )
������(A) ������(B) ������(A) 与 ,若 ������ ������ ������
>
������(B) ,则 ������
A 表示的反应速
考点二 基础梳理 考点突破
考点三
对点演练
-9-
例 1(2016 黑龙江哈尔滨高三调研)A 与 B 在容积为 1 L 的密闭 容器中发生反应:aA(s)+bB(g) cC(g)+dD(g),t1、 t2 时刻分别测得部 分数据如下表: n(B)/mol n(C)/mol n(D)/mol 反应时间/min 0.12 0.06 0.10 t1 0.06 0.12 0.20 t2 关闭 下列说法正确的是 ( ,因此无法确定 ) 不能确定 B 的起始物质的量 0~t1 时间段内的反应速率,A
