铁和铜及其化合物知识点
铁铜及其化合物

CaO+SiO2高=温=CaSiO3
( 生成炉渣)
三、铁、铜的物理性质
铁:银白色金属,密度7.86 g/cm3,熔点1535℃,硬度较 小,能够导电、导热;能被磁铁吸引,在一定条件下也 可带磁性,是一种磁性物质,纯铁具强抗蚀力 。
铜:紫红色金属,熔点约1083.4℃,沸点2567℃, 密度8.92g/cm3,具有良好的延展性。能够导电、导 热。
④
⑤ Cl2、Br2、HNO3、
H2O2、KMnO4(H+)
⑥还原剂:Zn等
Fe + Cu2+ = Fe2+ + Cu
Fe+2Fe3+=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
六、Fe3+和Fe2+的检验:
1.Fe3+在溶液中为 _棕__黄___色 ①加入NaOH溶液,产生__红__褐___色沉淀。 ②加入KSCN溶液,溶液变成__血__红____色。
又 4 Fe(OH)2+O2+2H2O= 4Fe(OH)3 2Fe(OH)3=Fe2O3 ·xH2O(铁锈)+(3-x)H2O
2、析氢腐蚀
发生条件: 钢铁表面吸附的水膜呈现较强酸性。反 应时有 H2 析出
铁: Fe-2e-=Fe2+ 杂质: 2H++2e-=H2↑ 总式: Fe+2H+=Fe2++H2↑
(2)铁与水的反应
3Fe + 4H2O(g) 高温 Fe3O4 + 4H2
(3)铁与酸的反应 非氧化性酸: Fe + 2H+ = Fe2+ + H2↑ 铁在冷的浓硫酸、浓硝酸中钝化
知识点3 铁铜及其化合物思维导图-备战2021高考化学元素及其化合物知识点思维导图

2Fe+3Cl2 点燃 2FeCl3 2Fe+3Br2 = 2FeBr3 2Fe+I2 △ FeI2
2、与硫:
FeBr3可做苯与溴取代的催化剂: Cl2通到含Fe2+、Br—、I—的溶液中是先氧化I—,再氧化Fe2+。最后氧化Br—
金属硫化物一般有颜色、难溶于水,只有碱金属硫化 物、硫化铵易溶于水,少数碱土金属硫化物微溶于水
(4)Cu2+中混有Fe2+:先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然
后加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3中之一,除Fe3+
(5)
制备无水氯化铁应在HCl气流中加热蒸干FeCl3溶液
(6)铝
盐和铁盐净水原理相似,都是水解生成Al(OH)3、Fe(OH)3胶体,吸附水中杂质
Cu2(OH)2CO3的名称为碱式碳酸铜,是铜绿、孔雀石的主 要成分,受热分解:Cu2(OH)2CO3 △ 2CuO+CO2↑+H2O
2、在潮湿的空气中形成绿色的铜锈: 2Cu+O2+CO2+H2O = Cu2(OH)2CO3
蛋白质的盐析:加入(NH4)2SO4、 Na2SO4等可使蛋白质发生盐析而对其 进行分离提纯,盐析是可逆的物理变化
正极;O2+4e—+2H2O = 4OH— 负极:2Fe—4e— = 2Fe2+
Fe2++2OH— = Fe(OH)2; 4Fe(OH)2+O2+2H2O = 4Fe(OH)3; 2Fe(OH)3 = Fe2O3•xH2O + (3x)H2O ( Fe2O3为红棕色粉末)
补充:(1)Fe(OH)3胶体的制备方法:将饱和FeCl3溶液滴加到沸水中,加热至
CuSO4•5H2O俗称胆矾,无水CuSO4为白色粉末,遇水变 蓝色(生成CuSO4•5H2O),可作为水的检验依据。
高三化学一轮复习——铁铜及其重要化合物
(5)向硫酸亚铁溶液中滴加 NaOH 溶液,边加边搅拌,即可制得白色的氢氧化亚 铁。( ) )
(6)Fe2O3 是红棕色粉末,俗称铁红,常用作红色油漆和涂料。( (7)氧化铁能与酸反应,所以可用于制作红色染料。( ) )
(8)铁表面自然形成的氧化层能保护内层金属不被空气氧化。(
答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)× (8)×
△ △
Cu(OH)2=CuO+H2O Cu(OH)2+4NH3· H2O= [Cu(NH3)4](OH)2+4H2O
Cu2++2OH-=Cu(OH)2↓
Cu2++2OH-=Cu(OH)2↓
注意:(1)溶液中的Cu2+常为蓝色(浓CuCl2为绿色, 稀CuCl2为蓝色),可作为Cu2+的判断依据。
(2) Cu2+与碱反应生成蓝色沉淀Cu(OH)2, Cu(OH)2溶于氨水形成深蓝色溶液,这是鉴定 Cu2+的原理之一。无水CuSO4遇水变为蓝色, 生成CuSO4· 5H2O,可作为水的检验依据。
4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
思考: 1、实验中为什么要用新制的 硫酸亚铁溶液? 2、实验中为什么滴入经煮沸 的NaOH溶液? 3、实验中为什么要将滴管尖 端插入试管里溶液底部,慢慢 挤出NaOH溶液? 4、还可以采用什么方法和措 施以保证制得氢氧化亚铁?
3.制备 Fe(OH)2 常用的 3 种方法
反思归纳 防止 Fe(OH)2 氧化的方法 (1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。 (2)将盛有 NaOH 溶液的胶头滴管尖端插入试管中的亚铁盐溶液底部,并慢慢挤 出 NaOH 溶液。 (3)在亚铁盐溶液上面充入保护气,如 H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。
高中化学【铁、铜及其化合物】基础知识

高中化学【铁、铜及其化合物】基础知识一、铁及其化合物1. 知识网络构建2. 重要反应必练写出下列反应的方程式,是离子反应的写出离子方程式。
①Fe高温下和水蒸气的反应:________________________②Fe2O3和Al在高温下反应:_________________________③Fe2O3和CO的反应:_________________________________④Fe和过量稀HNO3的反应:_____________________________⑤过量铁粉和稀HNO3的反应:____________________________⑥FeCl3溶液和Cu的反应:____________________________⑦FeCl3溶液和KSCN溶液的反应:______________________⑧FeO和稀HNO3的反应:___________________________⑨Fe3O4和稀HCl的反应:_________________________⑩Fe3O4和稀HNO3的反应:___________________________⑪Fe(OH)2和稀HNO3的反应:____________________________⑫Fe(OH)2长时间置于空气中:__________________________⑬FeCl2溶液中通入Cl2:__________________________⑭FeCl2溶液中加入NaClO:__________________________⑮FeCl2溶液中加入等物质的量的Na2O2:______________⑯FeCl2溶液中加入HNO3:_________________⑰FeCl2溶液中加入酸性KMnO4溶液:______________________⑱Fe(OH)3与HI的反应:____________________________⑲Fe2(SO4)3溶液中通入SO2气体:_____________________⑳FeCl3溶液中通入H2S气体:_____________________○21FeI2和少量Cl2反应:_______________________○22FeI2和过量Cl2反应:______________________3. 实验现象强化记忆①铁丝在氧气中燃烧的现象___________________。
第12讲 铁铜及其化合物(讲义)(解析版)

第12讲 铁铜及其化合物一 铁的位置和物理性质1.铁及其化合物间的主线Fe―→⎩⎪⎨⎪⎧FeO Fe 2O 3Fe 3O 4―→⎩⎨⎧Fe OH2Fe OH 3―→⎩⎨⎧FeSO 4·7H 2OFeCl 32.铁及其化合物间的转化关系3.铁元素的变价 (1)单质铁①生成+2价:铁与S 、H +、Cu 2+、I 2等反应生成+2价。
如:Fe +SFeS 、Fe +Cu 2+===Fe 2++Cu 。
①生成+3价:铁与Cl 2、Br 2等反应生成+3价。
如2Fe +3Cl 2=====点燃2FeCl 3。
①生成+2、+3价:铁与H 2O 、O 2反应生成Fe 3O 4。
3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
①铁与HNO 3反应:当Fe 过量生成+2价,3Fe +8H ++2NO -3===3Fe 2++2NO +4H 2O ; 当Fe 不足时生成+3价,Fe +4H ++NO -3===Fe 3++NO +2H 2O 。
(2)铁的化合物:FeO 、Fe 3O 4、Fe 2O 3、Fe(OH)2、Fe(OH)3、Fe 2+、Fe 3+等。
+2价铁具有还原性,与强氧化性物如HNO 3、Cl 2等发生氧化还原反应: 如:3FeO +10HNO 3===3Fe(NO 3)3+NO +5H 2O 。
+3价铁具有氧化性,与强还原性物质, 如:HI 、Fe 、Cu 、I -、S 2-等发生氧化还原反应,如:Fe 2O 3+6HI===2FeI 2+I 2+3H 2O,2Fe 3++Cu===2Fe 2++Cu 2+。
特别强调:①Fe 与一般酸反应生成Fe 2+,与酸的量无关,但Fe 与稀HNO 3反应时最终铁的价态与铁的量有关。
①铁与硫蒸气反应生成的是FeS 而不是Fe 2S 3;铁与碘蒸气反应生成的是FeI 2而不是FeI 3。
4.铁的氧化物特别强调:①FeO 、Fe 3O 4、Fe 2O 3与硝酸反应时均生成Fe 3+。
铁和铜及其化合物

Fe 铜、铁及其化合物一、铁及其化合物1.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。
密度7.86 g/cm 3,熔沸点较高。
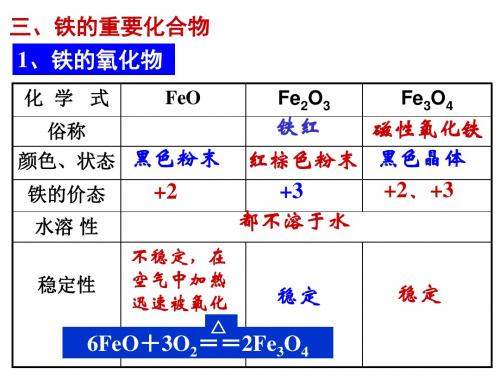
位置:第四周期,第Ⅷ 族 2.化学性质:(1)与非金属反应 Fe+S (I 2)FeS (FeI 2) 4Fe+3O 22Fe 3O 4 2Fe+3Cl 2(Br 2)2FeCl 3弱氧化剂 Fe 3+、H +、I 2、S 、铁后的金属阳离子(置换)… 强氧化剂 Cl 2、Br 2、HNO 3、浓H 2SO 4、MnO 4-(H +) … (2)与水反应 3Fe + 4H 2O(g)Fe 3O 4 + 4 H 2 ↑(置换)注意:铁在常温下不会和水发生反应,但在水和空气中O 2和CO 2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀) (3) 与酸反应a.与非氧化性酸反应 Fe +2H +== Fe 2++ H 2 b.与氧化性酸反应c.常温下,铁在冷浓硫酸,浓硝酸中发生钝化d.与浓硫酸反应:2Fe +6 H 2SO 4(浓)Fe 2(SO 4)3 +3SO 2 +6 H2Oe.与稀硝酸反应:①当Fe 少量时,离子方程式为:Fe + 4H ++ NO 3-== Fe 3++NO↑+2H 2O②当Fe 过量时,,离子方程式为:3Fe+8H ++2NO 3-== 3Fe 2++2NO↑+4H 2O ③当1:4<n( Fe) :n (HNO 3)<3:8 时,此情况下,Fe 3+和Fe 2+共存。
(4)与盐溶液反应:2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2++ Cu3.铁的氧化物FeO Fe 2O 3 Fe 3O 4 铁的化合价 +2 +3 +2、+3 颜色、状态黑色粉末红棕色粉末 黑色晶体 俗名 铁红 磁性氧化铁 水溶性 不溶于水 不溶于水 不溶于水氧化物类别碱性氧化物碱性氧化物Fe 2+Fe 3+与非氧化性酸反应FeO+2H + =Fe2+ +H2O Fe2O3+6H + =2Fe3+ +3H2O Fe3O4+8H + =2Fe3+ + Fe2++4H2O与还原剂反应(H2、CO、Al等) FeO+CO Fe+CO2Fe2O3+3CO2Fe+3CO23Fe3O4+8Al9Fe+4Al2O3用途用作红色油漆和涂料;赤铁矿是炼铁原料注:3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O4、铁的氢氧化物(1)Fe(OH)2的制备Fe(OH)2易被氧化,在制备时应注意:①FeSO4晶体中不能有 Fe3+;②配制后的FeSO4溶液中要加入少量铁粉;③配制溶液的蒸馏水以及所用NaOH溶液均须煮沸以除去其中溶解的氧气;实验:FeSO4溶液中加NaOH.①现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色②Fe2+容易被氧化,所以FeSO4溶液要新配制.③为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液.④为了防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.化学方程式: FeSO4 + 2NaOH = Fe(OH)2↓+Na2SO4 Fe2++ 2OH -= Fe(OH)2↓(白色)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(红褐色)(白色→灰绿色→红褐色)(2)Fe(OH)3的制备实验:FeCl3溶液中加NaOH溶液.①现象:生成红褐色沉淀②化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe2O3粉末.化学方程式: 2Fe(OH)3Fe2O3 +3H2O[小结]难溶性或微溶性的碱受热不稳定,容易分解。
专题4 第三单元 铁、铜及其化合物

10.铁与水蒸气反应,通常有以下两种装置,请回答下列问题:
装置一
装置二
(1)装置二中湿棉花的作用为_提__供__水__蒸__气___。
(2) 实 验 完 毕 后 , 取 出 装 置 一 的 少 量 固 体 , 溶 于 足 量 稀 盐 酸 , 再 滴 加 KSCN溶液,溶液颜色无明显变化,试解释原因:F__e3_O__4+__8_H__+_=_=_=_F_e_2_+_ _+__2_F_e_3_+_+__4_H_2_O_、__2_F_e_3_+_+__F_e_=_=_=_3_F__e2_+_(用离子方程式表示)。
该方法是先在装置Ⅰ中产生FeSO4溶液,并利用产生的H2排尽整个装置 中 的 空 气 , 待 检 验 H2 的 纯 度 后 , 再 关 闭 止 水 夹 K , 利 用 产 生 的 H2 把 FeSO4溶液压入装置Ⅱ中与NaOH溶液进行反应。
专题精练
1.用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用 不含O2的蒸馏水配制的NaOH溶液反应制备。 (1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_稀__硫__酸__、__铁__屑___。 (2)除去蒸馏水中溶解的O2常采用_加__热__煮__沸___的方法。 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液, 插 入 FeSO4 溶 液 液 面 下 , 再 挤 出 NaOH 溶 液 。 这 样 操 作 的 理 由 是 _避__免__生__成__的__F_e_(_O_H__)_2与__氧__气__接__触__而__被__氧__化__。
在少量Cl2中燃烧生成FeCl2 (4)Fe分别与氯气、盐酸反应得到相同
的氯化物 (5)Fe3O4中Fe的化合价有+2价和+3价,
三节铁铜及其化合物

现 变
象, 血
K
溶液变血红色
SC
N
溶 液
原 因
2Fe2++Cl2=2Fe3++2ClFe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
15
措施
Fe2+
Fe3+
滴加
现 象
生成白色絮状沉淀,迅 速转化为灰绿色,最终 变为红褐色
产生红褐色沉 淀
NaOH
溶液
原 Fe2++2OH-=Fe(OH)2↓ 因 4Fe(OH)2+O2+2H2O=
3
③铁与非氧化性酸(如盐酸)反应: Fe+2HCl=FeCl2+H2↑ , 常 温 下 遇 浓 H2SO4 、 浓HNO3会发生钝化作用,加热时会剧烈反 应,但不会有H2产生。
④铁与某些盐溶液反应: Fe+CuSO4=FeSO4+Cu;Fe+2FeCl3=3FeCl2 。
*⑤铁与水蒸气旳反应:
高温
第三节 铁、铜及其化合物
1
基础知识回忆
一、铁
1.铁在地壳中旳含量仅次于铝,主要以化 合态形式存在(除陨铁)。我国在商代开始使用铁, 在春秋早期我国已掌握冶铁技术。铁位于元素 周期表中第四面期,第Ⅷ族。铁原子在化学反 应中轻易失去2个或3个电子,所以,铁旳常见 化合价是+2价和+3价。其化合物及其水溶液往 往带有颜色。
氢氧化铁
Fe(OH)3 红棕色固体, 不溶于水
Fe(OH)3+△3H+=Fe3++3H2O
2Fe(OH)3=Fe2O3+3H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁及其化合物知识点一.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。
密度7.86 g/cm3,熔沸点较高。
位置:第四周期,第Ⅷ族二.化学性质:1.与非金属反应1)Fe+S(I2)FeS(FeI2) 2)4Fe+3O22Fe3O4 3)2Fe+3Cl2(Br2)2FeCl3弱氧化剂Fe3+、H+、I2、S、铁后的金属阳离子(置换)…Fe2+Fe3+2.与水反应3Fe + 4H2O(g) Fe3O4 + 4 H2↑(置换)注意:铁在常温下不会和水发生反应,但在水和空气中O2和CO2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀)3 与酸反应1)与非氧化性酸反应 Fe +2H+== Fe2+ + H22)与氧化性酸反应a)常温下,铁在冷浓硫酸,浓硝酸中发生钝化b)与浓硫酸反应:2Fe +6 H2SO4(浓)Fe2(SO4)3 +3SO2↑ +6 H2Oc)与稀硝酸反应:①当Fe少量时,离子方程式为:Fe + 4H+ + NO3-== Fe3++NO↑+2H2O②当Fe过量时,,离子方程式为:3Fe+8H++2NO3-== 3Fe2++2NO↑+4H2O③当1:4<n( Fe) :n (HNO3)<3:8 时,此情况下,Fe3+ 和Fe2+共存。
4.与盐溶液反应2Fe 3++ Cu = 2Fe 2++ Cu 2+Fe + 2Fe3+ = 3 Fe2+Fe + Cu2+ = Fe2+ + Cu三、铁的化合物Fe+CO+3CO+8Al注:3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O2、铁的氢氧化物(1)Fe(OH)2的制备Fe(OH)2易被氧化,在制备时应注意:⑴ FeS O4晶体中不能有 Fe3+;⑵配制后的FeSO4溶液中要加入少量铁粉;⑶配制溶液的蒸馏水以及所用NaOH溶液均须煮沸以除去其中溶解的氧气;实验:FeSO4溶液中加NaOH.①现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色②Fe2+容易被氧化,所以FeSO4溶液要新配制.③为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液.④为了防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.化学方程式: FeSO4 + 2NaOH = Fe(OH)2↓+Na2SO4 Fe2++ 2OH -= Fe(OH)2↓(白色)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(红褐色)(白色→灰绿色→红褐色)(2)Fe(OH)3的制备实验:FeCl3溶液中加NaOH溶液.①现象:生成红褐色沉淀②化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe2O3粉末.化学方程式: 2Fe(OH)3Fe2O3 +3H2O[小结]难溶性或微溶性的碱受热不稳定,容易分解。
生成相应的氧化物和水(3)Fe(OH)3胶体的制备向加热沸腾的蒸馏水中加入FeCI3溶液,待出现红褐色时,停止加热,便可得到 Fe(OH)3胶体。
制备时要注意:⑴不可长时间加热,因为加热会使胶体凝聚;⑵不能用自来水,因为自来水中的电解质也可使胶体凝聚。
四.铁的两种氢氧化物的比较化学式Fe(OH)2Fe(OH)3与非氧化性酸的反应Fe(OH)2+H2SO4=FeSO4+2H2OFe(OH)2+2H + =Fe2+ +2H2O2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2OFe(OH)3+3H + =Fe3+ +3H2O与氧化性酸的反应3Fe(OH)2+10HNO3(稀)=3Fe(NO3)3+NO↑+8H2O3Fe(OH)2+10H + +NO3 -=3Fe 3+ +NO↑+8H2OFe(OH)3+3HNO3(稀)=Fe(NO3)3+3H2OFe(OH)3+3H+=Fe3++3H2O与还原性酸的反应Fe(OH)2+2HI=FeI2+2H2OFe(OH)2+2H+ =Fe2++2H2O2Fe(OH)3+6HI=2FeI2+6H2O+I22Fe(OH)3+6H + +2I-=2Fe2++6H2O+I2热稳定性分解产物复杂2Fe(OH)3Fe2O3 +3H2O 五.铁盐和亚铁盐(1)Fe3+、Fe2+的检验:Fe3+的检验: 1.Fe3+盐溶液中滴加KSCN溶液。
现象是溶液变红色,反应方程式:FeCl3+3KSCN= Fe(SCN)3+3KClFe 3++3SCN -= Fe(SCN)3(红色)2.向Fe3+盐溶液中滴加NaOH溶液。
现象是产生红褐色沉淀,反应方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaClFe 3++ 3OH -= Fe(OH)3↓(红褐色)Fe2+的检验: ①向Fe2+盐溶液中滴加KSCN溶液,再滴加氯水(硝酸、H2O2等)。
现象是先无现象,加氯水后溶液呈红色反应方程式:2FeCl2+Cl2=2FeCl3 FeCl3+3KSCN= Fe(SCN)3+3KCl②向Fe2+盐溶液中滴加NaOH溶液。
现象是产生白色沉淀迅速转变为灰绿色,最后变成红褐色沉淀反应方程式:FeCl2+2NaOH= Fe(OH)2↓+2NaCl4Fe(OH)2+O2+2H2O=4Fe(OH)3(红褐色)(2)Fe3+的氧化性、Fe2+的还原性①Fe3+的氧化性:向FeCl3溶液中加入铁粉,现象是溶液由棕黄色变为浅绿色化学反程式2FeCl3+Fe=2FeCl2 对应离子方程式:2Fe3+(棕黄色)+Fe=3Fe2+(浅绿色)Fe3+还可以与Cu、HI、H2S等反应2FeCl3+Cu=2FeCl2+CuCl2对应离子方程式:2Fe 3++ Cu = 2Fe 2++ Cu 2+2FeCl3+2HI=2FeCl2+2HCl+ I2对应离子方程式:2Fe 3++ 2I- =2Fe 2+ + I22FeCl3+H2S=2FeCl2+2HCl+S↓对应离子方程式:2Fe 3++ H2S =2Fe 2++2H + + S↓②Fe2+的还原性:Fe2+在较强的氧化剂的作用下会被氧化为Fe3+向FeCl2溶液中通入氯气,现象是溶液由浅绿色变为棕黄色化学反程式:2FeCl2+Cl2=2FeCl3对应离子方程式:2Fe2++Cl2= 2Fe3++2Cl-除杂: FeCl3(FeCl2) 滴加氯水 FeCl2 (FeCl3) 加入铁粉(3).亚铁盐、铁盐溶液的保存⑴FeCI2、FeSO4等亚铁盐溶液保存时,要加入少量铁屑(防止 Fe2+被氧化)和滴入少量相应的酸溶液 ( 抑制 Fe2+水解) 。
另外要注意,保存 Fe(NO3)2溶液时,只要加铁屑防止氧化即可,不能加HNO3来防止水解。
⑵ FeCl3、Fe2(SO4)3等铁盐溶液保存时,要加少量相应的酸溶液(抑制Fe3+水解)。
(4).Fe3+盐的水解Fe3+为典型的弱碱阳离子,通常情况下,在水溶液中只有少部分发生水解。
但在一定条件(如加热,遇AlO2-、CO32-、CIO-等)下,水解程度会增大,甚至会发生彻底的双水解。
如:Fe3+ +3AlO2-+6H2O == Fe(OH)3↓+3AI(OH)3↓2Fe3+ +3CO32-+3H2O == 2Fe(OH)3↓+3CO2↑Fe3+ +3ClO-+3H2O == Fe(OH)3↓+3HCIO另外,加热并蒸干FeCI 3的水溶液,由于 FeCl3+3H2O Fe(OH)3+3HCl为一吸热反应,且 HCl 易挥发,加热会使平衡不断向右移动,FeCl 3最终变成 Fe(OH)3,再灼烧,2Fe(OH)3Fe2O3+3H2O,最后留下的物质为 Fe2O3。
而加热并蒸干 Fe2(SO4)3的水溶液,由于Fe2(SO4)3水解产生的 H2S04难挥发,加热不会使平衡不断右移,只能使水份减少,酸度增强,最后仍留下Fe2(SO4)3。
(5):FeSO4溶液是否变质的检验⑴加KSCN溶液不变红,另取样再加酸性KMnO4溶液紫色褪色,说明未变质。
⑵加KSCN溶液变红,另取样再加酸性KMnO4溶液紫色褪色,说明部分变质。
⑶加KSCN溶液变红,另取样再加酸性KMnO4溶液紫色不褪色,说明全部变质。
六.钢铁的腐蚀钢铁在潮湿的空气中发生电化腐蚀时,负极为铁,正极为碳,电解质溶液为溶有O2或 CO2等气体的水膜。
当水膜呈弱酸性或中性时发生吸氧腐蚀,负极反应为 Fe-2e-==Fe2+,正极反应为 2H2O +O2+4e-==4OH-;当水膜呈酸性时发生析氢腐蚀,负极反应为Fe-2e-==Fe2+,正极反应为 2H+ +2e-==2H2↑。
钢铁的电化学腐蚀以吸氧腐蚀为主。
铁锈的形成:Fe2++2OH-== Fe(OH)2↓,4Fe(OH)2+2H2O+O2==4Fe(OH)3↓,红褐色的Fe(OH)3失去部分水便得到铁锈(Fe2O3·nH2O) 。
也可表示成4Fe+3O2+nH2O == 2Fe2O3·nH2O。
铜的知识点整理一.铜:1)物理性质:颜色:红色(紫红色)金属,质软,密度:8.92g/cm3,熔点:1083OC 沸点:2582OC导电性:热和电的良导体(仅次于Ag)位置:第四周期第IB族2).化学性质:价态:+1(不稳定) +2(稳定)1.与某些非金属单质反应:(1)与氧气反应:2Cu + O22CuO(2)与硫反应:2Cu + S Cu2S (黑色物质)(3)与氯气反应:Cu + Cl2 CuCl2棕黄色的烟2、与酸反应:(非氧化性酸不反应)Cu + 2H2SO4(浓)CuSO4+SO2↑+2H2OCu + 4HNO3(浓) = Cu(NO3)2 + 2 NO2↑ + 2H2O3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2 NO ↑ + 4H2O3、与某些盐反应:Cu + 2AgNO3 = Cu(NO3)2 + 2 Ag 2FeCl3 + Cu = 2FeCl2 + CuCl2(完成离子方程式)4、其他的反应:2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3铜锈(铜绿)二铜的氧化物:CuO(黑色),Cu2O(红色)(1). 与酸反应:CuO + H2SO4 = CuSO4 + H2O Cu2O + H2SO4 = CuSO4 + Cu + H2O(2). 与还原性物质(如H2、CO、C等)反应:CuO + C(CO、 H2) = Cu + CO(CO2、H2O)三. 铜的氢氧化物及其反应Cu(OH)2: 蓝色物质,不溶性弱碱,(1). 与酸反应Cu(OH)2 + H2SO4 = CuSO4 + 2H2O(2). 受热分解(是难溶碱的共性)Cu(OH)2 CuO + H2O3)、弱氧化性:与新制氢氧化铜悬浊液反应配制新制的Cu(OH)2悬浊液:2ml 10%NaOH + 2%CuSO44~8滴蓝色絮状沉淀0.5ml乙醛、加热红色沉淀Cu2OCH3CHO+2Cu(OH)2△ CH3COOH+Cu2O↓+2H2O四. 铜盐及其反应(1). 碱式碳酸铜(铜绿)受热分解(2). 蓝色的 CuSO4溶液中通入H2S 气体,产生黑色沉淀。
