2015年高考化学真题汇编专题4:离子反应和离子方程式
(化学)高考化学离子反应真题汇编(含答案)

(化学)高考化学离子反应真题汇编(含答案)一、高中化学离子反应1.向含有FeBr 2溶液中通入一定量的Cl 2(还原性:Fe 2+>Br -),表示该反应的离子方程式肯定错误的是( ) A .2Fe 2++Cl 2=2Fe 3++2Cl -B .10Fe 2++2Br -+6Cl 2=10Fe 3++Br 2+12Cl -C .2Br -+Cl 2=Br 2+2Cl -D .2Fe 2++4Br -+3Cl 2=2Br 2+2Fe 3++6Cl - 【答案】C 【解析】 【分析】还原性:Fe 2+>Br -,则向含有FeBr 2溶液中通入一定量的Cl 2时,氯气先与Fe 2+反应,后与Br -反应。
【详解】A .当通入少量的氯气时,氯气只与亚铁离子反应,其反应的离子方程式为2Fe 2++Cl 2=2Fe 3++2Cl -,故A 正确;B .当溴化亚铁与氯气5:3反应时,其反应的离子方程式为10Fe 2++2Br -+6Cl 2=10Fe 3++Br 2+12Cl -,故B 正确;C .由分析可知,氯气先与亚铁离子反应,所以离子方程式中一定有亚铁离子参与,故C 错误;D .当通入过量氯气时,氯气能将亚铁离子和溴离子都氧化,反应的离子方程式为2Fe 2++4Br -+3Cl 2=2Br 2+2Fe 3++6Cl -,故D 正确; 综上所述,答案为C 。
2.X 溶液中含有下表所示离子中的某5种,且其离子浓度均为10.1mol L -⋅(不考虑水的电离和离子水解)。
向X 溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。
下列叙述错误的是( )A .原溶液中一定含有2Mg +B .X 溶液中不可能含有3HCO -和23CO -C .X 溶液中含有3种阳离子、2种阴离子D .生成气体的离子反应方程式为23323Fe NO 4H 3Fe NO 2H O +-++++=+↑+【答案】C【分析】各种离子的物质的量浓度均为0.1mol/L ,向溶液X 中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化,产生气体不可能是二氧化碳,则不含OH -、HCO 3-和CO 32-;根据表中的离子,可推知是Fe 2+、NO 3-在酸性环境下生成的一氧化氮,加入盐酸,生成气体的离子反应方程式为23323FeNO 4H 3Fe NO 2H O +-++++=+↑+,NO 3-反应后有剩余,故溶液中阴离子种类不变,所以原来溶液中含有Cl ﹣。
2015年高考化学分类汇编-离子反应

离子反应北京卷.2015.T11、某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理...的是(已知:饱和NaClO溶液的pH约为11)A、该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=== Cl-+ ClO-+ H2OB、该消毒液的pH约为12:ClO-+ H 2O HClO+ OH-C、该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2OD、该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—【答案】B【解析】此题考查离子方程式书写知识。
A是漂白液的制取, A 正确。
B中饱和NaClO溶液的 pH 约为 11,而该消毒液的 pH 约为 12,其碱性应为氢氧化钠导致,错误。
C中考查的是氧化还原方程式的书写,正确。
D考查的是漂白粉起漂白作用的原理,应用的是较强酸制取较弱酸,正确。
天津卷.2015.T8.下列关于物质或离子检验的叙述正确的是A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2【答案】B【解析】A项,Fe2+遇KSCN无变化,因此无法判断有无Fe2+,故错误; B项,无水硫酸铜遇水蒸气变蓝,这是无水硫酸铜的特征颜色变化,因此选项正确;C项,K+的焰色反应只有透过蓝色的钴玻璃,观察有无紫色才能判断是否含有K+,故错误;D项,SO2、CO2通过澄清石灰水,溶液都可以变浑浊,选项以偏概全,故错误。
安徽卷.2015.T 10.下列有关NaClO 和NaCl 混合溶液的叙述正确的是:A .该溶液中,H +、NH 4+、SO 42-、Br -可以大量共存B .该溶液中,Ag +、K +、NO 3-、CH 3CHO 可以大量共存C .向该溶液中滴入少量FeSO 4溶液,反应的离子方程式为:2Fe 2++ClO -+2H +=== Cl -+2Fe 3++H 2OD .向该溶液中加入浓盐酸,每产生1molCl 2,转移电子约为6.02×1023个【答案】D【解析】答案选择D 。
2015高考化学真题汇编_水溶液中的离子平衡
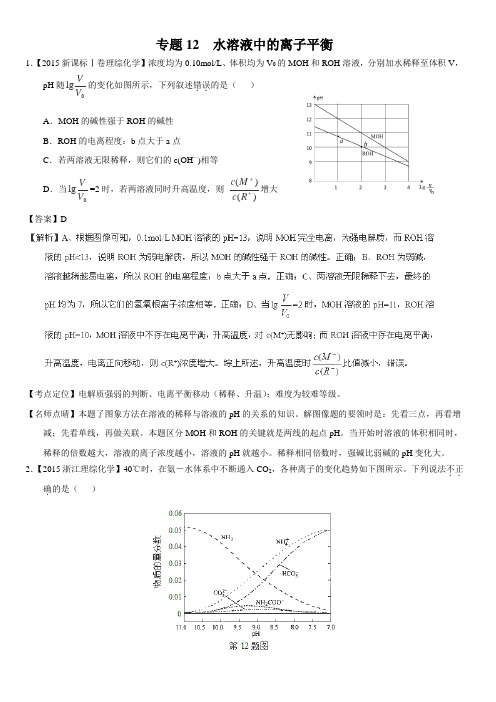
专题12 水溶液中的离子平衡1.【2015新课标Ⅰ卷理综化学】浓度均为0.10mol/L 、体积均为V 0的MOH 和ROH 溶液,分别加水稀释至体积V ,pH 随0lg V V 的变化如图所示,下列叙述错误..的是( )A .MOH 的碱性强于ROH 的碱性B .ROH 的电离程度:b 点大于a 点C .若两溶液无限稀释,则它们的c(OH -)相等 D .当0lg V V =2时,若两溶液同时升高温度,则 )()(++R c M c 增大 【答案】D【考点定位】电解质强弱的判断、电离平衡移动(稀释、升温);难度为较难等级。
【名师点晴】本题了图象方法在溶液的稀释与溶液的pH 的关系的知识。
解图像题的要领时是:先看三点,再看增减;先看单线,再做关联。
本题区分MOH 和ROH 的关键就是两线的起点pH 。
当开始时溶液的体积相同时,稀释的倍数越大,溶液的离子浓度越小,溶液的pH 就越小。
稀释相同倍数时,强碱比弱碱的pH 变化大。
2.【2015浙江理综化学】40℃时,在氨-水体系中不断通入CO 2,各种离子的变化趋势如下图所示。
下列说法不正..确.的是( )A .在pH =9.0时,c (NH 4+)>c (HCO ˉ3)>c (NH 2COOˉ)>c (CO 32-) B .不同pH 的溶液中存在关系:c (NH 4+)+c (H +)=2c (CO 32-)+c (HCO 3-)+c (NH 2COOˉ)+c (OHˉ) C .随着CO 2的通入,c(OHˉ)c(NH 3·H 2O)不断增大 D .在溶液中pH 不断降低的过程中,有含NH 2COOˉ的中间产物生成【答案】C【解析】A 、在pH =9.0时,作直线垂直于横坐标,从图上可直接看得出:c (NH 4+)>c (HCO ˉ3)>c (NH 2COOˉ)>c (CO 32-),A 正确;B 、根据电荷守恒可得:c (NH 4+)+c (H +)=2c (CO 32-)+c (HCO 3-)+c (NH 2COOˉ)+c (OHˉ),B 正确;C 、c(OHˉ)c(NH 3·H 2O)=43244()()()()()b K c OH c NH c NH H O c NH c NH -+++⨯=⋅⨯,K b 不变,c (NH 4+)不断增大,则比值不断减小,C 不正确;D 、从图上看,pH 降低过程中,有含NH 2COOˉ的中间产物生成,D 正确。
高考试题汇编——离子反应

高考化学试题汇编——离子反应1.(2015·四川卷)下列有关CuSO4溶液的叙述正确的是A.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存B.通入CO2气体产生蓝色沉淀C.与H2S反应的离子方程式:Cu2++ S2- = CuS↓D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O = Cu(OH)2↓+2NH4+2.(2015·江苏卷)下列指定反应的离子方程式正确的是A.氯气溶于水:Cl2+H2O = 2H++Cl-+ClO-B.Na2CO3溶液中CO32-的水解:CO32-+H2O = HCO3-+OH-C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2OD.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O 3.(2015·北京卷)某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理...的是(已知:饱和NaClO溶液的pH约为11)A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-= Cl-+ ClO-+ H2OB.该消毒液的pH约为12:ClO-+ H 2O HClO+ OH-C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO-4.(2015·山东卷)下列表示对应化学反应的离子方程式正确的是:A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32-+ SO2+ H2O=H2SiO3↓+SO32-C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=[Al(OH)4]-+4NH4+D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑5.(2014·四川卷)能正确表示下列反应的离子方程式是:A.Cl2通往NaOH溶液中:Cl2+OH-=Cl-+ClO-+H2OB.NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2OC.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2OD.Cu溶液于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O6.(2014·上海卷)向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸。
专题04 离子反应 三年(2015-2017)高考化学真题分项版解析(解析版)

1.【2017江苏卷】下列指定反应的离子方程式正确的是A.钠与水反应:Na +2H2O Na++2OH– + H2↑B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O H2↑+Cl2↑+2OH–C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + BaSO4↓+H2OD.向碳酸氢铵溶液中加入足量石灰水:Ca2+++OH–CaCO 3↓+H2O【答案】B【名师点睛】判断指定反应的离子方程式是否正确,通常从以下几个方面进行:①从反应原理进行判断,如反应是否能够发生、反应能否生成所给产物、反应是否可逆等。
②从物质存在形态进行判断,如电解质的拆分是否正确、是否正确表示了难溶物和气体等。
③从守恒角度进行判断,如是否遵循电荷守恒、质量守恒、氧化还原反应中电子转移守恒等。
④从反应条件进行判断,如是否标注了必要的条件,是否关注了反应物的量对参加反应的离子种类及其反应产物的影响(如本题D选项中的足量石灰水)等。
⑤从反应物的组成及反应物之间的配比进行判断,如本题中C选项硫酸和氢氧化钡分别为二元酸和二元碱。
2.【2017江苏卷】常温下,下列各组离子在指定溶液中能大量共存的是A.无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–B.=1×10 −12的溶液中:K+、Na +、、C.c(Fe2+) =1 mol·L−1的溶液中:K+、、、D.能使甲基橙变红的溶液中:Na+、、、【答案】B【解析】A.Fe3+和SCN−会发生反应生成血红色的配合物,A错误;B.根据K W可以求出c(OH−)=0.1mol/L,溶液显碱性,这4种离子可以大量共存,B正确;C.Fe2+还原性较强,氧化性较强,两者因发生氧化还原反应而不能大量共存,C错误;D.使甲基橙变红的溶液显酸性,不能在酸性溶液中大量共存,D错误。
【名师点睛】本题考查学生对溶液中离子的性质和离子反应的实质的认识,并将其应用到具体情境中分析问题、解决问题。
2015年高考化学真题分项解析专题03《离子反应》

专题03 离子反应1.【2015天津理综化学】下列关于物质或离子检验的叙述正确的是()A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2【答案】B【解析】A项Fe3+遇KSCN会使溶液呈现红色,Fe2+遇KSCN不反应无现象,如果该溶液既含Fe3+,又含Fe2+,滴加KSCN 溶液,溶液呈红色,则证明存在Fe3+但并不能证明无Fe2+,故A项错误;B项气体通过无水硫酸铜,粉末变蓝,则发生反应:CuSO4+5H2O═CuSO4·5H2O,CuSO4·5H2O为蓝色,故可证明原气体中含有水蒸气,B项正确;C项灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,Na+颜色反应为黄色,但并不能证明无K+,因为黄光可遮住紫光,故K+颜色反应需透过蓝色的钴玻璃滤去黄光后观察,故C项错误;D项能使澄清石灰水变浑浊的气体有CO2、SO2等,故将气体通入澄清石灰水,溶液变浑浊,则原气体比一定是CO2,D项错误;本题选B。
【考点定位】本题主要考查了常见物质、离子的检验,设计铁离子、水、钠离子、钾离子、二氧化碳气体。
【名师点睛】Fe3+与KSCN溶液的反应、Fe2+的检验、二者同时存在的检验,CuSO4固体与CuSO-4▪5H2O的颜色区别、水的检验,钠离子、钾离子的焰色反应的应用、检验时操作的异同,二氧化碳的检验、二氧化碳与澄清石灰水的化学方程式、现象的判断,注意在进行物质或离子的检验或鉴别时,现象与结论的对应关系的描述,不同操作的关键点,使学生着重记忆物质的性质的本质区别,学会利用物质的性质分析检验的方案及现象。
【注】本题分类与专题3、52.【2015四川理综化学】下列有关CuSO4溶液的叙述正确的是()A.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存B.通入CO2气体产生蓝色沉淀C.与H2S反应的离子方程式:Cu2++ S2-=CuS↓D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+【答案】A3.【2015山东理综化学】下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32—C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=[Al(OH)4]—+4NH4+D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑【答案】D【解析】A、稀硝酸与Na2SO3发生氧化还原反应,生成SO42‾、NO和H2O,错误;B、过量的SO2与Na2SiO3溶液反应生成HSO3‾,错误;C、Al(OH)3不与弱碱反应,所以Al2(SO4)3与过量氨水反应生成Al(OH)3,错误;D、Na2O2与H2O反应生成NaOH和O2,NaOH与CuSO4反应生成Cu(OH)2和Na2SO4,两个方程式加和可得离子方程式,正确。
2015年全国各地高考化学试题汇编考点3 离子反应

考点3 离子反应选择题1.(2015·安徽高考·10)下列有关NaClO和NaCl混合溶液的叙述正确的是( )A.该溶液中,H+、N、S、Br-可以大量共存B.该溶液中,Ag+、K+、N、CH 3CHO可以大量共存C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为2Fe2++ClO-+2H+Cl-+2Fe3++H2OD.向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个【解题指南】解答本题时应注意以下3点:(1)NaClO有氧化性、水溶液呈碱性;(2)CH3CHO有还原性;(3)浓盐酸与NaClO发生归中反应。
【试题解析】选D。
A项,H+与ClO-反应生成弱酸HClO而不能共存;B项,NaClO 可氧化CH3CHO,Ag+与Cl-反应生成AgCl沉淀而不能共存;C项,NaClO溶液呈碱性,而FeSO4少量,故离子方程式为6Fe2++3ClO-+3H2O3Cl-+4Fe3++2Fe(OH)3↓,错误;D项,发生的反应是Cl-+ClO-+2H+Cl2↑+H2O,故每生成1 mol Cl2,转移电子1 mol,正确。
【误区提醒】离子方程式书写的误区:(1)主观臆断,不符合客观事实:如本题的C项;(2)方程式等号两边物质的质量或电荷不守恒;(3)对三种状态(难溶解、易挥发、难电离)的物质错判或遗漏,将不该拆的弱电解质或难溶物写成了离子符号,而该拆的可溶性强电解质未拆写成离子符号。
2.(2015·山东高考·12)下列表示对应化学反应的离子方程式正确的是( )A.向稀HNO3中滴加Na2SO3溶液:S+2H+SO 2↑+H2OB.向Na2SiO3溶液中通入过量SO2:Si+SO 2+H2O H2SiO3↓+SC.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH 3·H2O[Al(OH)4]-+4ND.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O4Na++2Cu(OH)2↓+O2↑【解题指南】解答本题注意以下3点:(1)硝酸无论浓稀均具有强氧化性;(2)过量的二氧化硫会生成酸式盐;(3)Al(OH)3只能溶解在强碱中。
2015-2021全国化学高考真题 离子共存、离子反应

2015-2021全国化学高考真题离子共存、离子反应一、单选题1.下列过程中的化学反应,相应的离子方程式正确的是()A. 用碳酸钠溶液处理水垢中的硫酸钙:CO32−+CaSO4=CaCO3+SO42−B. 过量铁粉加入稀硝酸中:Fe+4H++NO3−=Fe3++NO↑+2H2OC. 硫酸铝溶液中滴加少量氢氧化钾溶液:Al3++4OH−=AlO2−+2H2OD. 氯化铜溶液中通入硫化氢:Cu2++S2−=CuS↓2.常温下,下列各组离子在给定溶液中能大量共存的是()A. pH=1的溶液:Fe2+、Mg2+、SO42−、NO3−B. pH=12的溶液:K+、Na+、NO3−、CO32−C. pH=7的溶液:Na+、Cu2+、S2−、Cl−D. pH=7的溶液:Al3+、K+、Cl−、HCO3−3.不能正确表示下列变化的离子方程式是()A. 碳酸镁与稀盐酸反应:+=+OB. 亚硫酸氢钠的水解:+O+C. 锌溶于氢氧化钠溶液:Zn++O=+个D. 亚确酸钠与氯化铵溶液受热反应:+个+O4.宏观辨识与微观探析是化学学科核心素养之一。
下列物质性质实验对应的反应方程式书写正确的是()A. Na2O2放入水中:Na2O2+H2O=2NaOH+O2↑B. H2O(g)通过灼热铁粉:3H2O+2Fe=Fe2O3+3H2C. 铜丝插入热的浓硫酸中:Cu+H2SO4=CuSO4+H2↑D. SO2通入酸性KMnO4溶液中:5SO2+2H2O+2MnO4−=5SO42−+4H++2Mn2+5.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是()粒子组判断和分析A Na+、Al3+、Cl−、NH3⋅H2O不能大量共存,因发生反应:Al3++4NH3⋅H2O=AlO2−+4NH4++2H2OB H+、K+、S2O32−、SO42−不能大量共存,因发生反应:2H++S2O32−=S↓+SO2↑+H2OC Na+、Fe3+、SO42−、H2O2能大量共存,粒子间不反应D H+、Na+、Cl−、MnO4−能大量共存,粒子间不反应A. AB. BC. CD. D6.对于下列实验,不能正确描述其反应的离子方程式是()A. 向氢氧化钡溶液中加入盐酸:H++OH−=H2OB. 向硝酸银溶液中滴加少量碘化钾溶液:Ag++I−=AgI↓C. 向烧碱溶液中加入一小段铝片:2Al+2OH−+6H2O=2[Al(OH)4]−+3H2↑D. 向次氯酸钙溶液中通入少量二氧化碳气体:ClO−+CO2+H2O=HClO+HCO3−7.某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四、离子反应和离子方程式
∙(2015北京11)某消毒液的主要成分为NaClO,还含有一定量的NaOH。
下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)()
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
B.该消毒液的pH约为12:ClO-+H 2O HClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-=Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO-
∙(2015安徽10)下列有关NaClO和NaCl混合溶液的叙述正确的是:
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
∙(2015海南6)己知在碱性溶液中可发生如下反应:
2R(OH)3 + 3C1O- + 4OH-= 2RO4n-+3Cl-+5H2O。
则RO4n-中r 的化合价是
A.+3 B.+4 C.+5 D.+6
∙(2015广东8)水溶液中能大量共存的一组离子是
A.、、、B.、、、
C.、、、D.、、、
∙(2015山东12)下列表示对应化学反应的离子方程式正确的是:
A、向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2O
B、向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32—
C、向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=[Al(OH)4]—+4NH4+
D、向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
∙(2015江苏9)下列指定反应的离子方程式正确的是()
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
∙(2015天津2)下列关于物质或离子检验的叙述正确的是
∙在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
∙气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气∙灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
∙将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2。
