最新盐类的水解知识点
盐类的水解知识点
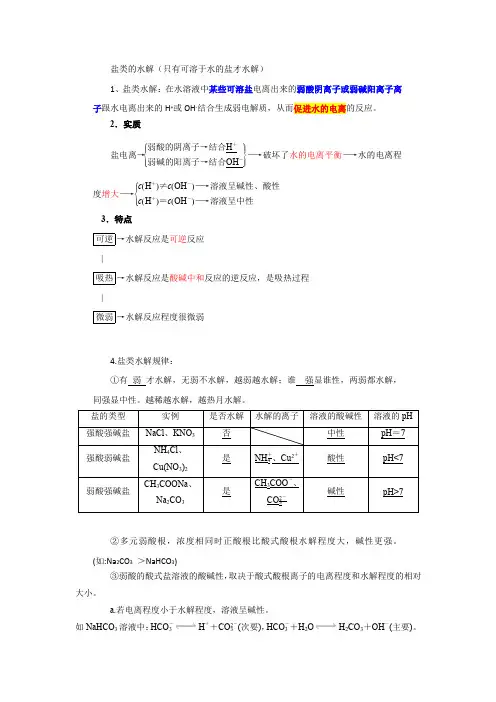
盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中某些可溶盐电离出来的弱酸阴离子或弱碱阳离子离子跟水电离出来的H +或OH -结合生成弱电解质,从而促进水的电离的反应。
2.实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→⎩⎪⎨⎪⎧c (H +)≠c (OH -)―→溶液呈碱性、酸性c (H +)=c (OH -)―→溶液呈中性 3.特点可逆→水解反应是可逆反应 |吸热→水解反应是酸碱中和反应的逆反应,是吸热过程 |微弱→水解反应程度很微弱4.盐类水解规律:①有 弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
越稀越水解,越热月水解。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na 2CO 3 >NaHCO 3)③弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
a.若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中:HCO -3H ++CO 2-3(次要),HCO -3+H 2O H 2CO 3+OH -(主要)。
b.若电离程度大于水解程度,溶液显酸性。
如NaHSO3溶液中:HSO-3H++SO2-3(主要),HSO-3+H2O H2SO3+OH-(次要)。
(目前必须知道HC2O4-、HSO-3、HPO32—和H2PO4—的电离大于水解)5.表示方法——水解的离子方程式(1)一般盐类水解程度很小,水解产物很少,在书写盐类水解方程式时要用“”号连接。
盐类水解一般不会产生沉淀和气体,所以不用“↓”或“↑”表示水解产物(双水解例外)。
不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
如:Cu(NO3)水解的离子方程式为Cu2++2H2O Cu(OH)2+2H+。
NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。
盐类的水解知识点

• 2.影响盐类水解的因素•(1)内因•盐本身的性质是决定盐水解程度大小的主要因素,组成盐的酸根相对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大。
•(2)外因•①温度•盐的水解是吸热反应,因此升高温度,水解程度增大。
•②浓度•盐的浓度越小,电解质离子相互碰撞结合成电解质“分子”的几率越小,水解程度越大。
•③外加酸碱:促进或抑制盐的水解,例如:•CH3COONa溶液中加强酸,盐的水解程度增大,加强碱,盐的水解程度减小。
•④外加盐•a.加入水解后酸碱性相反的盐,盐的水解互相促进;加入水解后酸碱性相同的盐、盐的水解互相抑制。
•b.加入不参加水解的固态盐,对水解平衡无影响;加入不参加水解的盐溶液,相当于对原盐溶液稀释,盐的水解程度增大。
• 1.盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4溶液蒸干得CuSO4固体;盐溶液水解生成易挥发性酸时,蒸干后一般得对应的弱碱,如AlCl3、FeCl3溶液蒸干后一般得Al(OH)3、Fe(OH)3。
•2.考虑盐受热时是否分解•因为Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干Ca(HCO3)2溶液得到CaCO3固体;蒸干NaHCO3溶液得到Na2CO3固体;蒸干KMnO4溶液得到K2MnO4和MnO2的混合物;蒸干NH4Cl溶液不能得到固体。
3.还原性盐在蒸干时会被O2氧化•例如,Na2SO3溶液蒸干会得到Na2SO4;FeSO4溶液蒸干会得到Fe2(SO4)3和Fe(OH)3的混合物。
•4.有时要从多方面考虑。
例如,蒸干NaClO溶液时,既要考虑ClO-水解,又要考虑HClO分解,所以蒸干NaClO溶液所得到的固体为NaCl。
高二化学第二册第三章盐类的水解知识点

高二化学第二册第三章盐类的水解知识点一、盐类的水解:盐类实例能否水解引起水解的离子对水的电离平衡的影响溶液的酸碱性强碱弱酸盐 CH3COONa 能弱酸阴离子促进水的电离碱性强酸弱碱盐 NH4Cl 能弱碱阳离子促进水的电离酸性强酸强碱盐 NaCl 不能无无中性1、定义:在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程。
2、实质:弱电解质的生成,破坏了水的电离,促进水的电离平衡的过程。
3、规律:有弱才水解、都弱都水解、越弱越水解、谁强显谁性。
即盐的构成中出现弱碱阳离子或弱酸根阴离子,该盐就会水解;这些离子对应的碱或酸越弱,水解程度越大,溶液的pH变化越大;水解后溶液的酸碱性由构成该盐离子对应的酸和碱相对强弱决定,酸强显酸性,碱强显碱性。
4、特点:①水解反应和中和反应处于动态平衡,水解进行程度很小。
②水解反应为吸热反应。
③盐类溶解于水,以电离为主,水解为辅。
④多元弱酸根离子分步水解,以第一步为主。
5、盐类水解的离子反应方程式因为盐类的水解是微弱且可逆的,在书写其水解离子反应方程式时应注意以下几点:(1)应用“ ”号表示,(2)一般生成物中不出现沉淀和气体,因此在书写水解离子方程式时不标“darr;”“uarr;”(3)多元弱酸根的水解分步进行且步步难,以第一步水解为主。
二、影响水解平衡的因素影响水解平衡进行程度最主要因素是盐本身的性质。
外界条件对平衡移动也有影响,移动方向应符合勒夏特列原理,下面以NH4+水解为例:NH4++H2ONH3?H2O+H+进行说明1、温度:水解反应为吸热反应,升温平衡右移。
2、浓度:改变平衡体系中每一种物质的浓度,都可使平衡移动。
盐的浓度越小,水解程度越大。
3、溶液的酸碱度:加入酸或碱能促进或抑制盐类的水解。
例如:水解呈酸性的盐溶液,若加入碱,就会中和溶液中的H+,使平衡向水解的方向移动而促进水解;若加入酸,则抑制水解。
以NH4+ + H2O=NH3?H2O + H+ 为例:条件 c(NH4+) c(NH3?H2O) c(H+) c(OH-) pH 水解程度平衡移动方向加热减少增大增大减少减少增大正向加水减少减少减少增大增大增大正向通入氨气增大增大减少增大增大减少逆向加入少量增大增大增大减少减少减少正向NH4Cl(S)通入HCI 增大减少增大减少减少减少逆向加入少量减少增大减少增大增大增大正向NaOH(S)以CH3COO- + H2O=CH3COOH + OH- 为例:条件 c(CH3COO-) c(CH3COOH) c(OH-) c(H+) pH水解程度平衡移动方向加热减少增大增大减少增大增大正向加水减少减少减少增大减少增大正向加入冰醋酸增大增大减少增大减少减少逆向加入少量增大增大增大减少增大减少正向醋酸钠(s)通入HCI 减少增大减少增大减少增大正向加入少量NaOH(S) 增大减少增大减少增大减少逆向第三章水的电离和溶液的pH知识点的全部内容就是这些,希望对大家化学学习有帮助。
高中化学知识点详解盐类的水解

高中化学知识点详解盐类的水解The latest revision on November 22, 2020盐类水解知识点及习题考点1盐类水解反应的本质(一)盐类水解的实质:溶液中盐电离出来的某一种或多种离子跟结合生成,从而了水的电离。
(二)盐类水解的条件:盐必须能;构成盐的离子中必须有,如NH4+、Al3+、CO32-、S2-等。
(三)盐类水解的结果(1)了水的电离。
(2)盐溶液呈什么性,取决于形成盐的对应的酸、碱的相对强弱;如强酸弱碱盐的水溶液显,强碱弱酸盐的水溶液显,强酸强碱盐的水溶液显,弱酸弱碱盐的水溶液是。
(3)生成了弱电解质。
(四)特征(1)水解:盐+水酸 + 碱,ΔH 0(2)盐类水解的程度一般比较,不易产生气体或沉淀,因此书写水解的离子方程式时一[特别提醒]:分析影响盐类水解的主要因素是盐本身的性质;外界因素主要有温度、浓度及外加酸碱等因素。
强碱弱酸盐:弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子,从而使溶液中c(H+)减小,c(OH-)增大,即c(OH-)>c(H+)。
如Na2CO3,NaHCO3强酸弱碱盐:弱碱阳离子与水电离出的OH-结合生成弱碱,从而使溶液中c(H+)增大,c(OH-)减小,即c(OH-)>c(H+)。
NH4Cl,AlCl3弱碱弱酸盐:弱碱阳离子与水电离出的OH-结合生成弱碱,弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子。
CH3COONH4()①KNO3②NaOH③CH3COO NH4④NH4Cl A、①>②>③>④B、④>③>①>②C、③>④>②>①D、③>④>①>②[解析]①KNO3为强酸强碱盐,在水溶液中电离出的K+和NO—对水的电离平衡无影响;②NaOH为强碱在水溶液中电离出的OH—对水的电离起抑制作用,使水的电离程度减小;③CH3COONH4为弱酸弱碱盐,在水溶液中电离出的NH4+和CH3COO—均可以发生水解生成弱电解质NH3·H2O和CH3COOH,并能相互促进,使水解程度加大从而使水的电离程度加大。
盐类水解知识点
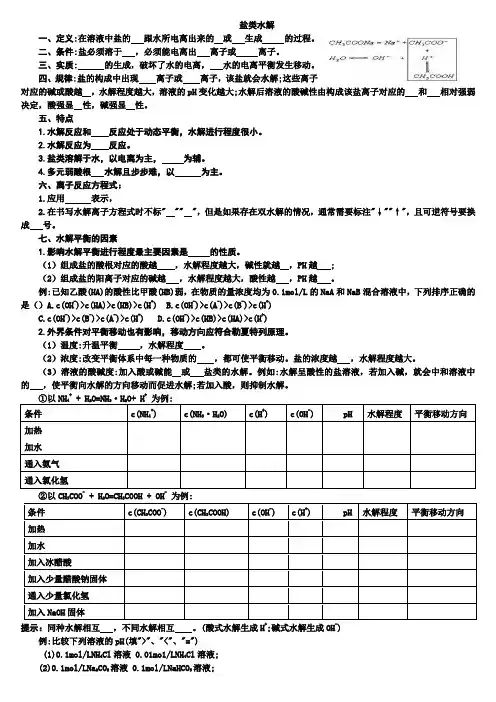
盐类水解一、定义:在溶液中盐的 跟水所电离出来的 或 生成 的过程。
二、条件:盐必须溶于 ,必须能电离出 离子或 离子。
三、实质: 的生成,破坏了水的电离, 水的电离平衡发生移动。
四、规律:盐的构成中出现 离子或 离子,该盐就会水解;这些离子对应的碱或酸越 ,水解程度越大,溶液的pH 变化越大;水解后溶液的酸碱性由构成该盐离子对应的 和 相对强弱决定,酸强显 性,碱强显 性。
五、特点1.水解反应和 反应处于动态平衡,水解进行程度很小。
2.水解反应为 反应。
3.盐类溶解于水,以电离为主, 为辅。
4.多元弱酸根 水解且步步难,以 为主。
六、离子反应方程式: 1.应用 表示,2.在书写水解离子方程式时不标" "" ",但是如果存在双水解的情况,通常需要标注"↓""↑",且可逆符号要换成 号。
七、水解平衡的因素1.影响水解平衡进行程度最主要因素是 的性质。
(1)组成盐的酸根对应的酸越 ,水解程度越大,碱性就越 ,PH 越 ; (2)组成盐的阳离子对应的碱越 ,水解程度越大,酸性越 ,PH 越 。
例:已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L 的NaA 和NaB 混合溶液中,下列排序正确的是()A.c(OH -)>c(HA)>c(HB)>c(H +) B.c(OH -)>c(A -)>c(B -)>c(H +)C.c(OH -)>c(B -)>c(A -)>c(H +) D.c(OH -)>c(HB)>c(HA)>c(H +) 2.外界条件对平衡移动也有影响,移动方向应符合勒夏特列原理。
(1)温度:升温平衡 ,水解程度 。
(2)浓度:改变平衡体系中每一种物质的 ,都可使平衡移动。
盐的浓度越 ,水解程度越大。
(3)溶液的酸碱度:加入酸或碱能 或 盐类的水解。
第30讲 盐类水解(讲义)(原卷版)_1

第30讲盐类水解目录考情分析网络构建考点一盐类水解原理【夯基·必备基础知识梳理】知识点1 盐类水解知识点2 盐类水解规律知识点3 盐类水解方程式的书写【提升·必考题型归纳】考向1 考查盐类的水解及溶液的酸碱性考向2 考查盐类水解规律及应用考点二盐类水解的影响因素及应用【夯基·必备基础知识梳理】知识点1 影响盐类水解的因素知识点2 盐类水解的应用知识点3 水解常数及应用【提升·必考题型归纳】考向1 考查盐类水解的影响因素考向2 考查盐类水解的应用考向3 考查水解常数的应用与计算考点三水溶液中粒子的数量关系【夯基·必备基础知识梳理】知识点1 电解质溶液中的三大守恒知识点2 电解质溶液中粒子浓度大小比较知识点3 水溶液中函数图像分析【提升·必考题型归纳】考向1 考查单一溶液中粒子浓度大小比较考向2 考查混合溶液中粒子浓度大小比较真题感悟考点一 盐类水解原理知识点1 盐类水解1.定义:在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.条件:可溶性盐必须有弱酸根离子或弱碱阳离子 3.实质:盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -→破坏了水的电离平衡→水的电离程度增大→溶液呈碱性、酸性或中性。
4.特点(1)可逆:水解反应是可逆反应;(2)吸热:水解反应是酸碱中和反应的逆反应; (3)微弱:水解反应程度很微弱。
知识点2 盐类水解规律1. 盐的分类与盐溶液的酸碱性“有弱才水解、无弱不水解、越弱越水解、都弱都水解、越热越水解、越稀越水解、谁强显谁性、同强是中性”。
知识点3 盐类水解方程式的书写1.一般要求水解记三点:①水写分子式,②中间用可逆(),③后无沉气出。
即盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。
盐类的水解知识点
【盐类的水解知识大复习】一、探究盐溶液的酸碱性结论:强酸弱碱盐显酸性,强碱弱酸盐显碱性,强酸强碱盐显中性。
二、盐溶液呈现不同酸碱性的原因三、盐的水解原理1.泄义:在溶液中,盐电离出来的阴离子或阳离子与水所电离出来的H+或0H结合生成弱电解质,这种作用叫做盐类的水解。
2.实质及结果实质:促进水的电离平衡。
结果:盐的溶液呈现出不同程度的酸、碱性。
3.水解条件a.盐必须溶于水中b.生成盐的酸或碱是弱酸或弱碱(有弱才水解,无弱不水解,都弱双水解)4.水解特征水解是微弱、可逆的,用可逆符号“=”【小结】水解规律:有弱才水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性5盐溶液中水的电离规律【例题】1、pH=3的HC1和pH=ll的NaOH溶液中由水电离出来的c(H+)*2、pH=3的NHQ 和pH=ll的CH3COONa溶液中由水电离出来的c(H+)水【小结】盐溶液中水的电离有如下规律:a.在强酸弱碱盐溶液中,盐的水解促进了水的电离,水的电离程度比纯水、酸或碱溶液(抑制水的电离)中水的电离程度大。
b.在酸或碱溶液中,c(HJ、c(OH)中小的那一个表示水的电离:在盐溶液中,c(H+)、c(OH) 中大的那一个反映了水的电离程度。
四、水解方程式的书写(1)判断能否水解;(2)水解是微弱的,用可逆符号表示。
通常不生成沉淀或气体,也不发生分解。
在书写离子方程式时一般不标“丨"或“ f ",也不把生成物(如H2CO3、NH)・FhO等)写成其分解产物的形式:(3)多元弱酸的盐分步水解,以第一步为主。
(4)多元弱碱盐的水解视为一步完成。
(5)双水解一一不完全双水解与完全双水解不完全水解用可逆符号,完全水解用等号表示。
五、盐类水解的影响因素1•内因——越弱越水解〔越热越水解,越稀越水解)以醋酸钠为例:CH3COO+H2O CHsCOOH+OH- K hK _ c(CH.COOH) c(OH ) _ c(CH.COOH) ・c(OH) • c(H ) »c(CH,COO ) c(CHCOO ) c(H )KA弱酸或弱碱的电离常数越(越弱),其所生成的盐水解的程度就越大。
2025届高考化学复习第51讲盐类的水解
第51讲盐类的水解1.了解盐类水解的原理及一般规律。
2.掌握盐类水解离子方程式的书写。
3.了解影响盐类水解程度的主要因素。
4.了解盐类水解的应用。
5.能利用水解常数(K h)进行相关计算。
考点一盐类的水解原理1.盐类水解的实质盐电离→{弱酸的阴离子→结合H+弱碱的阳离子→结合OH−}→生成弱电解质→破坏了水的电离平衡→水的电离程度增大→c(H+)≠c(OH-)→溶液呈碱性或酸性。
2.盐类水解的条件在组成上必须具有弱酸根阴离子或弱碱阳离子。
3.水解反应离子方程式的书写(1)盐类水解的离子方程式一般用“⇌”连接,且一般不标“↑”“↓”等状态符号。
(2)多元弱酸盐:分步书写,以第一步为主。
(3)多元弱碱盐:水解反应的离子方程式一步完成。
(4)阴、阳离子相互促进的水解①若水解程度不大,用“⇌”表示。
②相互促进且进行彻底的水解反应,书写时用“===”“↑”“↓”。
试写出下列盐溶液中水解的离子方程式。
①NH4Cl:_。
②Na2CO3:_、_。
③FeCl3:_。
④CH3COONH4:_。
⑤AlCl3溶液和NaHCO3溶液混合:_。
【师说·助学】盐类水解规律有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性。
【易错诊断】判断正误,错误的说明理由。
1.同浓度的Na2CO3溶液和CH3COONa溶液相比,前者pH大;同浓度的Na2CO3溶液和NaHCO3溶液相比,后者pH小:_。
2.常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液中水的电离程度相同:_。
3.酸式盐溶液一定呈酸性:_。
4.某盐溶液呈中性,则该盐一定是强酸、强碱盐:_。
【教考衔接】典例1[2022·浙江1月,1]水溶液呈酸性的盐是()A.NH4ClB.BaCl2C.H2SO4D.Ca(OH)2听课笔记【师说·延伸】导致水溶液呈酸性的溶质..有:酸、水解显酸性的正盐、酸式盐。
典例2[2021·广东卷,8]鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl 表示)。
最新盐类的水解知识点总结
最新盐类的水解知识点总结水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H++OH—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但普通以为中和反应程度大,大多以为是彻底以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱别水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为:1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐别一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若惟独电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(非常特别,电离大于水解):NaHSO3、NaH2PO4、NaHSO4 (三)妨碍水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度别变,浓度越小,水解程度越大.(2)浓度别变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的妨碍.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度考虑:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分不加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何妨碍?(五)盐类水解原理的应用考点 1.推断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分不为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。
(完整版)盐类的水解知识点总结
水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱不水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐不一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若只有电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(很特殊,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)影响水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度不变,浓度越小,水解程度越大.(2)浓度不变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的影响.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何影响?(五)盐类水解原理的应用考点 1.判断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分别为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.盐类水解的原理盐的类型溶液的pH能水解的离子Na2CO3强碱弱酸盐pH>7NH4Cl强酸弱碱盐pH<7NaCl强酸强碱盐pH=7(1)盐类水解的定义盐电离出来的阳离子(或阴离子)与水电离出来的OH-(或H+)结合生成弱电解质的反应.(2)盐类水解的条件盐能电离出弱酸根阴离子或弱碱阳离子.(3)盐类水解的实质纯水中存在电离平衡:H2O H++OH-,此时c(H+)=c(OH-),溶液显中性.加入强碱弱酸盐或强酸弱碱盐时,弱离子结合H+或OH-,使水的电离平衡向移动,使得c(H+)≠c(OH-),故溶液显酸性或碱性.(4)盐类水解的特点盐+H2O酸+碱①盐类水解是中和反应的逆反应,一般程度较小.②盐类水解是吸热反应.(5)盐类水解的规律有弱才水解,无弱不水解,越弱越水解,谁强显谁性,两弱具体定.(6)盐类水解方程式的书写①盐类水解一般是可逆的,书写时一般不写“=== ”,而用“”;水解程度一般较小,因此所得产物的浓度很小,一般不用“↑”或“↓”.可简记为“水写分子式,中间用可逆,后无沉气出”.②多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步即可.例如:Na2CO3水解:③多元弱碱盐的水解分步进行,一般一步写出.例如:AlCl3水解:Al3++3H2O Al(OH)3+3H+例如:Al2(SO4)3与NaAlO2相混合:Al3++3AlO+6H2O===4Al(OH)3↓2.影响盐类水解的因素(1)内因——盐本身的性质组成盐的离子所对应的酸或碱越弱,则越易水解,其溶液的酸性或碱性就越强.(2)外因①温度:因为盐类水解是吸热反应,所以升高温度,水解平衡向右移动,水解程度增大.②浓度:盐溶液加水稀释,则水解平衡向右移动,水解程度增大.③化学反应: A.强碱弱酸盐水解,如Na2CO3+H2O NaHCO3+NaOH,加酸促进其水解,加碱抑制其水解.B.强酸弱碱盐水解,如FeCl3+3H2O Fe(OH)3+3HCl,加碱促进其水解,加酸抑制其水解.1.向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为()A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.增大、减小、增大解析:0.1 mol/L CH3COONa中存在平衡CH3COO-+H2O CH3COOH+OH-,加入NH4NO3、FeCl3两种水解显酸性的盐会使平衡正向移动,c(CH3COO-)减小;加入Na2SO3这种水解显碱性的盐会使平衡逆向移动,c(CH3COO-)增大.答案: A2.有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是()A.3种溶液pH的大小顺序是③>②>①B.若将3种溶液稀释相同倍数,pH变化最大的是②C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②解析:相同物质的量浓度的①、②、③溶液:pH的大小顺序应为③>①>②,故A项错误;稀释相同倍数时,①、②存在水解平衡,③中pH变化最大,故B项错误;若pH相同的三种溶液,物质的量浓度大小顺序为:②>①>③,故D项错误;与25 mL 0.1 mol/L盐酸反应后①中为NaHCO3和NaCl溶液,②中为CH3COOH和NaCl溶液,③中为NaCl溶液,pH最大的是①,故C项正确.答案: C1.三个守恒(1)电荷守恒电荷守恒是指溶液呈电中性,即溶液中所有阳离子的电荷总浓度等于所有阴离子的电荷总浓度.如Na2CO3溶液中:(2)物料守恒物料守恒即原子守恒,指变化前后元素原子个数守恒.如:0.1 mol/L的Na2CO3溶液中:(3)质子守恒质子守恒指溶液中质子发生转移时,质子数不发生变化.2.具体情况因为电离和水解一般都是较弱的,所以产物粒子的浓度要小于原粒子的浓度.(1)多元弱酸溶液,依据弱酸的分步电离分析.(2)多元弱酸的正盐溶液中,依据弱酸根离子分步水解分析.(3)一元弱酸强碱盐溶液中,c(阳离子)>c(酸根离子)>c(OH-)>c(H+).如CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).(4)相同浓度不同的溶液中,比较同一种离子浓度的大小时,要考虑溶液中其他离子的影响.如相同物质的量浓度的三种溶液:①NH4Cl, ②NH4HSO4, ③NH4HCO3, c(NH )由大到小的顺序为②>①>③.(5)溶液混合后离子浓度的大小判断,要综合分析,主要考虑电离因素、水解因素及是否反应等对离子的影响.如0.1 mol/L的CH3COONa和0.1 mol/L的CH3COOH混合后,溶液中各离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).一般地,若混合时发生化学反应,要根据反应物的量及化学反应原理确定反应后溶液中的成分及各成分的浓度,再考虑电离和水解,从而作出判断.下列溶液中有关物质的量浓度关系正确的是() A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)D.0.1 mol/L的NaHA溶液,其pH=4, c(HA-)>c(H+)>c(H2A)>c(A2-)点拨:解答该题时先搞清每个选项属于哪种情况,然后再具体分析.其中关于等式的情况,无外乎电荷守恒,物料守恒,质子守恒或三种守恒的加减.解析:A项可根据溶液呈电中性确定;B项根据越弱越水解,因pH相同,则物质的量浓度关系为c(NaOH)<c(Na2CO3)<c(CH3COONa);C项中由电荷守恒得出:①c(H+)+c(Na+)=c(OH-)+c(CH3COO-),据物料守恒得出:②2c(Na+)=c(CH3COO-)+c(CH3COOH),将①×2-②即得出c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故C正确;D项中因为溶液显酸性,故应以电离为主,所以c(A2-)>c(H2A).答案:AC 将10 mL 0.1 mol/L氨水与 6 mL 0.2 mol/L盐酸混合反应后,溶液中离子浓度关系正确的是()答案:C1.溶液的配制或贮存(1)强酸弱碱盐在配制时,为抑制其水解,通常加入相应的强酸.如配制FeCl3溶液时,通常先将FeCl3固体溶解在相应的浓盐酸中,然后加水稀释至所需浓度.(2)强碱弱酸盐在配制时,为抑制其水解,通常加入相应的强碱.如配制Na2CO3溶液时,通常加少量NaOH.(3)保存强碱弱酸盐溶液时,通常用带有橡胶塞的试剂瓶,而不用玻璃塞,如Na2CO3溶液.2.判断盐溶液的酸碱性一般地,强碱弱酸盐溶液,显碱性;强酸弱碱盐溶液显酸性;强酸强碱盐溶液,显中性;弱酸的酸式盐溶液,要视弱酸根离子的水解与电离程度的相对大小,如NaHCO3溶液显碱性而NaHSO3溶液显酸性.3.判断盐溶液蒸干时所得产物(1)水解生成挥发性酸的盐溶液,蒸干时得不到原溶质,;若水解生成难挥发性酸的盐溶液,蒸干后仍得原溶质,如Al2(SO4)3.(2)水解生成强碱的盐溶液,蒸干后一般能得到原溶质,如Na2CO3.(3)受热易分解的盐溶液,因其分解而得不到原溶质,如Ca(HCO3)2、KMnO4等.(4)易被空气氧化的盐溶液,一般因氧化而得不到原溶质,如Na2SO3.(5)浓缩时易结合结晶水的盐溶液,浓缩时也得不到原溶质,如CaSO4.4.利用盐溶液来制取H2某些活泼金属与强酸弱碱盐溶液反应而产生气体.如:少量Zn片投入到浓的NH4Cl溶液中,而有H2、NH3产生.5.在生产、生活中的应用(1)泡沫灭火器原理:用Al2(SO4)2与NaHCO3作用,离子方程式为:Al3++3HCO===Al(OH)3↓+3CO2↑.(2)制取净水剂:通常用铁盐、铝盐来制取净水剂,如用明矾净水的离子方程式:Al3++3H2OAl(OH)3(胶体)+3H+.(3)制取胶体:用饱和盐溶液水解来制取胶体,如用FeCl3饱和溶液制取Fe(OH)3胶体:(4)化肥合理使用:铵态氮肥不能与草木灰混用,因(5)加强洗涤效果:热的纯碱溶液去污效果更好,因为升温,促进了的水解.(2009·江苏单科高考)下列溶液中微粒的物质的量浓度关系正确的是()L-1 NH4HSO4溶液中滴加NaOH溶液至中性:A.室温下,向0.01 mol·B.0.1 mol·L-1 NaHCO3溶液:c(Na+)>c(OH-)>cC.Na2CO3溶液:c(OH-)-c(H+)=c(HCO )+2c(H2CO3)D.25℃时,pH=4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)答案:CA1.下列过程或现象与盐类水解无关的是()A.纯碱溶液去油污B.铁在潮湿的环境下生锈C.加热氯化铁溶液颜色变深D.浓硫化钠溶液有臭味解析:A项,碳酸钠水解显碱性,利用油污在碱性条件下水解生成可溶于水的物质而达到去污目的;C项,氯化铁溶液中发生Fe3++3H2O Fe(OH)3+3H+,在加热条件下水解平衡正向移动造成体系颜色加深;D项,硫化钠溶液中存在S2-+H2O HS-+OH-,HS-+H2O H2S+OH-,水解产物H2S是产生臭味的原因;B项,是铁发生电化学腐蚀的结果,不涉及盐类的水解.答案: B2.在常温下,纯水中存在电离平衡H2O H++OH-,如果使水的电离程度增大,并使c(H+)增大,应加入的物质是()A.NaHSO4 B.KAl(SO4)2C.NaHCO3 D.CH3COONa解析:若使水的电离程度增大,而又要使酸性增强,故应考虑盐类的水解.A中加入NaHSO4电离出的H+能抑制水的电离,使水的电离程度减小;B中的KAl(SO4)2电离出的Al3+能发生水解,使水的电离程度增大,Al3++3H2O 3H++Al(oH)3,水解后,溶液中的c(H+)增大,符合题意;C中的也能水解,但水解后溶液呈碱性,溶液中的c(H+)降低,不合题意;同理,CH3COO-水解后,也使溶液呈碱性.答案: B方法归纳: 1.关于盐类水解的影响因素使盐类水解平衡发生移动的盐的类型有:(1)同离子型,即向水解的盐溶液中加了含有相同离子的盐,使水解的离子浓度发生了改变,如向CH3COONa溶液中加入CH3COOK固体,使CH3COO-浓度变大,CH33COO-的水解程度变小;(2)异离子型:①相互影响型:指加入的离子也水解,与原溶液中离子的水解相互抑制或促进,带同种电荷相互抑制,带异种电荷则相互促进;②相互反应型,指加入的盐与溶液中水解的离子相互反应,使原水解平衡发生移动.2.关于溶液的蒸干问题盐溶液蒸干、灼烧时所得产物的判断(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如盐溶液水解生成易挥发性酸时,蒸干、灼烧后一般得对应的氧化物,如(2)酸根阴离子易水解的强碱盐,如Na2CO3溶液等蒸干后可得到原物质.(3)考虑盐受热时是否分解.Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干、灼烧后分别为:(4)还原性盐在蒸干时会被O2氧化(5)有时要从多方面考虑.例如:蒸干NaClO溶液时,既要考虑ClO-水解,又要考虑HClO 分解,所以蒸干NaClO溶液所得固体为NaCl.1.下列变化不属于水解反应的是()A.①③⑤B.②③⑤C.①④⑤D.①③答案:A3.0.1 mol/L NaHCO3溶液的pH最接近于()A.5.6 B.7.0C.8.4 D.13.0解析:NaHCO3溶于水后,既能电离,又有水解,但水解作用大于电离作用,其水溶液呈弱碱性,故C项正确.答案:C4.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排序正确的是()A.c(OH-)>c(HA)>c(HB)>c(H+)B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+)D.c(OH-)>c(HB)>c(HA)>c(H+)解析:HA、HB都是弱酸,且酸性HA<HB.物质的量浓度相同的NaA和NaB混合溶液中,A-、B-发生水解,且A-的水解能力大于B-,A-、B-的水解均是微弱的,故溶液中有:c(OH-)>c(HA)>c(HB)>c(H+), c(B-)>c(A-)>c(OH-)>c(H+),只有选项A正确.答案:A。
