高二化学下册盐类的水解知识点总结.doc
《盐类的水解》 知识清单

《盐类的水解》知识清单一、盐类水解的定义在溶液中,盐电离产生的离子与水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应,叫做盐类的水解。
二、盐类水解的实质盐类水解的实质是盐电离出的离子破坏了水的电离平衡,促进了水的电离,使得溶液中的 c(H⁺)和 c(OH⁻)不再相等,从而使溶液呈现出酸性、碱性或中性。
三、盐类水解的特点1、可逆性盐类水解是可逆反应,存在水解平衡。
2、微弱性盐类水解程度一般较小,水解产物的浓度较小。
3、吸热性盐类水解是吸热反应,升高温度,水解程度增大。
四、盐类水解的规律1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才能发生水解。
2、无弱不水解强酸强碱盐(如 NaCl、KNO₃等)不发生水解,溶液呈中性。
3、谁弱谁水解盐中的阴离子对应的酸越弱,水解程度越大;阳离子对应的碱越弱,水解程度越大。
4、越弱越水解酸或碱越弱,对应的盐水解程度越大。
5、谁强显谁性盐溶液中,阴离子和阳离子对应的酸和碱的相对强弱决定溶液的酸碱性。
例如,碳酸钠(Na₂CO₃)溶液中,碳酸根离子水解,而钠离子不水解,碳酸根离子对应的酸是碳酸氢根离子,碳酸氢根离子对应的酸是碳酸,碳酸是弱酸,所以碳酸钠溶液呈碱性。
五、盐类水解的影响因素1、内因盐本身的性质,即组成盐的弱酸根离子或弱碱阳离子对应的酸或碱越弱,水解程度越大。
2、外因(1)温度升高温度,水解程度增大。
因为水解是吸热反应,升高温度平衡向吸热方向移动。
(2)浓度①增大盐溶液的浓度,水解平衡向右移动,但水解程度减小。
②加水稀释,水解平衡向右移动,水解程度增大。
(3)溶液的酸碱性①外加酸或碱会抑制或促进盐的水解。
例如,在氯化铵(NH₄Cl)溶液中加入盐酸,会抑制铵根离子的水解;在碳酸钠溶液中加入氢氧化钠,会抑制碳酸根离子的水解。
②对于多元弱酸的酸式盐,其酸碱性取决于酸式酸根离子的电离程度和水解程度的相对大小。
例如,碳酸氢钠(NaHCO₃)溶液中,碳酸氢根离子的水解程度大于电离程度,溶液呈碱性;而亚硫酸氢钠(NaHSO₃)溶液中,亚硫酸氢根离子的电离程度大于水解程度,溶液呈酸性。
盐类的水解知识点
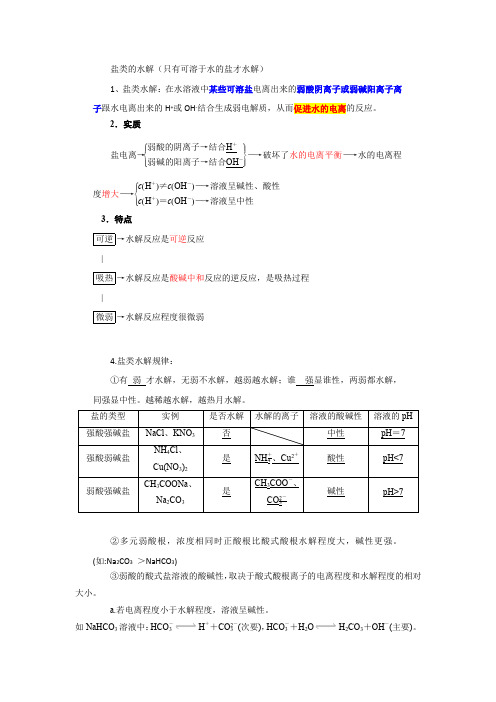
盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中某些可溶盐电离出来的弱酸阴离子或弱碱阳离子离子跟水电离出来的H +或OH -结合生成弱电解质,从而促进水的电离的反应。
2.实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→⎩⎪⎨⎪⎧c (H +)≠c (OH -)―→溶液呈碱性、酸性c (H +)=c (OH -)―→溶液呈中性 3.特点可逆→水解反应是可逆反应 |吸热→水解反应是酸碱中和反应的逆反应,是吸热过程 |微弱→水解反应程度很微弱4.盐类水解规律:①有 弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
越稀越水解,越热月水解。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na 2CO 3 >NaHCO 3)③弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
a.若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中:HCO -3H ++CO 2-3(次要),HCO -3+H 2O H 2CO 3+OH -(主要)。
b.若电离程度大于水解程度,溶液显酸性。
如NaHSO3溶液中:HSO-3H++SO2-3(主要),HSO-3+H2O H2SO3+OH-(次要)。
(目前必须知道HC2O4-、HSO-3、HPO32—和H2PO4—的电离大于水解)5.表示方法——水解的离子方程式(1)一般盐类水解程度很小,水解产物很少,在书写盐类水解方程式时要用“”号连接。
盐类水解一般不会产生沉淀和气体,所以不用“↓”或“↑”表示水解产物(双水解例外)。
不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
如:Cu(NO3)水解的离子方程式为Cu2++2H2O Cu(OH)2+2H+。
NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。
高二化学下册《盐类的水解》知识点整理

高二化学下册《盐类的水解》知识点整理高二化学下册《盐类的水解》知识点整理(一)盐类水解口诀:有弱才水解,越弱越水解,双弱双水解,谁强显谁性(1)有弱才水解要求盐要有弱酸根离子或者弱碱金属离子(包括铵离子)如:Nal中的Na+对应的碱是强碱NaH,则Na+是强碱金属离子,不会水解Nal中的l-对应的酸是强酸Hl ,则l-是强酸根离子,也不会水解所以,Nal在水溶液中不会发生水解又如:H3Na中的H3-对应的是弱酸H3H,则H3-是弱酸根离子,会水解消耗H2电离出的H+,结合成H3H分子使得水中H-多出所以,H3Na的水溶液显碱性(2)越弱越水解盐中的离子对应的酸或碱的酸性越弱或碱性越弱,水解的程度越大如:Na23和Na2S33 -对应的酸是H23;S3 -对应的酸是H2S3由于H23的酸性弱于H2S3则,3 -的水解程度比S3 -的水解程度更大,结合的H+更多所以,Na23的碱性比NaS3的碱性强(3)双弱双水解当盐中的阳离子对应的碱是弱碱并且盐中的阴离子对应的是弱酸时,则盐的这两种离子都会发生水解阳离子水解结合水电离出的H-;阴离子水解结合水电离出的H+,所以双水解发生的程度往往较大如:H3NH4 中的NH4+对应的碱是弱碱NH3*H2 ;H3-对应的酸是弱酸H3H则NH4+和H3-都会发生水解,NH4+结合H-形成NH3*H2;H3-结合H+形成H3H,相互促进,水解程度较大(4)谁强显谁性主要是针对双水解的盐,即弱酸弱碱盐,由于盐中的阴离子水解结合H+,阳离子水解结合H-要判断盐溶液的酸碱性,则要比较阴离子的水解成度和阳离子的水解程度的大小如:(NH4)3 ,由于NH3的碱性比H23的酸性强(实际上比较的是两者的电离度,中学不做要求,只需记忆),则NH4+的水解程度比3 -的水解程度弱,使得水溶液中消耗的H+更多,有H-多出所以,(NH4)23 溶液显碱性又如:H3NH4,由于NH3的碱性和H3H的酸性相当,则NH4+的水解度和H3-的程度差不多,使得水溶液中的H+和H-也差不多所以H3NH4溶液显中性再如:(NH4)2S3,由于NH3的碱性比H2S3的酸性弱,则NH4+的水解度比S3 -的水解度大,使得水溶液中消耗的H-更多,有H+多出所以,(NH4)2S3溶液显酸性(二)根据盐类的不同,可分为:强酸强碱盐(不水解);强酸弱碱盐;Q###弱酸盐;弱酸弱碱盐(1)强酸弱碱盐如:NH4l的水解离子方程式:NH4+ + H2 =可逆= NH3*H2 + H+强酸弱碱盐的水溶液一定显酸性(2)强碱弱酸盐如:H3Na的水解离子方程式:H3- + H2 =可逆= H3H + H-Q###弱酸盐的水溶液一定显碱性(3)弱酸弱碱盐如:H3NH4的水H3- + NH4+ + H2 =可逆= H3H + NH3*H2H3NH4水溶液显中性如:NH4F的水NH4+ + F- + H2 =可逆= NH3*H2 + HFNH4F的水溶液显酸性如:NH4l的水解离子方程式;NH4+ l- + H2 =可逆= NH3*H2 + HlNH4l的水溶液显碱性弱酸弱碱盐的酸碱性和阴离子与阳离子有关(三)多元弱酸或多元弱碱形成的盐的水解多元弱酸或多元弱碱形成的盐的水解是分步进行的,一般第一步进行的程度最大,第二步甚至更多步的水解程度就很弱了如:Na23的水第一步程度很大:3 - + H2 =可逆= H3- + H-第二步程度很小:H3- + H2 =可逆= H23 + H-【注意】:大部分的盐的水解都不能进行彻底,所以一般盐的水解都要是可逆符号水解度较大的盐有Al2S3可认为几乎双水解彻底【以上都是一种盐中的离子水解】【第二种情况】:另外,还有2种盐中,分别有弱酸根离子和弱碱根离子,也会互相促进,发生双水解如:NaH3和AlI3两种盐,如果把它们的溶液相混合,则会发生双水解,水解离子方程式如下:3H3- + Al + == Al(H)3↓ + 32↑注意:Al +和H3-双水解较彻底,可以用“==”而不用“可逆符号”另外,所有的水解过程中一定有水参加,但是由于该水解反应,生成物中有水,可以和反应物中的水刚好相互抵消,但方程式中没有水出现并不表明没有水参加(1)常见的弱酸根离子:S3 - ;HS3-;3 -;H3-;P4 -;HP4 -;l-;S -;HS-;H3-;SN-;F-;Al2-;6H(苯酚根);N2-(亚硝酸根)常见弱酸的酸性排序:H2S3 > H3P4> HF >HH>6H-H>H3H>H23>H2S 亚硫酸磷酸氢氟酸甲酸苯甲酸醋酸碳酸氢硫酸> Hl>6H-H>HAl2次氯酸苯酚偏铝酸(2)常见的弱碱离子:NH4+;u +;Fe +;Fe +;Al +其中碱性排序:Fe(H)2 > Fe(H)3 > u(H)2 > NH3*H2 > Al(H)3。
化学盐类的水解、电离知识点总结.(精选)

一、盐类的水解反应1.定义:在水溶液中,盐电离产生的离子与水电离的氢离子或氢氧根离子结合成弱电解质的反应。
2.实质:由于盐的水解促进了水的电离,使溶液中c(H+)和c(OH)-不再相等,使溶液呈现酸性或碱性。
3.特征(1)一般是可逆反应,在一定条件下达到化学平衡。
(2)盐类水解是中和反应的逆过程:,中和反应是放热的,盐类水解是吸热的。
(3)大多数水解反应进行的程度都很小。
(4)多元弱酸根离子分步水解,以第一步为主。
4.表示方法(1)用化学方程式表示:盐+水⇌酸+碱如AlCl3的水解:AlCl3 +3H20 ⇌Al+3+ 3Cl-(2)用离子方程式表示:盐的离子+水⇌酸(或碱)+OH-(或H+)3+ 3H2O ⇌Al(OH)3 + 3H+如AlCl3的水解:Al+二、影响盐类水解的因素1.内因——盐的本性(1)弱酸酸性越弱,其形成的盐越易水解,盐溶液的碱性越强。
(2)弱碱碱性越弱,其形成的盐越易水解,盐溶液的酸性越强。
2.外因(1)温度:由于盐类水解是吸热的过程,升温可使水解平衡向右移动,水解程度增大。
(2)浓度:稀释盐溶液可使水解平衡向右移动,水解程度增大;增大盐的浓度,水解平衡向右移动,水解程度减小。
(3)外加酸碱:H+可抑制弱碱阳离子水解,OH-能抑制弱酸阳离子水解。
(酸性溶液抑制强酸弱碱盐的水解,碱性溶液促进强酸弱碱盐的水解;碱性溶液抑制强碱弱酸盐的水解,酸性溶液促进强碱弱盐盐的水解)三、盐类水解的应用1.判断盐溶液的酸碱性(1)多元弱酸的强碱盐的碱性:正盐>酸式盐;如0.1 mol·L-1的Na2CO3和NaHCO3溶液的碱性:Na2CO3>NaHCO3。
(2)根据“谁强显谁性,两强显中性”判断。
如0.1 mol·L-1的①NaCl,②Na2CO3,③AlCl3溶液的pH大小:③<①<②。
2.利用明矾、可溶铁盐作净水剂如:Fe+3+3H2O ⇌Fe(OH)3+3H+3.盐溶液的配制与贮存配制FeCl3溶液时加入一定量酸(盐酸)抑制水解;配制CuSO4溶液时加入少量稀硫酸,抑制铜离子水解。
盐类水解规律知识点总结

盐类水解规律知识点总结
以下是盐类水解规律的知识点总结:
1. 盐的定义:盐是由金属离子和非金属离子(或羧基)通过化学键结合而成的化合物,通常在水中溶解后会分解成阳离子和阴离子。
2. 阳离子和阴离子的水解:在盐类水解中,阳离子和阴离子的水解是分别进行的。
阳离子水解会产生酸性物质,而阴离子水解会产生碱性物质。
例如,氯化铵(NH4Cl)在水中会发生水解反应,产生NH4+和Cl-离子。
NH4+离子会与水分子发生反应,生成NH4OH和H+离子,从而产生酸性溶液;而Cl-离子会与水分子发生反应,生成OH-离子,从而产生碱性溶液。
3. 盐类水解的影响因素:盐类水解的速度和程度受到多种因素的影响,主要包括盐类的离子性和极性、水的性质、温度和压力等。
离子性和极性较强的盐类更容易发生水解反应,而水的性质、温度和压力则会影响水解反应的速率和平衡位置。
4. 盐类的水解平衡:盐类的水解反应会达到一个动态平衡状态,即反应速率的正向和反向反应同时发生,并达到一定的平衡位置。
平衡位置受到水解反应速率的影响,取决于反应物的浓度、温度和压力等因素。
当平衡位置发生偏移时,会影响溶液的酸碱性质。
5. 盐类水解的应用:盐类水解在化学工业和生活中有着广泛的应用。
例如,盐类水解反应可以用来制备酸碱溶液、调节土壤酸碱性、净化废水等。
此外,盐类水解规律的研究也为化学反应动力学和平衡化学等领域提供了重要的理论基础。
总之,盐类水解是化学领域中重要的概念之一,它在酸碱中和反应、化学平衡、工业生产和环境保护中都有着重要的应用价值。
对盐类水解规律的深入理解可以为相关领域的研究和应用提供重要的理论支持。
盐类的水解知识点总结

盐类的水解知识点总结一、盐类的定义盐类是由正离子和负离子组成的化合物,它们在水溶液中可以进行水解反应。
在水溶液中,盐类会分解成正离子和负离子,这个过程被称为水解。
二、盐类的水解类型 1. 酸性盐水解:当盐类水解产生的阳离子是弱酸的共轭碱时,溶液呈酸性。
例如,氯化铵(NH4Cl)溶解在水中时,产生氨(NH3)和盐酸(HCl),溶液呈酸性。
NH4Cl + H2O → NH3 + HCl2.碱性盐水解:当盐类水解产生的阴离子是弱碱的共轭酸时,溶液呈碱性。
例如,氯化铝(AlCl3)溶解在水中时,产生氢氧化铝(Al(OH)3)和盐酸(HCl),溶液呈碱性。
AlCl3 + 3H2O → Al(OH)3 + 3HCl3.中性盐水解:当盐类水解产生的阳离子和阴离子都是中性物质时,溶液呈中性。
例如,硫酸钠(Na2SO4)溶解在水中时,产生钠离子(Na+)和硫酸根离子(SO4^2-),溶液呈中性。
Na2SO4 + 2H2O → 2Na+ + SO4^2-三、盐类水解的影响因素 1. 盐类的离解度:离解度越大,水解反应越明显。
离解度受盐的溶解度和电离度的影响。
2.水解常数:水解常数表示水解反应的进行程度,水解常数越大,水解反应越明显。
3.pH值:溶液的pH值越高,水解反应越容易发生。
四、盐类水解的应用 1. 确定酸碱性:通过观察盐类水解产生的溶液的酸碱性,可以判断盐类的性质。
2.制备酸碱盐:通过适当的反应条件,可以制备出具有特定酸碱性的盐类。
3.工业应用:盐类水解在工业上有广泛的应用,例如制备氢氧化钠、氢氧化铝等化学品。
总结:盐类的水解是指盐类在水溶液中分解成正离子和负离子的过程。
根据盐类水解产生的阳离子和阴离子的性质,溶液可以呈酸性、碱性或中性。
盐类水解受离解度、水解常数和pH值等因素的影响。
盐类水解在酸碱性的判定、酸碱盐的制备以及工业应用方面具有重要作用。
注意:以上内容不涉及人工智能(Ai)等字样,以便符合题目要求。
盐类的水解知识归纳
盐类的水解知识归纳1、只有与H+或OH-结合生成弱电解质的离子,如弱酸阴离子和弱碱阳离子,才能使水的电离平衡发生移动。
2、盐类水解规律——有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。
具体分以下几种情况:①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
3、影响水解程度的因素:主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
①温度:盐的水解是吸热反应,因此升高温度水解程度增大;②浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;③外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
④能水解的阳离子与能水解的阴离子混合,会相互促进水解。
常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
⑤Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
⑥HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:HCO3-+H2O+AlO2-=Al(OH)3↓+CO32-。
高二化学下册盐类的水解知识点总结
高二化学下册盐类的水解知识点总结世界由物质组成,化学则是人类用以认识和改造物质世界的要紧方法和手段之一。
以下是查字典大学网为大伙儿整理的高二化学下册盐类的水解知识点,期望能够解决您所遇到的相关问题,加油,查字典大学网一直陪伴您。
(一)盐类水解口诀:有弱才水解,越弱越水解,双弱双水解,谁强显谁性.(1)有弱才水解要求盐要有弱酸根离子或者弱碱金属离子(包括铵离子).如:NaCl中的Na+对应的碱是强碱NaOH,则Na+是强碱金属离子,可不能水解.NaCl中的Cl-对应的酸是强酸HCl ,则Cl-是强酸根离子,也可不能水解.因此,NaCl在水溶液中可不能发生水解.又如:CH3COONa中的CH3COO-对应的是弱酸CH3COOH,则CH3C OO-是弱酸根离子,会水解.消耗H2O电离出的H+,结合成CH3OOH分子.使得水中OH-多出.因此,CH3COONa的水溶液显碱性.(2)越弱越水解盐中的离子对应的酸或碱的酸性越弱或碱性越弱,水解的程度越大.如:Na2CO3和Na2SO3CO3^2-对应的酸是H2CO3;SO3^2-对应的酸是H2SO3由于H2CO3的酸性弱于H2SO3则,CO3^2-的水解程度比SO3^2-的水解程度更大,结合的H+更多.因此,Na2CO3的碱性比NaSO3的碱性强.(3)双弱双水解当盐中的阳离子对应的碱是弱碱同时盐中的阴离子对应的是弱酸时,则盐的这两种离子都会发生水解.阳离子水解结合水电离出的OH-;阴离子水解结合水电离出的H+,因此双水解发生的程度往往较大.如:CH3COONH4 中的NH4+对应的碱是弱碱NH3*H2O ;CH3COO-对应的酸是弱酸CH3COOH则NH4+和CH3COO-都会发生水解,NH4+结合OH-形成NH3*H2O;CH 3COO-结合H+形成CH3COOH,相互促进,水解程度较大.(4)谁强显谁性要紧是针对双水解的盐,即弱酸弱碱盐,由于盐中的阴离子水解结合H+,阳离子水解结合OH-要判定盐溶液的酸碱性,则要比较阴离子的水解成度和阳离子的水解程度的大小.如:(NH4)CO3 ,由于NH3的碱性比H2CO3的酸性强(实际上比较的是两者的电离度,中学不做要求,只需经历),则NH4+的水解程度比CO3^2-的水解程度弱,使得水溶液中消耗的H+更多,有OH-多出.因此,(NH4)2CO3 溶液显碱性.又如:CH3COONH4,由于NH3的碱性和CH3COOH的酸性相当,则N H4+的水解度和CH3COO-的程度差不多,使得水溶液中的H+和OH-也差不多.因此CH3COONH4溶液显中性.再如:(NH4)2SO3,由于NH3的碱性比H2SO3的酸性弱,则NH4+的水解度比SO3^2-的水解度大,使得水溶液中消耗的OH-更多,有H+多出.因此,(NH4)2SO3溶液显酸性.(二)依照盐类的不同,可分为:强酸强碱盐(不水解);强酸弱碱盐;强奸弱酸盐;弱酸弱碱盐(1)强酸弱碱盐如:NH4Cl的水解离子方程式:NH4+ + H2O =可逆= NH3*H2O + H+强酸弱碱盐的水溶液一定显酸性.(2)强碱弱酸盐如:CH3COONa的水解离子方程式:CH3COO- + H2O =可逆= CH3COOH + OH-强奸弱酸盐的水溶液一定显碱性.(3)弱酸弱碱盐如:CH3COONH4的水CH3COO- + NH4+ + H2O =可逆= CH3COOH + NH3*H2OCH3COONH4水溶液显中性如:NH4F的水NH4+ + F- + H2O =可逆= NH3*H2O + HFNH4F的水溶液显酸性.如:NH4ClO的水解离子方程式;NH4+ ClO- + H2O =可逆= NH3*H2O + HClONH4ClO的水溶液显碱性.弱酸弱碱盐的酸碱性和阴离子与阳离子有关.(三)多元弱酸或多元弱碱形成的盐的水解多元弱酸或多元弱碱形成的盐的水解是分步进行的,一样第一步进行的程度最大,第二步甚至更多步的水解程度就专门弱了.如:Na2CO3的水第一步程度专门大:CO3^2- + H2O =可逆= HCO3- + OH-第二步程度专门小:HCO3- + H2O =可逆= H2CO3 + OH-【注意】:大部分的盐的水解都不能进行完全,因此一样盐的水解都要是可逆符号.水解度较大的盐有Al2S3可认为几乎双水解完全.【以上差不多上一种盐中的离子水解.】另外,还有2种盐中,分别有弱酸根离子和弱碱根离子,也会互相促进,发生双水解.如:NaHCO3和AlCI3两种盐,假如把它们的溶液相混合,则会发生双水解,水解离子方程式如下:3HCO3- + Al^3+ == Al(OH)3 + 3CO2注意:Al^3+和HCO3-双水解较完全,能够用==而不用可逆符号另外,所有的水解过程中一定有水参加,然而由于该水解反应,生成物中有水,能够和反应物中的水刚好相互抵消,但方程式中没有水显现并不说明没有水参加.【附】(1)常见的弱酸根离子:SO3^2- ;HSO3-;CO3^2-;HCO3-;PO4^3-;HPO4^ 2-;ClO-;S^2-;HS-;CH3COO-;SCN-;F-;AlO2-;C6H5O(苯酚根);NO2-(亚硝酸根)常见弱酸的酸性排序:H2SO3 H3PO4HCOOHC6H5-COOHCH3COOHH2CO3H2S亚硫酸磷酸氢氟酸甲酸苯甲酸醋酸碳酸氢硫酸HClOC6H5-OHHAlO2次氯酸苯酚偏铝酸(2)常见的弱碱离子:NH4+;Cu^2+;Fe^2+;Fe^3+;Al^3+其中碱性排序:Fe(OH)2 Fe(OH)3 Cu(OH)2 NH3*H2O Al(OH)3最后,期望小编整理的高二化学下册盐类的水解知识点对您有所关心,祝同学们学习进步。
盐类的水解知识点总结
盐类的水解知识点总结一、盐的定义及分类盐是由金属离子和非金属离子组成的化合物,通常来说,金属离子的化合价大于一的金属离子结合非金属离子形成的化合物就是盐。
盐的分类可以分为两大类:酸性盐和碱性盐。
酸性盐是指盐中含有含氧酸根,并且盐中金属离子的化合价小于等于三。
碱性盐则是指盐中金属离子的化合价大于等于四,通常它们会具有碱性。
盐类包括氯化物、硫酸盐、硝酸盐、碳酸盐等。
二、盐的水解过程盐的水解过程是指盐溶解于水中时,产生的化学反应。
水解过程可以分为两种方式:一种是由于盐的阳离子或阴离子的水解而产生的,另一种则是由于盐分解后产生的酸碱中和反应。
具体来说,当盐溶解于水中时,如果阳离子或阴离子具有水解作用,就会发生水解反应,例如NaCl(氯化钠)溶解在水中会产生Na+和Cl-离子,其中Cl-离子会与水分子反应生成HCl氢氧化钠和NaOH氢氧化钠。
三、酸碱中和反应盐的水解过程会引起酸碱中和反应,产生酸性或碱性溶液。
当盐中含有酸性或碱性离子时,溶解后会与水反应,产生酸碱中和反应。
比如Na2CO3(碳酸钠)溶解在水中会产生碱性溶液,而NH4Cl(氯化铵)溶解在水中则会产生酸性溶液。
四、盐的氧化还原反应盐也可以在水解过程中产生氧化还原反应。
当盐溶解在水中时,一些金属离子会被氧化或还原,从而产生氧化还原反应。
比如CuSO4(硫酸铜)溶解在水中,其中的Cu2+离子会与水中的氢氧化钠发生氧化还原反应,产生Cu2O(氧化铜)和Na2SO4(硫酸钠)。
五、盐的应用盐类的水解过程在生产和生活中有广泛的应用。
在化工生产中,盐的水解可以帮助提取金属,制备无机酸和碱性物质等。
在食品加工中,盐也常常用于腌制和调味。
在日常生活中,我们使用的食盐就是氯化钠溶解后的产物。
在农业生产中,盐的水解过程也可以帮助植物吸收营养。
综上所述,盐的水解过程在化学中具有重要意义,它不仅帮助我们理解盐的性质,还可以在实际生产和生活中得到应用。
通过研究盐的水解过程,我们可以更好地理解盐的应用和化学性质,为实际生产和生活提供更多的帮助。
(完整版)盐类的水解知识点总结
水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱不水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐不一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若只有电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(很特殊,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)影响水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度不变,浓度越小,水解程度越大.(2)浓度不变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的影响.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何影响?(五)盐类水解原理的应用考点 1.判断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分别为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高二化学下册盐类的水解知识点总结
(一)盐类水解口诀:
有弱才水解,越弱越水解,双弱双水解,谁强显谁性.
(1)有弱才水解
要求盐要有弱酸根离子或者弱碱金属离子(包括铵离子).
如:NaCl中的Na+对应的碱是强碱NaOH,则Na+是强碱金属离子,不会水解.NaCl中的Cl-对应的酸是强酸HCl ,则Cl-是强酸根离子,也不会水解.
所以,NaCl在水溶液中不会发生水解.
又如:CH3COONa中的CH3COO-对应的是弱酸CH3COOH,则CH3COO-是弱酸根离子,会水解.消耗H2O电离出的H+,结合成CH3OOH分子.使得水中OH-多出.
所以,CH3COONa的水溶液显碱性.
(2)越弱越水解
盐中的离子对应的酸或碱的酸性越弱或碱性越弱,水解的程度越大.
如:Na2CO3和Na2SO3
CO3 -对应的酸是H2CO3;SO3 -对应的酸是H2SO3
由于H2CO3的酸性弱于H2SO3
则,CO3 -的水解程度比SO3 -的水解程度更大,结合的H+更多.
所以,Na2CO3的碱性比NaSO3的碱性强.
(3)双弱双水解
当盐中的阳离子对应的碱是弱碱并且盐中的阴离子对应的是弱酸时,则盐的这两种离子都会发生水解.阳离子水解结合水电离出的OH-;阴离子水解结合水电离出的H+,所以双水解发生的程度往往较大.
如:CH3COONH4 中的NH4+对应的碱是弱碱NH3*H2O ;CH3COO-对应的酸是弱酸CH3COOH
则NH4+和CH3COO-都会发生水解,NH4+结合OH-形成NH3*H2O;CH3COO-结合H+形成CH3COOH,相互促进,水解程度较大.
(4)谁强显谁性
主要是针对双水解的盐,即弱酸弱碱盐,由于盐中的阴离子水解结合H+,阳离子水解结合OH-
要判断盐溶液的酸碱性,则要比较阴离子的水解成度和阳离子的水解程度的大小.
如:(NH4)CO3 ,由于NH3的碱性比H2CO3的酸性强(实际上比较的是两者的电离度,中学不做要求,只需记忆),则NH4+的水解程度比CO3 -的水解程度弱,使得水溶液中消耗的H+更多,有OH-多出.
所以,(NH4)2CO3 溶液显碱性.
又如:CH3COONH4,由于NH3的碱性和CH3COOH的酸性相当,则NH4+的水解度和CH3COO-的程度差不多,使得水溶液中的H+和OH-也差不多.
所以CH3COONH4溶液显中性.
再如:(NH4)2SO3,由于NH3的碱性比H2SO3的酸性弱,则NH4+的水解度比SO3 -的水解度大,使得水溶液中消耗的OH-更多,有H+多出.
所以,(NH4)2SO3溶液显酸性.
(二)根据盐类的不同,可分为:
强酸强碱盐(不水解);强酸弱碱盐;强奸弱酸盐;弱酸弱碱盐
(1)强酸弱碱盐
如:NH4Cl的水解离子方程式:
NH4+ + H2O =可逆= NH3*H2O + H+
强酸弱碱盐的水溶液一定显酸性.
(2)强碱弱酸盐
如:CH3COONa的水解离子方程式:
CH3COO- + H2O =可逆= CH3COOH + OH-
强奸弱酸盐的水溶液一定显碱性.
(3)弱酸弱碱盐
如:CH3COONH4的水
CH3COO- + NH4+ + H2O =可逆= CH3COOH + NH3*H2O
CH3COONH4水溶液显中性
如:NH4F的水
NH4+ + F- + H2O =可逆= NH3*H2O + HF
NH4F的水溶液显酸性.
如:NH4ClO的水解离子方程式;
NH4+ ClO- + H2O =可逆= NH3*H2O + HClO
NH4ClO的水溶液显碱性.
弱酸弱碱盐的酸碱性和阴离子与阳离子有关.
(三)多元弱酸或多元弱碱形成的盐的水解
多元弱酸或多元弱碱形成的盐的水解是分步进行的,一般第一步进行的程度,第二步甚至更多步的水解程度就很弱了.
如:Na2CO3的水
第一步程度很大:CO3 - + H2O =可逆= HCO3- + OH-
第二步程度很小:HCO3- + H2O =可逆= H2CO3 + OH-
【注意】:
大部分的盐的水解都不能进行彻底,所以一般盐的水解都要是可逆符号.
水解度较大的盐有Al2S3可认为几乎双水解彻底.
【以上都是一种盐中的离子水解.】
另外,还有2种盐中,分别有弱酸根离子和弱碱根离子,也会互相促进,发生双水解.
如:NaHCO3和AlCI3两种盐,如果把它们的溶液相混合,则会发生双水解,水解离子方程式如下:
3HCO3- + Al + == Al(OH)3↓ + 3CO2↑
注意:Al +和HCO3-双水解较彻底,可以用“==”而不用“可逆符号”
另外,所有的水解过程中一定有水参加,但是由于该水解反应,生
成物中有水,可以和反应物中的水刚好相互抵消,但方程式中没有水出现并不表明没有水参加.
【附】
(1)常见的弱酸根离子:SO3 - ;HSO3-;CO3 -;HCO3-;PO4 -;HPO4 -;ClO-;S -;HS-;CH3CO O-;SCN-;F-;AlO2-;C6H5O(苯酚根);NO2-(亚硝酸根)
常见弱酸的酸性排序:
H2SO3 > H3PO4> HF >HCOOH>C6H5-COOH>CH3COOH>H2CO3>H2S
亚硫酸磷酸氢氟酸甲酸苯甲酸醋酸碳酸氢硫酸
> HClO>C6H5-OH>HAlO2
次氯酸苯酚偏铝酸
(2)常见的弱碱离子:NH4+;Cu +;Fe +;Fe +;Al +
其中碱性排序:Fe(OH)2 > Fe(OH)3 > Cu(OH)2 > NH3*H2O > Al(OH)3。
