氨基酸多肽与蛋白质
二十二章节氨基酸多肽蛋白质和核酸

4〕与甲醛的反响:
〔2〕羧基的反响 1〕酸性
2〕酯化反响
3〕脱羧反响
〔3〕氨基、羧基共同参与的反响
1〕与水合茚三酮反响〔可用来鉴别α– 氨基酸〕: α-氨基酸可以和水合茚三酮发生呈紫色的反响:
O
OH O
+RCH O C H
OH
O
N2H
水合茚三酮
OO N
O OH
兰紫色
2) 成肽反响
第二十二章 氨基酸、多肽、蛋白质和核酸
(Amino acids、proteins and nucleic acids)
第二十二章
氨基酸、多肽、蛋白质和核酸 (Amino acids、proteins and nucleic acids)
一. 氨基酸的构造和命名 二. 氨基酸的性质 三. α – 氨基酸的合成 四. 多 肽 五. 核 酸
2.α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性碳,因此都具有
旋光性,且以L-型为主。
α-C为决定构型的碳原子:
3. 命名:由来源、性质命名。
氨基酸构型习惯用D、L标记,主要看α– 位手性碳, NH2 在右为D – 型, NH2在左为L – 型。
COOH
H 2N
H
CH3
L – 丙氨酸
自然界存在的氨基酸一般都是α– 氨基酸,而且是L–型。
O
O
RCH O C+ HCl RCH O CH Cl
N3H
N3H
O
O
RCH O C+NaOHRCH O C N+a
N3H
N2H
O R CHC O
NH2
OH H+
O R CHC O
氨基酸、多肽与蛋白质

形成一级结构的化学键:
•肽键(主要化学键) •二硫键
目录
一级结构是蛋白质空间构象和特异生物学功能 的基础,但不是决定蛋白质空间构象的唯一因素。
目 目录 录
三、多肽链中的局部特殊构象是 蛋白质的二级结构
Genome Project) 。
21世纪,蛋白质组学 (Proteomic) 。
目录
一、蛋白质的生物学重要性
1. 蛋白质是生物体重要组成成分 分布广:所有器官、组织都含有蛋白质;细胞的 各个部分都含有蛋白质。 含量高:蛋白质是细胞内最丰富的有机分子,占 人体干重的 45%,某些组织含量更高, 例如脾、肺及横纹肌等高达80%。
目录
O NH2-CH-C H
甘氨酸
+
OH
O NH-CH-C H
甘氨酸
H
OH
-HOH
O O NH2-CH-C-N-CH-C H HH OH
甘氨酰甘氨酸
目录
肽键
* 肽是由氨基酸通过肽键缩合而形成的化合
物。 * 两分子氨基酸缩合形成二肽,三分子氨基
酸缩合则形成三肽……
* 由十个以内氨基酸相连而成的肽称为寡肽
目录
1951年, Pauling采用X(射)线晶体衍射发现了蛋
白质的二级结构——α-螺旋(α-helix)。
1953年,Frederick Sanger完成胰岛素一级序列测定。
1962年,John Kendrew和Max Perutz确定了血红蛋
白的四级结构。
20世纪90年代以后,后基因组计划(Post-Human
下公式推算出蛋白质的大致含量: 100克样品中蛋白质的含量 ( g % ) = 每克样品含氮克数× 6.25×100 1/16%
第16章 氨基酸、肽和蛋白质

茚三酮
C C O OH C OH O NH2 + RCHCOOH
水合茚三酮
C C O C O N O C C C HO + RCHO + CO2
蓝色或紫红色
是鉴别α-氨基酸的灵敏的方法——既可定性,又可定量。
8
若为亚氨基,与茚三酮作用,则呈黄色。 例: O C C OH C OH O + NH2 C COO C
的由 排基 列因 顺上 序的 决遗 定传 的密 。码 猪胰岛素分子的一级结构
17
二、蛋白质的二级结构(高级结构) 指多肽链主链在一级结构的基础上进一步的盘旋或折叠的方式 ——局部空间排列。 二级结构的主要形式 α-螺旋、β-折叠、β-转角、γ-转角、无规卷曲 1、α-螺旋 各肽键平面通过α-碳原子的旋转,围绕中心轴形成的一种紧密 螺旋盘曲构象。它是最常见、含量最丰富的二级结构。
OH R CH COOH NH3 H R CH COO NH3 H OH R CH COO NH2
pH<pI
pH=pI
pH>pI
注意点: 等电点为氨基酸分子呈电中性,而不是溶液的pH为中性。 例: 丙氨酸(中性) 谷氨酸(酸性) 赖氨酸(碱性) pI = 6.02 pI = 3.22 pI = 9.74
+
O 弱碱 + N H 2 -C H -C R NO2 O 2N O OH +
NO2
O
F
肽链
O 2N
N H -C H -C R
肽链
N H -C H -C R
混合氨基酸
黄色
二、C-端分析(羧酸多肽酶法) 用羧酸多肽酶水解多肽,只有靠近游离羧基的一个肽键可被水 解,再分离鉴定。
有机化学氨基酸、多肽、蛋白质

6 种异构体 24种异构体
许多种氨基酸按照不同的排列顺序, 构成了自 然界中种类繁多的多肽和蛋白质。
命名多肽时以C-末端的氨基酸残基为母体, 由 N-端叫起, 依次称为某氨酰(基)某氨酸。
O
O
O
H2N CHC NH CH2C NH CHC OH
N-端
CH3
CH2
C-端
丙氨酸残基 甘氨酸残基 苯丙氨酸残基
利用蛋白质分子胶体颗粒大不能透过半透膜 的性质可将蛋白质分离提纯,这种方法称为透析 法(dialysis)。
(三)蛋白质的沉淀和变性
调节蛋白质溶液的pH值至等电点, 再加入适当的脱水剂除去蛋白质分子表 面的水化膜, 可使蛋白质分子聚集而从溶液中沉淀析出。
根据生成紫色化合物颜色的深浅程度,或根据放出
CO2气体的体积,可对 α-氨基酸 进行定量分析。 也常用于层析实验中氨基酸的显色。
第二节 肽肽ຫໍສະໝຸດ 氨基酸残基之间彼此通过酰胺键 (肽键)连 接而成的一类化合物。其通式为:
RO
R’ O
H2N C-C-OH + H N C-C-OH
H
HH
A氨m基ino酸acid
第十四章 氨基酸、蛋白质
第一节 氨基酸
一、氨基酸的分类、命名和构型
氨基酸的结构特点
①都是α-氨基酸(脯氨酸是
α–亚氨基酸); H N
COOH H
R CH COO- 内盐
NH3+
偶极离子
②除甘氨酸外,都是L-氨基酸(左旋);
③各氨基酸侧链R基团不同,氨基酸结构和性质有差异
1、分类
据化学结构:
任何一种蛋白质分子在天然状态下均具有独特 而稳定的构象,这是蛋白质分子在结构上最显著的 特点。为了表示蛋白质分子不同层次的结构,常将 蛋白质分子结构分为一级、二级、三级和四级。一 级结构又称为初级结构或基本结构,二级结构以上 属于构象范畴,称为高级结构。
第十六章 氨基酸、多肽和蛋白质

OH R CH COOH +N2
+ H2O
若定量测定反应中所释放的N2的体积,即可计算出 氨基酸的含量,此方法称为van Slyke氨基氮测定法,常
用于氨基酸和多肽的定量分析。
第二节 肽
一、肽的结构和命名
肽是氨基酸残基之间彼此通过酰胺键相连而成的一 类化合物。 肽分子中的酰胺键又称为肽键(peptide bond)。 二肽可视为一分子氨基酸中的-COO―与另一分子氨基 酸中的NH3+脱水二成的。肽也是以两性离子的形式存在。
OH
H+
等电点 脱水
OH
H+
- - 带负电荷 脱水
OH
H
+
- - - -
(五)蛋白质的颜色反应 蛋白质分子内含有许多肽键和某些带有特殊基团的 氨基酸残基,可以与不同试剂产生特有的颜色反应,利 用此性质可鉴别蛋白质。
反应名称 试剂 颜色 作用基团 缩二脲反应 强碱、稀硫酸铜溶液 紫色或紫红色 肽键 茚三酮反应 稀茚三酮溶液 蓝紫色 氨基 蛋白黄反应 浓硝酸、再加碱 深黄色或橙红色 苯环 亚硝酰铁氢化钠 亚硝酰铁氢化钠溶液 红色 巯基
(五)氧化脱氨反应 氨基酸中的氨基能被 H2O2 或 KMnO4 等强氧化剂所氧 化,脱氨而生成α―酮酸。
[O]
R CH COOH NH2
R CH COOH + H2O NH
R C COOH + NH3 O
(六)氨基酸与亚硝酸的反应 氨基酸与亚硝酸作用,可定量释放氮气
+ NH3 R CH COO
+ H2NO2
使蛋白质发生沉淀的现象称为盐析(saltingout)。常用
的盐析剂有(NH4)2SO4、Na2SO4、NaCl和MgSO4等。
有机化学氨基酸
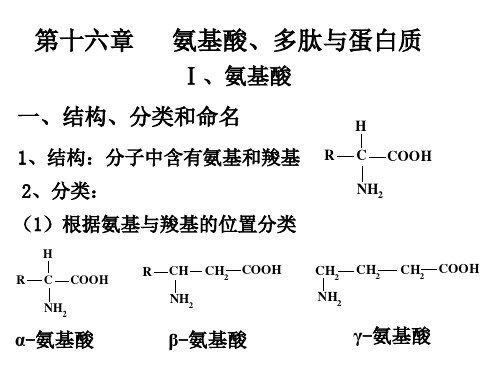
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
氨基酸,多肽,蛋白质的关系
氨基酸,多肽,蛋白质的关系
氨基酸是构成蛋白质的基本单元,是一类含有羧基(-COOH)和氨
基(-NH2)的有机分子。
它们通过共价键结合形成多肽,多个多肽之
间再形成蛋白质。
氨基酸在蛋白质中的序列是非常重要的,因为它们决定了蛋白质
的结构和功能。
蛋白质的结构包含着四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是氨基酸序列的线性排列;二级结构
包括α螺旋和β折叠;三级结构是主链的三维摆动,使得氨基酸侧
链在空间上排列成为蛋白质的特定形状;四级结构是由两个或多个链
相互作用而形成的复杂蛋白质结构。
蛋白质的功能非常广泛,包括结构支持、酶催化、信号传导和免
疫保护等。
每个蛋白质的功能都与它的结构密切相关,因此对于蛋白
质的结构和功能的研究非常关键。
一种具有特定功能的蛋白质的序列通常由数百个甚至上千个氨基
酸组成。
不同的氨基酸组成不同的序列,则产生不同的蛋白质结构和
功能。
在人体中,氨基酸可以由体内合成或外源性摄取获得。
不同种类
的氨基酸在人体中的相对含量不同,因此也影响了蛋白质的合成和功能。
总之,氨基酸、多肽和蛋白质之间是密不可分的关系。
氨基酸是
构成蛋白质的基本单元,而多个氨基酸结合形成多肽,多个多肽之间
再形成蛋白质。
蛋白质的序列和结构决定了其功能,因此研究氨基酸、多肽和蛋白质的相互关系对于解决人类健康问题具有重要意义。
16 氨基酸、多肽、蛋白质
氨基酸、多肽、蛋白质
内容
第一节 氨基酸 第二节 多肽 第三节 蛋白质简介
第十六章 氨基酸、多肽、蛋白质
1
蛋白质:
含氮的天然高聚物,生物体内一切组织的基本组成部分。 除水外,细胞内80%都是蛋白质。在生命现象中起重要的作 用。人类的主要营养物质之一。
如:
酶(球蛋白)——机体内起催化作用 激素(蛋白质及其衍生物)——调解代谢 血红蛋白——运输O2和CO2 抗原抗体——免疫作用
CH2 O C Cl + NH2 CH COOH
O
R
CH2 O C NH CH COOH
苄氧甲酰氯的酰基易引入,对以后应用的种种试剂较稳定,同时 还能用多种方法把它脱下来。
(2)氨基的烃基化: (与RX作用)
NO2
NO2
R
F + NH2 CH COOH
NO2
NO2 R NH CH COOH
氟代二硝基苯在多肽结构分析中用作测定N端的试剂。
丝胺酸 Ser
COOH N
H
NH2
HO
CH2CH COOH
脯胺酸 酪胺酸
pro Tyr
NH2 CH2CH COOH
N H
*色胺酸 Trp
第十六章 氨基酸、多肽、蛋白质
等电点 5.47 5.68 6.30 5.66 5.89
7
结构 II 酸性
NH2 HOOC CH2CH COOH
NH2 HOOC (CH2)2CH COOH
COOH
H2N
H
第十六章 氨基酸、多肽、蛋白质
CH2SH 4
下列19种氨基酸可组成无数蛋白质:
结构
名称
缩写
等电点
十五 氨基酸、多肽、蛋白质、核酸
DNA OH H OH H 核糖 核苷酸 H OH H 核苷 O NH2 N N HN N 碱基 N N H2N N N H H
磷酸 腺嘌呤(A)
HO
NH2 N O N H
O HN O N H
CH3
鸟嘌呤(G) 胞嘧啶(C) 胸腺嘧啶(T)
二 核酸的结构
HO
A O H H O P O H H O O P O H H O O P O OOO H H H OO H H H C H H H G
(3) 变性 蛋白质受热、紫外线及某些化学试剂(如HNO3、 Cl3CCOOH、苦味酸、单宁酸、重金属盐Cr3+、Hg2+、As3+等) 作用时,蛋白质的结构、性质发生变化,失去生理活性。如煮鸡 蛋、生皮鞣制等。蛋白质的变性一般为不可逆的。
第三节
一 核酸的组成
核酸
根据所含糖不同,将核酸分核糖核酸(RNA)和脱氧核糖核酸(DNA)
3
CH2CH2-NH2 N NH 组胺
组氨酸
4
氨基和羧基的反应
A 脱水反应 -氨基酸失水
O H3C H2N CH3 H3C HN O O NH CH3
C OH HC CH + HO C NH2 O
-氨基酸失水
环状交酰胺
R CH CH2 COOH NH2
R CH CH COOH + NH3
, -不饱和酸
1 定义
多肽与蛋白质
由氨基酸相互脱水形成的聚酰胺称为肽(peptides)或蛋白质
肽键
N端
H O H O O H O H + NH3 C C N C C N C C N C C H R2 H R3 H R4 OR1
四肽
有机化学第15章氨基酸多肽与蛋白质
H+ 水解 105oC
NHCH 2 CN H C H C NHCHCOH CH 3 CH 2 C 6 H 5 NO 2
DNFB-Gly-Ala-Phe
O O 2N NH CH 2 COH NO 2 O O + H 2 N CHC O H + H 2 NC HCOH CH 3 CH 2 C 6 H 5
甜菜碱
存在于多种蛋白性的动物保护组织(如毛发、角、指甲)中,通过氧化还 NH 2 原而相互转化。
-2 H 2 H SC H 2C H C O O H 2H NH2 SC H 2C H C O O H NH 2 SC H 2C H C H 2O O H
半胱氨酸
胱氨酸
3. 色氨酸
N H
C H 2C H C O O H NH2
R CH NH2 CH2 COOH R CH CH COOH
β-氨基酸受热失氨形成α, β-不饱和酸
R CH NH2 CH 2 C H 2CO O H R HC HN
H2 C CH2 + H O 2 C O
γ -氨基酸受热分子内氨基与羧基失水形成内酰胺(五元环内酰胺)
H2 C R CH NH2 CH2 CH2 C H 2C O O H HN C O CH 2 R HC CH 2
一 氨基的保护
1. 用氯代甲酸苯甲酯(或称苯甲氧基甲酰氯)保护
O
C6H5CH2OH+COCl2(光气)
C 6 H 5 CH 2 OCCl
Benzoxycarbonyl(简写Cbz)
反应过程:
+NH 3CH2CO2 -
O
C 6 H 5 CH 2 OCCl
O C 6 H 5 CH 2 OC-N H C H 2 C O O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十五章 氨基酸、多肽与蛋白质
(Amino Acids,Peptides and Protein )
一、教学目的和要求
1.掌握氨基酸的分类、常见氨基酸的结构和名称。
2.掌握氨基酸的化学性质。
3.理解多肽的一般结构。
4.了解蛋白质的一级结构 、二级结构、三级结构和四级结构。
5.了解蛋白质的性质。
6.了解氨基酸、蛋白质在生命活动中的重要意义。
二、教学重点与难点
重点是氨基酸的化学性质。
难点是蛋白质的一级结构 、二级结构、三级结构和四级结构。
三、教学方法和教学学时
(1)教学方法:以课堂讲授为主,结合必要的课堂讨论。
教学手段以板书和多媒体相结合,配合适量的课外作业。
(2)教学学时:2学时 四、教学内容 1、氨基酸。
2、多肽。
3、蛋白质。
4、核酸。
五、总结、布置作业
15.1 氨基酸Amino Acids
一、氨基酸的结构和分类
在蛋白质中常见的氨基酸约20种,除脯氨酸外都是α-氨基酸,除甘氨酸外都含手性碳原子且大多
为 L-构型。
组成蛋白质常见的氨基酸有20种,除甘氨酸外,其他氨基酸都有手性碳原子,具有旋光性,其构型
L 型,投影在右的为D 型。
D 、L 氨基酸在生理活性上差别很大。
二、氨基酸的化学性质
1. 氨基酸的两性和等电点
研究表明,氨基酸晶体是以偶极离子的形式存在的:
R-CH-COO NH 2
R-CH-COO -
N +
H 3
R-CH-COOH N +
H 3
H 3O +
OH
OH
H O +
氨基酸在溶液中的存在形式与溶液的pH 值有关,如果调节pH 使氨基酸成为正负电荷相等的偶极离子,
此时溶液的pH 值称为该氨基酸的等电点(pI) 等电点是每一种氨基酸的特定常数。
当pH <pI ,主要以正离子形式存在,在电场中会向阴极移动; 当pH >pI ,主要以负离子形式存在,在电场中会向阴极移动; 当pH =pI ,主要以偶极离子形式存在,在电场中会向阴极移动; 2. 与亚硝酸反应 放出氮气((Van Slyke 定氨基法)
R-CH-COOH +NH 2
HNO 2
R-CH-COOH +OH
N 2O H
2
测定放出的氮量,便可计算分子中氨基的含量。
3. 与甲醛反应
R-CH-COOH NH 2
HCHO
HOCH 2-N-CH 2OH
R-CH-COOH
甲醛固定氨基后,便可用碱滴定羧基。
原理:-OH 的-I 效应降低了N 原子上的电子云密度,使氨基的碱性消失,再用碱滴定-COOH ,从而测定氨基酸的含量——氨基酸的甲醛滴定法。
4. 络合性能
R CH O Cu O R CH
O
N H 2O
NH 2
5. 氨基酸的受热反应 α-氨基酸:
C
H 3NH 2
O
3
H C
H 3NH O
CH 3
NH
O
β- γ
- δ- 氨基酸脱水与相应的羟基酸脱水相似。
6. 与水合茚三酮反应——生成兰紫色物质
O
O
OH OH H 2N-CH-COOH
R
O O
OH
O
N
此反应可用来鉴别氨基酸。
7. 失羧作用
-CH-COOH
NH 2
H 2N-CH 2(CH 2)3Ba(OH)2-CO 2
H 2N-(CH
2)5
-NH 2
赖氨酸 尸胺
蛋白质腐烂时之所以极臭就是因为生成了剧毒的尸胺和腐肉胺(1,4-丁二胺)。
8. 失羧和失氨作用
(CH 3)2CHCH 2-CHCOOH + H 2O
NH 2
(CH 3)2CHCH 2CH 2OH
2 + NH 3
15.2 多肽Peptides
二肽的形成:
H 2
N-CH-COOH R
2N-CH-COOH
R'
H 2NCH-C-NHCHCOOH
O
R
R'
N H 2CH 2C N H
CH COOH
O
CH 3
N H 2
CH C N H
CH 2COOH
O CH 3
氧化型谷胱甘肽:
COOH
CHCH 2CH 2
N H 2C
N H
CH O
C
N H
CH 2COOH O COOH
CHCH 2CH 2
N H 2C
N H
CH O
C
N H
CH 2COOH O CH 2
S CH 2S
15.3 蛋白质Protein
一、组成和分类
蛋白质是由各种α-氨基酸通过酰胺键即肽键联成的长链分子,这种长链称肽链。
蛋白质水解后得多肽,多肽再继续水解最终分解成α-氨基酸。
蛋白质与多肽的关系犹如多糖与低聚糖,分子量大的叫蛋白质,分子量小的叫多肽,但蛋白质与多肽之间并无严格的界限。
蛋白质的主要组成元素是C 、H 、O 、N 、S ,有些蛋白质还含有P 、Fe 、I 、Mn 、Zn 等其他元素。
其中蛋白质的含N 量平均约 16%,即每克N 相当于6.25克蛋白质。
因此在农产品分析中,一般用定氮法测出样品中的含氮量,再推算出样品中的蛋白质的近似含量,称为粗蛋白含量:
粗蛋白%= N% × 6.25
单纯蛋白:水解最终产物只有氨基酸。
结合蛋白:由单纯蛋白和非蛋白质结合而成,彻底水解后除产生氨基酸外尚有辅基(如核酸、糖类、脂肪…)。
二、结构:
1、蛋白质分子的一级结构(肽链)
一级结构是指组成蛋白质分子的氨基酸的种类和排列顺序。
2、蛋白质分子的空间结构
在蛋白质分子中,多肽链内部或多肽链之间在三维空间上有其特定的走向和排布,可以呈现螺旋、折叠、蜷曲等形状,从而形成蛋白质特有的稳定构象。
β-折片:
肽链中CO-N 单键实际上约有40% 的双键特性。
O
N
O+
经X-射线测定,肽链若成平面排列,应有如下结构:
N
H
N
H
相邻肽链相互以氢键维系,若肽链中所有C-N 键共平面,是不可能存在的,因为
R基相互间有较大的排斥力。
若将红色部分稍向上或向下旋转少许,形成折片,使R基分别处于折片的折线位置,R基的排斥力即可消除。
经测定,重复单位的实际长度仅为0.70 nm。
N
H
O
N
H
H
N
N
H H
β-折片结构可用下列球棍模型表示:
α-螺旋结构:
毛发、角壳等纤维蛋白的二级结构主要是这种形式。
α-螺旋结构可用下图表示:
3、维持蛋白质构象的作用力:
维持蛋白质构象的作用力有氢键、疏水作用力、范德华作用力、离子键、二硫键和配位键。
三、蛋白质的理化性质
1、 1、 蛋白质的两性和等电点
蛋白质多肽链的N -端有氨基,C -端有羧基,其侧链上也常有碱性基团和酸性基团,因此蛋白质和氨基酸相似,也具有两性性质和等电点。
2、 2、 蛋白质的胶体性
蛋白质是高分子化合物,粒子的大小均在1-100nm 之间,属于胶体分散系范围,所以蛋白质溶液具有胶体性质。
3、 蛋白质的沉淀
分可逆沉淀与不可逆沉淀。
3、 3、 蛋白质的变性
蛋白质因受物理或化学因素的影响,改变了分子内部特有的结构,导致理化性质发生改变,生理活性丧失,称为蛋白质的变性。
4、 4、 蛋白质的水解
简单蛋白质彻底水解后都生成α-氨基酸。
6、 蛋白质的颜色反应 A 、缩二脲反应 B 、茚三酮反应
C 、黄蛋白反应
O
H O
O
-
O
OH
S
S
C 2H 5H 7C 3C 3H 7
H 5C 2
CH 3CH 2OH CH 3
CH 2OH
N +H 3。
