氨基酸、多肽,蛋白质
第17章氨基酸和蛋白质-新(4)

(一)两性电离和等电点
分子内部酸性基团和碱性基团所形成的盐称 为内盐。内盐分子中包含正、负离子两部分, 所以又称为两性离子(zwitter-ion)或偶极 离子。偶极离子即可与较强的酸反应,又可 与较强的碱反应,表现出两性化合物的特性。
(二)蛋白质的高级结构
蛋白质分子的多肽链并不是以完全伸展的线 状形式存在,而是通过分子中Cα —H、Cα — N单键的旋转而盘曲、折叠形成特定的三维 空间结构,这种空间结构称为蛋白质的高级 结构。
1.蛋白质的二级结构
蛋白质的二级结构主要指的是多肽链中 原子的空间排布。
N原子上的孤电子对与羰基之间形成共 轭体系,使得C—N单键具有部分双键性质, 限制了肽键的自由旋转。实际上,肽键具有 平面结构,称为肽键平面。其中Cα 1、羰基 碳和氧、氮和氢以及Cα 2共六个原子在同一 平面上,氧原子和氢原子呈反式。
中性氨基酸的pI在5.1~6.5之间
(二)显色反应
α -氨基酸与水合茚三酮在水溶液中加热时, 能放出二氧化碳,并生成紫色的化合物,称 为罗曼氏紫。
O OH
-
R-CH-COO
2
+ OH
N+ H3
O
ONH4 O
N=
O
O
+ RCHO + CO2
水合茚三酮
罗曼氏紫
此反应灵敏度高,是鉴定α -氨基酸简 便而迅速的方法,常用于层析时显色。还可 根据颜色的深浅程度及放出的二氧化碳的量 测定α -氨基酸的含量。
a- 螺旋(b)
(2)β—折叠 又称为β—片层结构。β—折 叠指多肽链呈一种铺开的折扇形状,相邻两 个氨基酸残基的距离约700pm。若干条多肽 链或一条多肽链的若干片段平行排列,维系 和固定β—折叠的作用力仍然是氢键。 β-折叠有两种类型,一种是多肽链从N-末端 到C-末端的排列是同方向的,称为平行β-折 叠,另一种是从N-末端到C-末端的排列是反 方向的叫反平行β-折叠。
氨基酸、多肽与蛋白质

形成一级结构的化学键:
•肽键(主要化学键) •二硫键
目录
一级结构是蛋白质空间构象和特异生物学功能 的基础,但不是决定蛋白质空间构象的唯一因素。
目 目录 录
三、多肽链中的局部特殊构象是 蛋白质的二级结构
Genome Project) 。
21世纪,蛋白质组学 (Proteomic) 。
目录
一、蛋白质的生物学重要性
1. 蛋白质是生物体重要组成成分 分布广:所有器官、组织都含有蛋白质;细胞的 各个部分都含有蛋白质。 含量高:蛋白质是细胞内最丰富的有机分子,占 人体干重的 45%,某些组织含量更高, 例如脾、肺及横纹肌等高达80%。
目录
O NH2-CH-C H
甘氨酸
+
OH
O NH-CH-C H
甘氨酸
H
OH
-HOH
O O NH2-CH-C-N-CH-C H HH OH
甘氨酰甘氨酸
目录
肽键
* 肽是由氨基酸通过肽键缩合而形成的化合
物。 * 两分子氨基酸缩合形成二肽,三分子氨基
酸缩合则形成三肽……
* 由十个以内氨基酸相连而成的肽称为寡肽
目录
1951年, Pauling采用X(射)线晶体衍射发现了蛋
白质的二级结构——α-螺旋(α-helix)。
1953年,Frederick Sanger完成胰岛素一级序列测定。
1962年,John Kendrew和Max Perutz确定了血红蛋
白的四级结构。
20世纪90年代以后,后基因组计划(Post-Human
下公式推算出蛋白质的大致含量: 100克样品中蛋白质的含量 ( g % ) = 每克样品含氮克数× 6.25×100 1/16%
氨基酸_多肽

肽键的平面特征
15
15.5 蛋白质的结构 蛋白质也是由氨基酸以酰胺键形成的大分子化合物。 蛋白质与多肽并无严格的界线,通常是将相对分子量在 10000以上的多肽称为蛋白质。在10000以下的称为多肽。 蛋白质的结构可分为四级: 一级结构:氨基酸的连接顺序。 二级结构:肽链的的构象及通过链内或链间的氢键形 成的α-螺旋、β-折叠等结构。 三级结构:是指在二级结构基础上,肽链相互扭在一 起或卷曲成其他形状。
∆ R CH2NH2 + CO2 R CH COOH 或脱羧酶 NH2
8 脱羧和脱氨基反应
(CH3)2CHCH2CHCOOH + H2O NH2 酶 (CH3)2CHCH2CH2OH + CO2 + NH3
11
二 多肽和蛋白质
一个氨基酸分子的氨基与另一个氨基酸的羧基之间失 水形成的酰胺键称为肽键。
16
四级结构:是指由多条具有一、二、三级结构的肽链 通过非共价键连接起来的结构形式。
一 級 结 构
二 級 结 构
三 級 结 构
四 級 结 构
17
α-螺旋 多肽链中的各个肽平面围绕同一 轴旋转,形成螺旋结构,螺旋一 周,沿轴上升的距离即螺距为 0.54nm,含3.6个氨基酸残基;两 个氨基酸之间的距离为0.15nm; 肽链内形成氢键,氢键的取向几 乎与轴平行,第一个氨基酸残基 的酰胺基团的-CO基与第四个氨 基酸残基酰胺基团的-NH基形成 氢键。 蛋白质分子为右手α-螺旋。
6
2 与亚硝酸反应
R CH COOH + HNO2 NH2 R CH COOH + N2 + H2O OH
反应是定量进行的,可以根据放出氮气的量计算分子 中氨基的量。(范斯来克氨基测定法) 3 与醛反应
第十六章 氨基酸、多肽和蛋白质

OH R CH COOH +N2
+ H2O
若定量测定反应中所释放的N2的体积,即可计算出 氨基酸的含量,此方法称为van Slyke氨基氮测定法,常
用于氨基酸和多肽的定量分析。
第二节 肽
一、肽的结构和命名
肽是氨基酸残基之间彼此通过酰胺键相连而成的一 类化合物。 肽分子中的酰胺键又称为肽键(peptide bond)。 二肽可视为一分子氨基酸中的-COO―与另一分子氨基 酸中的NH3+脱水二成的。肽也是以两性离子的形式存在。
OH
H+
等电点 脱水
OH
H+
- - 带负电荷 脱水
OH
H
+
- - - -
(五)蛋白质的颜色反应 蛋白质分子内含有许多肽键和某些带有特殊基团的 氨基酸残基,可以与不同试剂产生特有的颜色反应,利 用此性质可鉴别蛋白质。
反应名称 试剂 颜色 作用基团 缩二脲反应 强碱、稀硫酸铜溶液 紫色或紫红色 肽键 茚三酮反应 稀茚三酮溶液 蓝紫色 氨基 蛋白黄反应 浓硝酸、再加碱 深黄色或橙红色 苯环 亚硝酰铁氢化钠 亚硝酰铁氢化钠溶液 红色 巯基
(五)氧化脱氨反应 氨基酸中的氨基能被 H2O2 或 KMnO4 等强氧化剂所氧 化,脱氨而生成α―酮酸。
[O]
R CH COOH NH2
R CH COOH + H2O NH
R C COOH + NH3 O
(六)氨基酸与亚硝酸的反应 氨基酸与亚硝酸作用,可定量释放氮气
+ NH3 R CH COO
+ H2NO2
使蛋白质发生沉淀的现象称为盐析(saltingout)。常用
的盐析剂有(NH4)2SO4、Na2SO4、NaCl和MgSO4等。
有机化学氨基酸
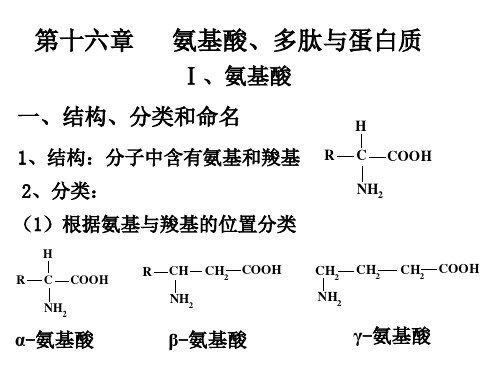
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
不同分子量肽的氨基酸组分

不同分子量肽的氨基酸组分
肽是由氨基酸通过肽键连接而形成的一类化合物,其分子量大小不同,可以分为小肽、寡肽、多肽和蛋白质。
以下是这些不同分子量肽的氨基酸组分特点:
1. 小肽:通常指的是由2-4个氨基酸组成的高活性肽。
这类肽的氨基酸组分相对较少,但它们在生物体内具有重要的生理功能,如调节代谢、促进生长等。
2. 寡肽:由2-10个氨基酸组成的肽,分子量一般在1000道尔顿以下。
寡肽的氨基酸组分相对较为简单,但它们在生物体内同样发挥着重要的生理作用,如抗菌、抗氧化等。
3. 多肽:由10-50个氨基酸组成的肽。
多肽的氨基酸组分相对较为复杂,可以包含多种不同的氨基酸。
这些多肽在生物体内具有广泛的生理功能,如激素、酶、抗体等。
4. 蛋白质:一般由51个以上氨基酸组成的肽。
蛋白质的氨基酸组分非常复杂,可以包含20种不同的氨基酸,且每种氨基酸的数量和排列顺序都不同。
蛋白质是生物体内最重要的分子之一,它们参与生物体的各种生理和生化过程,如酶催化、结构支撑、物质运输等。
氨基酸,多肽,蛋白质的关系
氨基酸,多肽,蛋白质的关系
氨基酸是构成蛋白质的基本单元,是一类含有羧基(-COOH)和氨
基(-NH2)的有机分子。
它们通过共价键结合形成多肽,多个多肽之
间再形成蛋白质。
氨基酸在蛋白质中的序列是非常重要的,因为它们决定了蛋白质
的结构和功能。
蛋白质的结构包含着四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是氨基酸序列的线性排列;二级结构
包括α螺旋和β折叠;三级结构是主链的三维摆动,使得氨基酸侧
链在空间上排列成为蛋白质的特定形状;四级结构是由两个或多个链
相互作用而形成的复杂蛋白质结构。
蛋白质的功能非常广泛,包括结构支持、酶催化、信号传导和免
疫保护等。
每个蛋白质的功能都与它的结构密切相关,因此对于蛋白
质的结构和功能的研究非常关键。
一种具有特定功能的蛋白质的序列通常由数百个甚至上千个氨基
酸组成。
不同的氨基酸组成不同的序列,则产生不同的蛋白质结构和
功能。
在人体中,氨基酸可以由体内合成或外源性摄取获得。
不同种类
的氨基酸在人体中的相对含量不同,因此也影响了蛋白质的合成和功能。
总之,氨基酸、多肽和蛋白质之间是密不可分的关系。
氨基酸是
构成蛋白质的基本单元,而多个氨基酸结合形成多肽,多个多肽之间
再形成蛋白质。
蛋白质的序列和结构决定了其功能,因此研究氨基酸、多肽和蛋白质的相互关系对于解决人类健康问题具有重要意义。
16 氨基酸、多肽、蛋白质
氨基酸、多肽、蛋白质
内容
第一节 氨基酸 第二节 多肽 第三节 蛋白质简介
第十六章 氨基酸、多肽、蛋白质
1
蛋白质:
含氮的天然高聚物,生物体内一切组织的基本组成部分。 除水外,细胞内80%都是蛋白质。在生命现象中起重要的作 用。人类的主要营养物质之一。
如:
酶(球蛋白)——机体内起催化作用 激素(蛋白质及其衍生物)——调解代谢 血红蛋白——运输O2和CO2 抗原抗体——免疫作用
CH2 O C Cl + NH2 CH COOH
O
R
CH2 O C NH CH COOH
苄氧甲酰氯的酰基易引入,对以后应用的种种试剂较稳定,同时 还能用多种方法把它脱下来。
(2)氨基的烃基化: (与RX作用)
NO2
NO2
R
F + NH2 CH COOH
NO2
NO2 R NH CH COOH
氟代二硝基苯在多肽结构分析中用作测定N端的试剂。
丝胺酸 Ser
COOH N
H
NH2
HO
CH2CH COOH
脯胺酸 酪胺酸
pro Tyr
NH2 CH2CH COOH
N H
*色胺酸 Trp
第十六章 氨基酸、多肽、蛋白质
等电点 5.47 5.68 6.30 5.66 5.89
7
结构 II 酸性
NH2 HOOC CH2CH COOH
NH2 HOOC (CH2)2CH COOH
COOH
H2N
H
第十六章 氨基酸、多肽、蛋白质
CH2SH 4
下列19种氨基酸可组成无数蛋白质:
结构
名称
缩写
等电点
第五课蛋白质和多肽的氨基酸序列测定
第三节 影响N端Edman反应裂解率的因素
在测序中往往可以发现,即使N端很均一的蛋白质(第一个循环出现单 个氨基酸残基),经过十几个循环后背景明显不及第一个残基清晰。这是 由于Edman反应是一个化学过程,在其耦联、裂解、转化等步骤都有可 能发生一些副反应,从而影响最终裂解效率。目前最佳产率为95%~98 %。因此,经过50次循环后,PTH—氨基酸分析谱中将出现较多杂峰, 影响正确辨认,也就是说对于一般蛋白质最多能分析至N端第50个氨基 酸左右,欲知全顺序,则需将蛋白质降解成一系列肽段分析后再拼接。 ①对于有些蛋白质由于含有较多的对Edman反应敏感的残基或肽键,裂 解效率将更低。 ②循环至Ser和Thr时产率突然降低,这是因为在进行这两个氨基酸残基 分析前一个循环中,三氟乙酸除起裂解作用外,可能与Ser和Thr上的羟 基反应,继而部分封闭Ser和Thr的N端—氨基。 ③另外,丝氨酸和苏氨酸的PTI-{{汀生物也会部分转化成其他产物,造 成产率的降低。 耦联试剂PITC本身也将发生下列副反应,形成一些“杂质”。测序完 成 后,电脑将每个循环的产率处理,得出起始产率(initial yield)和重复产 率 (repetitive yield),其中通过起始产率可以估计蛋白质的真实含量, 有时可以推测N端是否封闭(和氨基酸组成分析测得的含量相差甚远),而 重复产率则表明机器是否正常运转。另外,如果蛋白质或多肽中含有 过多的Ser、Thr、Glu、Trp等氨基酸残基,也将降低这两个数值。
四、影响C端测序反应产率的因素 C端测序副反应较多,最高初始产率仅为20%,而对于Glu,Asp, Ser,Thr等氨基酸,其产率将更低。如C端富含上述几种氨基酸,测序 将十分困难。另外,一旦遇到Pro,由于吡咯环的存在而不能与乙酸酐 反应成环,整个测序过程将终止。 到目前为止,C端测序可测1~10个残基,一次测序需要的量比N端测 序要大得多,至少需1nmol。 此外,因为不同的氨基酸反应产率不同,所以,对图谱的分析也比N 端测序复杂,需要较多的经验。目前C端测序结果最好的一个样品是马 肌红蛋白原,可测C端10个以上残基,通常将其作为标准样品来判断仪 器的稳定性。 另外,由于副反应的存在,有的氨基酸将生成不止一种ATH衍生物。 如Arg的ATH衍生物可能被乙酰化或烷化;Tyr-ATH可被乙酰化;Cys 被修饰后将形成丙烯酰胺化的Cys-ATH以及脱氢Ala-ATH;脱水ThrATH将产生两个非对映异构体。
十五 氨基酸、多肽、蛋白质、核酸
DNA OH H OH H 核糖 核苷酸 H OH H 核苷 O NH2 N N HN N 碱基 N N H2N N N H H
磷酸 腺嘌呤(A)
HO
NH2 N O N H
O HN O N H
CH3
鸟嘌呤(G) 胞嘧啶(C) 胸腺嘧啶(T)
二 核酸的结构
HO
A O H H O P O H H O O P O H H O O P O OOO H H H OO H H H C H H H G
(3) 变性 蛋白质受热、紫外线及某些化学试剂(如HNO3、 Cl3CCOOH、苦味酸、单宁酸、重金属盐Cr3+、Hg2+、As3+等) 作用时,蛋白质的结构、性质发生变化,失去生理活性。如煮鸡 蛋、生皮鞣制等。蛋白质的变性一般为不可逆的。
第三节
一 核酸的组成
核酸
根据所含糖不同,将核酸分核糖核酸(RNA)和脱氧核糖核酸(DNA)
3
CH2CH2-NH2 N NH 组胺
组氨酸
4
氨基和羧基的反应
A 脱水反应 -氨基酸失水
O H3C H2N CH3 H3C HN O O NH CH3
C OH HC CH + HO C NH2 O
-氨基酸失水
环状交酰胺
R CH CH2 COOH NH2
R CH CH COOH + NH3
, -不饱和酸
1 定义
多肽与蛋白质
由氨基酸相互脱水形成的聚酰胺称为肽(peptides)或蛋白质
肽键
N端
H O H O O H O H + NH3 C C N C C N C C N C C H R2 H R3 H R4 OR1
四肽
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OH-
NH2
RCH
H+
COO-
pH > pI
当一种氨基酸溶液的pH调至某一特定值,氨基酸刚好以偶
极离子存在,此时正、负电荷相等,静电荷为零,在电场中不
发生移动。此时溶液的pH值称为该氨基酸的等电点(Isoelectric
Point), 用 pI 表示。
11
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (四、氨基酸的性质)
邓健 制作 张鲁雁 审校
10
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (四、氨基酸的性质)
二、氨基酸的性质 (一) 氨基酸的酸碱性和等电点
在水溶液中氨基酸以阳离子、阴离子和偶极离子三种形式 存在,它们之间形成一动态平衡。
NH3+ OHRCH
H+ COOH
pH < pI
NH3+
RCH COO-
CHO
COOH
HO H L-甘油醛 H2N H L型
CH2OH
R
甘氨酸 无手性
丝氨酸 S-型 L-型
半胱氨酸 R-型 L-型
按D、L标记:除甘氨酸外,都有手性且为L-构型。
按R、S标记:所有手性的-碳原子构型(除半胱氨
Hale Waihona Puke 酸 -碳为R型外)都是S-构型。
7
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (一、结构分类命名)
固态时IR没有COOH的吸收峰 ,X衍射显示 羧基和氨基均成离子状态。
内盐结构, 使其物理性质与一般有机化合物
不同, 如熔点较高 (> 200C),大多难溶于有机溶
剂, 而易溶于强酸、强碱等极性溶剂中。
6
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (一、结构分类命名)
20种常见氨基酸均为-氨基酸,其构型:
(四)营养必需氨基酸
在人亮体写、内不异一能亮本合、亮成缬或、色合苯书成丙量、来不蛋看足、,苏必、需色由、食赖物8种蛋氨白基质酸补 充才(能缬维持异机苯体亮正常色生苏长发赖育蛋,称)为营养必需氨基酸。
讨论:
1、不同年龄段,各种氨基酸的需要量不一样。 2、不同的食物中各种氨基酸的种类和含量不同。动 物蛋白所含的氨基酸的种类和比例与人体所需的相近。 营养价值高。 3、为了营养均衡,不要偏食,注意食物的合理搭配。
缬氨酸
谷氨酸
5.96
不带电荷 不动
3.22
-
正极
赖
pH6.0
--
缬
谷
+ ++ +
在电泳仪中分离氨基酸
14
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (四、氨基酸的性质)
(二) 氨基酸的脱羧反应
-氨基酸与氢氧化钡一起加热或在高沸点溶剂
中回流, 可发生脱羧反应, 失去二氧化碳而得到胺。
R CH COO- OH-
把氨基当作取代基, 以羧酸做母体, 称为氨基某酸。 氨基的位置习惯上用希腊字母α、β、γ 等表示。
2. 俗 名
按其来源或性质命名。如天门冬氨酸最初由天 门冬的幼苗中发现; 甘氨酸因其具有甜味而得名。
英文缩写符号:Glu, Gly, Ile 中文简称:谷、甘、异亮
9
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (一、结构分类命名)
3
第十七章 氨基酸、多肽和蛋白质
【前言】
蛋白质是生物体内极为重要的一种生物大 分子,有着非常重要的生理功能,如机体内起 催化作用的酶、调节代谢的激素及起免疫作用 的抗体都是蛋白质。
几乎全部生命现象和所有细胞活动最终都 是通过蛋白质的介导来表达和实现的。
因此没有蛋白质就没有生命。
蛋白质 H2O
酸、碱或酶
(二) 氨基酸的分类
+
H3N CH
脂肪族氨基酸
COO-
中性氨基酸
非极性或疏水性的氨基酸
含芳环的氨基酸 R 极性但不带电荷的氨基酸
含杂环的氨基酸 医学上 带负电荷氨基酸(酸性氨基酸)
带正电荷氨基酸(碱性氨基酸)
8
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (一、结构分类命名)
(三) 氨基酸的命名 1. 系统命名法
NH3+
R CH2 NH2
CO2
在细菌或酶的作用下脱羧反应也可在常温下进行。
H CH2 C
CO2-
脱羧酶
CH2 CH2
N NH
NH3+
N NH NH2
CO2
NH2 CH2CH2CH2CH COOH -CO2 NH2 CH2CH2CH2CH2NH2
第17章 氨基酸 多肽和蛋白质
1
【内容提要】
第一节 氨基酸
结构 分类 命名 性 质
第二节 肽
结构 命名
肽键平面
第三节 蛋白质
元素组成 分类 结构 性质
2
【教学要求】
1.掌握氨基酸的结构特点、分类、命名和化 学性质;掌握肽的结构和命名;掌握蛋白质 的一级结构、理化性质。 2.熟悉肽链结构分析方法,蛋白质的二级结 构。 3.了解氨基酸和活性肽在医学上的意义、蛋白 质的三级和四级结构。
多肽 H2O
酸、碱或酶
α-氨基酸
-氨基酸是组成蛋白质的基本单位。
4
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (一、结构分类命名)
第一节 氨基酸
氨基酸(Amino Acid)是分子内同时含有氨 基和羧基的化合物。根据氨基和羧基的相对 位置, 有α、β、γ……-氨基酸等。
CH3CHCOOH NH2CH2CH2COOH NH2CH2CH2CH2COOH
(pH<4) (pH<7) (pH>7.5) 12
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (四、氨基酸的性质)
问题:在下面的实验中,各氨基酸将向何方移动?
能否用此法来分离氨基酸?
13
第十七章 氨基酸、多肽和蛋白质
问氨题基解酸 答:
赖氨酸
pI
pH6.0所带电荷 电泳方向
9.74
+ 负极
第一节 氨基酸 (四、氨基酸的性质)
-amNiHno2 acid
-amino acid
-amino acid
组成蛋白质属于-氨基酸(20种)。表17-1
5
第十七章 氨基酸、多肽和蛋白质 第一节 氨基酸 (一、结构分类命名)
一、氨基酸的结构、分类和命名 (一) 氨基酸的结构
R CH COOH R CH COO- 内盐
NH2
NH3+
偶极离子
将氨基酸的溶液置于电场中,若溶液的:
pH> pI,主要呈阴离子状态而向正极移动; pH< pI,主要呈阳离子状态而向负极移动;
电
pH=pI, 主要以两性离子形式存在。
既不向正极移动,也不向负极移动。
泳
等电点是氨基酸的重要理化常数之一。每
种氨基酸都有其特定的等电点。等电点时氨基 酸的溶解度最小。
酸性氨基酸: pI 2.8 ~ 3.2 中性氨基酸: pI 5.0 ~ 6.5 碱性氨基酸: pI 7.5 ~ 10.8
