第二章 第三节 第3课时 温度、催化剂对化学平衡移动的影响
高中化学第二章化学反应速率和化学平衡2.3.3温、催化剂对化学平衡移动的影响4化学

向)移动,但达到新平衡时的温度仍比
原平衡时高。反之亦然。如下图所示。
12/11/2021
第七页,共三十三页。
重点难点探究
(tànjiū)
重要(zhòngyào)
考向探究
随堂检测
( jiǎn cè)
知识点拨
一、若其他条件不变,改变温度对化学平衡移动的影响如下
条件的改变(其他条件不变)
考向探究
随堂检测
( jiǎn cè)
成功体验 2 下列事实中不能用勒夏特列原理解释的是(
)
A.在溴水中存在如下平衡:Br2+H2O
HBr+HBrO,当加入硝酸
银溶液后溴水颜色变浅
B.增大压强有利于合成氨反应
C.反应 CO+NO2
CO2+NO ΔH<0 升高温度使平衡向逆方
向移动
D.向 H2O2 溶液中滴入 FeCl3 溶液后,产生气泡速率增大
(2)C E B
(3)A
(4)如图所示:
(5)5∶6
12/11/2021
第十二页,共三十三页。
重点难点探究
(tànjiū)
重要(zhòngyào)
考向探究
随堂检测
( jiǎn cè)
规律方法点拨 分析温度对化学平衡的影响时需注意的问题:
(1)任何化学反应都伴随着能量的变化(放热或吸热)。在可逆反应里,若
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是
。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状
态,请在图中画出反应速率的变化曲线。
选择性必修1 第二章 第二节 第3课时 影响化学平衡的因素

《影响化学平衡的因素》教学设计一、课标解读《影响化学平衡的因素》属于课标选择性课程模块1《化学反应原理》主题2《化学反应的方向、限度和速率》内容。
1.内容要求通过实验探究,了解浓度、压强、温度对化学平衡状态的影响。
2.学业要求能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化,能讨论化学反应条件的选择和优化。
二、教材分析(1)知识类型、知识内容及其结构知识类型:化学原理内容(化学平衡移动原理)知识内容及其结构:化学平衡移动概念的建立(正向移动、逆向移动);浓度改变对平衡移动方向的影响及原因分析;了解控制反应条件在生产和科学研究中的意义。
(2)知识价值通过学习,让学生认识反应条件的改变对化学平衡状态会产生影响,使化学平衡状态发生改变。
因此,在生产、生活中,我们就可以应用化学平衡移动原理,通过选择条件、改变条件,服务于生产、服务于生活,获取最大效益。
在方法上,使学生在学习知识的过程中,学习研究问题的方法(在实践中发现问题—提出问题—分析研究问题—用所学理论解释问题—获得结论—应用结论(设计实验和解释实际问题))。
三、学情分析(1)学生已有的认知基础【知识基础】学生已经基本掌握化学反应速率和化学反应限度的概念及化学反应速率计算方法,对影响化学反应速率的因素有了初步的了解;认识可逆反应、化学平衡的特征;对平衡移动有初步认识,知道当一定外界条件改变时,有可能会引起平衡移动。
【能力基础】学生已经初步具备一定的化学实验能力(实验操作能力、实验观察能力、实验分析能力),初步具备合作解决问题的能力,学生具备了一定的语言表达能力,并初步具备应用所学知识解释、解决问题的能力。
(2)学生学习本课的困难或可能出现的问题实验能力的欠缺:实验基本操作能力(动手操作能力、实验有序性)差,实验操作阶段耗时较多;实验分析能力较差,缺乏从实验现象中发现、抽取、归纳总结规律的能力,难以获得实验结论;实验设计能力较差,缺乏设计有效实验检验理论预测的能力。
化学人教版选修4课件:第2章 第3节 第3课时 温度、催化剂对化学平衡移动的影响

-8-
第3课时 温度、催化剂 对化学平衡移动的影响
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂检测
探究一
探究二
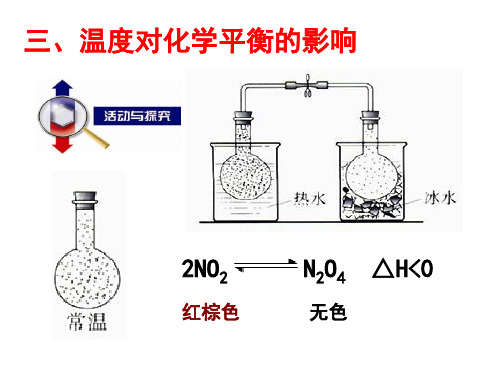
温度对化学平衡的影响
问题探究 1.对一定条件下的化学平衡状态: (1)若改变物质的浓度,化学平衡是否一定发生移动? (2)若改变体系的温度呢? 答案 (1)改变物质的浓度,化学平衡不一定发生移动,如H2(g)+I2(g)
-16-
第3课时 温度、催化剂 对化学平衡移动的影响
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂检测
探究一
探究二
知识归纳
1.影响化学平衡的因素
若其他条件不变,改变下列条件对化学平衡的影响如下:
改变的条件(其他条件不变)
化学平衡移动的方向
增大反应物浓度或减小生成物浓度 向正反应方向移动 浓度 减小反应物浓度或增大生成物浓度 向逆反应方向移动
新知预习
自主预测
首页
课前篇 自主预习
课堂篇 探究学习
随堂检测
(1)现象:
冰水中
热水中
现象
红棕色变浅
红棕色加深
(2)分析:降温→颜色变浅→平衡向放热方向移动;升温→颜色变 深→平衡向吸热方向移动。
2.结论:其他条件不变时,升高温度平衡向着吸热的方向移动,降
低温度平衡向着放热的方向移动。
-5-
第3课时 温度、催化剂 对化学平衡移动的影响
移动。
答案 B
-14-
第3课时 温度、催化剂 对化学平衡移动的影响
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂检测
探究一
教学设计2:2.2.4 温度、催化剂对化学平衡移动的影响

第二章化学反应速率与化学平衡第二节化学平衡第4课时温度、催化剂对化学平衡移动的影响教学目标1.通过实验探究,认识外界条件(温度)对化学平衡的影响规律。
2.了解催化剂在生活、生产和科学领域中的重要作用。
教学重难点重点:化学平衡的影响因素难点:勒夏特列原理教学过程一、导入新课[导入]上节课我们学习了浓度、压强对化学平衡移动的影响,如果改变温度等反应条件,化学平衡状态是否也会发生变化?如何变化?请大家带着这个问题随老师一起进入今天的学习!二、讲授新课知识点一影响化学平衡的因素[讲解]对于放热或吸热的可逆反应,当反应达到平衡后,改变温度也会使平衡发生移动。
[教师活动]演示实验2-3。
[学生活动]认真观看实验并填写表格。
[投影]3.温度对化学平衡的影响2NO2(红棕色)N2O4(无色)ΔH=-56.9 kJ/mol[讲解]实验表明,浸泡在热水中的烧瓶内红棕色加深,说明升高温度,NO2的浓度增大;浸泡在冰水中的烧瓶内红棕色变浅,说明降低温度,NO2的浓度减小。
知识点二勒夏特列原理(又称为平衡移动原理)[小结]大量实验证明,在其他条件不变的情况下,升高温度,会使化学平衡向吸热反应的方向移动;降低温度,会使化学平衡向放热反应的方向移动。
[师]任何化学反应都伴随着能量的变化(放热或吸热),因此,改变温度,化学平衡一定发生移动。
[讲解]催化剂能够同等程度地改变正反应速率和逆反应速率,因此,它对化学平衡的移动没有影响。
也就是说,催化剂不能改变达到化学平衡状态的反应混合物的组成,但是,使用催化剂能改变反应达到平衡所需的时间。
[师]通过这两节课的学习我们发现,改变浓度、压强、温度等因素可以提高反应产率或者抑制反应进行的程度。
法国化学家勒夏特列曾就此总结出一条经验规律:如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。
这就是勒夏特列原理,也称化学平衡移动原理。
[强调]勒夏特列原理适用于任何动态平衡体系(如溶解平衡、电离平衡等),非平衡状态不能用此来分析。
2024学年新教材高中化学第二章第3课时温度催化剂对化学平衡的影响pptx课件新人教版选择性必修1

提示: 升高温度,平衡逆向移动,平衡常数 减小。
方法突破
外界条件对化学平衡影响的过程
应用体验
视角1 勒夏特列原理的理解
1.[2023北京海淀高二期末]下列事实,不能用勒夏特列原理解释的是( C )
A.气体在热水中比在冰水中 B.制备氢氧化 C.加压后气体颜
)
A.反应Ⅱ的 < 0
√
B.其他条件不变,增大压强, Fe s 的产量增大
C.反应温度越高, Fe3 O4 主要还原产物中铁元素的价态越低
D.温度高于 1 040 ℃ 时,反应器中发生的主要反应的化学平衡常数 < 4
[解析] ~ ℃ ,随着温度的升高, 的体积分数增大,而反应Ⅰ是吸热反应,
提示: 甲中温度升高,气体颜色加深,说明平衡逆向移动;丙中温度降低,气体颜色
变浅,说明平衡正向移动。
反应 2NO2 g ⇌ N2 O4 g 正反应为放热反应,说明降低温度,平衡向放热反应方
向移动;逆反应为吸热反应,说明升高温度,平衡向吸热反应方向移动。
(2)上述实验中,甲烧杯升高温度的瞬间 (正)、 (逆)如何改变? (正)、
随着温度的升高,平衡正向移动, 体积分数减小,说明 ~ ℃ ,
和 发生的主要反应为Ⅱ,即反应Ⅱ是放热反应, < ,A正确;反应Ⅰ和反
应Ⅱ均为气体体积不变的反应,改变压强,平衡不移动,铁的质量不变,B错误;温
度高于 ℃ ,随着温度的升高, 的体积分数减小,说明反应以Ⅰ为主,即反应
甲烧杯里加入致热盐 CaCl2 ,向丙烧杯里加入制冷盐 NH4 NO3 ,不断搅拌直至溶液饱和,
可以看到,随着盐的加入,甲中混合气体的颜色变深,丙中混合气体的颜色变浅,乙
学案3:2.3.3影响化学平衡移动的因素(二)温度、催化剂对化学平衡移动的影响

第三节化学平衡第3课时影响化学平衡移动的因素(二)温度、催化剂对化学平衡移动的影响学习目标1.通过温度对可逆反应速率的影响,理解并掌握温度影响化学平衡移动的规律。
2.了解催化剂影响化学反应速率的实质,并进一步探讨对化学平衡的影响,从而了解催化剂在化工生产中的应用。
3.根据外界条件对化学平衡的影响,归纳勒夏特列原理。
新知导学一.温度对化学平衡移动的影响升高温度,平衡向方向移动。
降低温度,平衡向方向移动二.催化剂对化学平衡的影响1.加入催化剂可以大大地加快化学反应速率,是因为它可以降低反应的,从而提高活化分子,从而增大反应速率,但是由于催化剂能够地改变正、逆反应速率,因此它对化学平衡移动无影响。
2.催化剂改变达到化学平衡状态时的反应混合物中的含量,但是使用催化剂能反应达到平衡所需的。
三.勒夏特列原理1.原理如果改变影响平衡的一个条件(如浓度、压强或温度),则平衡将向着能够这种改变的方向移动。
2.注意事项(1)研究对象一定是处于平衡状态的。
(2)勒夏特列原理只适用于判断“改变影响平衡的条件”时的平衡移动方向。
(3)平衡移动的结果只能是“”外界条件的改变,但不能完全“”这种改变。
课堂互动探究探究一温度对化学平衡的影响实验探究:温度对化学平衡的影响实验原理:ΔH=-56.9 kJ·mol-1实验步骤:三只相同的圆底烧瓶盛有完全相同的上述平衡混合气体(颜色相同),将两只烧瓶分别浸入盛有热水和冰水的烧杯中,另一只烧瓶置于常温下(比较颜色)。
放置一段时间,直至颜色不再发生变化。
实验现象:实验内容烧瓶放入热水中烧瓶放入冰水中实验现象反应体系的颜色加深反应体系的颜色变浅由此现象,你得到的结论是什么?归纳总结1.任何化学反应都伴随着能量的变化(放热或吸热)。
在可逆反应里,若正反应为放(吸)热反应,逆反应必为吸(放)热反应。
正、逆反应的热量数值相等,但符号相反。
2.对于同一化学反应,升高温度,使v(吸)和v(放)都增大,但吸热反应速率增大的程度更大,即v(吸)>v(放),所以平衡向吸热方向移动;反之,降低温度,v(吸)和v(放)都减小,但吸热反应速率减小的程度更大,即v(吸)<v(放),平衡向放热方向移动。
第2章 第3节 第3课时 温度、催化剂对化学平衡的影响

人教版化学·选修4
返回导航 上页 下页
4.一密闭容器中建立 N2+3H2 2NH3 ΔH<0 的平衡体系,此时,N2 的浓度为 c(N2), 体系的温度为 T1,压强为 p1,按要求回答下列问题: (1)保持温度、体积不变,通入 N2,使 N2 的浓度变为 2c(N2),平衡向________方向移 动,重新平衡后,N2 的浓度为________。 (2)保持温度不变,压缩体积变为原来的12,使压强变为 2p1,平衡向________方向移 动,重新平衡后体系的压强变为________。 (3)保持体积不变,升高体系的温度至 2T1,平衡向______方向移动,重新平衡后,体 系的温度变为________。
人教版化学·选修4
返回导航 上页 下页
2.合成氨所需的氢气可用煤和水做原料经多步反应制得,其中的一步反应为
催化剂
CO(g)+H2O(g)
CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高 CO 的转化率,下列措施中正确的是( )
A.增加压强
B.降低温度
C.增大 CO 的浓度
D.更换催化剂
人教版化学·选修4
人教版化学·选修4
返回导航 上页 下页
解析:A.存在平衡 2NO2(g) N2O4(g),增大压强,混合气体的浓度增大,平衡体系 颜色变深,该反应正反应为体积减小的反应,增大压强平衡向正反应方向移动,二 氧化氮的浓度又降低,颜色又变浅,由于移动的目的是减弱变化,而不是消除,故 颜色仍比原来的颜色深,所以可以用平衡移动原理解释,故不选 A;B.存在平衡 2SO2 +O2(g) 2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应方向 移动,有利于合成 SO3,能用平衡移动原理解释,故不选 B;C.存在平衡 H2(g)+ I2(g) 2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体 系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释, 故选 C;D.氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡 Cl2+ H2O HCl+HClO 向右移动,能用平衡移动原理解释,故不选 D。 答案:C
温度、催化剂对化学平衡的影响
练习
一定量的混合气体在密闭容器中发生反应: m A (g) + n B (g) p C (g)
达到平衡后,温度不变,将气体体积缩小到原来 的1/2但达到平衡时,C的浓度为原来的1.8倍,则 下列说法正确的是 ( B ) A、m + n > p
B、A 的转化率降低 C、平衡向正反应方向移动 D、C的体积分数增加
合成氨的工艺流程如图2-24 所示。在工业生产中,可以通过以 下途径来提高合成氨的产率。请利 用有关知识分析采取这些措施的原 因。 1.向反应器中注入过量N2。 2.采用适当的催化剂。 3.在高压下进行反应。 4.在较高温度下进行反应。
思考并完成下列表格
2SO2(g) + O2(g)
2SO3(g)度
平衡移动的方向 新平衡建立时
O2浓度较原平衡 大 SO3浓度较原 平衡小 总压强比原平 衡大 平衡温度比旧 平衡高
具
体
抽 象
向右,即O2浓度 减小的方向 减小SO3的浓度 向右,即SO 浓 3 度增大的方向 增大压强 向右,即压强减 小方向 升高温度 向左,即温度降 低的方向 改变一个条件 减弱这种改变
• 总结:
其他条件 不变时:
升高温度 降低温度
化学平衡向吸热的方向移动 化学平衡向放热的方向移动
总的来说:化学平衡的移动能削弱温度改变给可 逆反应所带来的影响,但并不能完全抵消。
四、催化剂对化学平衡的影响
催化剂降低了反应的活 化能,正反应的活化能降低, 逆反应的活化能也降低,正 反应的活化分子百分数增加 几倍,逆反应的活化分子百 分数也增加几倍,正逆反应 速率增加的倍数相等,加催 化剂,不能使平衡发生移动, 只影响到达平衡的时间。
D、升温
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3课时温度、催化剂对化学平衡移动的影响
[核心素养发展目标] 1.变化观念与平衡思想:从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,温度、催化剂改变,平衡将会发生移动而建立新的平衡。
2.证据推理与模型认知:通过实验论证说明温度、催化剂的改变对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型(勒夏特列原理)。
一、温度、催化剂对化学平衡移动的影响
1.温度对化学平衡移动的影响
(1)实验探究温度对化学平衡移动的影响
按表中实验步骤要求完成实验,观察实验现象,填写下表:
2NO2(g) (红棕色)N2O4(g)
(无色)
ΔH=-56.9 kJ·mol-1
(2)温度对化学平衡移动的影响规律
①任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。
②当其他条件不变时:
温度升高,平衡向吸热反应方向移动;
温度降低,平衡向放热反应方向移动。
2.催化剂对化学平衡的影响规律
当其他条件不变时:
催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。
(1)温度可以影响任意可逆反应的化学平衡状态()
(2)催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率()
(3)升高温度,反应速率加快,化学平衡向正向移动()
(4)升高温度,反应速率加快,但反应物的转化率可能降低()
答案(1)√(2)×(3)×(4)√
分析化学平衡移动的一般思路。
