双向电泳原理及实验步骤(1)
双向电泳

30% Acrylamide储液
搅拌溶解 10% NP40 两性电解质(pH3~9.5) 10% 过硫酸铵*
1.6 mL
1.5 mL 0.50 mL 15 µ L
TEMED*
10 µ L
State Key Laboratory of Food Science and Technology
PART 3 实验方法 (3)灌制第一向凝胶 取1支1 mL注射器和一根长针头,吸取约0.5mL第一向凝胶
约7~8 h)停止电泳。如果聚焦好的凝胶不能马上进行第二向电
泳,在管内放置了几小时以上, 可在走第二向电泳之前再聚焦 电泳1~2h,以消除样品受扩散的影响。 (7)退胶 电泳结束后,在整极端凝胶内插入约1cm长的铜丝作为标
记,用洗耳球从玻璃管上样端轻轻挤入空气,将凝胶退胶或
用10mL注射器和长针头吸入一定的蒸馏水,将长针头一边沿 管壁推入一边注入蒸馏水使凝胶退出。
入覆盖溶液至管口。
(5)安装电泳槽 加样后将玻璃管插入电泳槽的架子上,在上
槽中玻璃管上端露出1 cm,剥去玻璃管下端的封口膜,准备 电泳。在电泳槽的下槽加2000 mL 10 mmol/L H3PO4溶液,将 柱胶下端浸入到H3PO4溶液中,注意胶下端不可有气泡(如果
有气泡,可以先用注射器将胶下端用H3PO4溶液灌满,再将
冰箱中可保存3~4个星期。
State Key Laboratory of Food Science and Technology
PART 3 实验方法 3.实验步骤 (1)准备玻璃管 取4支18 cm的长玻璃管,洗净晾干。
表1 第一向凝胶溶液配方 尿素 重蒸水 3.84 g 2.0 mL
(2)配制第一向凝胶溶液(8mL /4组) 配制方法见表1。
蛋白质双向电泳的基本原理(一)

蛋白质双向电泳的基本原理(一)蛋白质双向电泳的基本原理蛋白质双向电泳是一种常用的分离和分析蛋白质的技术方法。
它通过利用蛋白质在电场中移动的特性,结合两个方向的电场,实现对复杂蛋白质混合物的分离和鉴定。
下面将从浅入深地解释蛋白质双向电泳的基本原理。
1. 电泳的基本原理电泳是一种基于物质在电场中迁移的原理,将带电粒子或分子分离开的技术。
在电泳过程中,带电的蛋白质分子会受到电场的作用力而移动,移动的速度与其电荷大小和分子质量有关。
2. 单向电泳的局限性在传统的单向电泳中,蛋白质样品被施加一个方向的电场,使得蛋白质分子按一维的方向进行迁移。
然而,由于蛋白质复杂性和电泳条件的限制,单向电泳难以有效地分离复杂的蛋白质混合物。
3. 双向电泳的优势双向电泳是为了克服单向电泳的局限性,实现更好的分离效果而发展起来的一种电泳技术。
它利用两个方向的电场交替施加,使得蛋白质分子在水平和垂直方向上均发生迁移,从而实现更高分辨率的蛋白质分离。
4. 蛋白质双向电泳的操作步骤•第一维电泳:将蛋白质样品在一个细长的电泳槽中垂直施加电场,使得蛋白质在水平方向上移动。
一般使用等电聚焦(IEF)技术,根据蛋白质的等电点来完成分离。
•电泳缓冲:在第一维电泳过程中,需要使用特定的电泳缓冲液,以确保蛋白质在移动过程中维持稳定的电荷状态。
•Gel转移:第一维电泳后,将蛋白质分离到一根细长的凝胶条上,凝胶条上有各种不同pH值的缓冲液。
•第二维电泳:将凝胶条垂直放置在另一个电泳槽中,施加另一个方向的电场。
凝胶条上的蛋白质会在垂直方向上继续移动,最终得到更高分辨率的蛋白质分离结果。
5. 蛋白质双向电泳的应用蛋白质双向电泳在生物医学和生命科学研究中得到广泛应用。
它被用于分离和鉴定复杂蛋白质混合物,寻找新的蛋白质标记物或生物标志物,研究蛋白质的功能和相互作用等。
6. 结论蛋白质双向电泳是一种重要的分离和鉴定蛋白质的技术方法,通过结合两个方向的电场,实现对复杂蛋白质混合物的高效分离。
双向电泳详细操作过程
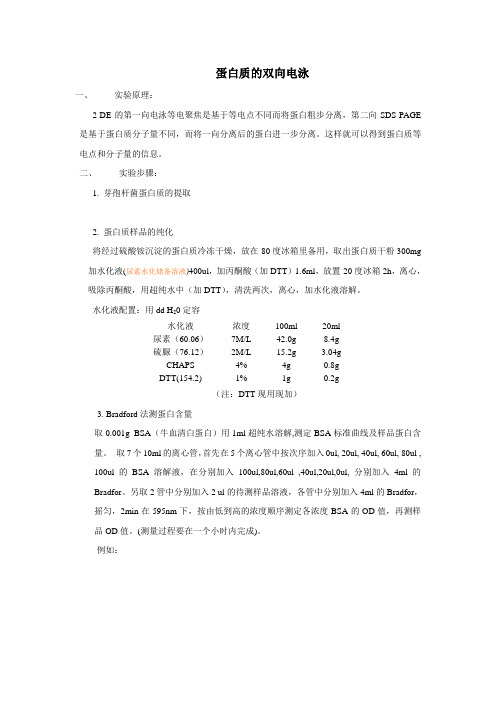
蛋白质的双向电泳一、实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE 是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二、实验步骤:1. 芽孢杆菌蛋白质的提取2. 蛋白质样品的纯化将经过硫酸铵沉淀的蛋白质冷冻干燥,放在-80度冰箱里备用,取出蛋白质干粉300mg 加水化液(尿素水化储备溶液)400ul,加丙酮酸(加DTT)1.6ml,放置-20度冰箱2h,离心,吸除丙酮酸,用超纯水中(加DTT),清洗两次,离心,加水化液溶解。
水化液配置:用dd H20定容水化液浓度100ml 20ml尿素(60.06)7M/L 42.0g 8.4g硫脲(76.12)2M/L 15.2g 3.04gCHAPS 4% 4g 0.8gDTT(154.2) 1% 1g 0.2g(注:DTT现用现加)3. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 20ul, 40ul, 60ul, 80ul , 100ul的BSA溶解液,在分别加入100ul,80ul,60ul ,40ul,20ul,0ul, 分别加入4ml的Bradfor。
另取2管中分别加入2 ul的待测样品溶液,各管中分别加入4ml的Bradfor,摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
例如:标准曲线方程式:Y= aX+b.其中Y为OD值,X为蛋白含量。
a、b通过作图输入数据可知G250的配置:称取G250 固体0.1g加水定容至1L。
使用前滤纸过滤。
比色皿用70%的乙醇保存,待用时用双蒸水冲洗,再用无水乙醇冲洗,双蒸水冲洗,再加入待测样品溶液润洗,然后,加入样品,测定OD值。
双向电泳技术的原理及应用

双向电泳技术的原理及应用1. 原理双向电泳技术是一种分离和鉴定蛋白质的常用方法。
它结合了凝胶电泳和电泳移动的优势,可以在同一实验中实现更高的分辨率和更好的分离效果。
双向电泳的原理基于两个关键因素:分子大小和电荷。
在实验中,蛋白质样品首先沿一个方向进行电泳。
由于蛋白质的不同大小和电荷,它们会在凝胶中形成不同的带状图案。
然后,凝胶会旋转90度,使蛋白质在垂直方向上进行电泳。
这样一来,蛋白质会在另一个方向上发生分离。
双向电泳的核心是双向凝胶,其结构类似于二维网络。
在第一个方向上,凝胶中的蛋白质会形成一维图案,而在第二个方向上,蛋白质会形成另一维图案。
通过对这两个图案的分析,可以得到更为准确的蛋白质信息。
2. 应用2.1 蛋白质分离和纯化双向电泳技术在蛋白质分离和纯化中有着广泛的应用。
由于双向电泳可以提供更高的分辨率,可以分离和鉴定更多的蛋白质。
这在研究蛋白质结构和功能以及疾病诊断中具有重要意义。
2.2 蛋白质组学研究双向电泳技术在蛋白质组学研究中发挥着重要作用。
通过双向电泳,可以分离出复杂样品中的蛋白质,并获得其质量和电荷信息。
这些信息可以用于鉴定蛋白质和研究其功能。
2.3 药物研发双向电泳技术在药物研发中也有广泛的应用。
通过双向电泳,可以分离和鉴定药物的靶点,进一步了解药物与蛋白质的相互作用机制。
这对于药物设计和优化具有重要意义。
2.4 分子生物学研究双向电泳技术在分子生物学研究中有着重要的应用。
通过双向电泳,可以鉴定蛋白质的表达变化,从而了解基因表达调控机制。
这对于研究细胞功能和疾病发生机制具有重要意义。
2.5 环境监测双向电泳技术在环境监测中也有着广泛的应用。
通过双向电泳,可以分离和鉴定环境中的污染物,从而评估环境质量和污染程度。
这对于环境保护和治理具有重要意义。
3. 优缺点3.1 优点•分辨率高:双向电泳可以提供更高的分辨率,可以分离和鉴定更多的蛋白质。
•信息丰富:双向电泳可以获得蛋白质的质量和电荷信息,有助于了解蛋白质的结构和功能。
蛋白质双向电泳实验流程

蛋白质双向电泳实验流程一.样品制备1.研磨研磨时间要尽量短,并需及时补充液氮,研磨要充分,同时要保证损失少。
2.重新加入8mltris饱和状态酚(ph8.8)和8ml裂解液,在通风橱内研磨30s。
先加8mltris饱和状态酚,tris饱和状态酚会变为液态,此时需以研磨碓将液态的tris饱和状态酚研磨变成小块。
接着重新加入8ml裂解液,也须要将液态的裂解液研磨变成小块。
等三者搅匀后,将粉末迁移至45mltube。
3.振荡30min。
室温静置,等待tube中液态变为液体后,已经开始震荡。
震荡须要持续30min,每震荡1min,放在冰上加热1min。
4.10000g,4℃,10min。
将酚相(topphase)转移至45mltube。
酚相(topphase)可置于冰上。
酚二者必须就是绿色的,水相必须就是淡黄色的。
5.取6ml的抽提液和6ml饱和酚加入水相,蜗旋振荡30min。
振荡需持续30min,每振荡1min,置于冰上冷却1min。
6.10000g,4℃,10min。
将酚二者(topphase)迁移至45mltube。
7.沉淀酚相。
取一定体积(是酚相的5倍)的0.1m乙酸铵/甲醇溶液(c20℃保存)于酚相(45mltube)。
振荡30s,c20℃培育1h或过夜。
8.冲洗结晶①15min,20,000g,4℃。
弃上清。
②提10ml0.1m乙酸铵/甲醇溶液,用移液器吸打。
c20℃结晶30min。
③15min,20,000g,4℃。
弃上清。
④重新加入10ml乙酸铵/甲醇溶液,用移液器吸打。
c20℃结晶30min。
⑤15min,20,000g,4℃。
弃上清。
⑥提10ml80%丙酮(ice-cold),用移液器吸打。
c20℃结晶30min。
⑦15min,20,000g,4℃。
弃上清。
⑧重新加入10ml80%丙酮(ice-cold),用移液器吸打。
c20℃结晶30min。
⑨15min,20,000g,4℃。
弃上清。
双向电泳操作步骤

双向电泳操作步骤双向电泳操作步骤及相关溶液配置A(实验过程一实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二实验步骤:1. 样品的溶解取纯化后的晶体蛋白3.0mg,加入300ul裂解液(1mg蛋白:100ul裂解液)振荡器上振荡10min左右,共处理一个小时。
其中每隔10,15分钟振荡一次,然后13200rpm离心15min除杂质,取上清分装,每管70ul,—80oC保存。
2. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 5ul,10ul, 15ul, 20ul 的BSA溶解液,另2管中分别加入2 ul的待测样品溶液,再在每管中加入相应体积的双蒸水(总体积为80ul),然后,各管中分别加入4ml的Bradford液(原来配好的Bradford液使用前需再取需要的剂量过滤一遍方能使用),摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
3. 双向电泳第一向---IEF(双向电泳中一律使用超纯水)3.1 水化液的制备称取2.0mg 的DTT,用700ul水化液储液溶解后,加入8ul 0.05, 的溴酚兰,3.5ul(0.5,v/v)IPG buffer (pH 3-10)振荡混匀,13200rpm离心15min 除杂质,取上清。
在含300ug 蛋白(经验值)的样品溶解液中加入水化液,至终体积为340ul,振荡器上振荡混合,13200rpm离心15min除杂质,取上清。
3.2 点样,上胶分两次吸取样品,每次170ul, 按从正极到负极的顺序加入点样槽两侧,再用镊子拨开 Immobiline DryStrip gels (18cm,pH 3—10)胶条,从正极到负极将胶条压入槽中,胶面接触加入的样品。
简述双向电泳的原理

简述双向电泳的原理
双向电泳是一种在凝胶电泳中使用的技术,用于分离和分析DNA、RNA、蛋白质等生物分子。
其原理是利用两个方向的电场来推动待分离的生物分子,以便在凝胶中获得更好的分离效果。
在双向电泳中,首先在一个方向上施加电场,使待分离的生物分子向一个方向移动。
然后,改变电场的方向,使其在另一个方向上移动。
这样,生物分子会在两个方向上进行移动,从而实现更好的分离效果。
双向电泳的原理涉及到凝胶电泳和电泳技术。
在凝胶电泳中,待分离的生物分子会在凝胶矩阵中随着电场的作用而移动,根据其大小和电荷的不同而被分离开来。
而双向电泳则是在凝胶电泳的基础上,通过改变电场的方向,使生物分子在两个方向上移动,以获得更好的分离效果。
双向电泳在生物分子分离和分析中具有重要的应用,尤其在蛋白质分离和分析中,可以帮助科研人员更准确地分离和鉴定不同的蛋白质。
通过掌握双向电泳的原理和技术,科研人员可以更好地开展生物分子研究,为生命科学领域的发展做出贡献。
总之,双向电泳的原理是利用两个方向的电场来推动待分离的生物分子,在凝胶中实现更好的分离效果,具有重要的生物分子分离和分析应用。
双向电泳原理及实验步骤

银染(Silver Stain Plus™ stain)
荧光染色(SYPRO® Ruby protein gel stain)
适用于质谱的染色方法
考马斯亮蓝染色
银染的检测灵敏度很高,可达到200pg,但其线性很差。普通的银染过程中因醛类的特异反应,而与下游质谱不兼容。
快速银染法,可与下游质谱兼容,但其检测灵敏度较低,并伴有很深的背景干扰。
聚焦时间的优化
IEF的基本条件
Stemp 1
Stemp 2
Stemp 3
total
voltage
Time
Volt-Hours
Ramp
250
20min
---
Linear
4000
4000
2hr
---
---
10,000V-hr
Linear
Rapid
5 hr
14,000V-hr
7 cm
Stemp 1
Stemp 2
双向电泳样品的溶解
是成功进行双向电泳的最关键因素之一 溶解的目标: 样品中非共价结合的蛋白质复合物和聚积体完全破坏,从而形成各个多肽的溶解液; 必须允许可能干扰2-DE分离的盐、脂类、多糖和核酸等物质的去除; 保证样品在电泳过程中保持溶解状态。
离液剂:通过改变溶液中的氢键结构使蛋白质充分伸展,将其疏水中心完全暴露,降低接近疏水残基的能量域。典型代表是尿素和硫尿。
02
样品上样缓冲液
标准溶液:
Reagent
Amount
8M urea
47ml of 8.5 stock or 24g urea in 25ml H2O
50mM DTT or 2mM TBP
385mg or 500ul of 200mM TBP stock
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可编辑版
2
蛋白质组分析的首要要求
• 将来自于全细胞、组织或生物体中所包含 的多达几千种混合蛋白质进行分离、检测 和分析 。
• 2-DE技术依然是大多数蛋白质组研究中分 离复杂蛋白质混合物的首选技术 。
可编辑版
3
生物学问题 的提出
实验模型 的设计
实验组和对照组 样品的制备
感兴趣 蛋白点 的切取
蛋白样品的IEF和PAGE电泳分离 图像扫描和初步分析
可c编h辑a版rge
9
样品制备基本原则
• 使所有待分析的蛋白样品全部处于溶解状态(包 括多数疏水性蛋白),制备方法应具有可重现性。
• 防止样品在聚焦时发生蛋白的聚集和沉淀。 • 防止在样品制备过程中发生样品抽提后的化学修
饰(如酶性或化学性降解等)。
• 完全去除样品中的核酸和某些干扰蛋白。 • 尽量去除起干扰作用的高丰度或无关蛋白,从而
可编辑版
15
样品上样缓冲液
标准溶液:
Reagent
8M urea
50mM DTT or 2mM TBP 4% CHAPS 0.2%carrier ampholytes 0.0002%bromophenol blue ddH2O
Amount
47ml of 8.5 stock or 24g urea in 25ml H2O
还原剂:在离液剂和去垢剂联用条件下,加用还原剂可 使已变性的蛋白质展开更完全,溶解更彻底。常用含 自由巯基的DTT或-巯基乙醇,以及不带电荷的三丁 基膦(TBP)进行还原。
可编辑版
14
两性载体电解质:即便在离液剂和去垢剂存在的情 况下,某些蛋白质也需要在盐离子的作用下才能保 持其处于溶解状态,否则这些蛋白质在其处于PI点 时会发生沉淀。 两性载体电解质的作用在于补充样品中少量的盐分 ,从而保证蛋白质的溶解性。应用时,两性电解质 的浓度应小于0.2%(w/v)。浓度过高会使IEF的升 压困难、速度降低。另外,为了保证实验的精确性 ,在选择不同pH范围的IPG胶条时,也应使两性电 解质的pH值与之相符合。
385mg or 500ul of 200mM TBP stock
2g
See next table
100ul of 0.1% stock
To 50ml
可编辑版
16
胶条蛋白载样量
影响IPG胶条对蛋白载样量的因素包括: • 待分析的蛋白点的量需满足随后的质谱分
析。 • 电泳的研究目的。 • 待研究蛋白的丰度: • 样品的复杂度。 • IPG胶条的pH范围
蛋白质组双向电泳 实验操作
可编辑版
1
1994年,澳大利亚Macquarie大学的Wilkins 和Williams首先提出了蛋白质组(Proteome) 的概念,其定义为在一种细胞内存在的全部蛋
白质。
蛋白质组研究中主要应用的技术包括:双相电 泳(2-DE)、新型质谱(MS)技术、数据库设置 与检索系统等。
可编辑版
17
IPG胶条蛋白质大约载样量
IPG Strip length
Analytical Load (silver staining)
7cm
10~100 g /125 l
Preparative Load (Coom staining)
级抽提,按样品溶解度不同进行分离。
可编辑版
12
双向电泳样品的溶解
• 是成功进行双向电泳的最关键因素之一
• 溶解的目标:
– 样品中非共价结合的蛋白质复合物和聚积体完全破坏, 从而形成各个多肽的溶解液;
– 必须允许可能干扰2-DE分离的盐、脂类、多糖和核酸 等物质的去除;
– 保证样品在电泳过程中保持溶解状态。
第二向:SDS-PAGE电泳
–
Proteins migrate through the gel at a rate proportional to their size.
Smallest proteins travel the furthest distance
+
pH 3
pH 7.5
pH10
size
保证待研究蛋白的可检测性。
可编辑版
10
样品制备
• 细胞样品:反复冻融、超声破碎
• 组织样品:碾磨、匀浆
• 植物样品:碾磨
• 分泌蛋白
蛋白质样品的浓缩、去除滤液中的高丰度蛋白
• 菌体蛋白
裂解液处理、超声破可编碎辑版
11
不同样品的基本处理方法
可溶性样品
固体组织样品 细胞
样品的分级处理
通过采用亚细胞分级、液相电泳和选择性沉淀等方法 对蛋白质样品进行分级处理,可降低样品的复杂性并 富集低丰度蛋白质。当前最简单有效的处理是采用分
胰酶对脱色后蛋白质的消化 质谱的多肽指纹图、微测序分析
蛋白信息的 初步获得
质谱结果的生物信息学分析和比对 新蛋白质的发现
可编辑版
其它实验
的进一步
验证
4Байду номын сангаас
蛋白质组研究的基本技术路线
蛋白质样品的制备
凝胶中的蛋白
双向电泳
图像分析
转印至膜上的蛋白
溶液中的蛋白
混合肽
肽指纹图
肽序列质谱数据 蛋白质质量 N端测序
数据搜索 新的或已知蛋白
蛋白转录可编后辑修版 饰的鉴定
5
一、双向电泳的实验原理
可编辑版
6
第一向:等电聚焦
+
pH 3
+
pH 3
pH 7.5 pH 7.5
–
pH 10
–
pH 10
+
pH 3
+
pH 3
pH 7.5
pH 7.5 可编辑版
–
pH 10
–
pH 10 7
一维固相pH梯度等电聚焦 (IEF with IPG):
可编辑版
13
增加样品溶解性的手段
离液剂:通过改变溶液中的氢键结构使蛋白质充分伸展, 将其疏水中心完全暴露,降低接近疏水残基的能量域。 典型代表是尿素和硫尿。
去垢剂:经过离液剂处理而暴露蛋白质的疏水基团后, 还常需至少一种去垢剂来溶解疏水基团。常用的去垢 剂有离子去污剂SDS、非离子去污剂Triton X-100和 NP-40、两性离子去垢剂CHAPS、OBG等。其中 CHAPS应用最普遍。
