1.1.3学案设计
高二化学反应原理优质学案:1.1.3反应焓变的计算

第3课时反应焓变的计算[核心素养发展目标] 1.证据推理与模型认知:构建盖斯定律模型,理解盖斯定律的本质,形成运用盖斯定律进行相关判断或计算的思维模型。
2.科学态度与社会责任:了解盖斯定律对反应热测定的重要意义,增强为人类科学发展而努力的意识与社会责任感。
一、盖斯定律1.盖斯定律的理解(1)对于一个化学反应,无论是一步完成或分几步完成,其反应焓变都是相同的。
(2)化学反应的反应焓变只与反应体系的始态和终态有关,而与反应的途径无关。
(3)某始态和终态相同,反应的途径有如下三种:(Ⅰ)(Ⅱ)(Ⅲ)。
则ΔH =ΔH 1+ΔH 2=ΔH 3+ΔH 4+ΔH 5。
2.盖斯定律的应用 根据如下两个反应Ⅰ.C(s)+O 2(g)===CO 2(g) ΔH 1=-393.5kJ·mol -1 Ⅱ.CO(g)+12O 2(g)===CO 2(g) ΔH 2=-283.0kJ·mol -1选用两种方法,计算出C(s)+12O 2(g)===CO(g)的反应热ΔH 。
(1)虚拟路径法反应C(s)+O 2(g)===CO 2(g)的途径可设计如下:则ΔH =-110.5kJ·mol -1。
(2)加合法①写出目标反应的热化学方程式,确定各物质在各反应中的位置, C(s)+12O 2(g)===CO(g)。
②将已知热化学方程式变形,得反应Ⅲ: CO 2(g)===CO(g)+12O 2(g) ΔH 3=283.0kJ·mol -1;③将热化学方程式相加,ΔH 也相加。
Ⅰ+Ⅲ得: C(s)+12O 2(g)===CO(g) ΔH =ΔH 1+ΔH 3,则ΔH =-110.5kJ·mol -1。
特别提示(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。
(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减(带符号)。
(3)将一个热化学方程式颠倒时,ΔH 的“+”“-”号必须随之改变,但数值不变。
辽宁省大连理工大学附属高中数学:新人教B版必修二 1.1.3圆柱、圆锥、圆台和球的结构特征 学案
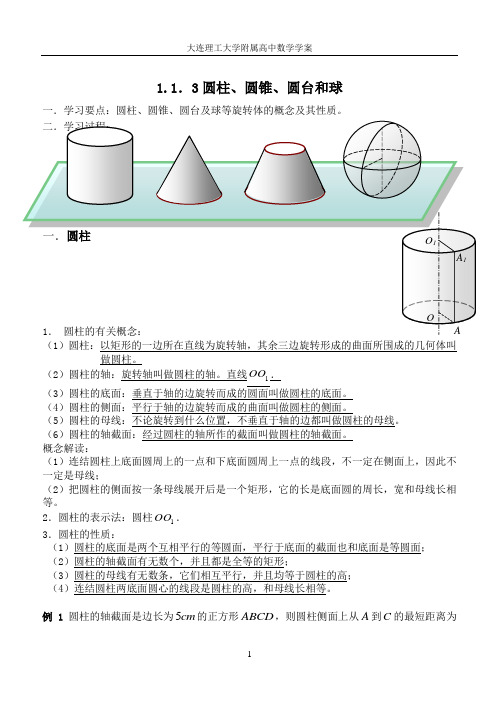
(3)圆柱的底面:垂直于轴的边旋转而成的圆面叫做圆柱的底面。
(4)圆柱的侧面:平行于轴的边旋转而成的曲面叫做圆柱的侧面。
(5)圆柱的母线:不论旋转到什么位置,不垂直于轴的边都叫做圆柱的母线。
(6)圆柱的轴截面:经过圆柱的轴所作的截面叫做圆柱的轴截面。
概念解读:(1)连结圆柱上底面圆周上的一点和下底面圆周上一点的线段,不一定在侧面上,因此不一定是母线;(2)把圆柱的侧面按一条母线展开后是一个矩形,它的长是底面圆的周长,宽和母线长相等。
2.圆柱的表示法:圆柱1OO .3.圆柱的性质:(1)圆柱的底面是两个互相平行的等圆面,平行于底面的截面也和底面是等圆面;(2)圆柱的轴截面有无数个,并且都是全等的矩形;(3)圆柱的母线有无数条,它们相互平行,并且均等于圆柱的高;(4)连结圆柱两底面圆心的线段是圆柱的高,和母线长相等。
例1 圆柱的轴截面是边长为5cm 的正方形ABCD ,则圆柱侧面上从A 到C 的最短距离为( )A .10cm BC. D. 二.圆锥1.圆锥的有关概念:(1)圆锥:以直角三角形的一条直角边所在直线为旋转轴,其余两边旋转 形成的曲面所围成的几何体叫做圆锥。
(2)圆锥的轴:旋转轴叫做圆锥的轴。
直线SO .(3) 圆锥的高:在轴上的这条边(或它的长度)叫做圆锥的高。
(4)圆锥的底面:垂直于轴的边旋转而成的圆面叫做圆锥的底面。
(5)圆锥的侧面:三角形的斜边绕轴旋转而成的曲面叫做圆锥的侧面。
(6)圆锥的母线:不论旋转到什么位置,斜边所在的边都叫做圆锥的母线。
(7)圆锥的轴截面:经过圆锥的轴所作的截面叫做圆锥的轴截面。
2. 圆锥的表示法:圆锥SO . 3. 圆锥的性质:(1)圆锥的底面是一个圆面,平行于底面的截面也是一个圆面;(2)圆锥的轴截面有无数个,并且都是全等的等腰三角形;(3)过顶点的圆锥的截面都是等腰三角形,它的腰就是圆锥的两条母线;(4)连结顶点与底面圆周上任意一点的线段,都是圆锥的母线。
上海牛津版(五四学制)六年级科学上册:1.1.3 发现和发明 学案

发现与发明
【学习目标】
一、知识与技能
(1)知道生活中的科学发现是科学探究的起点。
(2)了解一些科学发明,并认识到科学发明能影响人类的生活,并改变人类的生活方式。
(3)通过了解我国古代四大发明及其发展,比较发明前后以及进一步发展的人类的生活方式。
二、过程与方法
(1)学会在生活中发现、寻找科学规律的思维方式。
(2)利用对比的方法比较科学发明前后以及进一步发展的人类的生活方式的改变。
(3)学会获取信息、分析信息、利用信息的能力。
三、情感态度与价值观
(1)培养在生活中以科学的眼光看待事物的态度。
(2)通过了解科学家的发现和发明,激发学习科学的兴趣。
【学习重难点】
重点:了解一些科学发明,并认识到科学发明能影响人类的生活,并改变人类的生活方式。
难点:通过了解我国古代四大发明及其发展,比较发明前后以及进一步发展的人类的生活方式。
【学习过程】
一、填空
()发现了元素周期表。
()发现了万有引力。
二、问答
我国四大发明是当时世界上先进的技术,
1.四大发明值得是什么?
2.它们给当时人们的生活带来了什么样的变化呢?
3.它们的进一步发展又对我们现在的生活产生了什么影响呢?。
学案1:1.1.3 原子核外电子排布规则

第3课时原子核外电子排布规则【目标导航】1.掌握基态原子、激发态原子、电子云、原子轨道的概念。
2.能运用核外电子排布的规律熟练掌握1~36号元素的原子的核外电子排布。
【基础落实】一、能量最低原理、泡利原理和洪特规则1.能量最低原理原子的电子排布遵循____________能使整个原子的能量处于________状态,简称能量最低原理。
2.泡利原理在一个原子轨道里最多只能容纳____个电子,而且它们的自旋状态________,这个原理称为泡利原理。
3.洪特规则当电子排布在________能级的________轨道时,基态原子中的电子总是优先____________________,而且自旋状态________,这个规则称为洪特规则。
跟踪训练1 一定呈+1价的金属元素是()A.M层比L层电子数少6个电子的元素B.质量数为24,中子数为12的元素C.4s轨道上有1个电子的元素D.电子排布式为1s22s22p63s23p64s1的原子二、电子排布式与电子排布图1.电子排布式用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式。
写出下列基态原子的电子排布式:(1)16S:;(2)20Ca:;(3)26Fe:;(4)29Cu:。
2.电子排布图用方框代表一个原子轨道,用箭头表示一个电子,这样的式子称为电子排布图。
如Na:N:____________________________________O:____________________________________3.原子核外电子排布的表示方法(1)电子排布式和电子排布图反映的是基态原子即处于最低能量状态的原子的电子排布情况,它们相互关联,可以非常方便地相互转换。
(2)虽然电子排布是遵循构造原理的,但书写电子排布式时应按照能层的顺序书写。
如铁原子的电子排布式是1s22s22p63s23p63d64s2,而不写作1s22s22p63s23p64s23d6。
2020-2021高中数学第一册学案:1.1.3 第1课时交集与并集含解析

2020-2021学年高中数学新教材人教B版必修第一册学案:1.1.3 第1课时交集与并集含解析1.1.3集合的基本运算素养目标·定方向课程标准学法解读1.理解两个集合的并集与交集的含义,能求两个集合的并集与交集.2.在具体情境中,了解全集的含义.3.理解在给定集合中一个子集的补集的含义,能求给定子集的补集.4.能使用Venn图表达集合的基本运算,体会图形对理解抽象概念的作用。
1.学习本节时,重视对“交集”“并集”“补集"等概念的理解,特别是“且”“或”的区别,可结合维恩图或数轴理解.2.解题时注意运用图示法(维恩图、数轴、函数图像等)表示集合及进行运算,可以直观、快速地解答集合的运算问题.3.注意“集合运算"⇔“集合关系”间的转化,容易解决集合运算中的参数问题.4.养成用“交集、并集、补集”的思想去解决实际问题,提升数学学科素养。
第1课时交集与并集必备知识·探新知基础知识1.交集思考1:两个非空集合的交集可能是空集吗?提示:两个非空集合的交集可能是空集,即A与B无公共元素时,A与B的交集仍然存在,只不过这时A∩B=∅。
反之,若A∩B=∅,则A,B这两个集合可能至少有一个为空集,也可能这两个集合都是非空的,如:A={1,3,5,7,9},B={2,4,6,8,10},此时A∩B =∅.2.并集思考2:集合A∪B中的元素个数如何确定?提示:①当两个集合无公共元素时,A∪B的元素个数为这两个集合元素个数之和;②当两个集合有公共元素时,根据集合元素的互异性,同时属于A和B的公共元素,在并集中只列举一次,所以A∪B的元素个数为两个集合元素个数之和减去公共元素的个数.3.交集与并集的运算性质交集的运算性质并集的运算性质A∩B=B∩A A∪B=B∪AA∩A=A A∪A=AA∩∅=∅∩A=∅A∪∅=∅∪A=A如果A⊆B,则__A∩B=A__,反之也成立如果A⊆B,则__A∪B=B__,反之也成立思考3:判断集合A={2,3}与集合B={2,3,5}的关系,并写出A∩B和A∪B,你能发现什么规律?提示:A与B的关系为A B,A∩B={2,3},A∪B={2,3,5},由以上结论可推测A⊆B⇔A∩B=A⇔A∪B=B.基础自测1.已知集合M={-1,0,1},N={0,1,2},则M∪N=(C) A.{0,1}B.{-1,0,2}C.{-1,0,1,2}D.{-1,0,1}解析:M∪N={-1,0,1,2}.2.设集合M=(-3,2),N=[1,3],则M∩N=(A)A.[1,2)B.[1,2]C.(2,3]D.[2,3]解析:因为M=(-3,2),且N=[1,3],所以M∩N=[1,2).3.已知集合M={x|x2=9},N={x|-3≤x〈3,x∈Z},则M∩N =(B)A.∅B.{-3}C.{-3,3}D.{-3,-2,0,1,2}解析:由题意,得M={-3,3},由于N={-3,-2,-1,0,1,2},则M∩N={-3}.4.若集合A={x|-5<x〈2},B={x|-3<x<3},则A∪B=__{x|-5〈x<3}__,A∩B=__{x|-3〈x<2}__.5.已知A={-1}且A∪B={-1,3},则所有满足条件的集合B=__{3}或{-1,3}__.关键能力·攻重难类型交集的运算┃┃典例剖析__■典例1(1)已知集合A={0,2},B={-2,-1,0,1,2},则A∩B=(A)A.{0,2}B.{1,2}C.{0}D.{-2,-1,0,1,2}(2)已知A={x|x≤-2或x>5},B={x|1<x≤7},则A∩B=__(5,7]__。
学案2:1.1.3 泡利原理、洪特规则、能量最低原理

第3课时泡利原理、洪特规则、能量最低原理【目标导航】1.知道原子核外电子排布的“两原理一规则”2.会正确书写原子的电子排布式和电子排布图。
【自主学习】一、两原理一规则1.泡利原理:在一个原子轨道里,最多只能容纳个电子,而且它们的自旋状态。
电子自旋有和两种状态,常用上下箭头(↑和↓)表示自旋状态相反的电子。
2.洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是,而且自旋状态。
3.能量最低原理原子核外的电子应优先排布在的能级里,然后由里到外,依次排布在的能级里。
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s→→4p”这一顺序)。
预习交流1以下列出的是一些原子的2p能级和3d能级中电子排布的情况。
其中违反了泡利原理的是()二、电子排布图在电子排布图中,用方框表示,用箭头表示,其中一个方框表示,一个箭头表示,如13Al的电子排布图为。
预习交流2某原子核外共有6个电子,分布在K电子层与L电子层上,L电子层中电子的分布正确的是()【难点探究】一、泡利原理和洪特规则1.泡利原理在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,这就是泡利原理。
例如,锂原子的电子排布图为,而不是。
2.洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同,这就是洪特规则。
如碳原子的电子排布图是,而不是。
温馨提示核外电子在原子轨道上排布要遵循三个原则:能量最低原理、泡利原理和洪特规则。
这三个原则并不是孤立的,而是相互联系、相互制约的。
也就是说核外电子在原子轨道上排布要同时遵循着三个原则。
典题例解【例1】如果在3p能级上有3个电子,则它们应排布为(用电子排布图表示),而不能排布为,因为这违背了,也不能排布成,因为这违背了。
如果3p能级上有4个电子,有人认为可以排布为,你认为是否正确,说明理由:。
迁移应用1.下列电子排布图所表示的元素原子中,其能量处于最低状态的是()2.下列原子的电子排布式、最外层电子排布式或最外层电子排布图中,哪一种状态的能量较低?(1)氮原子:(2)钠原子:A.1s22s22p63s1 B.1s22s22p63p1(3)铬原子:A.[Ar]3d54s1 B.[Ar]3d44s2(4)碳原子:二、电子排布图1.电子排布图中各符号和数字的意义:2.在书写基态原子的电子排布图时,常出现以下几种错误:①(违反泡利原理)②(违反洪特规则)③(违反洪特规则)典题例解【例2】下面是第二周期部分元素基态原子的电子排布图,则下列说法错误的是()A.每个原子轨道里最多只能容纳2个电子B.电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道C.每个能层所具有的能级数等于能层的序数(n)D.若原子轨道里有2个电子,则其自旋状态相反迁移应用1.下列3d能级的电子排布图正确的是()2.下列表示方法错误的是()A.硫离子的电子式为]2-B.溴原子的简化电子排布式为[Ar]3d104s14p6C.氮原子的电子排布图为D.铜原子的结构示意图为案例探究洪特规则特例的应用第四能层只有1个电子的元素共有()种A.1B.2C.3D.4方法总结当同一能级上的电子排布为全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空状态(p0、d0、f0)时,具有较低的能量和较高的稳定性。
1.1.3学案设计

第一单元做自尊自信的人第一课珍惜无价的自尊第3课时彼此尊重才能赢得尊重学习目标1.在掌握自尊含义的基础上,理解自尊与尊重他人相互联系、密不可分;充分认识到维护人格最重要。
2.在生活中培养善于尊重他人的良好品质。
3.学会宽容待人的方法,做到自尊者达观。
预习内容一、维护人格最重要1.自尊的人最看重。
2.自尊的人不图虚荣,拒绝沾染不良习气,如、、、。
自尊的人绝不做的事。
二、自尊者豁达3.养成豁达、开朗的性格,可以更多地欣赏,感受。
4.对待议论与批评,要做到。
5.自尊要。
适度的自尊有助于我们;过度的自尊使我们。
三、善于尊重他人6.尊重他人最基本的表现,就是,,。
7.尊重他人,要、,。
8.尊重可以使人,可以使人,可以,从而产生无法估量的正面效应。
合作探究周恩来总理是尊重他人的典范。
他虽然身为国家领导人,时时处处尊重别人的劳动,尊重他人的人格。
一次理发时,由于他咳嗽了一下,理发师一不小心在他的脸上划了一个小口子,他不仅没有责怪理发师,还马上向理发师致歉:“这都怪我咳嗽时没和你打招呼!”理完发后,他还请理发师傅留下一起吃饭,以解除理发师傅不安的心情。
(1)这个故事给了你什么启示?(2)谈谈你在日常生活中应该怎样做一个善于尊重他人的人。
课堂反馈一、选择题(下列各题的四个选项中,只有一项是最符合题意的,请将所选选项前的字母编号填入括号内)1.英国著名作家萧伯纳曾遇到一个小女孩,并和她玩了很长时间。
分手时,萧伯纳对小女孩说:“回家告诉你妈妈,今天同你玩耍的是世界有名的萧伯纳。
”小女孩望了萧伯纳一眼,学着大人的口气说:“回家告诉你妈妈,今天同你玩耍的是小姑娘卡嘉!”大文豪立刻感到自己太傲慢了。
此后萧伯纳感慨地说:“是这位小女孩给我上了人生最好的一堂课!这个教训我一辈子也忘不了。
”你从故事中得到的启示是()A.知耻是自尊的重要表现B.尊重他人首先要善于欣赏他人,接纳他人C.彼此尊重才能赢得尊重D.自尊的人最看重自己的人格2.中学生王强性格活泼开朗,经常拿同学的缺点或者缺陷开玩笑,还经常给同学起绰号,同学们很反感。
河北省衡水中学高中数学1.1.3集合的基本运算(一)学案新人教A版必修1

河北省衡水中学高中数学1.1.3集合的基本运算(一)学案新人教A版必修1第一篇:河北省衡水中学高中数学 1.1.3集合的基本运算(一)学案新人教A版必修11.1.3集合的基本运算(一)一、学习目标1.理解并集、交集的含义,会求两个简单集合的并集与交集.2.体验通过实例的分析和阅读来自学探究集合间的关系与运算的过程,培养学生的自学阅读能力和自学探究能力.3.能使用Venn图表达集合的关系及运算,体会Venn图的作用.二、自学导引1、一般的,由所有属于的元素组成的集合,称为集合A与集合B 的并集,记作A Y B(读作“A并B”),即A Y B=.2、由属于的所有元素组成的集合,称为集合A与集合B的交集,记作A I B(读作“A交B”),即A I B=.3、A I A=,A Y A=,A I∅=,A Y∅=.4、若A⊆B,则A I B=,A Y B=.5、A I BA,A I BB,AA Y B,A I BA Y B.三、典型例题1、求两个集合的交集与并集例1求下列两个集合的交集和并集⑴A={1,2,3,4,5},B={-1,0,1,2,3};⑵A={x|x<-2},B={x|x>-5}.变式迁移1⑴设集合A={x|x>-1},B={x|-2<x<2}A Y B等于()A{x|x>-2}B.{x|x>-1}C.{x|-2<x<-1}D.{x|-1<x<2}⑵若将⑴中A改为A={x|x>a},求A Y B.2、已知集合的交集、并集求参数的问题例2已知集合A=-4,2a-1,a{2},B={a-5,1-a,9},若A I B={9},求a的值.3、交集、并集性质的综合应用例3设A={x|x2+4x=0},B={x|x2+2(a+1)x+a2-1=0}.⑴若A I B=B,求a的值;⑵若A Y B=B,求a的值。
变式迁移3已知集合A={x|-2≤x≤5},B={x|2m-1≤x≤2m+1},若A Y B=A,求实数m的取值范围.4、课堂练习1.已知A={0,1,2,3,4},B={3,0,5,6},则A I B等于()A{0,3}B.{0,1,2,3,4}C.{3,0,5,6}D.{0,1,2,3,4,5,6}2.已知M={x|x-2<0},N={x|x+2>0}则M I N等于()A.{x|x<2或x>-2}B.{x|-2<x<2}C.{x|x<2}D.{x|x>-2}23.已知集合M={x|y=x-1},,N={y|y=x2-1}那么M I N等于A.∅B.NC.MD.R4.若集合A={1,3,x},B=1,x2,A Y B={1,3,x},则满足条件的实数x的个数有{}()A.1个B.2个C.3 个D.4个二、填空题5.满足条件M Y{}1={1,2,3}的集合M的个数是.6.已知A I{-1且A⊆{-2,0,1}={0,1},0,1,2},则满足上述条件的集合A共有个.7.已知集合A={x|-1≤x≤2},B={x|2a<x<a+3}且满足A I B=∅,则实数a的取值范围是.8.已知集合A=1,4,a2-2a,B=a-2,a2-4a+2,a2-{}1,3},则A Y B=.3a+3,a2-5a},若A I B={10个高考试题1.集合A={x|-1≤x≤2},B={x|x<1},则A⋂(CRB)=(A){x|x>1}(B){x|x≥1}(C){x|1<x≤2}(D){x|1≤x≤2}{⎧⎪2.若集合A=⎨xlog1x≥⎪2⎩1⎫⎪⎬,则ðRA= 2⎪⎭⎛⎫⎛⎫(-∞,0]Y+∞,+∞+∞)A、B、 C、(-∞,0]Y D、+∞) ⎪⎪2⎪2⎪⎝⎭⎝⎭3.集合P={x∈Z0≤x<3},M={x∈Rx2≤9}则PIM=(A){1,2}(B){0,1,2}(C){x|0≤x<3}(D){x|0≤x≤3}4.若集合A={x-2<x<1},B={x0<x<2}则集合A ∩B= A.{x-1<x<1}B.{x-2<x<1} C.{x-2<x<2}D.{x0<x<1}第二篇:河北省衡水中学高中数学 1.1.1集合的含义与表示(一)学案新人教A版必修1高一数学必修一学案:1.1.1集合的含义与表示(一)一、学习要求:了解集合的含义,体会元素与集合的“属于”关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章 物质结构 元素周期律
第一节 元素周期表
第3课时 核素
学习目标
1.了解原子的构成。
2.知道元素、核素、同位素的概念。
3.掌握质子数、中子数、质量数之间的相互关系。
学习过程
一、原子的组成
2.质量数:
3.质量数(A )= +
[思考]1.碳14中的14指什么?
2.原子的质量数是否就是原子的相对原子质量?
3.氧原子的质量数为16,质子数为8,那么它的中子数是多少?
4.硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?
二、原子组成的表示方法
1.Z A X 的含义: 。
2.613C 、818O 、92238
U 三种原子的中子数各为多少?
三、三个概念
1.元素: 。
2.核素: 。
3.同位素: 。
4.三者的关系:
[练习]1.下列各组粒子属于同位素的是( )
A.35Cl 和37Cl
B.40K 和40Ca
C.O 2和O 3
D.H 2O 和D 2O
2.1H 、2H 、3H 、H +、H 2可以表示( )
A.氢的五种同位素
B.五种氢元素
C.化学性质不同的氢原子
D.氢元素的五种不同粒子
四、相对原子质量
[思考]元素的相对原子质量和原子的相对原子质量是一回事吗?
1.原子(核素)的相对原子质量: 。
2.元素的相对原子质量: 。
3.原子(核素)的近似相对原子质量:。
4.元素的近似相对原子质量:。
[练习]已知氯元素有两种天然同位素,并测得35Cl的原子个数百分比为75.77%,相对原子质量为34.969,37Cl的原子个数百分比为24.23%,相对原子质量为36.966,则氯元素的相对原子质量和近似相对原子质量分别为多少?
随堂检测
222Rn),从而对人体造成伤害,该核素核内
1.据报道,某些花岗岩中含有具有放射性的氡(
86
中子数与质子数之差为()
A.86
B.136
C.50
D.222
2.在①36Li②714N③1123Na④1224Mg⑤37Li⑥614C中:
(1)和互为同位素。
(2)和质量数相等,但不能互称同位素。
(3)和的中子数相等,但质子数不相等,所以不是同一种元素。
3.某元素一种同位素原子的质子数为m,中子数为n,则下列叙述正确的是()
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳原子的质量为W g,则此原子的质量为(m+n)W g
D.核内中子的总质量小于质子的总质量
4.用字母填写下列空格。
A.质子数
B.中子数
C.核外电子数
D.最外层电子数
E.电子层数
(1)同位素种类由决定;
(2)元素种类由决定;
(3)某元素有无同位素由决定;
(4)核素相对原子质量由决定;
(5)主族元素的化学性质主要由决定;
(6)核电荷数由决定;
(7)碱金属原子失电子能力相对强弱由决定;
(8)原子得失电子能力相对强弱由决定。
5.我国稀土资源丰富,下列有关稀土元素62144Sm与62150Sm的说法正确的是()
A.62144Sm与62150Sm互为同位素
B.62144Sm与62150Sm的质量数相同
C.62144Sm与62150Sm是同一种核素
D.62144Sm与62150Sm的核外电子数和中子数均为62
6.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子为“四中子”,也有人称之为“零号元素”。
下列有关“四中子”粒子的说法不正确的是()
A.该粒子不显电性
B.该粒子质量数为4
C.在周期表中与氢元素占同一位置
D.该粒子质量比氢原子大
7.铜有两种天然同位素2963Cu和2965Cu,已知铜元素的近似相对原子质量为63.5,则2963Cu的原子个数百分数是()
A.75%
B.25%
C.50%
D.45%
参考答案
学习过程
一、1.(1)原子呈电中性,质子数=核外电子数(=核电荷数=原子序数);(2)原子的质量集中在
原子核;(3)质子和中子的质量几乎相同,相对质量接近1
2.质子的相对质量取整数与中子的相对质量取整数相加起来所得的数值,用A 表示。
3.质子数(Z ) 中子数(N )
[思考]1.14是该碳原子的质量数。
2.原子的质量数并不是其相对原子质量,原子的相对原子质量是该原子的质量相对一个12C 原子质量的112的一个相对值,而质量数是质子数加中子数,但质子、中子的相对质量并不是1,而是近似等于1,此外原子的质量还包括电子。
3.N=A-Z=16-8=8。
4.Z =18-2+17=33。
二、1.原子X 质子数为Z ,质量数为A
2.613C 中子数为13-6=7 818
O 中子数为18-8=10 92238
U 中子数为238-92=146
三、1.具有相同核电荷数(即质子数)的一类原子的总称
2.具有一定数目的质子和一定数目的中子的一种原子
3.质子数相同而中子数不同的同一元素的不同原子互称为同位素
4.
[练习]1.A 2.D
四、[思考]因为一种元素可能存在多种核素,所以元素的相对原子质量和原子的相对原子质量不是一回事,元素的相对原子质量是多种核素相对原子质量的平均值。
1.一个原子质量跟一个碳12原子质量的112的比值
2.是按该元素所含各种天然、稳定核素所占的一定百分比算出来的平均值
3.就是相应原子的质量数
4.用质量数代替元素的各种核素的相对原子质量,求得的即为元素的近似相对原子质量
[练习]氯元素的相对原子质量:34.969×75.77%+36.966×24.23%=35.45
氯元素的近似相对原子质量:35×75.77%+37×24.23%=35.48 随堂检测
1.C
2.(1)① ⑤ (2)② ⑥ (3)③ ④
3.A
4.(1)AB (2)A (3)B (4)AB (5)D (6)A (7)E (8)DE
5.A
6.解析:该粒子无质子,故在周期表中不与氢元素占同一位置。
答案:C
7.解析:方法一:代数法。
设 2963Cu 的原子个数百分数为x ,则 2965Cu 的原子个数百分数为(1-x )。
根据元素近似相对原子质量的定义得63×x +65×(1-x )=63.5
x =75%。
方法二:十字交叉法。
因为平均相对原子质量是介于两种同位素的质量数之间,且是根据一定质量分数求和所得,所以可以根据十字交叉法求解。
根据题意有
则两种同位素63Cu 与65Cu 的原子个数比为1.5∶0.5=3∶1,所以63Cu 的原子个数百分数为34×100%=75%。
答案:A。
