毛细管电泳实验报告
毛细管电泳-紫外检测法测定

用于清洗毛细管,防止 样品残留。
标记物
用于增强样品在紫外检 测器中的信号,提高检
测灵敏度。
实验设备
ቤተ መጻሕፍቲ ባይዱ
01
02
03
04
毛细管电泳仪
用于分离样品中的各组分,具 有高分辨率和高灵敏度。
紫外检测器
用于检测样品中特定组分的紫 外吸收光谱,从而确定组分的
性质和浓度。
洗脱泵
用于提供洗脱液,清洗毛细管 内的残留物。
毛细管电泳-紫外检测法的优缺点
高分离效率
毛细管电泳具有高柱效和低扩散 系数,能够实现高效分离。
微量样品需求
只需少量样品即可完成分析,适 用于珍贵样品的分析。
毛细管电泳-紫外检测法的优缺点
快速分析
分析时间短,适合高通量分析。
多种检测模式
可结合多种检测器,如紫外、荧光、质谱等,实现多组分同时检测。
毛细管电泳-紫外检测法的优缺点
图表展示
通过柱状图、折线图等形式展示实验结果,便于直观地比较不同样品之间的差异 。
结果分析
吸光度分析
根据实验数据,分析各样品在检测波长下的吸光度,探讨吸 光度与样品浓度之间的关系。
分离效果评估
对毛细管电泳分离后的各组分进行紫外检测,分析分离效果 ,包括峰形、分离度等。
结果比较与讨论
1 2 3
不同样品比较
05
结论
研究成果总结
毛细管电泳-紫外检测法是一种 高效、灵敏的分离分析方法, 适用于多种化合物的分离和检
测。
在本实验中,成功分离和检测 了多种目标化合物,包括有机 酸、氨基酸、肽类和蛋白质等
。
该方法具有较高的分离效率和 灵敏度,能够满足实际应用的 需求。
毛细管电泳分离蛋白质研究

毛细管电泳分离蛋白质研究蛋白质是生命体中重要的组成部分之一,对维持生命机能和完成生命过程具有重要作用。
因此,对蛋白质的研究一直是生命科学领域的热点问题。
而毛细管电泳作为一种高效、高灵敏、高分辨的方法,已成为蛋白质分离和分析的常用手段之一。
什么是毛细管电泳?毛细管电泳是一种基于蛋白质电荷和大小的分离方法。
它利用毛细管内充满缓冲液,通过在毛细管中施加电场,将不同电荷和大小的蛋白质分离开来。
毛细管电泳和传统的凝胶电泳相比,具有更高的分辨率和灵敏度,样品需求量也更小。
毛细管电泳的优势毛细管电泳的优势主要有以下几点:1. 高分辨率:毛细管电泳可以分离出大小相差1-3%的蛋白质,而传统的凝胶电泳只能分离出10%以上的蛋白质。
2. 高灵敏度:毛细管电泳可以检测到微量蛋白质,而凝胶电泳的灵敏度较低。
3. 快速:毛细管电泳的分离速度快,比手性高效液相色谱要快10倍以上。
4. 自动化:毛细管电泳可以与多种检测方法结合使用,实现自动化检测。
毛细管电泳分离蛋白质的原理毛细管电泳分离蛋白质的原理是基于电荷和大小的差异。
蛋白质在毛细管中的运动速度与电场强度、离子缓冲液等多个因素有关。
在电场作用下,带有正电荷的蛋白质会向负电极移动,带有负电荷的蛋白质则向正电极移动。
而整体电荷为中性或近中性的蛋白质则不运动或运动极慢。
此外,蛋白质的大小也会影响其在毛细管中的运动速度。
较小的蛋白质分子可以通过毛细管的孔径,运动速度相对较快;而较大的蛋白质分子则相对较慢。
毛细管电泳分析的步骤毛细管电泳分析一般分为以下步骤:1. 样品预处理:将样品通过离心、过滤、去除盐等方法处理干净,以获得高质量的分离结果。
2. 毛细管填充:将毛细管填充缓冲液,以避免产生电荷扰动和样品游离。
3. 样品注入:将样品加载到毛细管中,一般通过注射器或电动势力注射等方法。
4. 施加电场:毛细管内施加电场,使电荷带正的蛋白质向负电极移动,电荷带负的蛋白质向正电极移动,而中性或近中性的蛋白质分子则不运动或运动极慢。
毛细管电泳实验
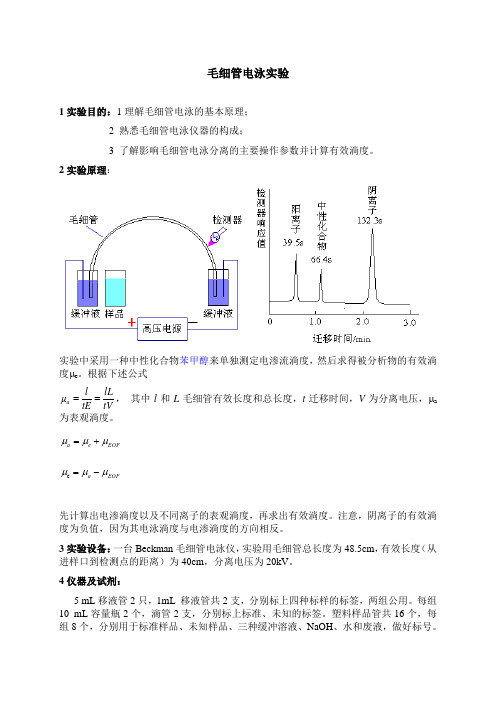
毛细管电泳实验1实验目的:1理解毛细管电泳的基本原理; 2 熟悉毛细管电泳仪器的构成;3 了解影响毛细管电泳分离的主要操作参数并计算有效淌度。
2实验原理:实验中采用一种中性化合物苯甲醇来单独测定电渗流淌度,然后求得被分析物的有效淌度μe 。
根据下述公式tV lL tE l a ==μ, 其中l 和L 毛细管有效长度和总长度,t 迁移时间,V 为分离电压,μa 为表观淌度。
EOF e a μμμ+= EOF a μμμ-=e先计算出电渗淌度以及不同离子的表观淌度,再求出有效淌度。
注意,阴离子的有效淌度为负值,因为其电泳淌度与电渗淌度的方向相反。
3实验设备:一台Beckman 毛细管电泳仪,实验用毛细管总长度为48.5cm ,有效长度(从进样口到检测点的距离)为40cm ,分离电压为20kV 。
4仪器及试剂:5 mL 移液管2只,1mL 移液管共2支,分别标上四种标样的标签,两组公用。
每组10 mL 容量瓶2个,滴管2支,分别标上标准、未知的标签。
塑料样品管共16个,每组8个,分别用于标准样品、未知样品、三种缓冲溶液、NaOH 、水和废液,做好标号。
滴瓶一共5个,分别装三种缓冲液(buffer)、1mol/L的NaOH和乙醇。
镊子、洗瓶、吸耳球、试管架、塑料样品管架、废液烧杯每组一个。
剪刀一把,记号笔一支,滤纸。
标样:苯甲醇、苯甲酸、水杨酸、对氨基水杨酸,均溶于二次水中,浓度1.00 mg/mL,作为标准品。
缓冲溶液(buffer):10 mmol/L NaH2PO4-Na2HPO4 1:1缓冲溶液(NaH2PO4和Na2HPO4 各5mMol/L);20 mmol/L NaH2PO4-Na2HPO41:1缓冲溶液(NaH2PO4和Na2HPO4 各10mMol/L),。
1mol/L NaOH溶液,二次去离子水。
5实验步骤:1.仪器的预热和毛细管的冲洗:在实验教师的指导下,打开仪器和配套的工作站。
毛细管电泳法

毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的含量测定毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的含量测定毛细管电泳又称高效毛细管电泳( High Performance Capillary Electrophoresis, HPCE) 是一种仪器分析方法。
通过施加10-40kV 的高电压于充有缓冲液的极细毛细管,对液体中离子或荷电粒子进行高效、快速的分离。
现在,HPCE 已广泛应用于氨基酸、蛋白质、多肽、低聚核苷酸、DNA 等生物分子分离分析,药物分析,临床分析,无机离子分析,有机分子分析,糖和低聚糖分析及高聚物和粒子的分离分析。
人类基因组工程中DNA 的分离是用毛细管电泳仪进行的。
毛细管电泳较高效液相色谱有较多的优点。
其中之一是仪器结构 简单(见图1)。
它包括一个高电压源,一根毛细管,紫外检测器及计算机处理数据装置。
另有两个供毛细管两端插入而又可和电源相连的缓冲液池。
high-v oltagepower supply BufferV ialBuffer V ial Detector Recording dev icecapillaryElectrode Electrode图1 CE 仪器组成示意图毛细管中的带电粒子在电场的作用下,一方面发生定向移动的电泳迁移,另一方面,由于电泳过程伴随电渗现象,粒子的运动速度还明显受到溶液电渗流速度的影响。
粒子的实际流速 V 是电泳流速度 Vep 和渗流速度 Veo 的矢量和。
即:V = Vep + Veo (1)电渗流是一种液体相对于带电的管壁移动的现象。
溶液的这一运动是由硅/水表面的Zeta 势引起的。
CE 通常采用的石英毛细管柱表面一般情况下(pH>3)带负电。
当它和溶液接触时,双电层中产生了过剩的阳离子。
高电压下这些水合阳离子向阴极迁移形成一个扁平的塞子流,如图2。
毛细管管壁的带电状态可以进行修饰,管壁吸附阴离子表面活性剂增加电渗流, 管壁吸附阳离子表面活性剂减少电渗流甚至改变电渗流的方向。
毛细管电泳

2. 药物分析 analysis of pharmaceutics
3. 氨基酸分析 analysis of amino acids 4. 核酸分析及DNA测序 analysis of nucleic acids and sequence of DNA 5. 新进展及热点问题 advances and special topics
2 DL
ap ELef
2D
tR ; 色谱 : n 5.54 Y 1/ 2
2
D—扩散系数;Y1/2--半峰宽
扩散系数小的溶质分离效率高,分离生物大分子的依据。
3.分离度
R 0.177
apVLef
DL
平均
平均
ap1 ap 2
2
影响分离度的主要因素;工作电压V;毛细管有效长度与总 长度比;有效淌度差。分离度可按谱图直接由下式计算:
苯甲醇、苯甲酸、水杨酸 的毛细管电泳分离
肖艳玲、陶海升
安徽师范大学化学与材料科学学院
一、实验目的
1、掌握毛细管电泳的基本概念; 2、通过实验熟悉毛细管电泳仪的基本原理和操作; 3、了解影响毛细管电泳分离的主要操作参数。
二、基本概念
电泳:在电解质溶液中,位于电场中的带电粒子在电场力的 作用下,以不同的速度向其所带电荷相反的电极方向迁移的 现象,称为电泳。 由于不同粒子所带电荷及性质的不同,迁移速率不同,可实 现分离。利用电泳现象对某些化学或生物物质进行分离分析 的方法(技术)叫电泳法(技术)。 电泳 毛细管电泳
电渗流的速度约等于一般离子电泳速度的5~7倍; (1)可一次完成带正电粒子、带负电粒子以及中性粒子的分离; (2)改变电渗流的大小和方向可改变分离效率和选择性, 如同改变LC中的流速;在CE中,控制电渗流非常重要。
毛细管电泳—紫外检测法测定

Y=104.14X+157.13
0.9978
1.00-50
0.44
3.10 实际样品测定及回收率实验
图3.10 益母草提取液的电泳图。 (a)益母草提取液;(b)加入标样后的益母草提取液 1.山奈酚;2.芦丁;3.金丝桃甙;4槲皮素。
结
论
本文研究了四种黄酮类物质在毛细管 中的CZE行为,对影响分离的一系列参数如 缓冲液的PH,浓度,分离电压,进样方式及 进样时间等进行了详细的考察,建立了CZEUV分离检测体系,在6min 内将四种黄酮类 物质完全分离,并对益母草样品进行了检测。
山奈酚 芦丁 金丝桃甙
回归方程
Y=178.83X-6.19 Y=123.40X+147.13 Y=222.58X-131
相关系数
0.9996 0.9985 0.9996
线性范围 检测限 (μg/ mL) (μg/ mL)
0.50-20 1.00-50 0.80-50 0.07 0.08 0.23
槲皮素
毛细管管径
本实验采用紫外检测的方法,毛细管的 短光程严重制约了它的灵敏度,从提高 灵敏度的角度考虑,宜采用管径为75μm 的毛细管。 由于仪器配备有恒温装置,很大程度上 减小了焦耳热的影响。 综合各种因素,实验最终选用管径为 75μm的毛细管。
3.7 最佳实验条件
未涂层弹性石英毛细管(58cm ×75μm,有效 长度48.8cm) 紫外检测波长为 254nm; 运行缓冲液为pH为8.30的5mmol/L硼砂10mmol/L磷酸二氢钠缓冲液; 采用压力进样,进样时间10s,进样压力 0.5psi; 分离电压20kV。
表1.1 1998年和2000年 药物分析杂志发表定量测定论文统计表
毛细管区带电泳分析
CZE在PSL微球中的应用
CZE分离不同组成成分的PSL微球混合 物 CZE测定PSL微球的电泳淌度 CZE用于研究两种不同组成成分的胶乳 粒子之间的相互作用。
微球的表观电泳淌度与 粒子的表面电荷(或荷质 比)之间无线性关系。
VanOman提出PSL微球的分离是因为 各粒子与毛细管内壁相互作用造成不同程 度的粒子滞后而产生的 Ballou认为PSL微球的分离与粒子自身 的性质有关
脂质体有包封脂溶性药物或水溶性药物 的特性,药物被脂质体包封后有主要特 点: 靶向性和淋巴定向性 缓释性 细胞亲和性与组织相容性 降低药物毒性 保护药物提高稳定性
脂质体的评价指标
脂质体的形态、粒径及其分布
包封率的测定
渗透率的测定 药物体内分布的测定
CZE在脂质体中的应用
微粒体-膜微囊
细胞在水溶液中通过机械力让其破裂产 生胞内膜,该膜包裹于微粒体表面而形 成微囊即称为线粒体-膜微囊
Radkon等利用CZE(Tris-硼酸电泳缓冲 液,pH 8.3,检测波长 280nm)研究微粒 体-膜微囊
检测器
CZE分析脂质体的在线检测方法有多种: 如UV,可见光吸收(合适的染剂嵌入在 膜内)、LIF(荧光染剂嵌入在膜内或包 裹于脂质体内)、柱后化学发光法等。
毛细管区带电泳分析 微米级和亚微米级粒子
粒子在电泳中迁移的机制 CZE在各种类型的粒子中应用 粒子在CZE中的特殊电泳行为
胶体粒子的电学性质
胶体粒子表面带有电荷 电泳
电离
离子吸附
离子溶解
Gouy-Chapman-Stern 模型
Smoluchowski 认为在电场中粒
子的运动是带电粒子表面的静电力F1 及阻力F2的综合结果。
化工实验 毛细管电泳
毛细管区带电泳(CZE) 分离硝基酚位置异构体
实验目的
1. 了解CZE分离的基本原理 2. 了解毛细管电泳仪的基本构造,
掌握其基本操作技术 3. 学会计算CZE的重要参数
基本理论
毛细管电泳: 毛细管电泳指以毛细管为通道、
以高压直流电场为驱动力的一类液相 分离分析技术。
毛细管电泳装置组成
毛细管的清洗
氢氧化钠溶液 二次水 盐酸 二次水
经处理后石英玻璃毛细管内 表面结构
Si Si O Si Si O Si Si Si
OO OO HH HH
OOO HHH
硅羟基的电离
pH >3
Si-OH
Si-O- + 会出现双电层:
Si Si O Si Si O Si
❖ 高压源系统 ❖ 分离系统 ❖ 检测记录系统
高压源系统的功能
提供大小可变的直流电压
电压显示窗 启动高压按钮 高压调节旋钮
电流显示窗 卸载高压按钮 仪器电源开关
高压源电极示意图
高压源正极
毛细管
高压源负极
分离系统的功能
提供样品分离分析 的通道和场所
分离系统详解
常用毛细管为石英玻璃毛细管
❖石英玻璃
思考题
1.如何计算间、对硝基苯酚的电 泳速度?
2 .如何实现电渗流方向的改变?
OO H+ H+
OO
O
H+ H+
H+
毛细管内液体
Si Si OO H+ H+
Si Si O Si Si O Si Si Si
-
OO H+ Na+
OO
OOO
H+ Na+ Na+ Na+ H+
+
药物分析实验:高效毛细管电泳分离检测苯磺酸氨氯地平对映体
四、含量测定
(1)标准溶液配制:取苯磺酸氨氯地平对照品适量,用超纯水 配成标准溶液。(已配好)
(2)待测样品准备:取外消旋氨氯地平1片(标示含量5 mg/片) 于50 mL容量瓶中, 在适量水中用超声波辅助浸溶10 min,定容至50 mL,滤纸 过滤,续滤液经过0.45 μm微孔滤膜过滤至EP管中。
六、数据
1、实验步骤 2、标准溶液的浓度以及对应的峰面积 3、样品测定的保留时间和峰面积(对照品和 供试品的色谱图) 4、计算过程及结果(包括分离度等) 5、实验思考题、心得等
2020/10/30
七、思考题
1、 高效毛细管电泳的特点? 2、 采用高效毛细管电泳拆分手性药物与采用高效液相色谱 和气相色谱拆分手性药物有何优势? 3、外标一点法和标准曲线法相比,优势和不足?可否用同 一浓度不同体积进样获得标准曲线? 4、采用HP-β-CD作为手性选择剂拆分的化合物有哪些? 利 用HP-β-CD作为手性拆分的优势?
6.129'
0.282'
-2 76
RS
1
2
3
4
5
6
7
8
9
10
11
12
13
min
-2 79
苯磺酸氨氯地平高效毛细管分离对映体图
、注意事项
1、 运行缓冲液须先超声脱气; 2、 缓冲液及样品须经过0.45 μm微孔滤膜过滤; 3、仪器操作时一定要弹起电压启/停控制按钮,停止高压 输出后(此时电压电流都显示0),才可以取出毛细管的 进样端进样; 4、进样时间和进样高度控制准确。
带电粒子的迁移速度=电泳和电渗流两种速度的矢量和 电泳:在电解质溶液中,位于电场中的带电离子在电场力的作用下, 以不同的速度向其所带电荷相反的电极方向迁移的现象 电渗流:是指管内溶液在外力电场作用下整体朝一个方向运动的现象
药物分析实验:高效毛细管电泳分离检测苯磺酸氨氯地平对映体
六、数据
1、实验步骤 2、标准溶液的浓度以及对应的峰面积 3、样品测定的保留时间和峰面积(对照品和 供试品的色谱图) 4、计算过程及结果(包括分离度等) 5、实验思考题、心得等
2020/10/30
七、思考题
1、 高效毛细管电泳的特点? 2、 采用高效毛细管电泳拆分手性药物与采用高效液相色谱 和气相色谱拆分手性药物有何优势? 3、外标一点法和标准曲线法相比,优势和不足?可否用同 一浓度不同体积进样获得标准曲线? 4、采用HP-β-CD作为手性选择剂拆分的化合物有哪些? 利 用HP-β-CD作为手性拆分的优势?
6.129'
0.282'
-2 76
RS
1
2345 Nhomakorabea6
7
8
9
10
11
12
13
min
-2 79
苯磺酸氨氯地平高效毛细管分离对映体图
五、注意事项
1、 运行缓冲液须先超声脱气; 2、 缓冲液及样品须经过0.45 μm微孔滤膜过滤; 3、仪器操作时一定要弹起电压启/停控制按钮,停止高压 输出后(此时电压电流都显示0),才可以取出毛细管的 进样端进样; 4、进样时间和进样高度控制准确。
1、配制44 mmol/L Citric acid + 30 mmol/L Tris(三羟甲基氨
基甲烷)+ 35mmol/L HP-β-CD为电泳运行液。 2、毛细管柱在使用前依次用 0.1 mol/L NaOH、超纯水和 电泳运行液各冲洗毛细管柱 5 min;
3、分离电压16 KV,进样10 S ,检测波长 λ 239 nm。
带电粒子的迁移速度=电泳和电渗流两种速度的矢量和 电泳:在电解质溶液中,位于电场中的带电离子在电场力的作用下, 以不同的速度向其所带电荷相反的电极方向迁移的现象 电渗流:是指管内溶液在外力电场作用下整体朝一个方向运动的现象
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
毛细管电泳实验报告
高乃群S0
实验目的
1.了解毛细管电泳实验的原理
2.掌握毛细管电泳仪的操作方法,并设计样品组分的分析过程.
3.学会处理实验数据,分析实验结果.
实验原理C E所用的石英毛细管柱, 在pH>3情况下, 其内表面带负电, 和溶液接触时形成了一双电层。
在高电压作用下, 双电层中的水合阳离子引起流体整体地朝负极方向移动的现象叫电渗, 粒子在毛细管内电解质中的迁移速度等于电泳和电渗流(EOF)两种速度的矢量和, 正离子的运动方向和电渗流一致, 故最先流出;中性粒子的电泳流速度为“零”,故其迁移速度相当于电渗流速度;负离子的运动方向和电渗流方向相反, 但因电渗流速度一般都大于电泳流速度, 故它将在中性粒子之后流出, 从而因各种粒子迁移速度不同而实现分离。
电渗是CE中推动流体前进的驱动力, 它使整个流体像一个塞子一样以均匀速度向前运动, 使整个流型呈近似扁平型的“塞式流”。
它使溶质区带在毛细管内原则上不会扩张。
一般来说温度每提高1℃, 将使淌度增加2% (所谓淌度, 即指溶质在单位时间间隔内和单位电场上移动的距离)。
降低缓冲液浓度可降低电流强度, 使温差变化减小。
高离子强度缓冲液可阻止蛋白质吸附于管壁, 并可产生柱上浓度聚焦效应, 防止峰扩张, 改善峰形。
减小管径在一定程度上缓解了由高电场引起的热量积聚, 但细管径使进样量减少, 造成进样、检测等技术上的困难。
因此, 加快散热是减小自热引起的温差的重要途径。
v1.0 可编辑可修改
实验设备:电泳仪。
仪器及试剂:
缓冲溶液(buffer):20 mmol/L Na
2B
4
O
7
缓冲溶液。
1mol/L NaOH溶液,二次
去离子水。
未知样饮料(雪碧和醒目)
1.实验步骤仪器的预热和毛细管的冲洗:打开仪器和配套的工作站。
工作温度设置为30℃,不加电压,冲洗毛细管,顺序依次是:1 mol/L NaOH溶液5 min,
二次水5 min,10 mmol/L NaH
2PO
4
-Na
2
HPO
4
1:1缓冲溶液5 min,冲洗过程中出
口(outlet)对准废液的位置,并不要升高托架。
2.混合标样的配制:毛细管冲洗的同时,配制标样苯甲酸浓度依次为、、、、1 mg/ml。
3.做标准曲线:待毛细管冲洗完毕,取1 ml混合标样,置于塑料样品管,放在电泳仪进口(Inlet)托架上sample的位置,然后调整出口(outlet)对准缓冲溶液(buffer),升高托架并固定,然后开始进样。
进样压力30 mbar,进样时间5 s。
进样后将进口(Inlet)托架的位置换回缓冲溶液(buffer),切记换回buffer 的位置!选择方法,修改合适的文件说明,然后开始分析,电压25 kV,时间约10 min。
4.未知浓度混合样品的测定:方法与条件同上,测试未知浓度混合样品,分析时间约25min,据苯甲酸钠标准曲线测雪碧与醒目这两种饮料中的苯甲酸钠的
含量。
5.不同缓冲溶液下迁移时间的变化:未知浓度混合样品的测定完毕后,冲洗毛细管,顺序依次是:1 mol/L NaOH溶液5 min,二次水5 min,然后更换进出
口两端的缓冲溶液为20 mmol/L Na
2B
4
O
7
,冲洗5 min;并在此条件下测试未知浓
度混合样品,电压25 kV,时间约10 min。
按照前面的顺序再次冲洗毛细管,再
次更换进出口两端的缓冲溶液为10 mmol/L NaH
2PO
4
-Na
2
HPO
4
pH为6,冲洗5 min;
并在此条件下测试未知浓度混合样品,电压25 kV,时间约15 min。
数据处理: 1.下图为苯甲酸钠的标准曲线:
浓度(mg/ml)峰面积
1
按照已知浓度峰的积分面积之比折算未知浓度混合样品中各个组分的浓度(外标定量法)。
实验测得:醒目:雪碧:
据标准曲线方程计算醒目中苯甲酸钠为: mg/ml;雪碧中苯甲酸钠为mg/ml
注意事项:
1.冲洗毛细管时禁止在毛细管上加电压;不允许更改讲义上给定的工作电压,也不建议改变进样时间。
2.样品和缓冲溶液之间的切换是手动的,在实验过程中要随时注意是不是放在正确位置;如果在分析时将样品或者洗涤液当作缓冲溶液,请停止分析并重新用对应缓冲溶液冲洗管路10 min。
冲洗毛细管对于实验结果的可靠性和重现性至关重要,务必认真完成每一次冲洗,不允许缩短冲洗时间或者不冲洗。
3.做完实验以后一定要用水冲洗毛细管,一天做完以后要用空气吹干,否则可能会导致毛细管堵塞,严重影响后面组的同学实验。
4.塑料样品管的里面容易产生气泡,轻敲管壁排出气泡以后方可放入托管架。
