关于原子轨道和电子云的图形课件
合集下载
原子核外电子的轨道形状课件

原子核外电子的运动特征
原子核外电子的轨道形状
一、电子云
注意: A.小黑点的含义 B.小黑点疏密的含义 C.H原子电子云的形状
原子核外电子的轨道形状
电子云:描述核外电子运动特征的图象。 电子云中的小黑点:
并不是表示原子核外的一个电子,而是表 示电子在此空间出现的机率。
电子云密度大的地方说明电子出现的机 会多,而电子云密度小的地方说明电子出 现的机会少。
3.各原子轨道的能量高低: 多电子原子中,电子填充原子轨道时,原子 轨道能量的高低存在如下规律:
(1)相同电子层上原子轨道能量的高低:
ns < np < nd < (2)形n状f 相同的原子轨道能量的高低:
1s < 2s < 3s < 4s…… (3)电子层和形状相同的原子轨道的能量相 等,如2px、2py、2pz轨道的能量相等。
原子核外电子的轨道形状
二 核外电子的排布 分层排布
电子层: K L M N O P Q
离核远近:近
远
能量高低:低
高
1234567 K LMNOPQ
原子核外电子的轨道形状
排布规律(一低四不超) (1)能量最低原理 (2)各层最多容纳2n2 个电子 (3)最外层不超过8个(K层2个) (4)次外层不超过18个,倒数第
s轨道:球形
原子核外电子的轨道形状
p轨道:纺锤形
原子核外电子的轨道形状
1、原子轨道的特点
①s原子轨道是球形的,p原子轨道是纺锤形的; ②S轨道是球形对称的,所以只有1个轨道; ③p轨道在空间上有x、y、z三个伸展方向,所 以p轨道包括px、py、pz3个轨道; ④d轨道有5个伸展方向(5个轨道)
三层不超过32个。 相互制约,相互联系
原子核外电子的轨道形状
一、电子云
注意: A.小黑点的含义 B.小黑点疏密的含义 C.H原子电子云的形状
原子核外电子的轨道形状
电子云:描述核外电子运动特征的图象。 电子云中的小黑点:
并不是表示原子核外的一个电子,而是表 示电子在此空间出现的机率。
电子云密度大的地方说明电子出现的机 会多,而电子云密度小的地方说明电子出 现的机会少。
3.各原子轨道的能量高低: 多电子原子中,电子填充原子轨道时,原子 轨道能量的高低存在如下规律:
(1)相同电子层上原子轨道能量的高低:
ns < np < nd < (2)形n状f 相同的原子轨道能量的高低:
1s < 2s < 3s < 4s…… (3)电子层和形状相同的原子轨道的能量相 等,如2px、2py、2pz轨道的能量相等。
原子核外电子的轨道形状
二 核外电子的排布 分层排布
电子层: K L M N O P Q
离核远近:近
远
能量高低:低
高
1234567 K LMNOPQ
原子核外电子的轨道形状
排布规律(一低四不超) (1)能量最低原理 (2)各层最多容纳2n2 个电子 (3)最外层不超过8个(K层2个) (4)次外层不超过18个,倒数第
s轨道:球形
原子核外电子的轨道形状
p轨道:纺锤形
原子核外电子的轨道形状
1、原子轨道的特点
①s原子轨道是球形的,p原子轨道是纺锤形的; ②S轨道是球形对称的,所以只有1个轨道; ③p轨道在空间上有x、y、z三个伸展方向,所 以p轨道包括px、py、pz3个轨道; ④d轨道有5个伸展方向(5个轨道)
三层不超过32个。 相互制约,相互联系
电子云与原子轨道(共9张PPT)
轨道表示式:能反映各轨道的能量的高低及各轨道上的电子
分布情况,自旋方向。
第9页,共9页。
一起的情形.
第3页,共9页。
d
能 级 的 原 子 轨 道
d能级的原子轨道有5个.
第4页,共9页。
二、研究原子结构
1s22s22p63s23p63d64s2
1且、自每旋个方C原向子_轨__道__上__不最。同多能N 容—纳泡___利_2个原电理O 子, 2电d结1当 11电当2P上电21P1从当以Ps当电从结ssss、 能 、 、 、能能能子构电子电的子元电下电子元构2222pS举级举当2222级级级排 示 子排 子 电 排 素 子 是 子 排 素 示ssssd、例的例电的的的2222布意排 布排子布周排表排布周意P2222f说原说子能原原3pppp、式图布 图布数图期布示布式期图个6666明子明排级子子3333d::在 (在。(表在铁在:表:原ssss能洪轨洪在分轨轨2222能能同 轨同轨中同原同能中能子级3333特道特同别道道直直一 道一道查一子一直查直pppp轨分规有规一有6666是是观观能 表能表出能的能观出观3333道别则则能51纺纺dddd地地级 示级示铜级级地铜地3个、P6666有: : 级种锤 锤4444反反的式的式的的的反的反.3xssss多时不,形形、2222P映映不 )不)外不不映外映少有同y的的5核核同 同围同同核围核,、P个什化,,每每Z外内轨 轨电轨轨外电内7轨么学合个个个电的道 道子道道电子的道规用在轨PP子质时 时排时时子排质,律语一能能道的子, ,布,,的布子每?。起级级,能数总 总,总总能,数个的有有每层和是 是它是是层它和轨情33个、核首是、是核___个个道___形轨能外先否能否外___原原上.___道级的单符级符的子子___最___最和电独合和合电轨轨___多多___各子占构各构子道道___能能__能层一造能造层_,,容它它___容级数个原级原数___纳们们___纳轨理理___几相相___的道。。___个互互电___(___电垂垂子___即子直直, ,,数分?,,而 而而分分为占其且 且且别别2不个自自 自自以以同,旋旋 旋旋PP的且方方 方方xx轨,,自PP向向 向向道yy旋怎,,___PP)___方样ZZ___,表表___向?___而示示___相。 。。且..反自。旋方向相同。
分布情况,自旋方向。
第9页,共9页。
一起的情形.
第3页,共9页。
d
能 级 的 原 子 轨 道
d能级的原子轨道有5个.
第4页,共9页。
二、研究原子结构
1s22s22p63s23p63d64s2
1且、自每旋个方C原向子_轨__道__上__不最。同多能N 容—纳泡___利_2个原电理O 子, 2电d结1当 11电当2P上电21P1从当以Ps当电从结ssss、 能 、 、 、能能能子构电子电的子元电下电子元构2222pS举级举当2222级级级排 示 子排 子 电 排 素 子 是 子 排 素 示ssssd、例的例电的的的2222布意排 布排子布周排表排布周意P2222f说原说子能原原3pppp、式图布 图布数图期布示布式期图个6666明子明排级子子3333d::在 (在。(表在铁在:表:原ssss能洪轨洪在分轨轨2222能能同 轨同轨中同原同能中能子级3333特道特同别道道直直一 道一道查一子一直查直pppp轨分规有规一有6666是是观观能 表能表出能的能观出观3333道别则则能51纺纺dddd地地级 示级示铜级级地铜地3个、P6666有: : 级种锤 锤4444反反的式的式的的的反的反.3xssss多时不,形形、2222P映映不 )不)外不不映外映少有同y的的5核核同 同围同同核围核,、P个什化,,每每Z外内轨 轨电轨轨外电内7轨么学合个个个电的道 道子道道电子的道规用在轨PP子质时 时排时时子排质,律语一能能道的子, ,布,,的布子每?。起级级,能数总 总,总总能,数个的有有每层和是 是它是是层它和轨情33个、核首是、是核___个个道___形轨能外先否能否外___原原上.___道级的单符级符的子子___最___最和电独合和合电轨轨___多多___各子占构各构子道道___能能__能层一造能造层_,,容它它___容级数个原级原数___纳们们___纳轨理理___几相相___的道。。___个互互电___(___电垂垂子___即子直直, ,,数分?,,而 而而分分为占其且 且且别别2不个自自 自自以以同,旋旋 旋旋PP的且方方 方方xx轨,,自PP向向 向向道yy旋怎,,___PP)___方样ZZ___,表表___向?___而示示___相。 。。且..反自。旋方向相同。
高三化学电子云与原子轨道PPT课件

则以及原子结构之间的关系,充分认识结构决定性质的化 学基础 • 四、教具准备 • 多媒体
课堂练习
1、判断下列表达是正确还是错误 1)1s22p1属于基态; 2)1s22s2 2p63s2 3p63d54s1属于激发态; 3)1s22s2 2p63d1属于激发态; 4)1s22s2 2p63p1属于基态;
①已知核外电子数目先按照能量最低原 理从1s排起
②其间应考虑是否需应用泡利原理和洪 特规则,特别是要求画外围轨道表示式
③最后考虑是否需要应用量子力学关于 全空、半充满、全充满的排布规定,如 Cr、Cu等原子
;托管班加盟 托管所加盟 午托班加盟 学生托管所;
2.p电子云/原子轨道的形状是纺锤形 (或称为哑铃形),其伸展方向是互向 垂直的三个方向(Px、Py、Pz)。
P电子原子轨道半径同样随着n增大而增大
科学探究
观察图1-14,这些图称为原子的 电子轨道表示式
1.每个原子轨道最多只能容纳几
个电子?
2.当电子排在同一个能级内时, 有什么规律?
★核外电子排布规则: 1.能量最低原理
答案: (1) x(2) x(3)√(4) x
五、电子云与原子轨道
思考: 宏观物体与微观物体(电 子)的运动有什么区别?
宏观物体的运动特征:
• 可以准确地测出它们在某一时刻 所处的位置及运行的速度;
• 可以描画它们的运动轨迹。
微观物体的运动特征:
电子的质量很小,只有9.11×10-31 千克;
核外电子的运动范围很小(相对于
宏观物体而言);
测不准
电子的运动速度很大;
1、电子云
图中 表示原子核,一个小黑点代表 电子在这里出现过一次
➢小黑点的疏密表示电子在核外空间 单位体积内出现的概率的大小。
课堂练习
1、判断下列表达是正确还是错误 1)1s22p1属于基态; 2)1s22s2 2p63s2 3p63d54s1属于激发态; 3)1s22s2 2p63d1属于激发态; 4)1s22s2 2p63p1属于基态;
①已知核外电子数目先按照能量最低原 理从1s排起
②其间应考虑是否需应用泡利原理和洪 特规则,特别是要求画外围轨道表示式
③最后考虑是否需要应用量子力学关于 全空、半充满、全充满的排布规定,如 Cr、Cu等原子
;托管班加盟 托管所加盟 午托班加盟 学生托管所;
2.p电子云/原子轨道的形状是纺锤形 (或称为哑铃形),其伸展方向是互向 垂直的三个方向(Px、Py、Pz)。
P电子原子轨道半径同样随着n增大而增大
科学探究
观察图1-14,这些图称为原子的 电子轨道表示式
1.每个原子轨道最多只能容纳几
个电子?
2.当电子排在同一个能级内时, 有什么规律?
★核外电子排布规则: 1.能量最低原理
答案: (1) x(2) x(3)√(4) x
五、电子云与原子轨道
思考: 宏观物体与微观物体(电 子)的运动有什么区别?
宏观物体的运动特征:
• 可以准确地测出它们在某一时刻 所处的位置及运行的速度;
• 可以描画它们的运动轨迹。
微观物体的运动特征:
电子的质量很小,只有9.11×10-31 千克;
核外电子的运动范围很小(相对于
宏观物体而言);
测不准
电子的运动速度很大;
1、电子云
图中 表示原子核,一个小黑点代表 电子在这里出现过一次
➢小黑点的疏密表示电子在核外空间 单位体积内出现的概率的大小。
电子云与原子轨道

材料结构优化
电子云和原子轨道理论可以用来优化材料的结构,如合金的结构、晶体ຫໍສະໝຸດ 结构等,从而提高材料的性能和稳定性。
03
材料表面与界面研究
电子云和原子轨道理论可以用来研究材料表面和界面的性质,如表面吸
附、表面重构、界面相互作用等,从而为材料表面的改性和界面工程提
供理论支持。
在生物学中的应用
生物大分子结构研究
预测分子的几何结构和性质
电子云和原子轨道理论可以用来预测分子的几何结构和性 质,如分子的形状、极性、光谱性质等,从而为分子设计 和合成提供理论支持。
在材料科学中的应用
01
材料性质预测
电子云和原子轨道理论可以用来预测材料的性质,如导电性、光学性质、
磁学性质等,从而为新材料的发现和应用提供理论支持。
02
能级
排布
原子轨道的能级由主量子数n、角量 子数l和磁量子数m共同决定。
电子按照能量从低到高的顺序填充到 各个原子轨道中,形成电子云。
能级从低到高依次为
s、p、d、f等,同一能级的不同轨道 称为简并轨道。
原子轨道的形状和取向
形状
根据主量子数n和角量子数l的不 同,原子轨道有不同的形状,如s 轨道为球形,p轨道为哑铃形,d 轨道为花瓣形等。
05 电子云与原子轨道的未来 发展
高精度计算方法的发展
密度泛函理论
随着计算能力的提升,密度泛函理论在电子云和原子轨道计算中 的应用将更加广泛,能够更精确地描述电子结构和性质。
多尺度模型
结合不同尺度的模型和方法,如量子力学、分子力学和经典力学, 以更全面地描述复杂体系的电子云和原子轨道行为。
机器学习和人工智能
电子云的交叠与屏蔽效应
电子云交叠是指不同原子或分子的电 子云在空间某处相互重叠,这会导致 电子的相互作用增强,从而影响原子 的化学性质和分子的稳定性。
2-2-2 原子轨道和电子云的图形

4. 等值线、轨道界面
电子云的等值线图形
例1. 讨论氦离子He+2s态波函数的节面位置和 形状.
1
2s
1 4
Z3
2a03
2 2
Zr a0
e
Zr a0
2s
A 2
Zr a0
e
Zr a0
要使2s=0
应有:
2 2rБайду номын сангаас 0 a0
氢原子3pz电子云界面图
原子轨道界面与电子云界面是同一界面, 原子轨道界 面值的绝对值等于电子云界面值的平方根, 原子轨道界面 图的不同部分可能有正负之分, 由波函数决定.
轨道节面分为两种: 角度节面(平面或锥面)有l个;
径向节面(球面)有n-l -1个. 共有n-1个节面.
通常所说的原子轨道图形,应当是轨道界面图.
规律:
① 在r=0处(核处) s型函数在核处有最大值 p型函数在核处为0
② 节面 (n-l-1)个 ns 有n-1个节面 np 有n-2个节面 Rn, l,有n-l-1个节面
③ 最大值分布 ns n,最大值离核越近 np n,最大值离核越近
R(r)与R2(r)的最大值离核越近 意味着电子主要出现在核附近
这说明r=a0处在单位球壳厚度内找到电子的几率 比任何其它地方单位球壳内电子出现的几率要大
② 极大值个数:
0.6
0.3
1s
0
径向分布函数有n-l个极大值,00..2146
有n-l-1个节面
0.08 0
2s
0.24
③ 主峰-最大值出现的位置
0.16 0.08
2p
ns n,主峰离核越远
0 0.16
ns n,主峰离核越远
电子云与原子轨道3

2.当电子排在同一个能级内时,有什么规律?
泡利原理: 一个原子轨道最多容纳2个电子,而且自旋方 向相反。 洪特规则: 电子在能量相同的轨道上排布时,将尽可能 分占不同的轨道并且自旋方向相反
学以致用:
1.观1s轨道电子云示意图,判断下列说
法正确的是 ( D ) A.一个小黑点表示1个自由运动的电子 B.1s轨道的电子云形状为圆形的面 C.电子在1s轨道上运动像地球围绕太阳旋 转 D.1s轨道电子云小黑点的疏密表示电子在 某一位置出现机会的多少
2. 原子轨道:即电子云轮廓图
电子云形状
s电子云呈球形,在半径相同的球面上, 电子出现的机会相同; p电子云呈纺锤形(或无柄亚铃形); d电子云是花瓣形;
f电子云更为复杂
原子轨道
P能级的原子轨道图
d原子轨道图
科学探究
观察图1-14,这些图称为原子的电子轨道表示 式
1.每个原子轨道最多只能容纳几个电子?
小黑点的疏密表示电子在核外空间 单位体积内出现的概率的大小。
电子轮廓图的制作
电子云含义: 为了形象的表示电子在原子核外空间的分布情况, 人们常用单位体积内小黑点的疏密程度来表示电 子在原子核外单位体积内出现概率的大小。
电子云轮廓图----原子轨道
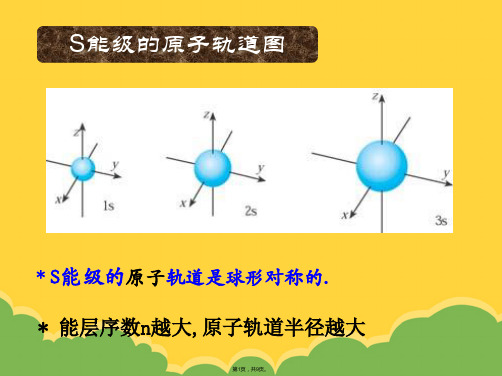
S能级的原子轨道
S能级的原子轨道是球形对称的.
第一节 原子结构
(第3课时)
电子云与原子轨道
1.电子云
思考 宏观物体的运动特征:
可以准确地测出它们在某一时刻所处的
位置及运行的速度; 可以描画它们的运动轨迹。
微观物体的运动特征:
电子的质量很小,只有9.11×10-31千克; 测 核外电子的运动范围很小(相对于宏观物 不 体而言); 准 电子的运动速度很大;
泡利原理: 一个原子轨道最多容纳2个电子,而且自旋方 向相反。 洪特规则: 电子在能量相同的轨道上排布时,将尽可能 分占不同的轨道并且自旋方向相反
学以致用:
1.观1s轨道电子云示意图,判断下列说
法正确的是 ( D ) A.一个小黑点表示1个自由运动的电子 B.1s轨道的电子云形状为圆形的面 C.电子在1s轨道上运动像地球围绕太阳旋 转 D.1s轨道电子云小黑点的疏密表示电子在 某一位置出现机会的多少
2. 原子轨道:即电子云轮廓图
电子云形状
s电子云呈球形,在半径相同的球面上, 电子出现的机会相同; p电子云呈纺锤形(或无柄亚铃形); d电子云是花瓣形;
f电子云更为复杂
原子轨道
P能级的原子轨道图
d原子轨道图
科学探究
观察图1-14,这些图称为原子的电子轨道表示 式
1.每个原子轨道最多只能容纳几个电子?
小黑点的疏密表示电子在核外空间 单位体积内出现的概率的大小。
电子轮廓图的制作
电子云含义: 为了形象的表示电子在原子核外空间的分布情况, 人们常用单位体积内小黑点的疏密程度来表示电 子在原子核外单位体积内出现概率的大小。
电子云轮廓图----原子轨道
S能级的原子轨道
S能级的原子轨道是球形对称的.
第一节 原子结构
(第3课时)
电子云与原子轨道
1.电子云
思考 宏观物体的运动特征:
可以准确地测出它们在某一时刻所处的
位置及运行的速度; 可以描画它们的运动轨迹。
微观物体的运动特征:
电子的质量很小,只有9.11×10-31千克; 测 核外电子的运动范围很小(相对于宏观物 不 体而言); 准 电子的运动速度很大;
原子轨道与电子云PPT课件(上课用)

113.人生的目的有二:先是获得你 想要的 ;然后 是享受 你所获 得的。 只有最 明智的 人类做 到第二 点总与 幽默的 人相伴 ,健康 总与阔 达的人 相伴。 20、对所学知识内容的兴趣可能成 为学习 动机。 ——赞 科夫 21、游手好闲地学习,并不比学习游手 好闲好 。—— 约翰·贝 勒斯
22、读史使人明智,读诗使人灵秀,数 学使人 周密, 自然哲 学使人 精邃, 伦理学 使人庄 重,逻 辑学使 人善辩 。—— 培根 23、我们在我们的劳动过程中学习思考 ,劳动 的结果 ,我们 认识了 世界的 奥妙, 于是我 们就真 正来改 变生活 了。— —高尔 基 24、我们要振作精神,下苦功学习。下 苦功, 三个字 ,一个 叫下, 一个叫 苦,一 个叫功 ,一定 要振作 精神, 下苦功 。—— 毛泽东
分别以___P_x_、____P_y_、_____P_z_为符号。 P原子轨道的平均半径也随能层序数增大而___增_大_
d能级的原子轨道
d能级的原子轨道有 个5.
科学探究
1 为什么画出的方框(轨道)是参差不齐的 2 每个轨道最多能填几个电子 3 填在同一个轨道中的电子的运动方向有何关系 4 电子在填充轨道时遵循怎样的先后顺序
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
105.人类的悲剧,就是想延长自己 的寿命 。我们 往往只 憧憬地 平线那 端的神 奇【违 禁词, 被屏蔽 】,而 忘了去 欣赏今 天窗外 正在盛 开的玫 瑰花。 ――[戴 尔·卡内 基]
25、我学习了一生,现在我还在学习, 而将来 ,只要 我还有 精力, 我还要 学习下 去。— —别林 斯基 2、人生就有许多这样的奇迹,看似比 登天还 难的事 ,有时 轻而易 举就可 以做到 ,其中 的差别 就在于 非凡的 信念。 3、影响我们人生的绝不仅仅是环境, 其实是 心态在 控制个 人的行 动和思 想。同 时,心 态也决 定了一 个人的 视野和 成就, 甚至一 生。
22、读史使人明智,读诗使人灵秀,数 学使人 周密, 自然哲 学使人 精邃, 伦理学 使人庄 重,逻 辑学使 人善辩 。—— 培根 23、我们在我们的劳动过程中学习思考 ,劳动 的结果 ,我们 认识了 世界的 奥妙, 于是我 们就真 正来改 变生活 了。— —高尔 基 24、我们要振作精神,下苦功学习。下 苦功, 三个字 ,一个 叫下, 一个叫 苦,一 个叫功 ,一定 要振作 精神, 下苦功 。—— 毛泽东
分别以___P_x_、____P_y_、_____P_z_为符号。 P原子轨道的平均半径也随能层序数增大而___增_大_
d能级的原子轨道
d能级的原子轨道有 个5.
科学探究
1 为什么画出的方框(轨道)是参差不齐的 2 每个轨道最多能填几个电子 3 填在同一个轨道中的电子的运动方向有何关系 4 电子在填充轨道时遵循怎样的先后顺序
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
105.人类的悲剧,就是想延长自己 的寿命 。我们 往往只 憧憬地 平线那 端的神 奇【违 禁词, 被屏蔽 】,而 忘了去 欣赏今 天窗外 正在盛 开的玫 瑰花。 ――[戴 尔·卡内 基]
25、我学习了一生,现在我还在学习, 而将来 ,只要 我还有 精力, 我还要 学习下 去。— —别林 斯基 2、人生就有许多这样的奇迹,看似比 登天还 难的事 ,有时 轻而易 举就可 以做到 ,其中 的差别 就在于 非凡的 信念。 3、影响我们人生的绝不仅仅是环境, 其实是 心态在 控制个 人的行 动和思 想。同 时,心 态也决 定了一 个人的 视野和 成就, 甚至一 生。
电子云图像

♦ 包立不相容原則比較簡單的定義為,每一個原 子軌域最多只能容納兩個自轉方向相反的電子 。
♦ 填入兩個電子的軌域,淨電子自轉磁量為0,此 為自然法則。
28
一個軌域能填入三個電子?
♦ 當然不行,因為違反自然法則,理由如下: 1. 電子自轉只有順時針及反時針方向兩種,沒 有其他可能的自轉方式。 2. 電子自轉方向相反才能配對於同一軌域,配 對電子淨磁量為0。 [此現象可以兩塊長條磁鐵為例說明,兩塊長 條磁鐵需相反極才能互相吸引配對。]
电子出现最大机率半径 n = 1: 1 ao (1s) n = 2: 4 ao (2p) n = 3: 9 ao (3d) n = 4: 16 ao (4f)
氢原子的电子能量能阶化
19
氢原子轨域距离函数图
20
氫原子軌域距離機率圖
21
原子軌域殼層及軌域數目
主殼層n 1 2
3
4
…
副殼層 s s p s p d s p d f …
♦ 原子最低能量的電子組態,稱為基態電子組 態。
♦ 原子之基態電子組態需遵循遞建原則(aufbau principle) 、包立不相容原則(Pauli exclusion principle) 、及洪德定則(Hund’s rule)。
26
遞建原則(aufbau principle)
♦ 在不考慮原子核內中子數目,元素原子的建構 方式為依序在原子核內加入一個質子,同時在 核外加入一個電子形成,稱為遞建原則(aufbau principle) 。
Cr: [Ar]4s13d5 (而不是[Ar]4s23d4) Cu: [Ar]4s13d10 (而不是[Ar]4s23d9)
原因: ♦ 4s與3d軌域能量差很小,4s軌域能量僅略低 於3d軌域。 ♦ 當過渡金屬原子的3d及4s軌域電子均達到半 滿或全滿時,能量較低。
♦ 填入兩個電子的軌域,淨電子自轉磁量為0,此 為自然法則。
28
一個軌域能填入三個電子?
♦ 當然不行,因為違反自然法則,理由如下: 1. 電子自轉只有順時針及反時針方向兩種,沒 有其他可能的自轉方式。 2. 電子自轉方向相反才能配對於同一軌域,配 對電子淨磁量為0。 [此現象可以兩塊長條磁鐵為例說明,兩塊長 條磁鐵需相反極才能互相吸引配對。]
电子出现最大机率半径 n = 1: 1 ao (1s) n = 2: 4 ao (2p) n = 3: 9 ao (3d) n = 4: 16 ao (4f)
氢原子的电子能量能阶化
19
氢原子轨域距离函数图
20
氫原子軌域距離機率圖
21
原子軌域殼層及軌域數目
主殼層n 1 2
3
4
…
副殼層 s s p s p d s p d f …
♦ 原子最低能量的電子組態,稱為基態電子組 態。
♦ 原子之基態電子組態需遵循遞建原則(aufbau principle) 、包立不相容原則(Pauli exclusion principle) 、及洪德定則(Hund’s rule)。
26
遞建原則(aufbau principle)
♦ 在不考慮原子核內中子數目,元素原子的建構 方式為依序在原子核內加入一個質子,同時在 核外加入一個電子形成,稱為遞建原則(aufbau principle) 。
Cr: [Ar]4s13d5 (而不是[Ar]4s23d4) Cu: [Ar]4s13d10 (而不是[Ar]4s23d9)
原因: ♦ 4s與3d軌域能量差很小,4s軌域能量僅略低 於3d軌域。 ♦ 當過渡金屬原子的3d及4s軌域電子均達到半 滿或全滿時,能量較低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.08 0
3s
0.12
④ n相同,lБайду номын сангаас同时
0.08 0.04
3p
l,主峰离核越近;
0 0.12 0.08
第一个极大值离核越远
0.04
3d
0 0 5 10 15 20 24
r/a0
3. 角度部分的对画图
(1) Y(θ,φ)~θ,φ图,即波函数角度分布图. (2) |Y (θ,φ)| 2~θ,φ图,即电子云角度分布图.
2n,l,m(r,,)d 电子在微体积元d中出现的几率
电子在半径为r处,厚度
为dr的球壳内电子出现
2 2n,l,m(r,,)d 的几率
0 0
2
R 2 r2sid nr dd
00
r2R 2d2 r 2d 2sid n
0
0
r2R2dr
D(r)dr
D(r)r2Rn,l2(r)
径向分布函数
几率和几率密度!!!
(2) 径向分布函数D(r)
前面R2(r)描述的是几率密度随r的分布情 况,要真正了解电子的分布情况,要关心电 子分布的几率---
电子在半径为r处,厚度为dr的球壳内 电子出现的几率
2n,l,m(r,,) 电子在(r, , )处出现的几率密度
dr2sindrd d 三维空间中的微体积元
这说明r=a0处在单位球壳厚度内找到电子的几率 比任何其它地方单位球壳内电子出现的几率要大
② 极大值个数:
0.6
0.3
1s
0
径向分布函数有n-l个极大值,00..2146
有n-l-1个节面
0.08 0
2s
0.24
③ 主峰-最大值出现的位置
0.16 0.08
2p
ns n,主峰离核越远
0 0.16
ns n,主峰离核越远
关于原子轨道和电 子云的图形
* 作图对象和作图方法
作图对象主要包括: (1) 复函数还是实函数
(2) 波函数 (即轨道)还是电子云(2) (3) 完全图形还是部分图形( or R or Y or ……)
作图方法主要包括: 函数-变量图、界面图、等值面(线)图、 网格图、黑点图
注意!!! -函数图像 -对波函数的数学描述 -并非运动轨迹和运动范围的描述
氢原子3pz电子云界面图
原子轨道界面与电子云界面是同一界面, 原子轨道界 面值的绝对值等于电子云界面值的平方根, 原子轨道界面 图的不同部分可能有正负之分, 由波函数决定.
轨道节面分为两种: 角度节面(平面或锥面)有l个; 径向节面(球面)有n-l-1个. 共有n-1个.
通常所说的原子轨道图形,应当是轨道界面图.
规律:
① 在r=0处(核处) s型函数在核处有最大值 p型函数在核处为0
② 节面 (n-l-1)个 ns 有n-1个节面 np 有n-2个节面 Rn, l,有n-l-1个节面
③ 最大值分布 ns n,最大值离核越近 np n,最大值离核越近
R(r)与R2(r)的最大值离核越近 意味着电子主要出现在核附近
特别注意!!!
分解得到的任何图形都只是从某一侧面描述 轨道或电子云的特征,而决不是轨道或电子云的 完整图形!
最常见的一种错误是把波函数角度分布图
Y(θ,φ)说成是原子轨道,或以此制成模型作为
教具。
角度分布图
Yl,m的节面数为l个 Rn,l的节面数为n-l-1个
n,l,m的节面数为n-1个
化学中很少使用复函数,下面给出氢原子实函数的轨 道界面图.
2. 径向部分的对画图
径向部分的对画图有三种: (1) R(r)-r图,即径向函数图 (2) R2(r)-r图,即径向密度函数图 (3) D( r ) - r图,即径向分布函数图
(1) R(r)-r图与R2(r)-r图 R(r)-径向函数 R2(r)-径向密度函数
物理意义: 电子在r处单位球壳厚度内电子出现的几率, 它反映了电子云随r的分布
b
a D(r)dr
物理意义: 电子在处于n, l状态时,电子在距离核为 a, b间的球壳内出现的几率
规律:
① 1s态
D(r)
0.6 0.5 0.4 0.3 0.2 0.1 0.0
0123456 r/a0
对1s轨道,几率密度随r下降,但微球壳体积随 r增大而增大。两个相反趋势的综合作用结果使 得在r=a0处D(r)出现了最大值
1. 原子轨道和电子云的等值面图
把函数值相同的空间各点连成曲面, 就是等值面图(其剖 面是等值线图).
电子云的等值面亦称等密度面. 电子云界面图是一种等密度面。 通常的选择标准是: 这 种等密度面形成的封闭空间(可能有几个互不连通的空间)能 将电子总概率的90%或95%包围在内(而不是这个等密度面 上的概率密度值为0.9或0.95).
