水化学1ppt-水环境化学
水分析化学ppt课件完整版

•水分析化学概述•水样的采集与处理目录•水质指标与测定方法•水体中常见离子的分析方法•有机污染物的分析方法•水质综合评价与监测01水分析化学概述水分析化学的定义与任务定义水分析化学是研究水及其所含组分的化学组成、结构、性质及其变化规律的科学。
任务通过对水样的采集、处理和分析,了解水体的化学性质、污染状况及其变化趋势,为水资源保护、水环境治理和水质监控提供科学依据。
包括地表水(河流、湖泊、水库等)和地下水,研究其化学组成、性质及变化规律。
天然水废水饮用水工业废水、生活污水等,研究其污染物的种类、浓度及迁移转化规律。
研究其水质标准、处理工艺及对人体健康的影响。
030201化学分析法仪器分析法生物分析法物理分析法利用化学反应原理进行定性或定量分析,如沉淀法、络合滴定法等。
利用生物体或生物组织对水样中的某些物质进行识别或测定,如生物传感器法、酶分析法等。
借助各种仪器设备对水样进行分析,如光谱法、色谱法、电化学法等。
通过测量水样的物理性质来推断其化学组成和性质,如电导率法、折射法等。
02水样的采集与处理水样的采集采样点的选择根据水体类型、污染状况和研究目的,选择合适的采样点,确保水样具有代表性。
采样时间和频率根据水体变化规律和污染物排放情况,确定采样时间和频率,以反映水体的真实状况。
采样器具的选择与清洗选用合适的采样器具,如玻璃瓶、聚乙烯瓶等,并确保器具干净、无污染。
根据水样性质和分析项目要求,选择合适的保存方法,如冷藏、冷冻、加入保存剂等。
保存方法确保水样在运输过程中不受污染、不发生变化,选择合适的运输方式和包装材料。
运输要求在保存和运输过程中,需记录水样信息、保存条件等,以便后续分析。
注意事项水样的保存与运去除水样中的悬浮物、颗粒物等杂质,提高分析的准确性。
过滤与离心调节pH 值消解与蒸馏富集与分离根据分析项目要求,调节水样的pH 值,以确保分析的准确性。
对于某些难以直接分析的项目,需进行消解或蒸馏处理,以消除干扰物质或提高检测灵敏度。
环境化学第三章水

二节 气体在水中的溶解性
水的质量特征:
• 酸度和碱度
第一节 概述
• 盐度和氯度:1千克水中碳酸盐转变为氧化物、溴化物 和碘化物转变为氯化物、有机物完全氧化后所含固体 的总克数。
• 硬度 • 溶氧量:25℃时的饱和浓度
[O2 (aq)] = 2.6×10-3 mol/L = 8.32 mg/L
• 清度和色度
化合物直接与 pH值有关,实际涉及到水解和羟基配合物的平
衡过程,该过程往往复杂多变,这里用强电解质的最简单关 系式表述: Me(OH)n(s) → Men+ + nOH根据溶度积表达式 可导出金属离子浓度 等号两边取负对数: Ksp = [Men+][OH-]n [Men+] = Ksp/[OH-]n = Ksp[H+]n/Kwn -lg[Men+] =-lgKsp-nlg[H+] + nlgKw (3-21)
HS- → H+ + S2则总反应: H2S →2 H+ + S2-
K2= 1.3×10-15
K1,2=K1K2=1.16×10-22
三、溶解沉淀平衡
在饱和水溶液中,H2S浓度总是保持在0.1mol/L,则 [H+]2[S2-] = K1,2×[H2S] = 1.16×10-22×0.1 = 1.16×10-23 由于在水溶液中 H 2 S 的二级电离甚微,故可近似认为 [H+] = [HS-],因此可求得溶液中[S2-]浓度:
三、溶解沉淀平衡
第二节 天然水中的平衡
溶解和沉淀是污染物在水环境中迁移的重要途径,一般金
属化合物在水中迁移能力,直观地可以用溶解度来衡量。
溶解度小者,迁移能力小; 溶解度大者,迁移能力大。 在固—液平衡体系中,需用溶度积来表征溶解度。
水环境化学天然水1省公开课金奖全国赛课一等奖微课获奖课件

二 水特征及其意义
•• 1、水物理性质 1)高沸点、高熔点 2)蒸发烧高 3)水在4℃时密度最大; 4)水含有突出界面特征,水表面张力大。
9/73
• •5)除极少数液体和固体(如液氨、液氢)外, 水比热容比任何其它液体和固体都高。
比热容(specific heat capacity)又称比热容量(specific heat), 简称比热容,是单位质量物质热容量,即是单位质量物体改变 单位温度时吸收或释放热能。
18/73
普通认为,蒸发作用是促成水同位素分馏主 要过程。 • • 因为重水蒸汽压比普通水蒸汽压略低,所以在蒸 发区(如大洋水)重水成份稍高。 • 由水蒸汽凝结生成雨水中重水成份较低。 • 南极冰是地球上最轻水。
•【 蒸汽压:一定温度下,液体和它蒸汽处于平衡状态时蒸汽所含有压力 称为饱和蒸汽压,简称蒸汽压。】
10/73
• 6)水含有很高介电常数,比任何其它纯液体高。 绝大部分离子化合物能够在水中电离。
• 介•电常数是度量物质极性大小一个有用参数。在化学中,介电常
数是溶剂一个主要性质,它表征溶剂对溶质分子溶剂化以及隔开 离子能力。
• 水分子强极性使它能与带电荷离子和分子发生相互结合作用。水 化作用是一个强烈放热过程,释放能量足以克服离子间彼此作用 力。
• 镁起源主要为白云岩、泥灰岩等风化产物溶解。
镁存在于全部天然水中,而且其含量仅次于Na+,Ca2+,常 居阳离子第二位。
39/73
• 天然水中Ca2+与Mg2+含量百分比关系有一个大致规律:在 溶解性固体总量低于500mg/L时, Ca2+与Mg2+摩尔比值改 变范围较大,从4:1到2:1。
• 当水中溶解性固体总量大于1000mg/L时, Ca2+与Mg2+摩尔 比值在2:1到1:1;
水环境化学1
α0 , α1 , α2为分布系数,与pH 有关。
因此封闭碳酸体系各主要形态与pH有关,而CT与pH无关
④开放碳酸体系特点及各主要形态计算 特点: * CT ≠常数 * [H CO *]总保持与大气相平衡的固定数值 2 3 即:[CO 2 (aq)] = KH p CO 2
CT = [H2CO 3 *] /α0 =[CO 2 (aq)] /α0 = KH p CO 2 /α0 [HCO 3 - ] = α1KH p CO 2 /α0 = K1 KH p CO 2 / [H+ ]
(3)水生生物
自养 异养
几个问题 天然水中主要离子总量可以粗略地作为TDS
A.名词—总含盐量(TDS)(≡总溶解固体量)
TDS=[Ca 2 + +Mg 2 + + Na+ +K+ ]+ [HCO3 - + SO4 2 - +Cl - ]
总含盐量 (总溶解固体量)为1000~10000 mg/L
的天然水称为咸水(淡水的总含盐量< 1000mg/L)
[CO32-] = K2[HCO3-] / [H+]
(2)
= 4.69×10-11×1.00×10-3 /1.00×10-8
= 4.69 ×10-6mol.L-1
例2
若 水 体 pH 升 高 到 10.00, 碱 度 仍 保 持
1.00×10-3 mol•L-1 ,再计算该水体中各碱度 成分的浓度。 碱度 = [ HCO3-] + 2[CO32-] + [ OH-]( mol.L-1) [OH-] = 1.00×10-4 mol.L-1
查表3-1(教材P102),氧气在25℃水中的亨利常数 KO2=1.28×10-8moL/(L· Pa) 则根据亨利定律,氧气在水中的溶解度为: [O2(aq)]=KO2· 2=1.28×10-8×0.2029×1.013×105 PO =2.63×10-4moL/L 由于氧的分子量为32,所以其溶解度为8.4mg/L或8.4PPm. 结论:25℃时 [O2(aq)]=8.4mg/L 问:若已知25℃湖水中溶解氧浓度为0.32 mg/L,大气中氧的分压 为多少?
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化

对于其他金属碳酸盐则可写为: -lg[Me2+] =0.5p Ksp -0.5pα2 由2 [Me2+] + [H+] = [HCO3-] + 2[CO32-] + [OH-]得: (Ksp/α2)1/2 (2 – α1- 2α2) + [H+] – Kw/[H+] = 0
当pH > pK2 时,α2≈1,CO32-为主,lg[Ca2+] = 0.5 lg KSP
四、氧化还原
氧化-还原平衡对水环境中无机污染物的迁移转化 具有重要意义。水体中氧化还原的类型、速率和平衡, 在很大程度上决定了水中主要溶质的性质。例如,厌 氧型湖泊,其湖下层的元素都将以还原形态存在;碳 还原成-4价形成CH4;氮形成NH4+;硫形成H2S;铁 形成可溶性Fe2+。其表层水由于可以被大气中的氧饱 和,成为相对气体性介质,如果达到热力学平衡时, 则上述元素将以氧化态存在:碳成为CO2;氮成为 NO3-;铁成为Fe(OH)3沉淀;硫成为SO42-。显然这种 变化对水生生物和水质影响很大。
发生吸附的表面净电荷的符号 - 金属离子所起的作用 吸附时所发生的反应 发生吸附时要求体系的pH值 吸附发生的位置 对表面电荷的影响 反离子
阳离子交换 配位体交换 >零电位点 任意值 扩散层 无 内层 负电荷减少 正电荷增加
(2)吸附等温线和等温式:在固定温度下,当吸附达到平 衡时,颗粒物表面的吸附量(G)与溶液中溶质平衡浓度
达到临界状态,就可以发生快速凝聚。
三、溶解和沉淀
溶解与迁移 实际溶解沉淀过程的复杂性 1、氧化物和氢氧化物:氧化物可以视作氢氧化物的脱水产物 Me(OH)n (s) Men+ + n OH根据溶度积: Ksp= [ Men+ ] [ OH- ]n 可转化为: [ Men+ ] = Ksp / [ OH- ]n = Ksp[ H+] / Kwn -lg [ Men+ ] = -lgKsp – n lg [ H+ ] + n lgKw pc = pKsp- n pKw + n pH = pKsp – n pOH 可以做 pc-pH 图,斜率等于 n,即金属离子价; 截距是 pH = 14 - (1/n)pKsp。
第三章水环境化学

TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
第水环境化学(共10张PPT)

cp—单位溶液理体积论上颗,粒物即的浓非度k离g/L子; 性有机化合物可通过溶解作用分配到土壤
有机质中,并经一定时间达到分配平衡,此时有机化合物
在土壤有机质和水中含量的比值称分配系数。
第5页,共10页。
▪实际上,有机化合物在土壤(沉积物)中的吸着存在着二种主要机
作用、挥发作用、水解作用、光解作用、生物富集和生物降 解作用等过程进行迁移转化。
第4页,共10页。
二、分配作用
1.分配理论
▪近20年来,国际上对有机化合物的吸附分配理论开展了
使得pH降低,一般伴随E降低,pH会降低,酸性增强,金属溶解,酸性增强情况下,金属Hg容易甲基化;
②靠吸范附 德作华用力,,广即后在者泛非则研极是性各究有种机化。溶学剂键结中力果,如土氢均壤键矿、表物离明质子对偶,有极机键颗化、合配粒物位物的键表及(面π沉键吸作积附用作物的用结或或果于。土土壤壤矿物)从质对水有机中化合吸物的表面吸附作用,前者主要
cT = cs·cp+cw 式中:cT—单位溶液体积内颗粒物上和水中有机毒物质量的总和ug / L;
cs—有机毒物在颗粒物上的平衡浓度,ug/kg;
cp—单位溶液体积上颗粒物的浓度kg/L;
cw—有机毒物在水中的平衡浓度,ug/L。
此时水中有机物的浓度(cw)为:cw =cT / (Kp cp十1)
第7页,共10页。
▪一般吸附固相中含有有机碳(有机碳多,则Kp大),为了在类型各异组分复 杂的沉积物或土壤之间找到表征吸着的常数,引入标化分配系数(Koc):
➢ 使得pH降低,一般伴随E降低,pH会降低,酸性增强,金属溶解, 酸性增强情况下,金属Hg容易甲基化; ➢ 静止水体的富营养化。
环境化学:第三章 水环境化学 1

第一节 天然水的基本特征及污染物的存在形态
②
CO2的溶解度
已知: 干空气中CO2的含量为0.0314%(体积),水
在25℃时蒸气压为0.03167×105 Pa, CO2的亨利定律
常数是3.34×10-7mol/(L·Pa) (25℃), CO2溶于水后发生
的化学反应是:
CO2+H2O = H++HCO3-
CO32-
60
α 40
20
0
2
4
6
8
10
pH
图3-1 碳酸化合态分布图
12
第一节 天然水的基本特征及污染物的存在形态
对于开放体系,应考虑大气交换过程:
[CO 2 (aq)] K H pCO 2
CT [CO 2 (aq)] / 0
1
0
K H pCO 2
1
K1
[HCO ] CT 1
人均水资源量相当于世界人均量的1/4。已经被联合
国列为13个贫水国家之一。
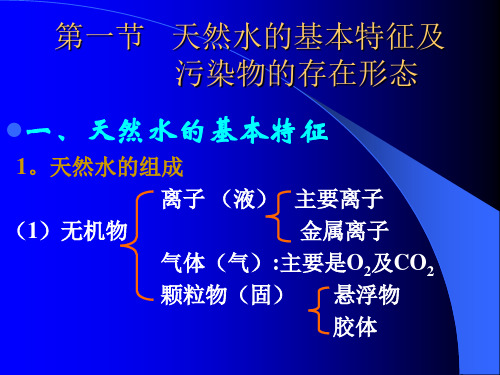
第一节 天然水的基本特征及污染物的存在形态
一、天然水的基本特征
1.天然水的组成
天然水体——包括水、水中的溶解物、悬浮物
以及底泥和水生生物。
天然水的组成按形态分为:可溶性物质和悬浮物质。
悬浮物质包括:
悬浮物、颗粒物、水生生物等。
一般情况下,天然水中存在的气体有O2、CO2、
H2S、N2和CH4等。
表3-2 海水中主要溶解气体的含量范围
气体
含量范围
/mg·L-1
O2
0~8.5
N2
CO2
H2S
Ar
8.4~14.5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3
2 3
[H 2 CO3 ] c T 0
[HCO3 ] c T 1
2 [CO3 ] cT 2
(1)封闭体系中碳酸盐物种 分布随pH的变化
什么是封闭体系?
水溶液中的CT不变,不与气相交换 没有固体碳酸盐,即不发生液固相交 换
反应比较快速,来不及与气相进行交 换;不存在、也没有生成固相碳酸盐
解答:
总碱度
=10 10-3mL 0.02mol / L 2 /100mL 4mmol / L
二氧化碳酸度
4mL 0.02mol / L /100mL 0.8mol / L
碳酸盐总量=总碱度+二氧化碳酸度=4.8mmol/L
Kw Alk cT1 2cT 2 [ H ] [H ]
Brö nsted酸碱(质子理论) Lewis酸碱(电子理论)
B HA
HB A
共轭酸碱对:HA—A-; HB—B-
酸碱平衡常数——酸碱的强弱
HA H2O H3O A
[ H ][ A ] Ka [ HA]
A H2O
OH HA
[OH ][ HA] Kb [A ]
H HCO3
H2CO3
苛性碱度
[OH-]-[H+]
2 酚酞碱度(碳酸盐碱度) [OH ] [CO3 ] [H ]
总碱度
Alk [HCO ] 2[CO ] [OH ] [H ]
3
2 3
封闭体系中碳酸盐物种随pH的分布
1 0.8 0.6
a
0.4 0.2 0 2.0
-5
cT 1.457 10 mol / L K pCO2 36.5Pa
' H
5
3.99 107 mol / L.Pa
KH 3.34 10 mol /(L.Pa)
7
平衡计算的基本原则
质量平衡 分配平衡 电荷平衡 合理的假定
水 2CO3
CO H2O
2 3
[H ] [OH ]
酚酞酸度(二氧化碳) [H ] [H CO ] [OH ] 2 3 总酸度 [H ] 2[H 2CO3 ] [HCO3 ] [OH ]
3)碱度、酸度、碳酸盐总量、pH之间的 关系
根据滴定结果,可以推算: 总碱度-碳酸盐碱度=碳酸盐总量 二氧化碳酸度-无机酸度=碳酸盐总量 总碱度+二氧化碳酸度=碳酸盐总量
[CO32 ][ H ] 2 10.33 K2 [ CO ] 10 mol / L 3 [ HCO3 ]
水中溶解的二氧化碳总量
cT [ H 2CO3 ] [ HCO3 ] [CO32 ] 1.22 105 2.33 106 1010.33 1.457 10 mol / L 0.639mg / L
Ka Kb Kw [OH ][H ]
酸碱的相对强弱
酸 HCl H2SO4 HIO3 HSO4H3PO4 HF HNO2 pKa -3 -3 0.8 2 2.1 3.2 4.5
强
碱
O2NH2S2OHH2SiO42PO43CO32-
pKb -10 -9 0 0 1.4 1.7 3.7
弱
1.水中碳酸盐物种及其分布
假定一个pH值,试算,直到上式成立!
例4
已知水体的pH7.0,碱度为1.4mmol/L, 假设该体系为封闭体系,且碱度由碳酸 盐物质和OH-组成,计算: (1)pH调至6.0所需加的酸量? (2)pH调至9.0所需加的碱量?
封闭体系中无论加强酸或强碱,CT
不变;碱度变化值为应加酸量或加 碱量
2 Alk [HCO3 ] 2[CO3 ] [OH ] [H ]
pK1 6.35
pK2 10.33
HCO3
CO32 H
水中的碳酸盐物种及其平衡 H2CO3* 简写为H2CO3
H2CO3 HCO
CO2 (g) H2CO3 HCO
3
3
CO
23
H2CO3
H HCO3
K m 102.8 K1 106.35 K 2 10
10.33 2 3
CO2 ( g ) CO2 (aq)
pKm 2.8
pK 3.55
' 1
KH 3.34 107 mol /(L.Pa)
CO2 (aq) H2O
H2CO3
3
H2CO3
HCO H
[H 2CO3 ] Km 102.8 [CO2(aq) ]
[ H2CO3 ] 0.0016[CO2( aq ) ]
Kw =cT (1 22 ) [H ] [H ]
求 算 pH 6 时
K1[H ] 1 2 [H ] K1[H ] K1K 2 K1K 2 2 2 [H ] K1[H ] K1K 2
初始碱度 与pH6时 碱度差 CT
pH=9时同样方法计算
—H CO a0 —HCO a1 —COa2
2 3 2-
3
3
-
4.0
6.0
8.0 pH
10.0
12.0
14.0
(2)开放体系碳酸盐物种 分布随pH的变化
大气中CO2浓度不变,与水相处于平衡
[H2CO3 ] KH pCO2
[ H 2CO3 ] cT 0 [ HCO3 ] cT 1 [CO ] cT 2
大气
气相
气溶胶颗粒
第二章 水化学
水中无机、有机物质的 颗粒物 存在形态与转化
地下水 溶质 固相
溶质
地表水 水溶液反应 溶质 溶质 固相 底泥(沉积物)
存在形态、分布
酸碱平衡
配位平衡 沉淀-溶解平衡 氧化-还原平衡 物质的转化 水解与亲核反应 还原反应 氧化反应 光解
第一节 酸碱化学——碳酸盐系统
根据离解平衡,有:
2 [CO ][H ] 3 [HCO3 ] K2
[ HCO3 ][ H ] [CO32 ][ H ]2 [ H 2CO3 ] K1 K1K2
[ H 2CO3 ] 0 [ H 2CO3 ] [ HCO3 ] [CO32 ] [ HCO3 ] 1 [ H 2CO3 ] [ HCO3 ] [CO32 ] [CO32 ] 2 [ H 2CO3 ] [ HCO3 ] [CO32 ]
[H ]2 0 2 [H ] K1[H ] K1K 2 K1[H ] 1 2 [H ] K1[H ] K1K 2 K1 K 2 2 2 [H ] K1[H ] K1K 2
封闭体系中碳酸盐物种随pH的分布
1 0.8 0.6
a
0.4 0.2 0 2.0
H CO
例1:计算大气CO2在纯水中的溶解量
2 cT [H2CO3 ] [ HCO3 ] [CO3 ]
未离解部分
KH 3.34 10 mol /(L.Pa)
7
pCO 1.013 10 3.60 10 36.5 Pa
5
2
4
CH CO K H pCO2 3.34 107 36.5
2 3
[CO2 ] 1 cT K H pCO2 0 0 1 K1 [HCO3 ] cT 1 K H pCO2 K H pCO2 0 [H ]
[CO3
2
2 K1K 2 ] cT 2 K H pCO2 2 K H pCO2 0 [H ]
4 2 0
—H CO a0 —HCO a1 —COa2
2 3 2-
3
3
-
酚酞变色
4.0 6.0 甲基橙变色
8.0 pH
10.0
12.0
14.0
2)酸度
与强碱发生中和作用的物质总量,代表中和强 碱的能力
OH H H2O OH H2CO3 HCO3 H2O
OH HCO
无机酸度
3
[HCO ] 2[CO ] [OH ] 1.00 10 mol/L
3 23 -3
因为[OH-]=10-4mol/L
[HCO ] 2[CO ] 9.00 10 mol/L
3 23 -4
10.33 K [HCO ] 10 [HCO 22 3 3] [CO3 ] 0.468[HCO 3] 10 [H ] 10
1 0.8 0.6
0.4 0.2 0 2.0
—H CO a0 —HCO a1 —CO a2
2 3 3 2-
3 -
a
酚酞变色
4.0
6.0
8.0 pH
10.0
12.0
14.0
甲基橙变色
例2——已知碱度和pH,求各物种浓度
已知水体的总碱度为1.00× 10-3mol/L , 计算pH8和pH10时水中H2CO3、HCO3-、 CO32-浓度(假定只由它们构成碱度)
3.一些引起碱度变化的反应
光合作用、呼吸作用
光合 呼吸
(CH 2O)n nO2 nCO2 nH 2O
[H2CO* 3 ] [CO2(aq) ] [H2CO3 ]
H2CO3* HCO3 H pK1 ?
[HCO3 ][H ] K1 [H 2 CO* 3] [HCO3 ][H ] /[H 2CO3 ] [H 2 CO* 3 ] /[H 2 CO 3 ] ' K1 ' K1 K m 10 6.35 1 1 Km
