2019高一化学人教版必修2“同课异构”教学课件第二章第二节 化学能与电能第2课时课件(19张)
合集下载
高一化学必修2第二章第二节 化学能和电能 课件 (共17张)

Zn +2NH4+ ==Zn2++2NH3↑+H2↑
特点:
a:一次性电池,不可逆 b:用KOH代替NH4Cl能提高 性能,延长寿命
(2)充电电池(又称二次电池)
铅蓄电池
负极:Pb+SO42- -2e- ==PbSO4 正极:PbO2+4H++SO42-+2e-==PbSO4+2H2O 电池总反应式:
活泼的其他金属
负极
。
3、电极反应式 :
负极: Fe - 2e - = Fe 2+
正极: Cu2+ +2e - = Cu
第二节 化学能与电能 第二课时:发展中的电源
干电池 碱性电池 蓄电池
锂离子电池
燃料电池
(1)干电池结构及电极反应原理
锌锰干电池构造
工作原理 负极:Zn-2e- ==Zn2+ 正极:2NH4+ +2e- == 2NH3↑+H2↑ 总反应:
化学能与电能
化学能与电能的转化
化学能
燃烧
蒸汽
发电机
热能
机械能
电能
原电池
【实验2-4】将锌片和铜片用带有电流表的导线连接, 插入到稀H2SO4中,观察现象。
现象:铜上有气泡,锌溶解, 电流表的指针发生偏转
结论:导线中有电流
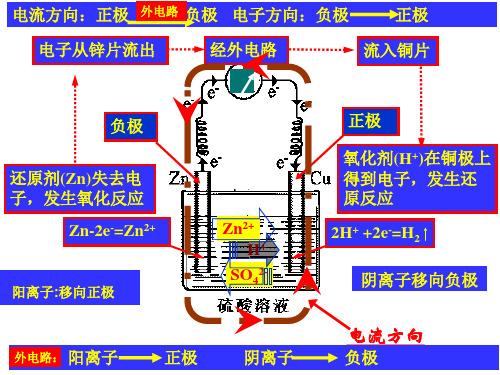
1、原电池:把化学能转变为电能的装置.
2、原电池工作原理
A
(+)
(-)
反应方程式:Zn+H2SO4 =ZnSO4+H2↑
(-)
内电路:阴离子移向负极 阳离子移向正极
Cu
Zn
H+
特点:
a:一次性电池,不可逆 b:用KOH代替NH4Cl能提高 性能,延长寿命
(2)充电电池(又称二次电池)
铅蓄电池
负极:Pb+SO42- -2e- ==PbSO4 正极:PbO2+4H++SO42-+2e-==PbSO4+2H2O 电池总反应式:
活泼的其他金属
负极
。
3、电极反应式 :
负极: Fe - 2e - = Fe 2+
正极: Cu2+ +2e - = Cu
第二节 化学能与电能 第二课时:发展中的电源
干电池 碱性电池 蓄电池
锂离子电池
燃料电池
(1)干电池结构及电极反应原理
锌锰干电池构造
工作原理 负极:Zn-2e- ==Zn2+ 正极:2NH4+ +2e- == 2NH3↑+H2↑ 总反应:
化学能与电能
化学能与电能的转化
化学能
燃烧
蒸汽
发电机
热能
机械能
电能
原电池
【实验2-4】将锌片和铜片用带有电流表的导线连接, 插入到稀H2SO4中,观察现象。
现象:铜上有气泡,锌溶解, 电流表的指针发生偏转
结论:导线中有电流
1、原电池:把化学能转变为电能的装置.
2、原电池工作原理
A
(+)
(-)
反应方程式:Zn+H2SO4 =ZnSO4+H2↑
(-)
内电路:阴离子移向负极 阳离子移向正极
Cu
Zn
H+
人教版高中化学必修二第二章第二节《化学能与电能》课件(共33张PPT)

存
排出大量温室气体
在
缺
可能导致酸雨
点
能量转化效率低
? 化学能
电能
演示探究 Zn Cu
稀H2SO4
实验现象
锌表面有气泡 产生,铜表面 无明显现象
Zn +2H+ = Zn 2+ +H2↑
1.反应中,哪种物质失电子,哪种物质得电子 2.什么方法可使Zn与H+分开,不让H+ቤተ መጻሕፍቲ ባይዱ接在 Zn表面得电子?
用导线将锌表面的电子引出来
电流表发生偏转。
稀H2SO4
电子由Zn 导线 铜片 H+ 定向移 动产生电流,故电流表的指针发生偏转
1.电子从Zn到H+经历了哪些途径? 2.你认为这个过程能量是如何转化的?
化学能直接转化为电能
二.化学能直接转化为电能
1.原电池的概念、前提
概念: 将化学能转化为电能的装置
前提: 能自发发生氧化还原反应
2019/8/11
最新中小学教学课件
33
谢谢欣赏!
2019/8/11
最新中小学教学课件
34
小结
化
间接:化学能燃烧热能蒸汽机械能发动机电能
学
能
与
装置
直接:
原电池
电
能
工 作
概
构 成
原念 条
理
件
习题一: 原电池的判断
1.下列装置中能组成原电池形成电流的是( C )
A
A
Cu Cu
Zn Cu
A
B
H2SO4
A Zn Cu
酒精 A
Zn
Cu
C
H2SO4
D
化学能与电能 高一下化学人教版(2019)必修第二册(共28张PPT)

图6-7 原电池原理示意图
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流
一 、原电池
1. 正、负极 2.电极反应式 3. 总反应式 4.电子流向 5. 阴、阳离子流向 6. 电势高低
4.工作原理:
外电路:负极
正 极 正极 I、 负极
内电路:阳离子 → 正极 阴 离 子 → 负 极
电势越低,越易失电子; 电子从低电势流向高电势; Zn电极电势低,失电子;
锌片:Zn-2e-=Zn²+ (氧化反应)
电子经导线流向Cu 片 , 溶液中的H+由于电场作用下 移向Cu片得电子被还原成H₂。 铜片:2H++2e-=H₂ 个
(还原反应)
一、原电池
1.定义:将化学能直接转变成电能的装置,称为原电池
2.正负极:
正极: 电子流进(或电流流出)的一极
负极: 电子流出(或电流流进)的一极
②溶液:两电极均插入电解质 溶液中(熔融电解质); ③导线:两极用导线相连,形成闭合回路。
【练习】(1)
是负极,
(2)外电路中电流由
流向
(3)Zn 片附近c(SO₄2 一)如何变化
( 4 ) 现 象 :Zn
,Cu
是正极;
; ;
【课堂练习】
请在图上标出电子的流动方向和电流方向,并判断正负极,写出电 极反应式和总反应式。
H₂—
a电极
负载
H
O₂
b电极 电解质 溶液
H₂O
【课堂练习】
1.下列设备工作时,将化学能转化为电能的是
A
B
C
D
锂离子电池
太阳能集热器
燃气灶
硅太阳能电池
【课堂练习】
高一化学必修Ⅱ人教新课标第二章第二节2.2化学能和电能(共22张ppt)
H2SO4为电解质溶液的氢氧燃料电池的电极反应 式
负极:2H2–4e-===4H+ 正极:O2+4H++4e-====2H2O
电解质溶液为KOH溶液的氢氧燃料电池的电极反应式该如何写?
负极:2H2 + 4OH--4e- ==== 4H2O 正极:O2 + 2H2O +4e-====4OH碱性条件下 ——有效地防止电解质溶液对外壳的腐蚀
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
3、根据原电池两极发生的变化来判断: 原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生 加或不变为正极
(H2),或质量增
8.下列化学电池不易造成环境污染的是 ( A )
A. 氢氧燃料电池 B.锌锰电池
C.镍镉电池
D. 铅蓄电池
9.对于锌一铜一稀酸组成的原电池装置中,当导线中有1 mol 电子通过时,理论上的两极变化是( A )。
①锌片溶解了32.5g
②锌片增重32.5g
③铜片上析出lg H2
④铜片上析出1mol H2
A.正极附近的SO42-离子浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
2.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu, 该反应的原电池的正确组成是( C )
AB
C
正极
Zn Cu Cu
负极
Cu Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4
14.关于用水制取二级能源氢气,以下研究方向不正确的是( AD )。 A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不
负极:2H2–4e-===4H+ 正极:O2+4H++4e-====2H2O
电解质溶液为KOH溶液的氢氧燃料电池的电极反应式该如何写?
负极:2H2 + 4OH--4e- ==== 4H2O 正极:O2 + 2H2O +4e-====4OH碱性条件下 ——有效地防止电解质溶液对外壳的腐蚀
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
3、根据原电池两极发生的变化来判断: 原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生 加或不变为正极
(H2),或质量增
8.下列化学电池不易造成环境污染的是 ( A )
A. 氢氧燃料电池 B.锌锰电池
C.镍镉电池
D. 铅蓄电池
9.对于锌一铜一稀酸组成的原电池装置中,当导线中有1 mol 电子通过时,理论上的两极变化是( A )。
①锌片溶解了32.5g
②锌片增重32.5g
③铜片上析出lg H2
④铜片上析出1mol H2
A.正极附近的SO42-离子浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
2.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu, 该反应的原电池的正确组成是( C )
AB
C
正极
Zn Cu Cu
负极
Cu Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4
14.关于用水制取二级能源氢气,以下研究方向不正确的是( AD )。 A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不
人教版高中化学必修二第二章第二节《化学能与电能》课件.(共张PPT)

例子
如:普通锌锰 电池、碱性锌 锰电池、锌银 纽扣电池
二次电池
燃料电池
铅蓄电池、 锌银蓄电池、 镍镉电池、 锂离子电池
氢气、甲醇、天 然气、煤气与氧 气组成燃料电池。
小型高性能 燃料电池
2.化学电池优点
(1)能量转换效率高,供能稳定可靠。
(2)可以制成各种形状和大小、不同容量和电压的 电池和电池组,使用方便。 (3)易维护,可在各种环境下工作。
人教版高中化学必修二第二章第二节 《化学 能与电 能》课 件.(共2 0张PPT )
铅蓄电池放电的电极反应:
负极( Pb ) Pb(s) + SO42-(aq) - 2e- = PbSO4 (s)(氧化反应)
正极(PbO2) PbO2 (s) +4H+ (aq) + SO42-(aq) + 2e- = PbSO4 (s)
二、二次电池介绍
二次电池
铅蓄电池 镉镍电池
氢镍电池 锂离子电池 ……
人教版高中化学必修二第二章第二节 《化学 能与电 能》课 件.(共2 0张PPT )
人教版高中化学必修二第二章第二节 《化学 能与电 能》课 件.(共2 0张PPT )
铅蓄电池
人教版高中化学必修二第二章第二节 《化学 能与电 能》课 件.(共2 0张PPT )
一、一次电池介绍
锂电池 ……
人教版高中化学必修二第二章第二节 《化学 能与电 能》课 件.(共2 0张PPT )
碱性锌锰电池:(-) Zn│KOH│MnO2 (+)
负极(Zn):Zn + 2OH- - 2e- = Zn(OH)2 正极(MnO2):2MnO2+2H2O+2e- =2MnOOH+2OH电池总反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 优缺点简析:只能使用一次,不能充电;价格较贵;比 能量和储存时间有所提高,适用于大电流和连续放电。
高一人教版化学必修2第二章第二节化学能和电能课件 (共21张ppt)

化学能与电能的转化
1、【实验探究一】
分组合作探究,用与铜锌导电装置连接好的酒精去接触电流计 是否有偏转,再用与铜锌导电装置连接好的柠檬去接触电流计, 然后观察分析得出结论:
相互对比
酒精
柠檬
①必须有电解质溶液。
化学能与电能的转化
2、【实验探究二】
将电极全部换成碳棒或锌片插入柠檬中,观察电 流计的指针是否偏转?
化学能与电能的转化
(2)原电池工作原理 工作原理: Zn+ H2 SO4 =ZnSO4+H2
2eZn + 2H+ = Zn2+ + H2↑
电极反应式: 负极(:Zn) Zn -2e- = Zn2+ 氧化反应
正极:(Cu)2H++2e- = H2 ↑还原反应
(铜片在这里起传导电子的作用)
化学能与电能的转化 ቤተ መጻሕፍቲ ባይዱ展巩固
化学能与电能的转化
板书设计
化学能转化为电能 1.定义:把化学能直接转化为电能的装置叫做原电池 负极:活泼性较强的金属 正极:活泼性较弱的金属或非金属 2、电极反应: 负极:Zn-2e-=Zn2+(氧化反应) 正极:2H+ +2e-=H2(还原反应) 总反应式:Zn+2H+=Zn2+ +H2 ↑(氧化还原反应) 3、形成条件: ①有电解质溶液 ②活泼型相同的电极 ③自发进行的氧化还原反应 ④形成闭合回路
化学能与电能的转化
原电池形成的条件:
①必须有电解质溶液。 ②必须是两个活泼型不同的电极。 ③必须能自发进行的氧化还原反应。 ④必须形成闭合回路。
化学能与电能的转化
【巩固提升】
H2SO4溶液
(可以)
人教版高中化学必修二课件高一化学第二章第二节化学能与电能1.pptx

交流产生思维的碰撞,归纳出原电池的形成 条件。训练学生归纳总结能力和表达交流能 力;培养学生自我评价能力、自我修正精神
五、过程分析
Ⅰ、引入主题: Ⅱ、实验探究1: Ⅲ、启发总结: Ⅳ、实验探究2: Ⅴ、归纳总结: Ⅵ、知识应用:
Ⅵ、知识应用
[随堂练习]
1、根据Zn+Cu2+=Zn2++Cu的反应原理设计一个原电池,当Zn
电流:正极→导线→负极→电解质溶液→正极
电解质溶液中离子如何转移? 阳离子→正极,阴离子→负极
五、过程分析
Ⅰ、引入主题: Ⅱ、实验探究1: Ⅲ、启发总结: Ⅳ、实验探究2: Ⅴ、归纳总结: Ⅵ、知识应用:
Ⅳ、“实验探究2” 探究原电池的形成条件
[学生探究性实验] 设计一个原电池
e-
实
负极 G 正极 验
五、评价分析
本节课我的设计理念遵循以下五条原则: 以问题为载体,以实验探究为方法;以学生 为主体;以合作交流为手段;以能力提高为 目的。通过实验探究和问题的驱动让学生通 过自主的尝试活动,在感知和实践的基础上 获取知识、提高能力。
H2SO4溶液 能量转化究形式让:学生认化识学原能电转池变的为装热能
G
实验2 置和概念.启发学生思考
Zn
Cu 现象:“ 下一导Z电n流步线片表理”溶指解解所针原,起偏电转的C池u作上原用有理,气做为泡
反应: 铺垫Zn。+2H+ = Zn2++H2 ↑
Cu不反应 H2SO4溶液 能量转化形式: 化学能转变为电能
E Zn+Na+ =
H2SO4溶液
Zn+2H+ = Zn2++H2 ↑
A
五、过程分析
Ⅰ、引入主题: Ⅱ、实验探究1: Ⅲ、启发总结: Ⅳ、实验探究2: Ⅴ、归纳总结: Ⅵ、知识应用:
Ⅵ、知识应用
[随堂练习]
1、根据Zn+Cu2+=Zn2++Cu的反应原理设计一个原电池,当Zn
电流:正极→导线→负极→电解质溶液→正极
电解质溶液中离子如何转移? 阳离子→正极,阴离子→负极
五、过程分析
Ⅰ、引入主题: Ⅱ、实验探究1: Ⅲ、启发总结: Ⅳ、实验探究2: Ⅴ、归纳总结: Ⅵ、知识应用:
Ⅳ、“实验探究2” 探究原电池的形成条件
[学生探究性实验] 设计一个原电池
e-
实
负极 G 正极 验
五、评价分析
本节课我的设计理念遵循以下五条原则: 以问题为载体,以实验探究为方法;以学生 为主体;以合作交流为手段;以能力提高为 目的。通过实验探究和问题的驱动让学生通 过自主的尝试活动,在感知和实践的基础上 获取知识、提高能力。
H2SO4溶液 能量转化究形式让:学生认化识学原能电转池变的为装热能
G
实验2 置和概念.启发学生思考
Zn
Cu 现象:“ 下一导Z电n流步线片表理”溶指解解所针原,起偏电转的C池u作上原用有理,气做为泡
反应: 铺垫Zn。+2H+ = Zn2++H2 ↑
Cu不反应 H2SO4溶液 能量转化形式: 化学能转变为电能
E Zn+Na+ =
H2SO4溶液
Zn+2H+ = Zn2++H2 ↑
A
人教版高中化学第二章第二节《化学能与电能》.(共20张PPT)教育课件

• • 学习重要还是人脉重要?现在是一 个双赢 的社会 ,你的 价值可 能更多 的决定 了你的 人脉, 我们所 要做的 可能更 多的是 专心打 造自己 ,把自 己打造 成一个 优秀的 人、有 用的人 、有价 值的人 ,当你 真正成 为一个 优秀有 价值的 人的时 候,你 会惊喜 地发现 搞笑人 脉会破 门而入 。从如 下方 面改进 :1、专 心做可 以提升 自己的 事情; 2、学 习并拥 有更多 的技能 ;3、成 为一个 值得交 往的人 ;4学 会独善 其身, 尽量少 给周围 的人制 造麻烦 ,用你 的独立 赢得尊 重。
化学电池的创新设想
光合作用有二氧化碳与水合成葡萄糖,同时放出氧 气,写出化学方程式。
6CO2(g)+ 6H2O (l) = C6H12O6 (g) + 6O2 (g) 光、叶绿体 设想将写成的反应式倒过来,可设计成一个原电池,
产生电流。这样,我们通过正逆反应,就从太阳能产生 了电能。写出这种原电池的电极反应。
• • 理财的时候需要做的一方面提高收入, 令一方 面是节 省开支 。这就 是所谓 的开源 节流。 时间管 理也是 如此, 一方面 要提高 效率, 另一方 面是要 节省时 间。主 要做法 有:1、 同时做 两件事 情(备 注:请 认真选 择哪些 事情可 以同时 做), 比如跑 步的时 候边听 有声书 ;2、 压缩休 息时间 提升睡 眠效率 ,比如 晚睡半 小时早 起半小 时(6~7个小 时即可 );3、 充分利 用零碎 时间学 习,比 如做公 交车、 等车、 上厕所 等。
负极:CH4+10 OH-–8e- == CO32-+7H2O
化学电池与新能源
请考虑,化学电池有污染,这个问题如何解决? (开发新能源)
风力发电
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
能实现该反应的原电池是(CD ) A .正极为Cu 、负极为Fe,电解质溶液为FeCl3溶液
B .正极为C 、负极为Fe,电解质溶液为Fe(NO3)3溶液
C .正极为Fe 、负极为Zn,电解质溶液为Fe2(SO4) 3溶液
D .正极为Ag 、负极为Fe,电解质溶液为CuSO4溶液
二、发展中的化学电源
二、发展中的化学电源
使用燃料电池的汽车
二、发展中的化学电源
其他电池
空气电池
二、发展中的化学电源
•
废电池对环境的危害
电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环境造成严 重的污染。
上世纪50年代,震惊世界的日本“水俣病” 就是因汞中毒引起的。
二、发展中的化学电源
减少污染 节约资源
二、发展中的化学电源
第二章 化学反应与能量
第二节 化学能与电能 第2课时发展中的化学电源
二、发展中的化学电源
干电池
碱性电池
锂离子电池
燃料电池 蓄电池
二、发展中的化学电源
一次性电池:如干电池
化学电池
二次电池(可充电电池):铅蓄 电池等
燃料电池:氢氧燃料电池
二、发展中的化学电源
1、干电池(锌锰电池) 负极:Zn – 2e- == Zn2+ 正极: 2NH4+ +2MnO2 + 2e== 2NH3 + Mn2O3 + H2O
碱性电池
二、发展中的化学电源
2、充电电池
负极:Pb + SO42- - 2e- == PbSO4 正极:PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O
总反应:
Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O
已知:PbSO4难溶于水
铅蓄电池构造示意图
1、随着人们生活质量的不断提高,废电池必须进 行集中处理的问题被提到议事日程,其首要原因 是( B ) A.利用电池外壳的金属材料 B.防止电池中汞、镉和铅等重金属离子对土 壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
二、发展中的化学电源
2、某原电池总反应的离子方程式为2Fe3++Fe==3Fe2+,不
总反应:2H2 + O2 = 2H2O
碱性条件下 — 有效地防止电解质溶液对外壳的腐蚀 负极:2H2 + 4OH- – 4e- == 4H2O 正极:O2 + 2H2O + 4e- == 4OH-
总反应:2H2 + O2 = 2H2O
二、发展中的化学电源
燃料电池不是把还原剂、氧化剂物质全 部贮藏在电池内,而是在工作时,不断从外 界输入,同时将电极反应产物不断排出电池
3、燃料电池:
⑴ 氢氧燃料电池
4e-
2H2 + O2 == 2H2O
H2
O2
负极:2H2 – 4e- == 4H+ 正极:O2 + 2H2O + 4e- == 4OH-
总反应:2H2 + O2 == 2H2O
二、发展中的化学电源
电解质溶液的酸碱性对电极反应的影响 酸性条件下 负极:2H2 – 4e- == 4H+ 正极:O2 + 4H+ &锌筒 (负极) 石墨棒 (正极) NH4Cl、ZnCl2 和 H2O等 MnO2和C
总反应:
普通锌-锰干电池的结构
Zn+2NH4+ +2MnO2 =Zn2++2NH3 +Mn2O3 + H2O
二、发展中的化学电源
•
思考与交流:锌锰干电池即使不用,放置过 久,也会失效(作为电解质的糊状NH4Cl显 酸性),为了充分而有效地利用锌锰干电池, 在购买、保存和使用方面你有何经验与建议? 请与同学交流分享。
3、 如图所示,在铁圈和银圈的焊接处,用 一根棉线将其悬在盛水的烧杯中,使之 平衡;小心的向烧杯中央滴入CuSO4溶 液,片刻后可观察到的现象是(D )
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜; D. 银圈向下倾斜;
本节内容结束
二、发展中的化学电源
汽车用蓄电池
锂离子电池
锂离子电池:它是新一代可 充电的绿色电池,现已成为 笔记本电脑、移动电话、摄 像机等低功耗电器的主流。
二、发展中的化学电源
• 思考与交流:充电电池与一次电池相 比有何优点?如何科学合理地使用充电 电池?请与同学们讨论、交流。
优点:可反复使用
二、发展中的化学电源
B .正极为C 、负极为Fe,电解质溶液为Fe(NO3)3溶液
C .正极为Fe 、负极为Zn,电解质溶液为Fe2(SO4) 3溶液
D .正极为Ag 、负极为Fe,电解质溶液为CuSO4溶液
二、发展中的化学电源
二、发展中的化学电源
使用燃料电池的汽车
二、发展中的化学电源
其他电池
空气电池
二、发展中的化学电源
•
废电池对环境的危害
电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环境造成严 重的污染。
上世纪50年代,震惊世界的日本“水俣病” 就是因汞中毒引起的。
二、发展中的化学电源
减少污染 节约资源
二、发展中的化学电源
第二章 化学反应与能量
第二节 化学能与电能 第2课时发展中的化学电源
二、发展中的化学电源
干电池
碱性电池
锂离子电池
燃料电池 蓄电池
二、发展中的化学电源
一次性电池:如干电池
化学电池
二次电池(可充电电池):铅蓄 电池等
燃料电池:氢氧燃料电池
二、发展中的化学电源
1、干电池(锌锰电池) 负极:Zn – 2e- == Zn2+ 正极: 2NH4+ +2MnO2 + 2e== 2NH3 + Mn2O3 + H2O
碱性电池
二、发展中的化学电源
2、充电电池
负极:Pb + SO42- - 2e- == PbSO4 正极:PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O
总反应:
Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O
已知:PbSO4难溶于水
铅蓄电池构造示意图
1、随着人们生活质量的不断提高,废电池必须进 行集中处理的问题被提到议事日程,其首要原因 是( B ) A.利用电池外壳的金属材料 B.防止电池中汞、镉和铅等重金属离子对土 壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
二、发展中的化学电源
2、某原电池总反应的离子方程式为2Fe3++Fe==3Fe2+,不
总反应:2H2 + O2 = 2H2O
碱性条件下 — 有效地防止电解质溶液对外壳的腐蚀 负极:2H2 + 4OH- – 4e- == 4H2O 正极:O2 + 2H2O + 4e- == 4OH-
总反应:2H2 + O2 = 2H2O
二、发展中的化学电源
燃料电池不是把还原剂、氧化剂物质全 部贮藏在电池内,而是在工作时,不断从外 界输入,同时将电极反应产物不断排出电池
3、燃料电池:
⑴ 氢氧燃料电池
4e-
2H2 + O2 == 2H2O
H2
O2
负极:2H2 – 4e- == 4H+ 正极:O2 + 2H2O + 4e- == 4OH-
总反应:2H2 + O2 == 2H2O
二、发展中的化学电源
电解质溶液的酸碱性对电极反应的影响 酸性条件下 负极:2H2 – 4e- == 4H+ 正极:O2 + 4H+ &锌筒 (负极) 石墨棒 (正极) NH4Cl、ZnCl2 和 H2O等 MnO2和C
总反应:
普通锌-锰干电池的结构
Zn+2NH4+ +2MnO2 =Zn2++2NH3 +Mn2O3 + H2O
二、发展中的化学电源
•
思考与交流:锌锰干电池即使不用,放置过 久,也会失效(作为电解质的糊状NH4Cl显 酸性),为了充分而有效地利用锌锰干电池, 在购买、保存和使用方面你有何经验与建议? 请与同学交流分享。
3、 如图所示,在铁圈和银圈的焊接处,用 一根棉线将其悬在盛水的烧杯中,使之 平衡;小心的向烧杯中央滴入CuSO4溶 液,片刻后可观察到的现象是(D )
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜; D. 银圈向下倾斜;
本节内容结束
二、发展中的化学电源
汽车用蓄电池
锂离子电池
锂离子电池:它是新一代可 充电的绿色电池,现已成为 笔记本电脑、移动电话、摄 像机等低功耗电器的主流。
二、发展中的化学电源
• 思考与交流:充电电池与一次电池相 比有何优点?如何科学合理地使用充电 电池?请与同学们讨论、交流。
优点:可反复使用
二、发展中的化学电源
