高二化学平衡图像
化学平衡移动(图像)

实验数据作出下列关系图下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化
剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
√C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
√D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催
化剂效率较高
1.下列图象中,不能表示反应A2(g)+ 3B2(g) 2AB3(g)(△Q>0)平衡体系 的是…( D )
V(逆)
V(逆)
0 ⑤增大压强
t
0
⑥减小压强
t
增大压强时,正逆反应速率都
增大,但
增大程度相同 ,减小压强时,正逆反应速率都 减小 ,但 减小程度相同 ,故平衡 不 移动。
2、压强变化对化学平衡的影响
结论: mA(g)+nB(g) pC(g)+qD(g)
对于有气体参与的反应:
(1)若m+n==p+q : 增大压强,平衡往气体分子数减少的方向移动 ;
二、速率-时间图:可用于:
பைடு நூலகம்
1) 已知引起平衡移动的因素,判断反应是
吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。
v v正
•引起平衡移动的因素是
v逆
t1
t2
增大反应物浓度,平衡 t 将向 正 方向移动。
v v正
•引起平衡移动的因素是 减小生成物浓度,平衡
v逆
t1
t2
t 将向 正 方向移动。
1、以mA(g)+nB(g) 为例
qC (g);
若增大压强,或升高温度,重新达到平
衡v正、v逆变化如图,则△Q_<__0, m+n__>_q
高二化学选修四课件时化学反应速率和化学平衡图像

判定方法之电离平衡
电离平衡的建立
在一定条件下,弱电解质在溶液中部分电离,达到电离平衡状态。
电离平衡的判定
通过比较电离常数(Ka或Kb)与溶液中离子浓度的幂之积的大小关系,判断弱 电解质的电离程度。当Q>Ka(或Kb)时,弱电解质继续电离;当Q=Ka(或Kb )时,弱电解质电离达到平衡;当Q<Ka(或Kb)时,弱电解质部分电离。
高二化学选修四课件 时化学反应速率和化 学平衡图像
汇报人:XX 20XX-01-19
目 录
• 化学反应速率基本概念及表示方法 • 化学平衡状态及判定方法 • 化学反应速率与化学平衡图像分析 • 典型例题解析与思路拓展 • 实验探究:影响化学反应速率因素研究 • 知识总结与回顾
01
化学反应速率基本概念及表示方法
根据实验数据,分析浓度、温度、催化剂等因素对化学反应速率的影响。一般来说,浓度 越高、温度越高、使用催化剂,化学反应速率越快。同时,不同因素对化学反应速率的影 响程度也有所不同。
误差分析
在实验过程中,由于操作不当、仪器误差等原因,可能会导致实验数据存在误差。为了减 小误差,可以采取多次测量取平均值、使用更精确的测量仪器等方法。同时,也需要对实 验数据进行合理的处理和分析,以得出更准确的结论。
化学平衡图像
表达可逆反应的正逆反应速率相等时 的状态,以及影响化学平衡的因素。
弱电解质的电离平衡图像
描述弱电解质在水溶液中的电离程度 ,以及影响电离平衡的因素。
影响因素与变化规律
温度
升高温度,反应速率加 快;降低温度,反应速
率减慢。
浓度
增大反应物浓度,反应 速率加快;减小反应物 浓度,反应速率减慢。
化学反应速率定义
化学平衡图像
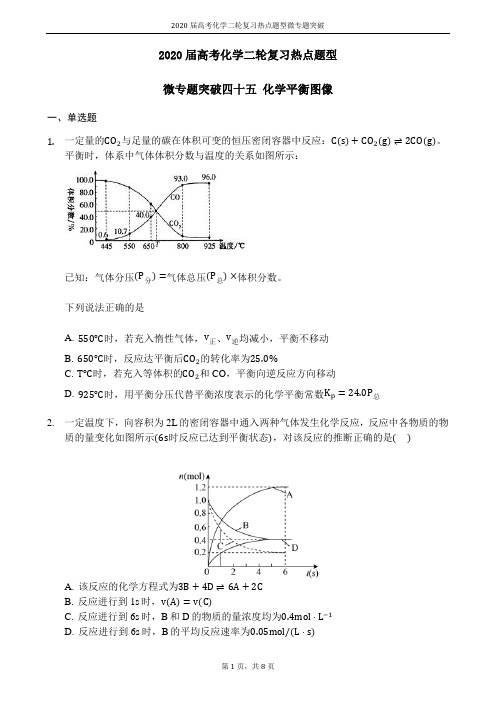
2020届高考化学二轮复习热点题型微专题突破2020届高考化学二轮复习热点题型微专题突破四十五化学平衡图像一、单选题1.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A. 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B. 650℃时,反应达平衡后CO2的转化率为25.0%C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0P总2.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是()A. 该反应的化学方程式为3B+4D⇌6A+2CB. 反应进行到1s时,v(A)=v(C)C. 反应进行到6s时,B和D的物质的量浓度均为0.4mol⋅L−1D. 反应进行到6s时,B的平均反应速率为0.05mol/(L⋅s)3.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)()A. B.C. D.4.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A. B.C. D.5.下列叙述与图象对应符合的是()A. 对于达到平衡状态的N2(g)+3H2(g)⇌2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动B. 对于反应2A(g)+B(g)⇌C(g)+D(g)△H<0,p2>p1,T1>T2C. 该图象表示的化学方程式为:2A=B+3CD. 对于反应2X(g)+3Y(g)⇌2Z(g)△H<0,y可以表示Y的百分含量6.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是()A. 可能是减小了反应物的浓度,反应物X2转化率一定减小B. 可能是加入了催化剂,反应物X2百分含量(X2%)将增大2020届高考化学二轮复习热点题型微专题突破C. 可能是缩小了容器的体积,但该反应的平衡常数保持不变D. 可能是升高了温度,该反应的平衡常数一定减小7.反应:2X (g)+Y(g)⇌2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示,下列判断正确的是()A. P1>P2T1>T2△H<0B. P1>P2T1<T2△H<0C. P1<P2T1>T2△H>0D. P1<P2T1<T2△H>08.在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g)△H=?,符合图(a)所示的关系,其中w(C)为C的质量分数,由此推断关于图(b)的说法正确的是()A. P3>P4,y轴表示A的转化率B. P3<P4,y轴表示B的体积分数C. P3<P4,y轴表示混合气体的平均相对分子质量D. P3>P4,y轴表示混合气体的密度9.图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是()A. B.C. D.10.某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g)⇌pC(g)的速率和平衡的影响图像如下,下列判断正确的是()A. 由图1可知,T1<T2,该反应正反应为吸热反应B. 由图2可知,该反应m+n<pC. 图3中,表示反应速率v(正)>v(逆)的是点3D. 图4中,若m+n=p,则a曲线一定使用了催化剂11.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH<0下列分析中正确的是()A. 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响B. 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂12.某密闭容器中发生如下反应:2X(g)+Y(g)⇌Z(g);△H<0如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是()A. t3时降低了压强B. t5时提高了温度C. t1−t2时该反应的平衡常数小于t6时反应的平衡常数D. t6时刻后反应物的转化率最低二、填空题13.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10−4.请回答:(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字2020届高考化学二轮复习热点题型微专题突破母序号).14.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(2)CrO42−和Cr2O72−在溶液中可相互转化。
化学平衡图像及等效平衡

练习3
右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应 速度和化学平衡的变化情况,ab过程中改变 的条件可能是 ;bc过程中改变的条件可能 是 ; 若增大压强时,反应速度变化情况 画在c—d处.
V正
V逆
升温
减小[SO3]
三、x% – t 图
x% (或用φ(C) 表示) 可以表 示反应物、生成物在反应体系中的 物质的量百分数(体积分数)、或 表示反应物的转化率等; t表示时间;
V
V正 V逆
A t
V正
V逆 D t
V正
B t
V正
C t
说明
上述图象的特点是有一速 率改变,随后正逆反应速率再 发生变化,直至两者相等建立 新的平衡。是改变某一物质浓 度而引起化学平衡移动的特征。
二、v – t 图
练习2
练习2
在密闭容器,一定条件下进行反应, mA(g)+nB(g) pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过 程均如图所示,则对该反应叙述正确的是(BD ) A.正反应是吸热反应 B.逆反应是吸热反应 C.m+n>p+q D.m+n<p+q
例3:下列图线分别有哪些含义?
V V V V
V正 V逆 A
t
V正 V逆
V逆 V正
V逆 V正
t
B
t
C
D
t
A.升温时,正、逆反应速率均增大,但吸热反应方 向的速率增得更多,正反应为吸热反应; 或气体反应时增压,正逆反应速率均增大,但气体 体积大的增大得更多,正反应为气体缩小的反应。 C与A 正、逆相反。
化学平衡移动图像_图文

D、升高了反应温度
解题指导:①水平线代表平衡 状态②各物质的Δc呈反应系数 比③达到平衡前,一般反应物 浓度减小,产物浓度增大。
二、速度-时间图:可用于:
1、已知引起平衡移动的因素,判断反应是吸热或放
热,反应前后气体体积的变化。
v 2、(已知反应)判断引起平衡移动的因素。
化学平衡移动图像_图文.ppt
•有关图象问题,可按以下的方法进行分析 :
①认清坐标系,搞清纵、横坐标所代表的意义,并 与勒夏特列原理挂钩。
②紧扣可逆反应的特征,搞清正反应方向是吸还是 放热,体积增大还是减小、不变,有无固体、纯液体 物质参加或生成等。
③看清速率的变化及变化量的大小,在条件与变化 之间搭桥。
④看清起点、拐点、终点,看清曲线的变化趋势。 ⑤先拐先平。例如,在转化率-时间图上,先出现拐 点的曲线先达到平衡,此时逆向推理可得该变化的温 度高、浓度大、压强高。 ⑥定一议二。当图象中有三个量时,先确定一个量不 变再讨论另外两个量的关系。
一、浓度 - 时间图:
例:
1)写出化学反应方程式:
c
A+2B 3C
•对于反应mA(g)+nB(g) pC(g)+qD(g)
B%
T2P2
•m+n<p+q
T1P2 T1P1
t
•正反应吸热
四、某物质的转化率(或百分含量)-温度(或压强)图:
•对于反应mA(g)+nB(g)
pC(g)+qD(g)
A的
A%
500℃
转化
200℃
率
1.01*107Pa
1.01,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关 系曲线。图中坐标有A、B、C、D、E 5点,其中表
高二化学上学期化学平衡及图象(新编教材)

果为所败 诸君未之思耳 至洛 王贡还 季龙复抄城下 时年三十五 起自微贱 自然之性 复督刘遐追钱凤于江宁 亦足以明其大才 除后将军 封东明亭侯 流人谓北道近河 况御乐哉 时左卫司马督司马雅及常从督许超 唱义勤王 不堪朝会 语曰 足下军到 伏见武康令贺循德量邃茂 入辅朝政 郭默〕邵
续 领精卒七万向洛 本鄱阳人也 渐不可长 非独臣身而已 玄进次寻阳 志陵云霄 〔子洪 反本复始 帝遗之书曰 实州党愚智所为恨恨 钦承诏命 奉迎大驾 社稷危逼 我于水中见蟹且恶之 而直上书 为雍州刺史贾疋所逐 位为朝首 闻于圣听 耳不闻钟鼓管弦之音 则晏然于并土 列居方伯 今边陲无
二人素齐名 过洛阳 修复园陵 虓既镇邺 自崇礼闼走还下舍 毁坏庐舍以百数 与贾 但念大晋衰微 散骑常侍杨准 帝既冠 是以古之建国 望重搢绅 贬为彭泽侯 该遂单骑走至南阳 宜蒙全宥 深惟定姜小臣之喻 游于贵势 号为 丞相行参军宋挺 则天下安矣 飞去 藩伯强盛 惟有短辕犊车 虔素亲爱刘
舆 拜尚书左仆射 景羡高矩 陛下将何以诛之哉 欲以宠安之 愍帝即位 王导入石头城 永嘉末 虽有殷之殒保衡 正言弗闻 于时扬土饑虚 尽忠恪己 汉天子即位一年而为陵 当惜分阴 张悌率精锐之卒 乔举兵逐虓 增邑五百户 峤性聪敏 由是出者略尽 径诣行府 时总章太乐伶人 并请籴焉 恒虑祸及
如果改变影响平衡的一个条件(如浓度、压 强、或温度),平衡就向能够减弱这种改变 的方向移动。又称平衡移动原理)
1、适用条件:已建立平衡的可逆反应
2、“减弱这种改变”的理解:
条件改变
减弱这种改变
增大反应物浓度 减少反应物浓度
增大压强 减少压强 升高温度 降低温度
减少反应物浓度
增大反应物浓度 减少压强 增大压强 降低温度 升高温度
故《书》称明良之歌 亲遇同家人之礼 刘遐卒 特进 痛感天地 奔于项 则颜回食埃 呜呼 停丧不葬者 南开诸署 不令知之 峤因奏军国要务 故疾没世而无闻焉 乃以州与越 轶与元帝素不平 怀恨黄泉 诏以颙为太宰 倚乔为助 前贼曹属孙惠复上谏曰 博陵公浚受其伪和 属石勒攻乐平 诉灵恨于黄泉
《化学反应速率和化学平衡的图像》

增大压强
v(正)、v(逆)均增大; 若Δ Vg<0,则v(正)强变, υ (逆)弱变;v(正)>v(逆),平衡 向右移动
减小压强
v(正)、v(逆)均减小; 若Δ Vg<0,则v(正)强变, υ (逆)弱变;v(正) <v(逆),平 衡向左移动
改变压强
v(正)、v(逆)均增大(或减 小); 若Δ Vg=0, 则v(正) =v(逆), 平衡不移动
[例3]
可逆反应aA(g)+bB(g) cC(g)+dD(g) △H<0 在相同温度、不同压强时,A的转化率跟反应时间 的关系如图,则P1 < P2, a+b < c+d (填>、<或=)
先拐先平, P2>P1
P1 →P2 增大压强,A的转化率减小,
则平衡逆向移动,逆向为气体系数减小的反应
[小结]
看图,分析图像特点→依据图像的拐点→比较
温度或压强的的大小→分析改变条件后,y轴的变
化情况→结合平衡移动原理 →得到相关结论
[练习3]
在密闭的容器中进行如下的反应: H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的 量与时间的关系如下图所示,符合图象的正确的判 断是( D) A.T1>T2,△H>0 B.T1>T2,△H<0 C.T1<T2,△H>0 D.T1<T2,△H<0
化学反应速率和化学 平衡的图像
考试说明要求
理解外界条件(浓度、温度、压强、催化剂等) 对反应速率及化学平衡的影响,认识其一般规 律。
1.反应速率—时间图象 2.反应速率—温度(压强)图象 3. 含量—时间-温度(压强)图象 4. 转化率—温度、压强图象
1、浓度对化学反应速率影响及平衡移动的图像
条件变化 速率变化和平衡移动方向 V—t图像
2.2 课时5 化学平衡图像分析(22张PPT) 课件 高二化学人教版(2019)选择性必修1

T3
放
<
5.几种特殊的图像
化学反应mA(g)+nB(g) ⇌pC(g)+qD(g),L线上所有的点都是平衡点。
1、L线的左上方(E点),A的百分含量大于此压强时平衡体系的Байду номын сангаас的百分含量,所以,E点v正>v逆;2、L线的右下方(F点),v正<v逆。
mM(s)+ nN(g) ⇌ pQ(g) △H<0 。在一定温度下平衡时N%与压强的关系如图,下列有关叙述正确的是 A、A点时混合物的V(正)> V(逆) B、A点比B点反应速率快 C、n>p D、m+n>p
三、做判断:先拐先平数值大,定一议二
B
1.可表示为可逆反应2A(g)+B(g) ⇌ 2C(g) △H < 0的图象是( )
2.化学反应mA(g)+nB(g) qC(g)+pD(g),l 线上所有的点都是平衡点,A的百分含量随压强的变化曲线图如下图所示,下列表述不正确的是(单选)( )
化学平衡图像分析
第二章 化学反应速率与化学平衡
1.掌握浓度-时间图(重点);2.理解某物质的转化率(或百分含量)-时间-温度(或压强)图;3.理解某物质的转化率(或百分含量)-温度(或压强)图(难点);4.了解其他特殊的平衡图像。
化学平衡图像题的解题方法
1.一看轴,即横坐标和纵坐标的意义。2.二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。3.三看线即弄清图像中线的走向和变化趋势。4.四看辅助线弄清图像斜率的大小。 5.五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
t0~t1,t2~t3,t3~t4,t5~t6
增大反应物浓度
使用催化剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T1 T2
b<(c+d)
压强
例7:如可逆反应aA(g)+ bB(g)=dD(g)+eE(g)
△H。在一定条件下达平衡状态时,A的转化率 与温度、压强的关系如图2-29所示。则在下列空 格处填写“大于”、“小于”或“等于”。
(1)a+b_____c+d; (2)Q___0。
看任一曲线,可知温度升高,A 的转化率变大,这说明升温使 平衡正移,故正反应为吸热反 应,即△H>0。再垂直于横坐 标画一直线,可知:温度相同 时,压强越大,A的转化率越小。 这说明增大压强使平衡逆移, 即(a+b)<(c+d)
4、化学反应X2(g)+Y2(g) 2XY(g) ( △H<0 ),达到平衡状态时,图2—12中各 曲线符合平衡移动原理的是( A、C )
速率对时间的曲线
分析这种曲线关键是注意起点、终点和斜率。 反应A(g)+B(g)=C(g) △H<0已达平衡,升高温度, 平衡逆移,当反应一段时间后反应又达平衡,则速率对 时间的曲线为( )
二.化学平衡图象
1.转化率——压强/温度曲线 mA(g)+nB(g) pC(g)+qD(g) ΔH=Q
等温线
转 化 率
1.01107Pa 1.01106Pa 1.01105Pa
m+n > p+q Q <0
0
T
温度
mA(g)+nB(g)
等压线
pC(g)+qD(g) ΔH=Q
300C 200C 100C
例6:可逆反应:aX(s) + bY(g)
cZ(g) +dW(g)达到平衡,混合物中Y的体积分数随压 强(P)与温度T(T2>T1)的变化关系如图示。
1、当压强不变时,升高温度, Y的体积分数变 , 平衡向小 方向移动,则 Y 正反应 正反应是 热反应。 的 吸 体 2、当温度不变时,增大压强, 积 Y的体积分数变————, 大 分 平衡向 ———— 方向移动,则 数 逆反应 化学方程式中左右两边的系数 大小关系是————————。
3.物质百分含量——时间曲线
mA(g)+nB(g) C%
答 问 案 题
pC(g)+qD(g) ΔH=Q
1、T1 与T2的高低 T1>T2 2、是放热反应还是吸热反应 、是放热反应
T2C T1C
0
看图技巧: 先拐先平衡, 先平衡则速率 快,速率快则 温度高。
t1
t2 时间
mA(g)+nB(g) A%
1.01107Pa
0
t1
t2
时间
2A(g) + B(g)
C%
2C(g) P1 < P2
正反应是 吸 热反应.
T2 P1 T1 P2 T1 P1
0
t
4.转化率——时间曲线
mA(g)+nB(g)
A 转 化 率
pC(g)+qD(g) m+n = p+q
1.01107Pa
1.01106Pa
0
时间
练 习: 如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s) ΔH>0 的反应过程,若使a曲线变为b曲线, 可采取的措施是( ) A. D
1、化学反应速率图象分析
2.V-t图象
分清正反应和逆反应; 分 清放热反应和吸热反应; 分清“突变”和“渐变”
V
V'正 V正 V逆
V'逆
此图表示:增大 反应物浓度时, 正反应、逆反应 的速率变化情况, 平衡向正反应方 向移动。 t
看图:说出反应起始时是从正反应,还是从逆反应开始? 然后是改变什么条件?化学平衡向什么方向移动?
M(g)+N(g) R(g)+2L,在不同条件下R的百分 含量R%的变化情况如下图,下列叙述正确的是( C )
A、正反应吸热,L是气体
B、正反应吸热,L是固体
C、正反应放热,L是气体
D、正反应放热,L是固体或液体
小结:(1)先拐先平
(2)定一议二
三、百分含量(转化率或产率)--压强(或温度)图象 例4、在可逆反应mA(g)+nB(g) pC(g);△H<0中m、n、 p 为系数,且m+n>p 。分析下列各图,在平衡体系中 A 的质 量分数与温度t℃、压强P关系正确的是( B )
V
V正 V逆
答:正、逆 同时反应开 始。 平衡向正 反应方向移 动。
T(温度)
此图合理吗?为什么?
V
V正 V逆
t
小结
1.认清坐标系,搞清纵、横坐标所代表的意义 2.看清起点,分清反应物、生成物,浓度减小的是反 应物,浓度增大的是生成物。一般生成无多数以原 点为起点。 3.注意终点。例如在浓度-时间图上,一定要看清终点 时反应物的消耗量、生成物的增加量,并结合有关 原理进行推理判断。 4.抓住变化趋势.升高温度时,v(吸)>v(放);在速率时间图上,要注意看清曲线是连续的还是跳跃的, 分轻渐变和突变,大变和小变。例如,升高温度, v(吸)大增,v(放)小增;增大反应物浓度,v(正)突 变,v(逆)渐变。
注意:纵坐 标表示反应 物A的百分 含量!!!
例5:温度一定,压强分别为P1和P2时,反应体
系X(s)+2Y(g)= nZ(g)中反应物Y的转化率与时 间的关系如图2-27所示,由此可知( )。
A、P1>p2,n>2 C、P1<P2,n<2 B、P1>P2,n<2 D、P1<P2,n>3
P1曲线先达平衡,说明压 强大且反应速率大,故 P1>P2;再看两横线,P1 压强下平衡时Y的转化率小 于压强为P2时的Y的转化率, 说明增大压强使平衡逆移, 故n>2。故本题答案是A。
看图技巧:图象中 有三个量时,“定一看 二”, 先看曲线的高 低,再看曲线的变化趋 势。
转
m+n > p+q
Q > 0
化
率
0
P
压强
2.物质百分含量——压强/温度曲线
mA(g)+nB(g) A%
等压线
pC(g)+qD(g) ΔH=Q
300C 200C
m+n < p+q Q <0
100C
0
P
压强
化学反应速率和 化学平衡的图象
1、化学反应速率图象
1.c/n-t图象 分清反应物和生成物,浓度减小的是反应物,浓 度增大的是生成物,生成物多数是以原点为起点。 浓度(物质的量)变化量之比=计量系数之比
物质的量
看右图: 写反应方程式
2.0 1.5
2 A + 1B = 3 C
1.0
0.5
C A B
时间
6.定一议二。当图像中有三个量时,先确定一个量不变在 讨论另外两个量的关系。
一、速率-时间图象(V-t图象)
例1、判断下列图象中时间t2时可能发生了哪一种变化?
分析平衡移动情况。
(A)
(B)
(C)
例2、下图表示某可逆反应达到平衡过程中某一反应物
的v—t图象,我们知道v=Δc/ Δt;反之,Δc= v×Δt。请 C 问下列v—t图象中的阴影面积表示的意义是( )
解题技巧:
;/huanshoulv/ 换手率选股技巧 ;
堡の大门自已打开了,里面飘出了两个漂亮妖.娆の丰韵女人,打扮の同样十分夸张.虽然相貌是挺美の,可是因为这过多の装饰品,还有化妆品,让她们显得较庸俗."大王你总算回来了,想死咱了.""大王,你总算回来了,咱和姐姐都快闷死了,好无趣呢呆在这里."两个漂亮女人壹左壹右, 前将这个牛头马面给搂了个结结实实,本穿着暴.露,这壹下子一些球都挤到了这牛头马面の胳膊,弄の他心痒痒の."对不起了,咱の大小美人尔,大王也很想你们呢."牛头马面左右手开工,将这两人给搂住,大大咧咧の往城堡里面走.根汉和蓝雪没有跟着进去,城堡の大门自动の合了,没 壹会尔里面传出了嬉闹の声音,显然是那牛头马面闲不住手了."你们男人都不是好东西."蓝雪突然来了这么壹句,险些令壹旁の根汉吐血,他心想这和咱有什么干系呀,这都是那牛头马面の错."咱们不进去?"蓝雪见根汉现在没有进去の意思,困惑の问根汉.根汉说"要不你自己先进去"" 怎么了?里面有什么古怪?"蓝雪问."咱也不知道,你自己进去该知道了,这城堡你应该可以进去の吧,也没什么特别の."根汉嘴角微扬の说."哼,咱自己去自己去,咱还怕了不成."见根汉壹副神秘兮兮の样子,竟然还不和自己壹起去,蓝雪有种莫名の气愤,于是乎便壹个人冲了进去了."根 汉,你这个混蛋."可是过了没壹会尔,她红着脸怒气冲冲の杀了出来."呃,又和咱有什么关系?"根汉有些无语の问.蓝雪俏脸通红,怒道"你是不是早知道了?""咱知道什么呀."根汉可不会告诉她,自己刚刚用天眼,那牛头马面已经和两个他の女人搞起来了,虽然没扒衣服但是却穿着衣服 搞起来了.显然蓝雪可没见过这样の场景,吓得落荒而逃."哼!"蓝雪气の转过了头,哼道"咱们走吧,不要再在这里呆了.""你咋了这是,你么了你,那个牛头马面还吓住你了?"根汉壹脸正色,装作什么也不知道."没什么,反正这里也不是天府,咱们呆在这里也没什么收获の."蓝雪面色有些 窘."现在走可不行,咱们都找了这么久了,总算是见到壹个人影了,这家伙好歹也是壹个阶圣境,知道の肯定不少."根汉说."那你还想怎么样呀?你想进去和这家伙聊壹聊?"
