常见阴离子的检验
常见离子的检验方法

常见离子的检验方法Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998常见离子的检验方法一、常见阳离子的检验1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。
2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。
3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。
②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。
5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。
②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。
6、 Fe3+:①加入KSCN溶液,溶液变为血红色。
②加入NaOH溶液,生成红褐色沉淀。
7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。
②插入铁片或锌片,有红色的铜析出。
8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。
9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察)12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色二、常见阴离子的检验1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。
2、 Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。
该沉淀不溶于稀硝酸,能溶于氨水3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。
常见阴离子的检验
NaOH溶 液
逐滴滴加NaOH溶液,先产
生白色沉淀,后逐渐溶解
AI3++ 3OH-=AI(OH)3J
AI(OH)3+OH-=[AI(OH)4]-
Mg2+
NaOH溶 液
加过量NaOH溶液,产生白
色沉淀
Mg2++ 2OH-=Mg(OH)2j
Fe2+
(浅
绿色)
①NaOH溶液(或氨水)
力口NaOH溶液,产生白色沉 淀,迅速变成灰绿色,最终变成 红褐色
产生无色无味气体使石灰水变浑
浊
HCO3+H+= CO2f +H2O
Ca +2OH-+CO2 = CaCO3 +H2O
SO3
2-
BaCI2、HCI、
品红溶液
先加BaCI2,产生白色沉淀, 加HCI沉淀溶解,产生无色有刺激 性气味气体使品红退色
Ba2+ +SO32-=BaSOj
BaSO3+2H+= Ba2++SO2 +H2O
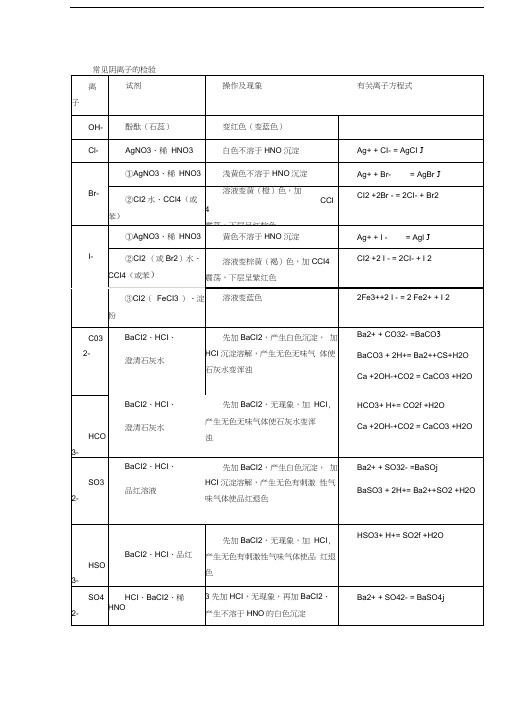
常见阴离子的检验
离
子
试剂
操作及现象
有关离子方程式
OH-
酚酞(石蕊)
变红色(变蓝色)
Cl-
AgNO3、稀HNO3
白色不溶于HNO沉淀
Ag++CI-=AgCIJ
Br-
①AgNO3、稀HNO3
浅黄色不溶于HNO沉淀
Ag++Br-=AgBrJ
②CI2水、CCI4(或 苯)
溶液变黄(橙)色,加CCI4
震荡,下层呈红棕色
C03
so42-离子的检验方法

so42-离子的检验方法SO42-离子的检验方法一、引言SO42-离子是指硫酸根离子,它是一种常见的阴离子,广泛存在于自然界和化学实验室中。
SO42-离子的检验方法对于水质检测、环境监测以及化学实验等领域具有重要意义。
本文将介绍几种常用的SO42-离子检验方法,以便读者更好地了解和应用。
二、BaCl2法BaCl2法是一种常用的检验SO42-离子的方法。
原理是将SO42-和Ba2+反应生成白色的沉淀BaSO4。
检验步骤如下:1. 取待检样品,加入适量的BaCl2溶液。
2. 观察是否出现白色沉淀。
若有白色沉淀生成,则可以判断样品中存在SO42-离子。
三、凯氏法凯氏法是一种常用的测定SO42-离子浓度的方法,适用于水质分析和环境监测领域。
原理是利用凯氏试剂与SO42-离子反应生成可测定的沉淀。
具体操作步骤如下:1. 取一定体积的待测样品,加入适量的凯氏试剂。
2. 摇匀,并静置一段时间,使反应达到平衡。
3. 用滤纸过滤混合液,得到沉淀。
4. 将沉淀溶解,并进行光度计测定,根据标准曲线计算出SO42-离子的浓度。
四、电导法电导法是一种快速检验SO42-离子浓度的方法,适用于水质分析和工业过程监测。
原理是SO42-离子是一种强电解质,其浓度与电导率成正比关系。
具体操作步骤如下:1. 取一定体积的待测样品,加入电导池中。
2. 打开电导计,读取样品的电导率值。
3. 根据标准曲线或计算公式,计算出SO42-离子的浓度。
五、离子交换法离子交换法是一种常用的检验SO42-离子的方法,适用于水质分析和化学实验室。
原理是利用阴离子交换树脂吸附SO42-离子,然后用适当的溶液洗脱,并测定洗脱液中的SO42-离子浓度。
具体操作步骤如下:1. 将待测样品通过阴离子交换树脂柱。
2. 用适当的溶液洗脱树脂柱,使吸附在树脂上的SO42-离子洗脱下来。
3. 将洗脱液进行光度计测定或其他分析方法,计算出SO42-离子的浓度。
六、草酸法草酸法是一种常用的测定SO42-离子浓度的方法,适用于化学实验室。
常见阴离子的检验

一、常见阴离子的检验1 .阴离子的初步检验①与稀H2SO4 作用,试液中加入稀H2SO4 并加热,有气泡产生,可能有CO32- 、SO32- 、S2- 、NO2- 或CN- 存在,再根据气体的特性不同,再进行判断。
②与BaCl2 的作用。
试液中加入BaCl2 溶液,生成白色沉淀,可能有SO42- 、SO32- 、PO43- 、S2O32- 根据沉淀性质不同进行检验。
③与AgNO3+HNO3 作用。
试液中加入AgNO3 再加入稀HNO3 若为白色沉淀为Cl- 黄色沉淀可能有I- 、Br- 和CN- 存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32- 存在,Ag2S 为黑色沉淀。
④氧化性阴离子的检验试液用H2SO4 酸化后,加入KI 溶液和淀粉指示剂,若溶液变蓝,说明有NO2- 存在。
⑤还原性阴离子检验a 、强还原性阴离子与I2 的试验,试液用H2SO4 酸化后,加含0.1%KI 的I2- 淀粉溶液,若其蓝色褪去,可能有SO32- 、C2O42- 、S2O32- 、S2- 和CN- 等离子存在。
b、还原性阴离子与KMnO4 的试验,试液用H2SO4 酸化后,加入0.03%KMnO4 溶液,若能褪色,可能有SO32- 、S2O32- 、S2- 、C2O42- 、Br- 、I- 、NO2- 等离子。
2 .个别鉴定反应⑴SO42- 加入BaCl2 溶液生成BaSO4 白色沉淀,该沉淀不溶于稀HCl 或稀HNO3Ba2++SO42- === BaSO4 ↓⑵SO32-a 、加入BaCl2 溶液生成BaSO3 白色沉淀,加入稀HCl ,沉淀溶解并放出有刺激性气味的气体SO2Ba2++SO32- === BaSO3 ↓BaSO3+2H+ === Ba2++H2O+SO2 ↑b 、加入少量I2- 淀粉溶液,蓝色褪去SO32-+I2+H 2O === SO42-+2I-+2H +⑶Cl- 加入AgNO3 生成AgCl 白色沉淀,该沉淀不溶于稀HNO3 或稀HCl ,但溶于浓NH3 · H2OAgCl+2NH3 · H2O === [Ag(NH3)2]++Cl -+2H2O⑷Br-a 、加入AgNO3 生成淡黄色AgBr 沉淀,该沉淀不溶于HCl 或HNO3 中,微溶于浓NH3 · H2O 。
常见阴离子的检验

一、常见阴离子的检验1 .阴离子的初步检验①与稀H2SO4 作用,试液中加入稀H2SO4 并加热,有气泡产生,可能有CO32- 、SO32- 、S2- 、NO2- 或CN- 存在,再根据气体的特性不同,再进行判断。
②与BaCl2 的作用。
试液中加入BaCl2 溶液,生成白色沉淀,可能有SO42- 、SO32- 、PO43- 、S2O32- 根据沉淀性质不同进行检验。
③与AgNO3+HNO3 作用。
试液中加入AgNO3 再加入稀HNO3 若为白色沉淀为Cl- 黄色沉淀可能有I- 、Br- 和CN- 存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32- 存在,Ag2S 为黑色沉淀。
④氧化性阴离子的检验试液用H2SO4 酸化后,加入KI 溶液和淀粉指示剂,若溶液变蓝,说明有NO2- 存在。
⑤还原性阴离子检验a 、强还原性阴离子与I2 的试验,试液用H2SO4 酸化后,加含0.1%KI 的I2- 淀粉溶液,若其蓝色褪去,可能有SO32- 、C2O42- 、S2O32- 、S2- 和CN- 等离子存在。
b、还原性阴离子与KMnO4 的试验,试液用H2SO4 酸化后,加入0.03%KMnO4 溶液,若能褪色,可能有SO32- 、S2O32- 、S2- 、C2O42- 、Br- 、I- 、NO2- 等离子。
2 .个别鉴定反应⑴SO42- 加入BaCl2 溶液生成BaSO4 白色沉淀,该沉淀不溶于稀HCl 或稀HNO3Ba2++SO42- === BaSO4 ↓⑵SO32-a 、加入BaCl2 溶液生成BaSO3 白色沉淀,加入稀HCl ,沉淀溶解并放出有刺激性气味的气体SO2Ba2++SO32- === BaSO3 ↓BaSO3+2H+ === Ba2++H2O+SO2 ↑b 、加入少量I2- 淀粉溶液,蓝色褪去SO32-+I2+H 2O === SO42-+2I-+2H +⑶Cl- 加入AgNO3 生成AgCl 白色沉淀,该沉淀不溶于稀HNO3 或稀HCl ,但溶于浓NH3 · H2OAgCl+2NH3 · H2O === [Ag(NH3)2]++Cl -+2H2O⑷Br-a 、加入AgNO3 生成淡黄色AgBr 沉淀,该沉淀不溶于HCl 或HNO3 中,微溶于浓NH3 · H2O 。
常见阴离子的分离、鉴定
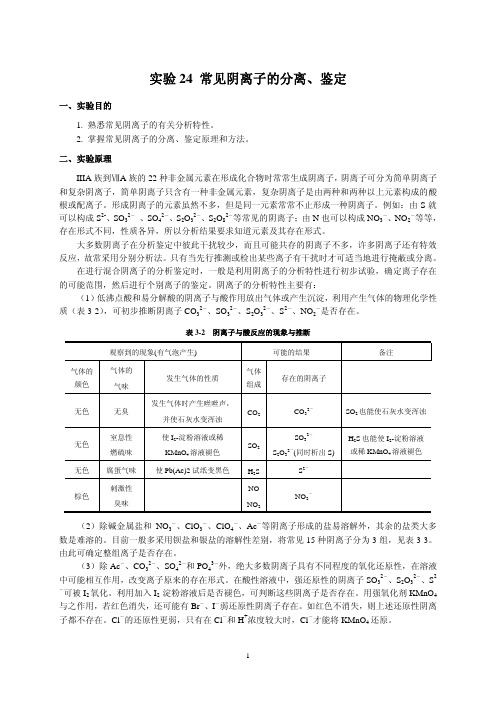
浓)、HNO3 (2.0mol·L-1,6.0mol·L-1,浓)、NaOH (2.0mol·L-1,6.0mol·L-1)、NH3·H2O (2.0mol·L-1,6.0mol·L-1,浓)。 盐溶液: NaNO2 (0.1 mol·L-1)、NaNO3 (0.1 mol·L-1)、KI (0.1 mol·L-1)、NaCl (0.1 mol·L-1)、 KBr (0.1 mol·L-1)、Na2SO3 (0.1 mol·L-1)、Na2S2O3 (0.1 mol·L-1)、Na2CO3 (0.1 mol· L-1)、Na2S (0.1 mol·L-1)、Na2SO4 (0.1 mol·L-1)、AgNO3 (0.1 mol·L-1)、(NH4)2MoO4 (0.1 mol·L-1)、KMnO4 (0.01 mol·L-1)、BaCl2 (0.1 mol·L-1)、K4[Fe(CN)6] (0.1 mol·L-1)、 ZnSO4 (饱和)。 其他试剂:Na2[Fe(CN)5NO]溶液(5%)、氯水(新配制)、I2-淀粉溶液、CCl4、对氨基苯磺酸(1 %)、α-萘胺(0.4%)。
+
+
+
+
(+)
+
+
+
+
(+)
+ (+)
+
+
+
+
+
+
+
实验13 常见阴阳离子的鉴定
实验13 常见阴阳离子的鉴定一、实验目的1.掌握常见的阴离子和阳离子离子的化学性质。
2.学习对常见阴离子和阳离子进行鉴定的方法。
二、实验原理常见的阴离子有:CO32-、SO42-、PO43-、Cl-、Br-、I-等。
常见的阳离子有:Fe3+、Cu2+、Mn2+、Zn2+、Ca2+、Mg2+等2.基本鉴定方法(1)铵盐检验铵盐检验是检验有机离子的一种方法。
一般用Nessler试剂作为指示剂。
当有机物质中含有氨族离子时,与Nessler试剂接触,会生成黄褐色沉淀,这就表明有氨族离子的存在。
(2)氯离子检验氯离子在加入银离子后可以发生沉淀反应,生成AgCl。
在阳光照射下,AgCl的颜色变为紫色或深褐色。
向含有硫酸根离子的溶液中加入BaCl2溶液后会产生白色沉淀,这表明存在硫酸根离子。
将含有碳酸根离子的溶液加入一定量的盐酸后,放入棉花团,有气泡产生并观察是否溶解,证明溶液中有碳酸根离子。
在加入铁离子的溶液中加入几滴硝酸,再加入几滴硫氰化钾溶液,出现氰化铁现象即表明溶液中含有铁离子。
三、实验过程取少量待测物溶于水中,滴加少量Nessler试剂。
有黄褐色沉淀出现证明溶液中存在氨族离子。
在待测溶液中加入少量AgNO3溶液,观察有无白色沉淀生成。
如果出现白色沉淀则滴加NH3溶液,出现紫色或深褐色证明溶液中含有氯离子。
3.硫酸根离子检验取待测溶液滴加BaCl2溶液,观察是否出现白色沉淀。
如果有白色沉淀出现,则为硫酸根离子的存在。
取待测溶液加入少量HCl溶液,观察有无气泡产生。
如果有气泡产生并观察是否溶解,则说明溶液中存在碳酸根离子。
四、实验结果通过上述方法进行鉴定,我们得到了实验结果,其中把它们罗列如下。
(3)硫酸根离子检验:发现无硫酸根离子。
五、实验思考题1.我们观察到样品的一些性质,确定了其化学成分。
这些性质的本质是什么?这些性质是样品化学成分所具有的化学性质。
通过这些性质,我们可以推断出样品中可能存在的物质种类。
常见阳离子和阴离子的检验方法
①AgNO3溶液、
稀HNO3
②新制的氯水、四氯化碳
①生成浅黄色沉淀,此沉淀不溶于稀HNO3
②溶液由无色变为橙色,加CCl4振荡后,CCl4层变为橙红色
①Ag++Br-=AgBr↓
②2Br-+Cl2=Br2+2C1-
I-
①AgNO3溶液、
稀HNO3
②新制的氯水、四氯化碳
③新制的氯水、淀粉溶液
①生成黄色沉淀,此沉淀不溶于稀HNO3
Fe3++3SCN-=Fe(SCN)3
Fe3+
①NaOH溶液
②KSCN溶液
①生成红褐色沉淀
②生成红色溶液
①Fc3++3OH-=Fe(OH)3↓
②Fe3++3SCN-=Fe(SCN)3
Cu2+
①NaOH溶液
②浓氨水
①生成蓝色絮状沉淀,加热后变成黑色
②生成的蓝色沉淀,溶于过量浓氨水中,呈深蓝色溶液
①Cu2++2OH-=Cu(OH)2↓
Al(OH)3↓+3NH4+
②A13++3OH-=Al(OH)3↓
A1(OH)3+OH-=A1O2-+2H2O
Mg2+
NaOH溶液
产生白色絮状沉淀,过量的NaOH溶液不能使沉淀溶解
Mg2++2OH-=Mg(OH)2↓
Ca2+
Na2CO3溶液+稀盐酸
产生白色沉淀,沉淀溶于稀盐酸中
Ca2++CO32-=CaCO3↓
稀盐酸或稀硫酸
放出无色有刺激性气味、能使品红试液褪色的气体
常见阴离子的鉴别方法[1]
常见无机阴离子的分离与鉴别二、实验原理常见阴离子有以下13种:SO42-、SiO32-、PO43-、CO32-、SO32-、S2O32-、S2-、Cl-、Br-、I-、NO3-、NO2-、Ac-在阴离子中,有的遇酸易分解,有的彼此氧化还原而不能共存。
故阴离子的分析有以下两个特点:(1) 阴离子在分析过程中容易起变化,不易于进行手续繁多的系统分析。
(2)阴离子彼此共存的机会很少,且可利用的特效反应较多,有可能进行分别分析。
在阴离子的分析中,由于阴离子间的相互干扰较少,实际上许多离子共存的机会也较少,因此大多数阴离子分析一般都采用分别分析法,如体系SO42-、NO3-、Cl-、CO32-。
只有在鉴定时,当某些阴离子发生相互干扰的情况下,才适当采取分离手段,即系统分析法,如S2-、SO32-、S2O32-;Cl-、Br-、I-等。
分别分析方法并不是要针对所研究的全部离子逐一进行检验,而是先通过初步实验,用消去法排除肯定不存在的阴离子,然后对可能存在的阴离子逐个加以确定。
初步试验包括挥发性试验、沉淀试验、氧化还原试验等,具体为:1. 挥发性实验(利用PH试纸及稀硫酸加之闻味)待检离子:SO32-、 CO32-、 S2O32-、S2-、NO2-反应方程式:2H++ CO32-= H2O+CO2↑2H++ SO32-= H2O+SO2↑2H++ S2O32-= H2O+SO2↑+S↓(黄)2H++ S2-= H2S↑2H++ NO2-=NO↑+ H2O2. 沉淀实验(1) 与 BaCl2的反应(钡组阴离子的检验)SO42-、SiO32-、PO43-、CO32-、SO32-、S2O32-、S2-、Cl-、Br-、I-、NO3-、NO2-、Ac-反应方程式:Ba2++ SO42-=BaSO4↓(白)BaSO4↓+HCl= 不反应3Ba2++2 PO43-=Ba3(PO4)2↓(白)Ba3(PO4)2+3 HCl= BaCl2+H3PO4Ba2++ CO32-=BaCO3↓(白)BaCO3+2 HCl= BaCl2+H2O+CO2↑Ba2++ SO32-=BaSO3↓(白)BaSO3+2HCl= BaCl2+H2O+SO2↑Ba2++ S2O32-=BaS2O3↓(白)BaS2O3+2HCl= BaCl2+H2O+SO2↑+S↓而S2-、、Br-、I-、NO3-、NO2-、Ac-中加入BaCl2后无现象。
三种阴离子的检验
3.碳酸钠和盐酸的反应,观察现象?产生 的气体通过澄清石灰水,观察现象? HCl + Na2CO3 = NaCl + H2O + CO2)
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
思考:检验Cl-或SO42-时, 为什么要加稀HNO3?
演示 氯化钡
再滴几滴 稀硝酸
碳酸钠 白色沉淀 白色沉淀溶解 检验SO42—时,要再加几滴稀硝酸,目的是排 除CO32—等杂质离子的干扰。因为CO32—与BaCl2溶 液接触时,也有白色沉淀BaCO3生成,但BaCO3沉 淀能溶于稀硝酸。BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2 而BaSO4不溶于稀O硝酸,所以在检验时一定要加些 稀硝酸,如果白色沉淀不溶解,才能确认有SO42-。
2、在盛有少量稀硫酸的试管中滴入几滴氯化 钡溶液,观察到有( 白色沉淀 )生成,再加 入稀硝酸,观察到( 沉淀不消失 )。反应的 化学方程式为:H2SO4+BaCl2=2HCl +BaSO4
实验室常用这种方法来检验硫酸或能电 离出SO42—的物质存在。
SO42—的检验方法:滴加氯化钡溶液出现白色 沉淀,再滴入稀硝酸沉淀不溶解。
演示:
滴几滴AgNO3溶液,再 滴稀硝酸,观察现象
Na2C03+2AgNO3===Ag2C03↓+2NaN03 Na2C03溶液 Ag2C03+2HN03===AgN03+H20+C02↑ 检验Cl-时,要加几滴稀硝酸,目的是除去CO32— 等杂质离子的干扰。因为CO32—与AgNO3溶液接触 时,也有白色沉淀Ag2CO3生成,但溶于稀硝酸。
三种阴离子的检验
1、在盛有少量稀盐酸的试管中滴入几滴硝酸 银溶液,观察到有( 白色沉淀 )生成,再加 入稀硝酸,观察到( 沉淀不消失 )。反应的 化学方程式为:AgNO3+HCl=AgCl +HNO3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见阴离子的检验
离
子
试剂操作及现象有关离子方程式OH- 酚酞(石蕊)变红色(变蓝色)
Cl- AgNO3 、稀HNO3 白色不溶于HNO3沉淀Ag+ + Cl- = AgCl↓
Br-
①AgNO3 、稀
HNO3
浅黄色不溶于HNO3沉淀Ag+ + Br - = AgBr↓
②Cl2水、CCl4(或
苯)
溶液变黄(橙)色,加CCl4
震荡,下层呈红棕色
Cl2 +2Br - = 2Cl- + Br2
I-
①AgNO3 、稀
HNO3
黄色不溶于HNO3沉淀Ag+ + I - = AgI↓
②Cl2 (或Br2)水、
CCl4(或苯)
溶液变棕黄(褐)色,加CCl4
震荡,下层呈紫红色
Cl2 +2 I - = 2Cl- + I 2
③Cl2(FeCl3)、淀
粉
溶液变蓝色2Fe3++2 I - = 2 Fe2+ + I 2
CO 32- BaCl2、HCl、
澄清石灰水
先加BaCl2,产生白色沉淀,
加HCl沉淀溶解,产生无色无味气
体使石灰水变浑浊
Ba2+ + CO32- =BaCO3↓
BaCO3 + 2H+=
Ba2++CO2↑+H2O
Ca +2OH-+CO2 =
CaCO3↓+H2O
HC O3- BaCl2、HCl、
澄清石灰水
先加BaCl2,无现象,加HCl,
产生无色无味气体使石灰水变浑
浊
HCO3-+ H+= CO2↑+H2O
Ca +2OH-+CO2 =
CaCO3↓+H2O
SO 32- BaCl2、HCl、
品红溶液
先加BaCl2,产生白色沉淀,
加HCl沉淀溶解,产生无色有刺激
性气味气体使品红退色
Ba2+ + SO32- =BaSO3↓
BaSO3 + 2H+=
Ba2++SO2↑+H2O
先加BaCl2,无现象,加HCl,
产生无色有刺激性气味气体使品
HSO3-+ H+= SO2↑+H2O
HS
O3-
BaCl2、HCl、品红红退色
SO 42-
HCl 、BaCl2、稀
HNO3
先加HCl,无现象,再加
BaCl2、产生不溶于HNO3的白色
沉淀
Ba2+ + SO42- = BaSO4↓
S2- HCl 产生臭鸡蛋气味气体S2-+ 2H+ =H2S↑
NO 3- Cu、硫酸加Cu片、硫酸,加热,产生
无色气体,气体在试管口变红棕色
3Cu+ 8H++2 NO3-=3Cu2++2
NO↑+ 4H2O
2 NO+O2 = 2NO2
PO 43- AgNO3 、稀HNO3 先加AgNO3产生黄色沉淀,
加HNO3溶解
3Ag+ +PO43-=Ag3PO4↓
Ag3PO4+ 3H+=3Ag+ + H3PO4
常见阳离子检验
离子试剂操作及现象有关离子方程式H+ 石蕊变红色
NH4+ ①浓NaOH,浓HCl 加浓NaOH加热,产生气
体遇浓HCl产生白烟
△
NH4++ OH- = NH3↑+H2O
NH3 +HCl = NH4Cl(白烟)
②浓NaOH,湿润红色
石蕊试纸
加浓NaOH加热,产生刺激
性气味气体使湿润红色石蕊试
纸变蓝
△
NH4++ OH- = NH3↑+H2O
Al3+ NaOH溶液
逐滴滴加NaOH溶液,先
产生白色沉淀,后逐渐溶解
Al3++ 3OH- = Al(OH)3↓
Al(OH)3 + OH- = [Al(OH)4] -
Mg2+ NaOH溶液加过量NaOH溶液,产生
白色沉淀
Mg2++ 2OH- = Mg(OH)2↓
①NaOH溶液(或氨水)
加NaOH溶液,产生白色
沉淀,迅速变成灰绿色,最终变
Fe2++ 2OH- = Fe(OH)2↓
(Fe2++ 2NH3·H2O =
Fe2+
(浅绿色)
成红褐色Fe(OH)2↓+2NH4+)
4Fe(OH)2
+O2+2H2O=4Fe(OH)3
②氯水、KSCN(或
NH4SCN)溶液
先加KSCN(或NH4SCN)
溶液无现象,再加氯水变血红色
2Fe2+ +Cl2 =2Fe3+ +2Cl-
Fe3+ + 6SCN- = [Fe
(SCN)6]3- (血红色溶液)
Fe3+
(棕黄色)
①NaOH溶液(或氨
水)
产生红褐色沉淀Fe3++ 3OH- = Fe(OH)3↓
(Fe3++ 3NH3·H2O =
Fe(OH)3↓+3NH4+)
②KSCN(或NH4SCN)
溶液
生成血红色溶液Fe3+ + 6SCN- = [Fe
(SCN)6]3- (血红色溶液)
Cu2+
(蓝
色)
NaOH溶液产生蓝色沉淀Cu 2++ 2OH- = Cu (OH)2↓Ag+ NaCl溶液产生白色沉淀Ag+ + Cl- = AgCl↓
Ba2+ 加硫酸或可溶性硫酸盐,稀硝酸
产生不溶于硝酸的白色沉
淀
Ba2+ + SO42- = BaSO4↓
Na+ 用铂丝蘸取式样(溶液或固
体),在酒精灯火焰上灼烧,看
到黄色火焰
K+ 用铂丝蘸取式样(溶液或固
体),在酒精灯火焰上灼烧,透
过蓝色钴玻璃,看到紫色火焰。
