度人教版化学九年级下册课堂练习第九单元课题3溶液的浓度 第1课时 溶质的质量分数
人教版九年级化学下册同步练习附答案第九单元课题3 溶液的浓度

课题3 溶液的浓度(总分:52分时间:40分钟)一、选择题(本题包括9小题,每小题2分,共18分。
每小题只有1个选项符合题意)1.向200 g溶质质量分数为10%的蔗糖溶液中加200 g水,搅拌后把所得溶液倒掉一半,剩余的溶液溶质质量分数为()A.10%B.5%C.2.5%D.20%2.配制50 g 5%的氯化钠溶液,下列说法或做法正确的是()A.将准确称取的氯化钠固体直接倒入装有水的量筒中溶解B.称量氯化钠时药品和砝码(最小的砝码为1 g)放置颠倒了,所配制溶液溶质量分数偏大C.用量筒量取水时仰视液面,所配制溶液溶质质量分数偏小D.若用稀释10%的氧化钠溶液的方法配制上述溶液,需加水30 g3.如图是某同体物质的溶解度曲线。
则t2℃时,该物质的饱和溶液中溶质的质量分数为( )A.20%B.l6.7%C.30%D.23.1%4.某同学在实验室配制480 mL 0.5mol•L﹣1 NaOH溶液以备使用。
其操作步骤如图所示,则如图操作应在图中的()(填选项字母)之间。
A.②与③B.①与②C.④与⑤D.⑤与⑥5.小兰同学配制50 g 5%的氯化钠溶液,取水时他是俯视读数的,这位同学配得的溶液质量分数()A.等于5%B.大于5%C.小于5%D.无法判断6.要配制一定质量分数的氢氧化钠溶液,正确的操作步骤是()A.称量、溶解、计算、装瓶、贴标签B.称量、计算、溶解、装瓶、贴标签C.计算、称量、溶解、装瓶、贴标签D.溶解、计算、称量、装瓶、贴标签7.如图是配制100g溶质质量分数为5%的氯化钠溶液的操作过程.以下说法错误的是()A.该实验操作顺序为③②④⑤①B.称量时如果发现指针偏向右边,应向左盘添加氯化钠C.配制该溶液需要称取5g氯化钠,量取100mL水D操作①中玻璃棒的作用是搅拌,加速溶解8.保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是()A. B.C. D.9.将 50g 98%的浓硫酸全部溶于水配制成 10%的稀硫酸,需要加入水的质量为()gA.400B.440C.450D.500二、填空题(本题包括7小题,共29分)10.(3分)用5%的KNO3溶液配制150g溶质质量分数为2%的硝酸钾营养液,需要加水的质量是________g;用量筒量取水时,若读数时仰视,则导致配制溶液的质量分数________(天“偏大”或“偏小”);玻璃棒在配制过程中的作用是________。
人教版九年级下册化学 第九单元 课题3 溶液的浓度 同步练习 有答案

课题3溶液的浓度一选择题1.下列对于溶质的质量分数的叙述正确的是()A.一定质量溶液所含溶质的质量B.溶液中溶质质量与溶液质量之比C.1 L溶液里所含溶质的质量D.100 g溶剂里所含溶质的质量2.已知某溶液的溶质质量分数为20%,则下列比例正确的是()A.溶质质量∶溶液质量=1∶5B.溶剂质量∶溶液质量=1∶5C.溶质质量∶溶剂质量=1∶5D.溶质质量∶溶液质量=4∶53.向100 g质量分数为10%的NaOH溶液中加入12.5 g NaOH固体,完全溶解后,所得溶液中溶质质量分数为()A.12.5%B.20%C.22.5%D.25%4.如果将100 g溶质质量分数为20%的硝酸钾溶液稀释成溶质质量分数为10%的硝酸钾溶液,需加水的质量为()A.50 g B.90 g C.100 g D.200 g5.在温度不变的条件下,欲使下列溶液溶质的质量分数变为原来2倍的方法,最可行的是()A.将20 g硝酸钾饱和溶液蒸发掉10 g水B.将20 g硝酸钾不饱和溶液蒸发掉10 g水C.在10 g10%的硝酸钾溶液中,加入5 g 40%的硝酸钾溶液D.在10 g硝酸钾不饱和溶液中加入10 g硝酸钾固体6.保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是()7.20 ℃时,硝酸钾的溶解度为31.6 g,在此温度下,向50 g水中加入20 g硝酸钾后,所得溶液中溶质的质量分数为()A.40.0% B.30.0%C.28.6% D.24.0%8.电解水时,常在水中加入少量硫酸以增大水的导电性,若用9%的硫酸溶液50 g,通直流电进行电解水的实验,过一段时间后,硫酸的溶质质量分数变为10%,则被电解的水的质量为()A.3 g B.5 g C.7 g D.10 g9.现有一杯20 ℃时的硝酸钾饱和溶液,欲改变其溶质质量分数,下列方法可行的是()A.加入一定量的硝酸钾B.恒温蒸发部分水C.升温到60℃D.加入一定量的水10.如图为a、b、c三种不含结晶水的固体物质的溶解度曲线,下列叙述中正确的是()A.t1℃时,a、b、c饱和溶液的溶质质量分数为20%B.P点表示:t2℃时,a、b的溶液是饱和状态,c的溶液是不饱和状态C.t2℃时,a、b、c 三种物质溶液的溶质质量分数:a>b>cD.70 g a的饱和溶液从t2℃降温到t1℃时,析出晶体15 g11.X、Y、Z三种物质的溶解度曲线如图所示。
九年级下册化学人教版习题课件 第九单元 课题3 溶液的浓度 第1课时 溶质质量分数

9.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化 的图象不正确的是( D )
AHale Waihona Puke BCD10.如图所示关于过氧化氢溶液的说法中错误的是( A.500 g溶液中含溶质30 g B.500 mL溶液的质量为550 g C.500 mL溶液中溶质与溶剂的质量比为3∶7 D.取出 50 mL溶液,溶质质量分数仍为30%
知识点❷:溶质质量分数的计算 3.计算公式:
溶质质量分数=_____溶溶____液质____质质____量_量_____ ×100%=_溶__质__溶_质___质_量___质__+__量__溶____剂____质___量___ ×100%。
4.常温下,将15 g氯化钠加入到60 g水中,完全溶解后,溶液中氯化钠的质 量分数为( B ) A.15% B.20% C.25% D.33.3% 5.欲配制100 g 0.9%的NaCl溶液,需要NaCl的质量是( A ) A.0.9 g B.9 g C.99.1 g D.100 g
A)
11.20 ℃时,将20 g硝酸钾固体加入50 g水中,搅拌,充分溶解后,仍有4.2 g 硝酸钾固体未溶解。请填写下列空白: (1)所得溶液是20 ℃时硝酸钾的__饱__和_______(填“饱和”或“不饱和”)溶液。 (2)20 ℃时硝酸钾的溶解度为__3_1_._6_____g。 (3)所得溶液中硝酸钾的溶质质量分数为 __2_4_._0_%_____(精确到0.1%)。
6.配制溶质质量分数为5%的下列溶液,能达到目的的是( A ) A.称取5.0 g氯化钾,溶解在95 mL 水中,充分搅拌 B.称取5.0 g生石灰,放入95 mL水中充分搅拌 C.量取5.0 mL浓盐酸,倒入95 mL 水中,充分搅拌 D.称取5.0 g碳酸钙,放入95 mL水中,充分搅拌
人教版九下化学第九单元课题3溶液的浓度知识点梳理
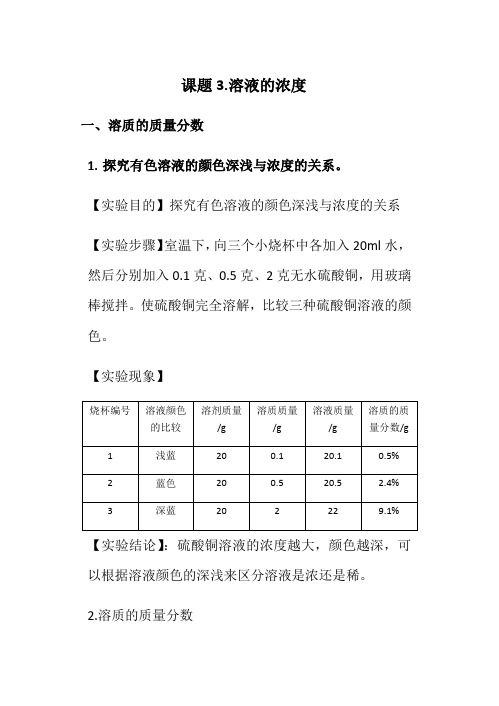
课题3.溶液的浓度一、溶质的质量分数1.探究有色溶液的颜色深浅与浓度的关系。
【实验目的】探究有色溶液的颜色深浅与浓度的关系【实验步骤】室温下,向三个小烧杯中各加入20ml水,然后分别加入0.1克、0.5克、2克无水硫酸铜,用玻璃棒搅拌。
使硫酸铜完全溶解,比较三种硫酸铜溶液的颜色。
【实验现象】【实验结论】:硫酸铜溶液的浓度越大,颜色越深,可以根据溶液颜色的深浅来区分溶液是浓还是稀。
2.溶质的质量分数(1)定义:溶质的质量分数就是溶质的质量与溶液质量之比(2)公式:=溶质质量溶质质量%100%100⨯+=⨯=溶剂质量溶质质量溶质质量溶液质量溶质质量溶质的质量分数可变形为:溶质的质量=溶液的质量×溶质的质量分数溶液的质量%100g 100⨯+=s s 分数饱和溶液中溶质的质量注意:①这里的溶质质量指的是溶解在溶液里的溶质质量不包括未溶解或者结晶析出的溶质的质量。
②代入公式计算的一定是质量,必要时用密度公式换算成质量③一定温度下饱和溶液的溶质的质量分数最大。
④除质量分数以外,人们有时也用体积分数来表示溶液的浓度。
例如:用做消毒剂的医用酒精中乙醇的溶质质量体积分数为75%,就是指100ml的医用酒精中含75ml 的乙醇。
3.溶解度与溶质质量分数的关系二、有关溶液的计算1.溶液的稀释(1)计算依据:稀释前后溶液中溶质的质量不变(2)稀释方法:加溶剂稀释或加稀溶液稀释(3)关系式:加水稀释:m浓×a%=(m 浓+m水)×b%稀加稀溶液稀释:m浓×a%浓+m稀×b%稀=(m浓+m稀)×c%(表示稀释后溶液中溶质的质量分数)2.溶液的增浓(1)增加溶质(注意:温度不变,向饱和溶液中增加溶质,溶质的质量分数不变)原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中溶质的质量,即:原溶液中溶质的质量+增加的溶=混合后溶液中溶质的质量溶液的质量=原溶液的质量+增加的溶质的质量即若:设原溶液的质量为Ag,溶液质量分数为a%,加溶质为Bg后,变成溶质质量分数为b%的溶液,即:Ag×a%+Bg=(Ag+Bg)×b%(2)蒸发溶剂(无晶体析出)根据溶液蒸发溶剂后,溶质的质量不变。
人教版九年级下册化学 第九单元 溶液 课题3 第1课时 溶液的溶质质量分数

(1) 10
90
100
(2) 20
80
100
(3) 50
100
150
(4) 40
10
50
溶质的质量分数 10%
20% 33.3% 80%
知识点 2:溶液的稀释
4.如果将 100 g 溶质质量分数为 20%的硝酸钾溶液稀释成溶质质量分数
为 10%的硝酸钾溶液,需加水的质量为
(C )
A.50 g
B.90 g
C.100 g
D.200 g
5.在 200 g 16%的 KNO3 溶液中加入 8 g KNO3,全部溶解后所得溶液的质 量为 22008 8g,其中 KNO3 的质量为 440 0g,溶剂的质量为 11668 8g,溶质的 质量分数为 1199..2%2%。
6.某食盐溶液中,溶质的质量分数为 20%,它表示 A.100 g 水中溶解 20 g 食盐 B.食盐溶液中食盐与水的质量比为 1∶5 C.100 mL 食盐溶液中含有 20 mL 食盐 D.每 100 g 溶液中含有 20 g 食盐
C.蒸发掉 50 g 水
D.加入 100 g 10%的 NaCl 溶液
11.现有一杯 20 ℃恰好饱和的硝酸钾溶液,欲改变其溶质质量分数。下
列方法可行的是
(D )
A.加入一定量的硝酸钾
B.恒温蒸发水分
C.升温到 60 ℃
D.加入一定量的水
12.20 ℃时 KCl 的溶解度是 34 g。取 65 g KCl 溶液放入甲烧杯中,按 如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( D ) A.甲烧杯中是 KCl 的饱和溶液 B.乙和丙烧杯中 KCl 的质量分数相等 C.丁烧杯中 KCl 的质量分数为 34% D.若乙烧杯中溶液恰好饱和,则 40 ℃时 KCl 的溶解度为 40 g
人教版九年级化学下册《第九单元 课题3 溶液的浓度 第1课时》同步练习题及参考答案

课题3溶液的浓度第1课时溶质的质量分数及其计算1.(2017成都中考)根据下表信息,相关说法正确的是()温度/℃溶解度/gNaCl KCl NH4Cl KNO32036.034.037.231.64036.640.045.863.96037.345.555.2110A.20℃时,NaCl的溶解度为36.0B.40℃时,KCl饱和溶液的溶质质量分数为40%C.40℃时,向100g水中加入50g NH4Cl充分溶解,溶液质量为145.8gD.从60℃降温到20℃,KNO3和KCl的饱和溶液析出晶体较多的是KNO32.在实验操作中如果不慎将少量浓硫酸沾到皮肤上,应立即用大量的水冲洗,然后涂上稀碳酸氢钠溶液。
配制200g质量分数为4%的碳酸氢钠溶液,需要碳酸氢钠的质量为()A.4gB.8gC.192gD.200g3.下列有关溶液的说法正确的是()A.将植物油与水混合,得到的是溶液B.配制溶液时,搅拌可以增大溶质的溶解度C.将10%的KNO3溶液倒出一半,剩余溶液中溶质的质量分数为20%D.将25g KCl溶液蒸干得到5g KCl固体,则原溶液中溶质的质量分数为20%4.经测定Na2SO4在不同温度时的溶解度数据如下表所示。
A、B、C、D四个选项中,能够表示随温度变化饱和溶液中溶质质量分数变化曲线的是()温度/℃406080100溶解度/g48.845.343.742.55.20℃时,对100g5%的食盐溶液作了如下处理,求所得溶液中溶质的质量分数(假设每次所得溶液中无溶质析出或剩余)。
(1)蒸发10g水后,溶质的质量分数为。
(2)加入10g食盐后,溶质的质量分数为。
(3)增加10g食盐和10g水后,溶质的质量分数为。
(4)加入100g15%的食盐溶液后,溶质的质量分数为。
6.在初中化学中,我们学习了溶液的有关知识。
下图是KNO3的溶解度曲线。
(1)从该溶解度曲线可以得到的信息是(写一条)。
(2)小明参照上图在20℃时进行了如下实验。
九年级化学下册 第九单元《溶液》课题3 溶液的浓度课时1 溶质质量分数概念及基本公式

下述方法正确的是( D )
A、称取0.5g 过氧乙酸溶于100g水中 B、称取0.15g 过氧乙酸溶于1000g水中 C、称取50g 过氧乙酸溶于950g水中 D、称取5g 过氧乙酸溶于995g水中
3、采用什么方法可以使200克10%的氯化 钠溶液变成30%的氯化钠溶液?
55克 495克
2、某工厂化验室配制5000克20%的盐 酸,需要38%的盐酸(密度为1.19克/毫 升)的体积是多少?
V = 2211.4 ml
课堂巩固练习
1、长沙卷:用浓盐酸配制一定质量分数的稀盐
酸,正确的操作步骤是( D )
A、计算、称量、溶解 B、称量、加水、溶解 C、溶解、计算、量取 D、计算、量取、溶解
物质质量
溶液的各物质
总和
质量
课堂练习4
某学生将6g镁条加入到70mL的稀硫酸 中,恰好完全反应,反应后所得溶液的 质量为 100g.试计算:(1)该反应共产 生氢气的质量 (2)该稀硫酸的质量分数 (3)反应后所得溶液中溶质的质量分 数。
0.5g, 25.9%, 30%
学案 课堂练习
1、配制500毫升质量分数为10%的氢氧 化钠溶液(密度为1.1克/毫升),需要 氢氧化钠和水的质量各是多少?
空气以及某些溶液的配制
学点一、溶质质量分数的概念
对有色的溶液,我们可以直接地观察溶 液的颜色,来判断溶液的浓或稀吗?
你会计算相关的物理量吗?
1、定义:
是溶质质量和溶液质量之比 。
2、公式: 某溶质质量分数=
某溶质质量
溶液质量
100%
= ——某—一—溶—质—质—量—х100% 全部溶质+溶剂
人教版九年级化学下册第九单元溶液课题3溶液的浓度习题新版

课题 3溶液的浓度第 1 课时溶质的质量分数1知识管理1.溶质的质量分数定义:溶液中溶质的质量分数是__溶质质量 __与 __溶液质量 __之比。
溶质质量溶质质量公式:溶质的质量分数=溶液质量×100%=溶质质量+溶剂质量×100%。
变形公式:溶质质量=__溶液质量×溶质的质量分数__。
溶质质量溶液质量= __溶质的质量分数__。
说明:溶质的质量分数是溶液浓度的定量表示,溶质质量分数越大的溶液浓度越大。
2.溶液的稀释依据:溶液稀释前后,__溶质 __质量不变。
注意:两种溶液混淆时,质量能够相加,但体积不可以相加。
2基础题考点 1 溶质质量分数1.对于“ 10%的食盐溶液”的含义,解说不正确的选项是(A)A. 100 g 水中溶解了10 g 食盐B.食盐溶液中溶质和溶剂的质量比是1∶ 9C.将 10 g 食盐溶解于90 g 水中获得的溶液D. 100 g 10% 的食盐溶液中溶有 10 g 食盐2.农业生产中往常用10%~ 15%的食盐溶液选种,现有配制好的15%的食盐水200 kg,此中含水 (B)A. 30 kg B. 170 kgC. 140 kg D. 200 kg3.必定温度下,某蔗糖溶液中溶质与溶液的质量比为2∶ 8,则 200 g 该溶液中含蔗糖的质量为 (B)A. 40 g B.50 gC. 160 g D . 150 g4.某温度时,将20 g KNO3溶解在 100 g水中恰巧饱和,对于该饱和溶液的表达正确的是 (D)A.m( 溶质 ) ∶m( 溶剂 ) = 20∶ 120B.溶质的质量分数为20%C.升温后,溶质的质量分数增大D.降温后,有固体析出考点 2溶液稀释的计算5.必定温度下,将溶液用水稀释,必定不发生变化的量是(B)A.溶液的质量 B .溶质的质量C.溶剂的质量 D .溶质的质量分数6.将 100 g 98% 的浓硫酸注入900 g 水中,所得稀硫酸中溶质的质量分数为(A) A. 9.8% B . 10.0%C. 10.9% D . 11.1%7.某溶液溶质的质量分数为 20%,加入 50 g 水后变成 10%,稀释后溶液中溶质的质量是(B)A. 50 g B C. 100 g D . 10 g . 40 g8.化学实验室现有质量分数为要把 50 g 上述浓硫酸稀释为质量分数为过程 )98%的浓硫酸,但在实验室中常需要用较稀的硫酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019-2019学年度人教版化学九年级下册课堂练习
班级姓名
第九单元溶液
课题3__溶液的浓度__
第1课时溶质的质量分数
1.向100 g 10% NaOH溶液中加入12.5 g NaOH固体,完全溶解后,所得溶液中溶质质量分数为( )
A.12.5% B.20.0%
C.22.5% D.25%
2.硫酸镁在工农业以及医疗上有广泛应用,其溶解度如下表所示,则下列说法正确的是( )
A.硫酸镁的溶解度随温度升高而增大
B.10 ℃时,27.7 g硫酸镁和72.3 g水可配制成质量分数为27.7%的硫酸镁溶液
C.50 ℃时,100 g硫酸镁饱和溶液中溶质和溶剂的质量比为49∶100
D.70 ℃时的硫酸镁饱和溶液升温至90 ℃,溶液的溶质质量分数增大
3.一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成溶
质质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水() A.1.5 mL B.2 mL
C.3 mL D.4 mL
4.农业生产上常需要用溶质质量分数为16%的氯化钠溶液选种,现配制100 kg这种溶液,需氯化钠____kg;将其中的50 g溶液稀释成溶质质量分数为8%的氯化钠溶液,需加水的质量为____g;20 ℃时,向50 g 水中加入20 g氯化钠,充分溶解后,得到溶液的质量为68 g,则20 ℃时,氯化钠的溶解度为____。
5.[2019·舟山]松材线虫病是危害松属植物的一种毁灭性流行病。
目前,防治松材线虫主要措施是给松树“注射”一种有效成分是苦参碱的免疫激活剂。
注药方法是在松树树干基部斜钻出一个小孔,在小孔上插入药剂瓶,依靠树体自身的输导功能将药液运输到树体各个部位,达到防治松材线虫病的目的。
已知每瓶药剂的质量是50 g,苦参碱的质量分数为0.3%。
欲利用质量分数30%的苦参碱原液,配制这样的免疫激活剂50 000瓶,需要原液的质量是多少?
6.取四份20 ℃时一定质量的饱和硝酸钾溶液,分别进行如下实验后,所得结论正确的是()
A.保持温度不变,蒸发10 g水后,溶液中溶质的质量分数增大B.保持温度不变,加入10 g硝酸钾后,溶液中溶质质量分数增大
C.保持温度不变,蒸发10 g水后,硝酸钾的溶解度增大
D.降温至10 ℃时,硝酸钾的溶解度减小
7.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图象不正确的是()
8.已知某物质在不同温度下的溶解度数据如下表所示:
如果要配制该物质溶质质量分数为20%的饱和溶液200 g,需要水____g,此时溶液的温度应为____℃。
9.如图是甲、乙两种固体物质的溶解度曲线图,请回答下列问题:
(1)20 ℃时,将15 g的甲物质充分溶解在50 g水中,所形成溶液的溶质质量分数是____。
(2)10 ℃时,欲将150 g乙物质的饱和溶液质量分数减小一半,需要加水____ g。
(3)某同学欲将20 ℃时300 g 20%的甲溶液溶质质量分数增大一倍,他采用恒温蒸发水的方法,并进行了如下计算:
试分析:他能否达到目的?并说明理由。
他不能达到目的;20 ℃时,20%的甲溶液为该温度下的饱和溶液,温度不变,溶解度不变,其饱和溶液中溶质质量分数不变。
10.双氧水(H2O2)是工业上重要的绿色氧化剂,又是常用的医用消毒剂。
(1)小明从试剂商店购得一瓶溶质质量分数为30%的双氧水,用于制取O2。
若配制溶质质量分数为5%的双氧水600 g,需溶质质量分数为30%的双氧水的质量为多少?
(2)为了操作方便,改称量液体的质量为量取液体体积。
若配制溶质质量分数为5%的双氧水600 g,应取溶质质量分数为30%的双氧水(密度为1.1 g/cm3 )与水的体积比为多少?
参考答案
1. B
2. C 【解析】根据表格中的数据可知,硫酸镁的溶解度一开始随温度升高而增大,等温度达到一定值时,随着温度的升高溶解度反而减小,A错误;10 ℃时,硫酸镁的溶解度为27.7 g,10 ℃时,72.3 g水中最多能溶解硫酸镁的质量小27.7 g,则形成的溶液的溶质质量分数小于27.7%,B错误;50 ℃时,硫酸镁的溶解度是49 g,则此时硫酸镁饱和溶液中溶质和溶剂的质量比为49∶100,C正确;据表可知:温度从70 ℃升高到90 ℃时,硫酸镁的溶解度减小,故70 ℃时的硫酸镁饱和溶液升温至90 ℃,有硫酸镁固体析出,溶液溶质质量分数减小,D错误。
3.B
4.16 50 36g
5.解:设需要原液的质量为x。
根据溶液稀释前后溶质的质量不变可得
x×30%=50 g×0.3%×50 000
x=25 000 g=25 kg
答:需要原液的质量是25 kg。
6.D
7.D【解析】将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,故A正确;将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,应该从零开始,故B正确;将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,故C正确;将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,溶剂的质量不变,溶质质量分数逐渐减小,故D错误。
8.160 60
9.(1)20%
(2)150
(3)解:设蒸发水的质量为x。
300 g×20%=(300 g-x)×40%
解得x=150 g
【解析】 (1)20℃时,甲的溶解度为25 g,即在20℃时,100 g 水中最多溶解25 g甲,溶液达到饱和状态;则20 ℃时将15 g的甲物质充分溶解在50 g水中,最多只能溶解12.5 g甲,形成的是饱和
溶液,所形成溶液的溶质质量分数是12.5 g
12.5 g+50 g×100%=20%。
(2)10 ℃时,乙的溶解度为15 g,其饱和溶液中溶质的质量分
数为15 g
15 g+100 g×100%≈13.0%;
设要加水的质量为x,根据溶液稀释前后溶质的质量不变,则150 g×13.0%=(150+x)×6.5%,解得x=150 。
(3)20 ℃时,20%的甲溶液为该温度下的饱和溶液;恒温蒸发水,温度不变,有晶体析出,所得溶液仍为该温度下的饱和溶液,其溶质的质量分数不变,故该同学不能达到目的。
10.解: (1)设需溶质质量分数为30%的双氧水的质量为x。
600 g ×5%=x×30%
x=100 g
(2)100 g 30%的双氧水的体积为100 g
1.1 g/cm3
,
需要水的体积为(600 g-100 g)÷1.0 g/cm3=500 cm3,故应取30%的双氧水与水的体积比为
100 g 1.1 g/cm3∶500 cm3=
1
5.5
=
10
55
=
2
11
=2∶11。
答:(1)需溶质质量分数为30%的双氧水的质量为100 g。
(2)双氧水与水的体积比为2∶11。
