2018年北京高考化学试题
2018年北京理综化学高考试题文档版(含答案).doc

绝密★启封并使用完毕前试题类型: 2018年普通高等学校招生全国统一考试理科综合能力测试(化学)(北京卷)注意事项:1.本试卷分第I卷(选择题)和第n卷(非选才i题)两部分.2.答题前,考生务必将自己的姓名、准考证号填写在本试题相应的位置^3.全部答案在答题卡上完成,答在本试题上无效^4.考试结束后,将本试题和答题卡一并交回.第一部分(选择题共120分)本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法7.下列中草药煎制步骤中,属于过滤操作的是A.冷水浸泡B.加热煎制C.算渣取液D.灌装保存8.下列食品添加剂中,其试用目的与反应速率有关的是A.抗氧化剂B.调味剂C.着色剂D.增稠剂9.在一定条件下,甲苯可生成二甲苯混合物和苯。
有关物质的沸点、熔点如下:下列说法不正确的是学.科.网A.该反应属于取代反应B.甲苯的沸点高于144 CC.用蒸储的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来10.K2C2O7溶液中存在平衡:Cr2O72-(橙色)+H2O- 2 CrO42-(黄色)+2H+。
用&52。
7溶液进行下列实验:结合实验,下列说法不正确的是A.①中溶液橙色加深,③中溶液变黄B.②中Cr2O72-被C2H50H还原学科.网C.对比②和④可知K2Cr2O7酸性溶液氧化性强D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色11.在两份相同的Ba(0H)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHS04溶液,其导电能力随滴入溶液体积变化的曲线如右图所示c 下列分析不正确.的是学.科.网A.①代表滴加H2 S04溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、0HC.c点,两溶液中含有相同量的0H「D.a、d两点对应的溶液均显中性12.用石墨电极完成下列电解实验现象a d处试纸变蓝;b处变红,局部褪色;两个石墨电极附近有气泡产c处无明显变化生;n处有气泡产生;下列对实验现象的解释或推测不合理..的是A、a、b 处:2H 2O 2e=H2 2OHB、b 处:2Cl 2e CI2…, 「一、一一_ 2C、c处发生了反应:Fe 2e FeD、根据实验一的原理,实验二中m处能析出铜第II卷25.(17 分)功能高分子P的合成路线如下:(1) A的分子式是C7 H8,其结构简式是。
2018年北京高考理综化学试题word版含答案

绝密★启封并使用完毕前2018年普通高等学校招生全国统一考试理科综合能力测试(北京卷)本试卷共16页,共300分.考试时长150分钟.考生务必将答案答在答题卡上,在试卷上作答无效.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16第一部分(选择题共120分)本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.下列我国科技成果所涉及物质的应用中,发生的不是..化学变化的是A.甲醇低温所制氢气用于新能源汽车B.氘、氚用作“人造太阳”核聚变燃料C.偏二甲肼用作发射“天宫二号"的火箭燃料D.开采可燃冰,将其作为能源使用7.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下.下列说法不正确...的是A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C―H键发生断裂C.①→②放出能量并形成了C―C键D.该催化剂可有效提高反应物的平衡转化率8.下列化学用语对事实的表述不正确...的是A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218OB.常温时,0。
1 mol·L-1氨水的pH=11。
1:NH3·H2O+4NH+OH−C.由Na和C1形成离子键的过程:D.电解精炼铜的阴极反应:Cu2+ +2e −Cu9.下列实验中的颜色变化,与氧化还原反应无关的是A B C D实验NaOH溶液滴入FeSO4溶液中石蕊溶液滴入氯水中Na2S溶液滴入AgCl浊液中热铜丝插入稀硝酸中现象产生白色沉淀,随后变为红褐色溶液变红,随后迅速褪色沉淀由白色逐渐变为黑色产生无色气体,随后变为红棕色10.一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。
其结构片段如下图下列关于该高分子的说法正确的是A.完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境B.完全水解产物的单个分子中,含有官能团―COOH或―NH2C.氢键对该高分子的性能没有影响D .结构简式为:11.测定0.1 mol·L -1 Na 2SO 3溶液先升温再降温过程中的pH,数据如下。
2018年北京高考化学试题与解释

2018年普通高等学校招生全国统一考试理科综合能力测试化学(北京卷)本试卷共16页,共300分。
考试时长150分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16第一部分(选择题)本部分共7小题,每小题6分,共42分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
1.下列我国科技成果所涉及物质的应用中,发生的不是..化学变化的是A.甲醇低温所制氢气用于新能源汽车B.氘、氚用作“人造太阳”核聚变燃料C.偏二甲肼用作发射“天宫二号”的火箭燃料D.开采可燃冰,将其作为能源使用A 不符题意;核聚变或核裂变过程中原子核发生了变化,与化学变化过程中分子发生改变而原子没有改变的含义不同,不属于化学变化的研究范畴,固选B;无论是什么,作为火箭的燃料是利用其燃烧时发生的化学变化过程中释放出巨大的能量从而产生巨大的反冲力实现发射的目的的;可燃冰是现代科学家发现的一种深藏于深海海底的甲烷与水形成的结晶物,其中的甲烷,具有可燃性,能够燃烧,是不可多得的新能源。
2.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下。
下列说法不正确...的是A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C―H键发生断裂C.①→②放出能量并形成了C―C键D.该催化剂可有效提高反应物的平衡转化率【答案与解释】D。
利用CH4和CO2反应制备CH3COOH的化学反应方程式为:CH4+CO2CH3COOH,原子百分百得到利用,A正确;从上述示意图中,CH4在选择性活化催化过程产生的游离基是基于甲烷中的一个C—H键的断裂形成的,B正确;从示意图中说明,①产物的能量比②产物的能量高,因此,由①→②是属于放热反应,并有C—C键形成,C正确;催化剂能够改变反应物的反应速率,但不能使化学平衡发生移动,即不能改变反应物转化率或生成物的产率,D观点错误,选D。
【高考】2018年北京市高考化学试卷
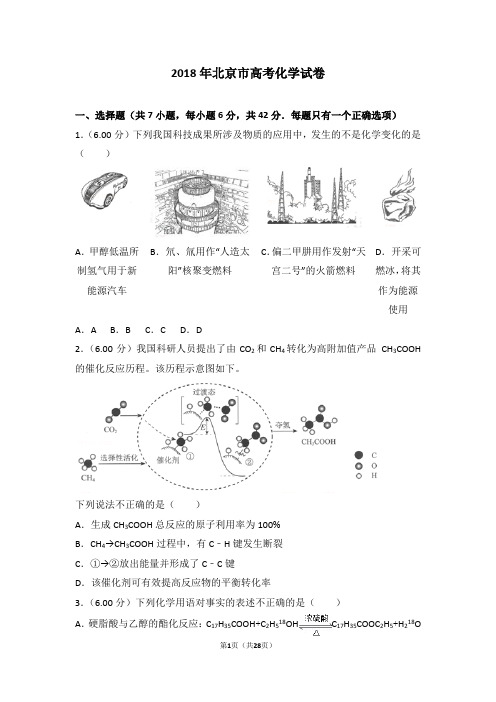
2018年北京市高考化学试卷一、选择题(共7小题,每小题6分,共42分.每题只有一个正确选项)1.(6.00分)下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是()A.甲醇低温所制氢气用于新能源汽车B.氘、氚用作“人造太阳”核聚变燃料C.偏二甲肼用作发射“天宫二号”的火箭燃料D.开采可燃冰,将其作为能源使用A.A B.B C.C D.D2.(6.00分)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH 的催化反应历程。
该历程示意图如下。
下列说法不正确的是()A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C﹣H键发生断裂C.①→②放出能量并形成了C﹣C键D.该催化剂可有效提高反应物的平衡转化率3.(6.00分)下列化学用语对事实的表述不正确的是()A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218OB.常温时,0.1mol•L﹣1氨水的pH=11.1:NH3•H2O⇌NH4++OH﹣C.由Na和Cl 形成离子键的过程:→D.电解精炼铜的阴极反应:Cu2++2e﹣═Cu4.(6.00分)下列实验中的颜色变化,与氧化还原反应无关的是()A B C D实验NaOH溶液滴入FeSO4溶液中石蕊溶液滴入氯水中Na2S溶液滴入AgC1浊液中热铜丝插入稀硝酸中现象产生白色沉淀,随后变为红褐色溶液变红,随后迅速褪色沉淀由白色逐渐变为黑色产生无色气体,随后变为红棕色A.A B.B C.C D.D5.(6.00分)一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料,其结构片段如下图。
下列关于该高分子的说法正确的是()A.完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境B.完全水解产物的单个分子中,含有官能团一COOH或一NH2C.氢键对该高分子的性能没有影响D .结构简式为:6.(6.00分)测定0.1mol•L﹣1 Na2SO3溶液先升温再降温过程中的pH,数据如下:时刻①②③④温度/℃25304025 pH9.669.529.379.25实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
2018年北京高考化学试题与解释

绝密★启封并使用完毕前2018年普通高等学校招生全国统一考试理科综合能力测试化学(北京卷)本试卷共16页,共300分。
考试时长150分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16第一部分(选择题)本部分共7小题,每小题6分,共42分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
1.下列我国科技成果所涉及物质的应用中,发生的不是..化学变化的是A.甲醇低温B.氘、氚用作“人造太C.偏二甲肼用作发射D.开采可燃A不符题意;核聚变或核裂变过程中原子核发生了变化,与化学变化过程中分子发生改变而原子没有改变的含义不同,不属于化学变化的研究范畴,固选B;无论是什么,作为火箭的燃料是利用其燃烧时发生的化学变化过程中释放出巨大的能量从而产生巨大的反冲力实现发射的目的的;可燃冰是现代科学家发现的一种深藏于深海海底的甲烷与水形成的结晶物,其中的甲烷,具有可燃性,能够燃烧,是不可多得的新能源。
2.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下。
下列说法不正确...的是 A .生成CH 3COOH 总反应的原子利用率为100% B .CH 4→CH 3COOH 过程中,有C―H 键发生断裂 C .①→②放出能量并形成了C―C 键 D .该催化剂可有效提高反应物的平衡转化率【答案与解释】D 。
利用CH 4和CO 2反应制备CH 3COOH 的化学反应方程式为:CH 4+CO 2CH 3COOH ,原子百分百得到利用,A 正确;从上述示意图中,CH 4在选择性活化催化过程产生的游离基是基于甲烷 中的一个C —H 键的断裂形成的,B 正确;从示意图中说明,①产物的能量比②产物的能量高,因此,由①→②是属于放热反应,并有C —C 键形成,C 正确;催化剂能够改变反应物的反应速率,但不能使化学平衡发生移动,即不能改变反应物转化率或生成物的产率,D 观点错误,选D 。
(完整版)2018年北京高考理综化学试题版含答案,推荐文档

绝密★启封并使用完毕前2018 年普通高等学校招生全国统一考试理科综合能力测试(北京卷)本试卷共16 页,共300 分。
考试时长150 分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16第一部分(选择题共120 分)本部分共20 小题,每小题6 分,共120 分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是7.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH 的催化反应历程。
该历程示意图如下。
下列说法不正确的是A. 生成 CH 3COOH 总反应的原子利用率为 100%B .CH 4→CH 3COOH 过程中,有 C―H 键发生断裂C .①→②放出能量并形成了C―C键D .该催化剂可有效提高反应物的平衡转化率8. 下列化学用语对事实的表述不正确的是A. 硬脂酸与乙醇的酯化反应:C 17H 35COOH+C 2H 518OHC 17H 35COOC 2H 5+H 218O NH+ B.常温时,0.1 mol·L -1 氨水的 pH=11.1:NH 3·H 2O 4+OH −C. 由 Na 和 C1 形成离子键的过程:D .电解精炼铜的阴极反应:Cu 2+ +2e − Cu9.下列实验中的颜色变化,与氧化还原反应无关的是10. 一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。
其结构片段如下图下列关于该高分子的说法正确的是A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境B .完全水解产物的单个分子中,含有官能团―COOH 或 ―NH 2C .氢键对该高分子的性能没有影响AB CD实验NaOH 溶液滴入FeSO 4 溶液中石蕊溶液滴入氯水中Na 2S 溶液滴入 AgCl 浊液中热铜丝插入稀硝酸中现象产生白色沉淀,随后变为红褐色 溶液变红,随后迅速褪色沉淀由白色逐渐变为黑色产生无色气体,随后变为红棕色3D. 结构简式为:11. 测定 0.1 mol·L -1 Na 2SO 3 溶液先升温再降温过程中的 pH ,数据如下。
2018年高考北京卷化学试题(含答案解析)

绝密★启封(qǐ fēnɡ)并使用完毕前2018年普通高等学校(gāoděngxuéxiào)招生全国统一考试理科综合能力(nénglì)测试化学(huàxué)(北京(běi jīnɡ)卷)本试卷共16页,共300分。
考试时长150分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16第一部分(选择题)1. 下列我国科技成果所涉及物质的应用中,发生的不是..化学变化的是()2. 我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下。
下列说法不正确...的是()A. 生成CH3COOH总反应的原子利用率为100%B. CH4→CH3COOH过程中,有C―H键发生断裂C. ①→②放出能量并形成了C―C键D. 该催化剂可有效提高反应物的平衡转化率3. 下列化学用语对事实的表述不正确...的是()A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218OB. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O+OH−C. 由Na和C1形成离子键的过程:D. 电解精炼铜的阴极(yīnjí)反应:Cu2+ +2e −Cu4. 下列实验中的颜色(yánsè)变化,与氧化还原反应(fǎnyìng)无关的是()A B C D实验NaOH溶液滴入FeSO4溶液中石蕊溶液滴入氯水中Na2S溶液滴入AgCl浊液中热铜丝插入稀硝酸中现象产生白色沉淀,随后变为红褐色溶液变红,随后迅速褪色沉淀由白色逐渐变为黑色产生无色气体,随后变为红棕色5. 一种芳纶纤维的拉伸(lā shēn)强度比钢丝还高,广泛用作防护材料。
2018年北京理综化学高考试题及答案

2018年普通高等学校招生全国统一考试(北京卷)理综化学试题6.下列我国科技成果所涉及物质的应用中,发生的不是..化学变化的是7.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下。
下列说法不正确...的是A.生成CH3COOH总反应的原子利用率为100% B.CH4→CH3COOH过程中,有C-H键发生断裂C.①→②放出能量并形成了C-C键D.该催化剂可有效提高反应物的平衡转化率8.下列化学用语对事实的表述不正确...的是A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218ONH+OH−B.常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O+4C.由Na和C1形成离子键的过程:D.电解精炼铜的阴极反应:Cu2+ +2e−Cu9.下列实验中的颜色变化,与氧化还原反应无关的是10.一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。
其结构片段如下图下列关于该高分子的说法正确的是A .完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境B .完全水解产物的单个分子中,含有官能团―COOH 或―NH 2C .氢键对该高分子的性能没有影响D .结构简式为:11.测定0.1 mol·L -1 Na 2SO 3溶液先升温再降温过程中的pH ,数据如下。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl 2溶液做对比实验,④产生白色沉淀多。
下列说法不正确...的是 A .Na 2SO 3溶液中存在水解平衡:23SO -+H 2O3HSO -+OH − B .④的pH 与①不同,是由于23SO -浓度减小造成的C .①→③的过程中,温度和浓度对水解平衡移动方向的影响一致D .①与④的K w 值相等12.验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl 溶液)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018年普通高等学校招生全国统一考试(北京卷)理科综合能力测试可能用到的相对原子质量:H 1 C 12 N 14 O 166•下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是7.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下。
• CO oo H F列说法不正确的是A .生成CH3COOH总反应的原子利用率为100%B. CH4T CH3COOH过程中,有C—H键发生断裂C. ①T②放出能量并形成了C —C键A •甲醇低温所制氢气用于新能源汽车B •氘、氚用作人造太阳核聚变燃料C.偏二甲肼用作发射天宫二号”的火箭燃料D.开采可燃冰,将其作为能源使用遊择性活化\CH.C0OHD .该催化剂可有效提高反应物的平衡转化率&下列化学用语对事实的表述不正确..的是A .硬脂酸与乙醇的酯化反应:C17H35COOH+C 2H518OH..一:一二C17H35COOC2H5+H 2180B. 常温时,0.1 mol L-1氨水的pH=11.1 : NH3 NH ;+OH-C. 由Na和C1形成离子键的过程:― Na4[:ClTD .电解精炼铜的阴极反应:Cu2+ +2e-Cu9•下列实验中的颜色变化,与氧化还原反应无关的是A B C D实验NaOH溶液滴入石蕊溶液滴入氯Na2S溶液滴入热铜丝插入稀硝FeSO;溶液中水中AgCI浊液中酸中现象产生白色沉淀,溶液变红,随后沉淀由白色逐渐产生无色气体,随后变为红褐色迅速褪色变为黑色随后变为红棕色10. 一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。
其结构片段如下图下列关于该高分子的说法正确的是A .完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境B •完全水解产物的单个分子中,含有官能团一COOH或一NH2C.氢键对该高分子的性能没有影响D .结构简式为:11-123实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
F列说法不正确的是2 ■A • Na2SO3溶液中存在水解平衡:SO3 +H2O HSO3+OH-B•④的pH与①不同,是由于SO:浓度减小造成的C.①T③的过程中,温度和浓度对水解平衡移动方向的影响一致D .①与④的K w值相等12.验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
A .对比②③,可以判定Zn保护了FeB .对比①②,K3[Fe(CN)6]可能将Fe氧化C.验证Zn保护Fe时不能用①的方法D .将Zn换成Cu,用①的方法可判断Fe比Cu活泼25. (17分)8-羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。
F 图是8-羟基喹啉的合成路线。
0H8耗某咋唏ii. 同一个碳原子上连有 2个羟基的分子不稳定。
(1) __________________________________ 按官能团分类,A 的类别是 。
(2) A ^B 的化学方程式是 ________________________(3) ____________________________ C 可能的结构简式是 。
(4) _____________________________ dD 所需的试剂a 是 。
(5) _____________________________ D IE 的化学方程式是 。
(6) ____________________________ F I G 的反应类型是 。
(7) 将下列K IL 的流程图补充完整:(8) _____________________________________ 合成8-羟基喹啉时,L 发生了 (填氧化”或还原”反应,反应时还生成了水,则L 与G 物质的量之比为 ____________。
已知:i.26. ( 13分)磷精矿湿法制备磷酸的一种工艺流程如下:已知:磷精矿主要成分为 Ca 5(PO 4)3(OH ),还含有Ca 5(PO 4)3F 和有机碳等。
溶解度:Ca 5(PO 4)3(OH )<CaSO 4 0.5H 2O (1) 上述流程中能加快反应速率的措施有 ____________ 。
(2) 磷精矿粉酸浸时发生反应:△2Ca 5(PO 4)3(OH )+3H 2O+10H 2SO 4^ 10CaSO 4 0.5H 2O+6H 3PO 4① 该反应体现出酸性关系: H 3PO 4 _______________ H 2SO 4 (填“〉或“<)”。
② 结合元素周期律解释①中结论: P 和 S 电子层数相同, _________ 。
(3) 酸浸时,磷精矿中Ca 5(PO 4)3F 所含氟转化为HF ,并进一步转化为SiF 4除去。
写出生成HF 的化学方程式: ___________ 。
(4) 出02将粗磷酸中的有机碳氧化为 CO 2脱除,同时自身也会发生分解。
相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。
80C 后脱除率变化的原因:20 fiO fit) IflO温度比(5) 脱硫时,CaCO 3稍过量,充分反应后仍有SO 42-残留,原因是 ___________ ;加入BaCO 3可进一步提高硫的脱除率,其离子方程式是 _________________________ 。
(6) 取a g 所得精制磷酸,加适量水稀释, 以百里香酚酞作指示剂, 用b mol L -1NaOH溶液滴定至终点时生成 Na 2HPO 4,消耗NaOH 溶液c mL ,精制磷酸中 H 3PO 4的H?SOd/\磷精矿 T 瞬精矿粉 -------------研磨 酸侵 ,網制璘酸酸侵L_>磷石音【主要成分为OSOj ” D.5H ;O )CaCOi/A质量分数是________ 。
(已知:H3PO4摩尔质量为98 g mol-1)27. (12分)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。
过 程如下:(1) ______________________ 反应 I : 2H 2SO 4(I) 2SO 2(g)+2H 2O(g)+O 2(g) A H i =+551 kJ moL反应 川:S(s)+O 2(g) -------- SO 2(g) A H 3= — 297 kJ mol 1 反应n 的热化学方程式: __________________ 。
(2) 对反应n ,在某一投料比时,两种压强下,H 2SO 4在平衡体系中物质的量分数随温度的变化关系如图所示。
P 2 ________ P 1 (填’•”或2”,得出该结论的理由是(3) I 「可以作为水溶液中SO 2歧化反应的催化剂,可能的催 化过程如下。
将ii 补充完整。
i . SO 2+4「+4H + ----- S J +0+2H 2Oii . I 2+2H 2O+ _______ ______________ + ______ +2 I(4) 探究i 、ii 反应速率与SO 2歧化反应速率的关系,实验如下:分别将 18 mL SO 2饱和溶液加入到2 mL 下列试剂中,密闭放置观察现象。
(已知:12易溶解在KI 溶液 中) 序号 ABCD试剂组成0.4 mol L — 1 KIa mol • 1 KI 0.2 mol L — 1 0.2 mol L — 1 KI0.2 mol L — 1H 2SO 40.0002 mol I 2H 2SO 4实验现象溶液变黄,一段 溶液变黄,出现无明显现象 溶液由棕褐色很时间后出现浑浑浊较A 快快褪色,变成黄浊色,出现浑浊较A 快罪G軒S去异超」①B是A的对比实验,贝U a= _________ 。
②比较A、B、C,可得出的结论是 __________________________③实验表明,S02的歧化反应速率 D > A,结合i、ii反应速率解释原因:28. (16分)实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生。
2,在碱性溶液中较稳定。
(〔)制备K2FeO4 (夹持装置略)①A为氯气发生装置。
A中反应方程式是____________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液。
C中C12发生的反应有3Cl2+2Fe(OH)3+1OKOH ^=2K2FeO4+6KCI+8H 2O,另外还有___________________ 。
(2)探究K2FeO4的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有CI2。
为证明是否K2FeO4氧化了C「而产生CI2,设计以下方案:I .由方案I中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定是K2FeO4将CI氧化,还可能由____________________ 产生(用方程式表示)。
n .方案n可证明K2FeO4氧化了CI「。
用KOH溶液洗涤的目的是② ____________________________________________ 根据K2FeO4的制备实验得出:氧化性CI2 ________________________________________________________ FeO4 (填>''或2”,而方案n实验表明,CI2和FeO2的氧化性强弱关系相反,原因是_____________________ 。
③资料表明,酸性溶液中的氧化性FeO2 > MnO 4,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42> MnO 4。
若能,请说明理由;若不能,进一步设计实验方案。
理由2018年普通高等学校招牛全国统一考试理科综合参考答案(北京卷)6. B7. D8. A9. C 10. B11. C12. D25. (17 分)(1) 烯烃F曰Fomin(2) CH2=CHCH3+Cl2 ------------------- CH2=CHCH 2CI+HCI(4) NaOH , H2O^H2SO4(5) ------------------------------------------------------ HOCH2CH(OH)CH 2OH * CH2=CHCHO+2H 2O26. (13 分)(1) 研磨、加热(2) ① v②核电荷数P v S,原子半径P>S,得电子能力P v S,非金属性P v S(3) -------------------------------------------------- 2Ca5(PO4)3F+10H2SO4+5H2O10CaSO40.5H2O+6H 3PO4+2HF T(4) 80 C后,H2O2分解速率大,浓度显著降低(5) CaSO4微溶 -------------- B aCO3+SO:+2H3PO4BaSO4+CO2 f +HO+2 H2PO4(3) HOCH2CHCICH 2CI CICH2CH(0H)CH 2CI1a27. (12分)(1)3SO2(g)+2H 20 (g)^=2H2SO4 (l)+S(s) 少2=- 254 kJ mol-1(2)>反应n是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,H2SO4的物质的量增大,体系总物质的量减小,H2SO4的物质的量分数增大(3)SO2 SO42- 4H +(4 [① 0.4②I-是SO2歧化反应的催化剂,H +单独存在时不具有催化作用,但H+可以加快歧化反应速率③反应ii比i快;D中由反应ii产生的H+使反应i加快28. (16分)(1 )©2KMnO 4+16HCI^=2MnCI 2+2KCI +5Cl 2? +8HO③ CI2+2OH -^=CI- +ClO-+H2O(2)® i. Fe3+ 4FeO42-+20H+4Fe3++3O2? +10HOii.排除CIO -的干扰②> 溶液的酸碱性不同③理由:FeO42-在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是Mn04-的颜色方案:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色(6)0.049bc。
