含氟苯甲酰基硫脲衍生物的合成、阴离子识别性能及植物生长调节活性研究
硫脲衍生物的合成和生物活性研究

第3 4卷 第 7期 20 06年 7月
化
学
工
程
Vo . 4 No 7 13 .
C HEMI AL E C NGI EE NG( HI A) N RI C N
J1 2o u. o 6
硫 脲 衍 生物 的合 成 和生 物 活 性 研 究
s nhe i e t o r a c m p u d . y t ss n w hiu e o o n s
Ke r s:s n h ss;t i u e e v tv s;f n ii e;t xc t c in y wo d y t e i h o r a d r aie i u g cd o ii a t y o
t . T i tu t r s we e c n ime y I . H i me hersr c u e r o fr d b R NM R n l me tla ay i. Th i lgc la tv t e t ho a d ee n a n lss e b o o ia ci i t ss s w y
H N 确认 ,并测 定了其 中5种植物病菌 的室 内毒 力作用 ,结 果表 明 : 部分化 合物 具有 良好 的抑 菌和杀 菌 活 MR 大
性 。这些参数为新 的硫脲类 化合物的合成和筛选提供 了依据 。 关键词 :合成 ; 硫脲衍生物 ; 杀菌剂 ;毒力作用
中 图 分 类 号 :Q4 5 4 T 5 . 1 文献标识码 : A 文 章 编 号 :0 59 5 (0 6 0 -040 10 - 4 20 )70 5 - 9 4
孙 晓红 ,刘 源发 ,王 慧芳
(西 北 大 学 1 学 研 究 所 ;2 .化 .化 学 系 ,陕 西 西 安 70 6 ) 10 9
N-(3-氟苯甲酰基)-N’-芳基硫脲衍生物的合成及其生物活性

S n h ssa d Bil gc lAciiy y t ei n oo ia tv t
o u r e z y i u e sDe i a i e fFl o b n o lTh o r a rv tv s
H h n—i, Q NJ gdn , H ig WE a—a U C agqu I i —og n U Bn , I i o T b
有鉴于此 , 为研究 硫脲 及其衍 生物 的合 作 成 、 生物活性 晶体结构 引、 。及配位性能 等
工作的一部分 , 我们将超声辐射与相转移催化技
术联用 , P G40为相转移催化剂 , 以 E- 0 通过 3氟 一 苯甲酰氯与硫氰酸铵反应制得 3氟苯 甲酰基异 一
硫氰酸酯( ) 2与芳胺 (a 3 ) 2; 3 一 k 反应 , 高产率地 合成 了 1 种未见文献报道 的 3氟苯 甲酰基硫脲 1 一 衍生物(a l , ce e1 。初步生物活性实验 1 — k Shm )
t n e ce i rmai mi e i i .2 r a td w t a o t a n mme itl o gv e c re p n i g e e e o e u r e z y o h c d ae y t ie t o r s o d n lv n n v lf o b n o l h l
21 0 0年第 1 卷 8 第 1 , 4~ 7 期 4 4
合 成 化 学
C ie eJ un lo y tei e sr hn s o ra fS nht Ch mi y c t
V 11 o . 8,2 1 00
N . 4 o 1. 4—4 7
・
研究 论 文 ・
Ⅳ(. .3氟苯 甲酰基 )Ⅳ . . 芳基硫脲衍生物的合成及其生物活性
硝基苯酰基硫脲衍生物的合成与生物活性研究
一
南 阳 4 36 ; 70 1
南阳 436 ) 7 0 1
zI N 一 —
一 。
物生长 和抗 肿瘤 等作 用 。 为 了寻 找新 的活性 物 质 和先导 化合 物 , 文采 用 活 性基 团拼 接法 , 杀 菌 本 将
硝 基 苯 酰 基 硫 脲 衍 生 物 的 合 成 与 生 物 活 性 研 究
● Βιβλιοθήκη 柳 文敏 H , 宏 伟 惠 丰立 周 桂 平 王 倩 王 , , ,
( . 阳师 范学 院化 学 与制 药工 程学 院 , 1南 河南
2 南 阳师范学 院生 物与 生命科 学学 院 , . 河南
关键词 : 酰氨基硫脲 ; 芳基酰肼 ; 萘乙酸 ; ・ 合成 ; 生物活性
第2 2卷第 3 期 21 0 0年 3月
化 学 研 究 与 应 用
Ch mi a s a c n p ia in e cl Re e r h a d Ap l t c o
V0 . 2. . I 2 No 3 M a- 2 0 l ., 01
文 章编 号 :0 41 5 ( 0 0 0 -3 3 4 1 0 —6 6 2 1 ) 30 4 - 0
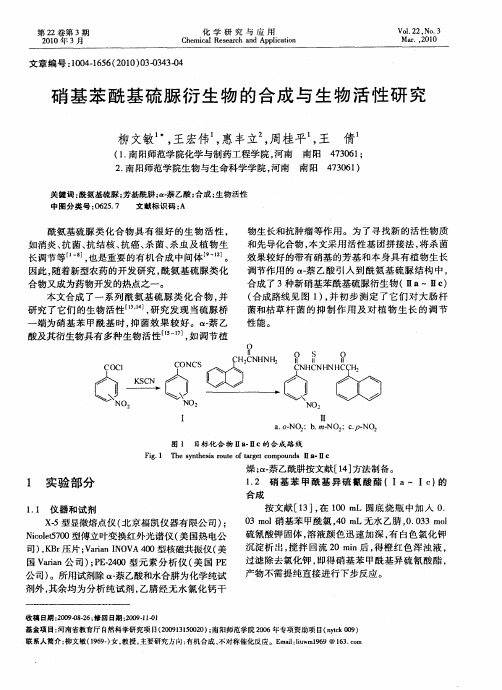
NO,
I
l I a oN :b m- . - O1 . NO, . N02 :CP-
图 1 目标 化 合 物 ia 1c的 合 成 路 线 i. I
F g 1 T e s nh ssr u e o r e o o n s I ・ I i . h y t e i o t f a g tc mp u d 1 8 I c t
化 学 研 究 与 应 用 13 目标 化合 物 ( I —IC 的合成 . Ia I )
《合成化学》2010年(第18卷)总目次

2羟基。. 一 1萘甲醛缩 Ⅳ 氨基 - 苯 甲酰基硫脲 的合成 及其阴离子识别性能 …………… 樊润梅 . Ⅳ-
水溶性双 甲基化大豆苷元磺 酸钴 的合成及其 晶体结构 ……………………… ……… 王秋亚
铜(Ⅱ)一 牛磺酸缩 2 吡啶 甲醛席夫碱 一3 5二羟基苯 甲酸三元配合物 的合成 及其晶体结构 . ,-
合 成 化 学 C ieeJunl f yte cC e s y h s ora o nh t hmir n S i t
一 7 1一 7
《 成化 学》 2 1 ( 1 合 0 0年 第 8卷 )
总 目 次
第1 期
有机小分 子催化不对称 H n 反应 的研究 进展 …………………… 付记亚 er y
二烯丙基 乙胺的合成 … ……………… …………………………… 刘立华
伟 田莉莉 ( 一1 ) I 0 伟 李 杉杉( 1 ) 1— 6
俊 刘 清泉( —2 ) 1 7 云 张 尊 听 ( —3 ) 1 1
… …… …… …………… 丁佩佩
葛凤燕 蔡 再生 ( 3 1—1 ) 丁 国华 张 晓松 ( —2 ) 1 3
纪晨旭 ( 9 ) 1— 9 李爱桃 ( —1 1 1 0) 刘 瑛 ( —14 1 0)
3碘_. . 5甲基. ,- 1 5苯并硫氮杂革- (H)酮 的合成 ………………… 陶李 明 45 -
2 乙氧羰基-- . 3 甲基4,- 5四亚 甲基 吡咯的合成 ……………………… …… …………… 徐海 云 ( )2氨基. ,. s .. 1 1二苯基 一一 1丙醇 的合成 ……………… … 彭化南 余泗莲 余 斌 周安西 杨艳艳
秦敬东
拓宏桂
胡
冰
魏太保 ( — 4 1 4)
含氟苯甲酰基硫脲衍生物的合成及生物活性研究

含 氟苯 甲酰基 硫脲 衍 生 物 的合 成及 生物 活 性研 究
胡 昌秋 , 秦 敬 东 ,胡 冰 ,魏 太 保
( 西北 师 范 大 学 化 学 化 工 学 院 ,甘 肃 省 高 分 子 材 料重 点 实 验 室 ,甘 肃 州 7 0 7 ) 3 0 0
摘
要 :以 P 4 0为催 化 剂 ,将 超 声 波 辐 射 与 相 转 移 催 化 技 术 联 用 ,通 过 含 氟 苯 甲酰 氯 与硫 氰 酸 铵 反 应 合 成 了 中 E 。
p omo i fe to s 2, fu b n oy t i r a e y1 g yc la em u h b te ha na t o e s r tng e f c fbi( 2 一l or e z lh ou e ph n ) l o r c e t r t n mo —hi ur a . Ke r s: fu b n o lt o r a rv tv s; ulr s i p s r n f rc t l ss; bil gy c la tv t y wo d l or e z y hi u e sde ia i e ta on c; ha e t a s e a a y i o o ia c i iy
间体 含 氟 苯 甲酰 基 异 硫 氰 酸 酯 , 它分 别 与 芳胺 和 2 2_ ,. 二氨 基 乙二 醇 二 苯 醚 反 应 , 高产 率 获 得 1 2种 相 应 含 氟 苯 甲酰 基
硫 脲衍 生物 . 初 步 生 物 活性 实验 表 明 , 目标 化 合 物 对 油 莱 和 小 麦 的 生长 均 具 有 显 著 的促 进 作 用 ,且 双硫 脲 衍 生 物 对植 物 生 长 的促 进 作 用优 于 单硫 脲 衍 生物 .
硫脲类化合物研究概述

2)应 用 于 医 药领 域 。硫 脲 类 化合 物 在 医 药 领 域也 表 现 出广 泛 的 生 物 活 性 ,如抗 结核 、抗 肿瘤 、抗
第3 期
翟智卫 硫 脲类 化合物研 究概述
必 要对 硫 脲 类化 合 物 以往 的研 究 状 况做 概 括介 绍 , 以方便 以后 的研 究 工 作者 快 速 了解 其 发展 进程 。下 面 就 从几 个方 面来 概述 硫脲 类 化合 物 的发 展情 况 。
1 硫脲类化合物 的分 类
之 所 以称 为硫 脲 类 化 合物 是 因为 其具 有硫 脲 的基 本结 构( 图1 示 1 如 所 。根 据 与其 基 本 结构相 连 基 团 的 不 同 ,可 以将硫 脲 类 化合 物 分 为 :硫脲 、酰基 硫脲 、氨基 硫脲 、缩 氨 基 硫脲 等 4 。其 中,硫 脲 、酰基 硫 类
第2 卷 第3 1 期 2I年9 0 1 月
洛阳理工学院学报( 然科学版) 自
J u n l f u y n n t u e f S in e n e h o0 y Na u a S in e d t n o r a o o a gI si t c c d T c n 1g ( t r I ce c i o ) L t o e a E i
催化 、橡 胶 防老 化 等领 域 。
1)应 用于农 药领 域 。硫 脲 类化 合 物 具有广 泛 的 生物活 性 ,如 杀 虫 、除草 、 杀菌 、植 物 生长 调节 等 , 从2 世纪6 年代 以来就 受到 了人 们 的高度 关注 。硫脲 类化 合物 托布 津和 甲基托 布津 早 在2 世 纪6 年代就 已 O 0 0 0
硫脲类化合物合成方法研究进展

2010年第30卷有机化学V ol. 30, 2010第2期, 173~180 Chinese Journal of Organic Chemistry No. 2, 173~180* E-mail: mjzhangtju@Received February 16, 2009; revised May 10, 2009; accepted July 7, 2009.国家自然科学基金(No. 20802049)资助项目.174有机化学V ol. 30, 2010硫代光气与伯胺缩合制备关键活性中间体异硫氰酸酯后再与胺迅速发生加成反应, 生成相应的硫脲类化合物, 如果是与仲胺反应得到的稳定中间体不是异硫氰酸酯而是二取代氨基硫代甲酰氯, 然后与胺类化合物发生取代反应, 得到目标产物. 例如: 2001年Dalluhn研究组[26]以硫代光气和二甲胺为原料在催化剂三乙胺存在下获得稳定中间体二甲氨基硫代甲酰氯(1), 然后用溶于碱性溶液中的双芳磺酰胺2作为亲核试剂与1发生亲核取代反应, 高收率地得到磺酰仲氮负离子取代Cl的产物双芳磺酰硫脲3 (Scheme 1).Scheme 1但硫代光气是一种剧毒的挥发性液体, 其生产、贮运和使用都不安全、不方便, 且反应中放出HCl气体, 对环境的危害较大. 因此, 一系列使用非硫代光气合成中间体异硫氰酸酯的绿色方法成为人们研究的重点, 其中主要包括从苯环上连接各种强吸电子基的芳(磺酰)伯胺制备相应的异硫氰酸酯的方法[27].非硫代光气法对于从芳(磺酰)胺制备芳(磺酰)异硫氰酸酯已很普遍, 但对于从杯芳胺合成杯芳异硫氰酸酯却未见文献报道. 所以, 尽管硫代光气有巨毒, 基于它极强的反应活性, 仍用于中间体杯芳异硫氰酸酯 4 (Scheme 2)的制备, 4再与胺类化合物发生加成反应获得杯芳硫脲5[28]. .2 以异硫氰酸酯和胺为原料的合成Neville等[29]以四异硫氰酸硅酯和胺为原料首次合成N-单-和N,N-二取代硫脲, 产率高达97%~100%. Neville法是用四氯化硅与硫氰酸铵制备四异硫氰酸硅酯, 再和胺作用后水解, 反应底物适用面宽, 产率高, 避免了硫代光气的使用, 该反应不足之处是使用的溶剂种类较多, 且四异硫氰酸硅酯毒性较大也不易制备.与四异硫氰酸硅酯相比, 异硫氰酸烷基或芳基酯与胺的反应活性以及由它们制备的产品用途远远超过毒性, 所以通过它们合成具有特殊用途且其它反应不易合成的硫脲类化合物, 具有一定的实践意义. 例如: 1994Scheme 2年, Scheerder研究组[30]用异硫氰酸苯酯与四氨基杯芳烃在氯仿溶剂中于室温条件下缩合, 合成可以选择性络合氯离子的中性配位体6 (Eq. 1). 2002年, 杨发福等[31]用过量异硫氰酸苯酯与1,3-二氨基杯[4]-四丁醚于室温条件无溶剂直接缩合, 生成可以选择性络合24H PO-离子的杯[4]-双硫脲.运用异硫氰酸酯法除了制备杯芳硫脲之外, 还可制备芳磺酰硫脲[32]及环硫脲(1-芳磺酰四氢咪唑-2-硫酮). 例如: 最近, Faidallah小组[33]用对取代吡唑苯磺酰胺与异硫氰酸酯为原料在无水碳酸钾存在下于丙酮中回流, 合成了具有降血糖等生物活性的磺酰硫脲类化合物, 关于磺酰环硫脲合成方法研究始于1980年, McFarland 等[34]用对甲苯磺酰异硫氰酸酯与氨基乙醇为底物, 以浓硫酸为催化剂在甲醇中发生分子内关环反应合成芳磺酰环硫脲结构. 之后, 很少有文献用其它反应报道此类结构. 直至2007年, Cutting研究组[35]用磺酰亚胺7与异硫氰酸酯取代的杂环酰亚胺8在手性配体催化下发生No. 2丁从文等:硫脲类化合物合成方法研究进展175对映选择性Mannich 反应合成了手性芳磺酰环硫脲9 (Eq. 2).以异硫氰酸酯和胺为起始原料合成硫脲类化合物的反应普遍在有毒且有挥发性的有机溶剂中进行, 很少于绿色溶剂里发生. 2007年, Xiao 研究组[36]将肉桂酰异硫氰酸酯、取代苯胺与离子液体四氟硼酸1-丁基-3-甲基咪唑盐([Bmim][BF 4])于室温下混合搅拌可合成一系列肉桂酰基硫脲, 产率高达98.3% (Eq. 3). 该方法的优点在于反应时间短(2~12 min), 易于操作, 后处理简单, 环境友好, 离子液体经简单处理后可循环使用至少九次.由于异氰酸酯不稳定, 不便于储存, 而且异硫氰酸酯的制备大都需要较长的反应时间, 生产也极不安全, 因此, 探索快速高效以及环境友好的合成方法具有一定的理论意义和实践价值.3 以硫氰酸盐、酰氯和胺为原料的合成以硫氰酸盐、酰氯和胺为原料可以在原位生成异硫氰酸酯, 不需分离直接和胺反应, 克服了传统的用过量光气与伯胺反应, 将过量的光气除去后得到异硫腈酸酯, 再与另一种伯胺反应合成不对称硫脲, 同时, 由于异硫腈酸酯有毒且相对较活泼, 该方法能够将两步反应连续进行.3.1 三组分直接回流的合成Sridevi 等[37]首次用硫氰酸铵、芳基甲酰氯与2-胺 基-苯并咪唑在无水丙酮中直接回流制备N -苯甲酰基- N I -(苯并咪唑-2-基)硫脲, 同时获得有价值的副产品N -(苯并咪唑-2-基)苯甲酰胺, 从而为绿色化学开辟了一条绿色通道. 2007年, 史达清研究组[38]用硫氰酸钾、取代苯甲酰氯与对硝基苯胺在无水丙酮中回流, 首次合成阴离子受体芳酰基硫脲. 此类方法存在的弊端在于, 回流时间长, 使用无水溶剂, 产率也不高.3.2 相转移催化剂参与下的合成Reeves 等[39]用硫氰酸钾水溶液与酰氯的苯溶液在室温下搅拌, 以四丁基溴化铵(TBAB)为相转移催化剂, 采用液-液相转移催化法, 制备酰基异硫氰酸酯后再与苯胺加热首次合成了N -酰基-N'-苯基-硫脲(Scheme 3).该反应缩短了反应时间, 产率高达82%, 底物酰氯适用面较宽, 但Reeves 法经过了异硫氰酸酯的分离纯化步骤, 并且使用的硫氰酸盐大大过量, 造成了原料不必要的浪费.Scheme 3采用操作更为简便的固-液相转移催化法, 以廉价无毒、来源丰富、稳定性高的聚乙烯醇-400 (PEG-400)为相转移催化剂, 进行固-液相转移催化法合成, 也是近年来研究较多的绿色合成方法之一[40]. 例如1992年,魏太保等[41]以5-芳基-2-呋喃甲酰氯与硫氰酸铵反应, 即得相应的酰基异硫氰酸酯, 可以不经分离直接与芳胺加成, 生成了5-芳基-2-呋喃甲酰基硫脲(Eq. 4). 2001年, Li 研究组[42]以5-(4-氯苯基)-2-呋喃甲酰氯、硫氰酸铵和芳基甲酰肼为原料, 在PEG-400催化下, 于室温条件下合成了1-芳基甲酰基-5-(4-氯苯基)-2-呋喃甲酰基-氨基硫脲.3.3 微波与相转移催化剂参与下的合成微波作为一种高频电磁波, 它能促进许多化学反应的进行, 具有反应速度快、效率高、节约能源、实现原子经济性合成和生态友好绿色合成等优点[43], 有不少文献已将微波应用于硫脲衍生物的合成中. 例如2003年, 李正等[44]利用微波辐射(MWI)技术快速高产率地合成含苯并呋喃甲酰基的氨基硫脲(Scheme 4), 该方法涉及到苯并呋喃甲酰氯、硫氰酸铵和芳甲酰肼等三组分在PEG-400的催化下于氯仿和DMF 溶剂中一锅法缩合,176有 机 化 学 V ol. 30, 2010其中介电常数较大的DMF 溶剂可有效改善微波吸收效率, 利于缩短反应时间和提高产率.Scheme 43.4 超声波与相转移催化剂参与下的合成与常规方法比较, 超声辐射法具有简便易控、能耗低、改善反应条件、加快反应速度、提高反应产率以及使一些用传统方法难以进行的化学反应得以实现的优点, 因此近年来引起化学工作者广泛关注[45]. 例如2006年, 薛思佳等[46]将超声辐射和相转移催化结合起来, 以PEG-400为固-液相转移催化剂, 以乙腈为溶剂, 在超声辐射(USI)下顺利得到酰基硫脲(Scheme 5), 反应中间体酰基异硫氰酸酯也无需隔离, 反应温度由90 ℃降低至60 ℃, 反应总收率由49%提高至70%, 反应时间缩短为3 h.Scheme 52008年, 孙燕荣等[47]报道了类似的工作, 并且和常规加热法进行了比较, 结果表明常规加热法合成目标产物需回流3 h 左右, 而采用超声波辐射法, 只需在60 ℃下超声波辐射约20 min, 反应时间仅是常规方法的11%, 产率比常规方法提高了7%~19%左右. 总之, 超声波辐射法是一个反应时间短、条件温和、产率高、副反应少并且应用面较宽的好方法. 3.5 水介质中相转移催化剂参与下的合成以上合成方法都需经中间体异硫氰酸酯的制备步骤, 并且整个合成需要在相对昂贵、有毒的有机溶剂中进行, 对环境存在着不可避免的污染.随着人们对人类生存环境的日益重视, 越来越多的化学家将合成研究的重点放在对环境无污染的绿色合成上, 绿色合成要求合成中采用无毒的溶剂、试剂或催化剂, 尤其对反应溶剂的选择更是绿色合成研究的重点, 其中水被认为是最理想的绿色溶剂. 例如2006年, 王喜存等[48]在氯化三乙基苄基铵(TEBA)存在下, 于水介质中一步合成N -芳基- N '-(2-苯并呋喃甲酰基)硫脲(11)和1-芳甲酰基-4-(2-苯并呋喃甲酰基)氨基硫脲(12) (Scheme 6), 产率高达72%~87%. 与以上相转移催化方法相比, 本法将多步反应合并为一步, 并且在反应过程中不使用有机溶剂, 避免了资源浪费和环境污染, 具有操作简单、反应条件温和和环境友好等特点. 用水作为有机合成反应的溶剂, 体现了绿色化学中溶剂绿色化的要求, 开辟了合成硫脲类化合物的绿色途径.Scheme 63.6 微波参与下无溶剂无催化剂的合成自从Gedye 等[49]报道了微波作为反应热源可促进有机反应以来, 微波技术的应用即成为有机反应研究的热点之一, 因此, 具有速度快、产率高、操作简单、环境友好等优点的微波促进下的无溶剂非均相有机反 应[50]被成功应用于硫脲衍生物的合成.例如, 2005年, Wang 等[51]在无溶剂和无催化剂条件下, 利用微波间歇加热合成1,4-二取代氨基硫脲衍生物13 (Scheme 7). 反应只需5 min, 产率高达82%~88%, 与以上直接回流和相转移催化方法比较, 该方法避免了有机溶剂的使用和原料的浪费, 为酰氨基硫脲类化合物的合成提供了一条绿色通道.Scheme 74 以二硫化碳和胺为原料的合成4.1 直接加热合成Allen 等[52]报道了用二硫化碳和乙二胺为原料直接No. 2丁从文等:硫脲类化合物合成方法研究进展177加热到一定温度合成环状硫脲(四氢咪唑-2-硫酮)的方法(Eq. 5). 该方法的优点在于产率高, 反应时间短, 避免使用催化剂. 具备这些优点的原因可能是五元环硫脲结构具有很大的稳定性, 一旦生成便以固体形式从反应混合液中很快析出.4.2 催化剂参与下的合成Allen 报道的上述方法除了存在反应体系中有H 2S 气体放出, 污染环境的缺点之外, 在同样的反应条件下, 对于合成其它非环硫脲类化合物还存在回流时间较长、产率很低的问题, 因此人们在催化剂方面作了许多研究, 以使全过程更加简洁高效、环境友好.1999年, Ballabeni 研究组[53]以二硫化碳和伯胺为底物, Zn-Al HT (500)作为催化剂, 在高压釜中进行反应, 首次无溶剂合成了1,3-二取代对称硫脲14 (Eq. 6), 当底物胺是乙二胺和邻苯二胺时, 可得到相应的杂环硫酮产物, 产率高达100%. Ballabeni 催化法操作简单, 反应条件温和, 反应时间较短(2 h), 产率很高(最高达到100%), 催化剂Zn-Al HT (500)可以循环使用, 应用范围广泛, 因此它是一种高效合成对称硫脲、环状硫脲特别是具有光活性硫脲类化合物的绿色方法. 但该反应仍存在一些不足: 底物胺适用面狭窄, 只适合一些活性较强的芳香族伯胺和脂肪族伯胺; 反应中使用的催化剂不易得到, 制备时涉及到高温回流、加热时间过长、需要小心控制等问题.近年来, 基于双氧水作为催化剂的低毒性、低污染、高活性、价廉易得以及对环境友好等优点[64], 倍受化学工作者普遍关注. 例如: 1997年, Li 研究组[54]采用双氧水作为催化剂脱去硫化氢改进了合成路线中关键中间体异硫氰酸酯的制备方法之后, 2000年, Sasaki 等[55]以取代间苄二胺 15 和二硫化碳为原料, 氢氧化钠和双氧水作为催化剂, 用四氢呋喃水溶液作为溶剂, 在氯仿高度稀释条件下得到大环双硫脲16 (Scheme 8), 它可以作为阴离子受体强烈选择性络合24H PO -和Ac -阴离子, 其络合阴离子的能力强于相应的非环状硫脲. 4.3 微波参与下的合成2004年, Sandin 等[56]以2-取代丙二胺17和二硫化Scheme 8碳为原料, 乙醇为溶剂和催化剂, 通过微波辐射方式, 在200 s 内完成了5-取代六氢嘧啶-2-硫酮(18)的合成(Eq. 7). 但是Sandin 微波辐射法, 存在着H 2S 气体从反应中放出污染环境的问题. 此外, 乙醇在该反应中作为溶剂和催化剂在微波辐射下可导致许多副产品生成, 特别是一硫代氨基甲酸乙酯, 相比之下, 廉价易得的无机碱 NaOH 或KOH 溶液作为催化剂的选择较为理想.5 以硫代羰基转移试剂与胺为原料的合成以硫代光气或异硫氰酸酯和伯胺、仲胺为原料合成对称和非对称硫脲已成为人们广泛采用的方法, 然而此类方法涉及到原料的巨毒性, 此外, 用硫代光气或二硫化碳为原料进行反应, 不可避免地放出HCl 或H 2S 气体污染环境. 一系列替代它们的诸如二硫氰三苯膦[57] (TPPT)、三硫代碳酸盐[58]、二硫代或单硫代秋兰姆[59]、苯胺基硫代羰基1,2,4-三唑[60]、活化的二硫代胺基甲酸盐[61]等硫代羰基转移试剂已经吸引了不少研究者目光.以上硫代羰基转移试剂法尽管避免了巨毒的硫代光气或异硫氰酸酯, 也解决了HCl 或H 2S 气体放出污染环境的问题, 从而给反应提供了安全性和环境友好性, 但它们遭受实际条件的限制, 涉及到苛刻的反应条件、无水溶剂的使用、繁琐的多步骤操作、不易得到的起始原料、反应缺乏普遍适用性、总体收率也很低.2000年, Mohanta 研究组[62]以1-(甲基二硫代羰基)咪唑(19)或其N -甲基盐20为硫代羰基转移试剂, 在回流的乙醇溶剂中与胺发生取代反应合成了对称硫脲 21 (Eq. 8)和非对称硫脲22 (Scheme 9), 当反应以乙二胺或178有 机 化 学 V ol. 30, 2010邻苯二胺和19或20为底物在乙醇中加热时, 可得到四氢咪唑-2-硫酮和苯并咪唑-2-硫酮, 产率高达96%.Scheme 9值得一提的是, 硫代羰基转移试剂19或20与仲胺 (N -甲基苯胺、吗啉)按1∶2物质的量比在乙醇中回流时, 没有获得相应的四取代对称硫脲21, 结果生成了意外产物二硫代胺基甲酸甲酯. 然而, 对于非对称硫脲22的合成方法, 底物不管是氨气还是伯胺和仲胺, 都具有一定的普遍适用性.另外, 此类硫代羰基转移试剂的结构类似于硫代光气, 是个高效、安全的硫代羰基转移试剂, 反应条件温和, 操作简单, 反应在无毒的乙醇溶剂中进行, 试剂种类少, 产率高, 这无疑是硫脲类化合物合成研究中的绿色化新进程.6 以取代硫脲与胺为原料的合成以上讨论了胺作为亲核试剂与硫代羰基转移试剂发生亲核取代反应合成N -取代硫脲, 胺作为亲核试剂还可以与N -取代硫脲发生亲核取代反应合成新型硫脲类化合物.1999年, Xian 课题组[63]以一系列烷基伯胺或仲胺作为亲核试剂与N -亚硝基-1,3-二甲基硫脲于室温下在乙腈中发生亲核取代反应, 以95%以上的高产率合成了一系列N -取代硫脲23 (Eq. 9). 与化合物23传统制备方 法[64]相比, 该方法不仅产率高,而且很容易进行.烷基伯胺或仲胺作为亲核试剂, 除了易与亚硝基硫脲发生亲核取代生成N -取代硫脲外, 还易与1,3-二芳基对称硫脲发生亲核取代生成N -取代硫脲, 例如, 1993年, Ramadas 等[65]用1,3-二苯基硫脲在少量三乙胺催化下, 于乙腈中回流, 被伯胺或仲胺亲核取代, 生成非对称硫脲24 (Eq. 10). 与传统的非对称硫脲[66]的制备方法相比较, Ramadas 法反应时间较短(1.5~3 h), 产率较高(70%~92%).作为亲核试剂的烷基伯胺或仲胺是手性胺时, 取代产物将是手性硫脲. 例如, 2008年, 王进家等[67]用手性胺取代1,3-二芳基对称硫脲, 成功地获得了手性硫脲 25 (Eq. 11). 此方法避免了传统方法[10]异硫氰酸酯的使用, 且具有反应简便、产率较高、后处理简单等优点.7 结语和展望硫脲类化合物在各行各业具有广泛的应用, 因此近年来一直都有关于此类化合物合成新方法的文献报道, 从中不难看出, 如何寻找温和高效的催化剂和合成路线将是今后的探索目标, 利用微波加热和超声辐射技术缩短反应时间和优化条件值得尝试. 此外对于磺酰(环)硫脲的新合成方法以及硫脲类化合物的不对称合成研究均较少, 本文课题组正朝这方面开展更加深入的研究, 以经无机碱KOH 水溶液处理的磺酰胺和胺、二硫化碳为原料, 在室温下, 磺酰铵盐(RSO 2NHK)作为亲核试剂在水中与胺和二硫化碳的加合物发生亲核取代反应合成磺酰硫脲(Eq. 12), 底物是N -单磺酰二胺与二硫化碳时, 可发生分子内关环反应生成磺酰环硫脲(Eq. 13). 与以上报道的方法相比, 我们提出的方法全部在水相中进行, 且反应中所用的二硫化碳、KOH 价格均不高, 条件温和, 步骤简单, 具有潜在的应用前景.No. 2 丁从文等:硫脲类化合物合成方法研究进展179References1 Xue, S.-J.; Duan, L.-P.; Ke, S.-Y.; Zhu, J.-M. Chin. J.Struct. Chem. 2004, 23, 441 (in Chinese).(薛思佳, 段李平, 柯少勇, 朱剑明, 结构化学, 2004, 23,441. )2 Bessard, Y.; Crettaz, R. Tetrahedron2000, 56, 4739.3 Sriram, D.; Yogeeswari, P.; Madhu, K. Bioorg. Med. Chem.Lett. 2006, 16, 876.4 Faidallah, H. M.; Al-Saadi, M. S.; Rostom, S. A. F.; Fahmy,H. T. Y. Med. Chem. Res. 2007, 16, 300.5 Venkatachalam, T. K.; Mao, C.; Uckum, F. M. Bioorg.Med. Chem. 2004, 12, 4275.6 Jurasek, A.; Safar, P.; Zvalk, V. Chem. Pap. 1987, 41, 693.7 (a) Wazeer, M. I. M.; Isab, A. A.; Fettouhi, M. Polyhedron2007, 26, 1725.(b) Fettouhi, M.; Wazeer, M. I. M.; Isab, A. A. J. Coord.Chem.2007, 60, 369.8 Linton, B. R.; Goodman, M. S.; Hamilton, A. D. Chem. Eur.J. 2000, 6, 2449.9 Hayashita, T.; Onodera, T.; Kato, R.; Nishizawa, S.;Teramae, N. Chem. Commun. 2000, 755.10 (a) Okino, T.; Nakamura, S.; Furukawa, T.; Takemoto, Y.Org. Lett. 2004, 6, 625.(b) Jiang, L.; Zheng, H. T.; Liu, T. Y.; Yue, L.; Chen, Y. C.Tetrahedron2007, 63, 5123.11 Makhsumov, A. G.; Safaev, A. S.; Abidova, S. V. KatalPererab. Uglevodordn. Syrya1968, 2, 101 [Chem. Abstr.1969, 71, 101668v].12 Alder, A. EP307361, 1989[Chem. Abstr. 1989, 111,173788b].13 De Deyn, P.; Mareseau, B.; Quneshi, I. A.; Mori, A. Gua-nidino Compounds in Biology and Medicine, Vol. 2, John Libbey & Co. Limited, London, 1997.14 Wang, X. C.; Song, A. Y.; Zhu, J. H.; Yang, Z.; Zhang, Z.Synth. Commun. 2007, 37, 1627.15 Griffin, T. S.; Woods, T. S.; Klayman, D. L. In Advances inHeterocyclic Chemistry, Vol. 18, Eds.: Katritzky, A. R.;Boulton, A. J., 1975, p. 99 and references therein.16 Takeuchi, N.; Kasama, T.; Ikeda, R.; Shimizu, K.; Hatake-yama, K. Chem. Pharm. Bull. 1984, 32, 2249.17 Nishizawa, S.; Cui, Y. Y.; Minagawa, M.; Morita, K.; Kato,Y.; Taniguchi, S.; Kato, R.; Teramae, N. J. Chem. Soc.,Perkin Trans. 22002, 866. 18 Kato, R.; Cui, Y. Y.; Nishizawa, S.; Yokobori, T.; Teramae,N. Tetrahedron Lett. 2004, 45, 4273.19 Li, J. Z.; Zhang, Z. F.; Fan, E. K. Tetrahedron Lett.2004,45, 1267.20 Sun, X.-H.; Tao, Y.; Liu, Y.-F.; Jia, Y.-Q.; Chen, B.; Yang,J.-W. Chin. J. Org. Chem. 2008, 28, 155 (in Chinese).(孙晓红, 陶燕, 刘源发, 贾婴琦, 陈邦, 杨建武, 有机化学, 2008, 28, 155.)21 Wilcox, C. S.; Kim, E.; Romano, D.; Kuo, L. H.; Burt, A.L.; Curran, D. P. Tetrahedron 1995, 51, 621.22 (a) Scheerder, J.; Fochi, M.; Engbersen, J. F. J.; Reinhoudt,D. N. J. Org. Chem. 1994, 59, 7815.(b) Raposo, C.; Almaraz, M.; Martın, M.; Weinrich, V.;Mussons, M. L.; Alcazar, V.; Caballero, M. C.; Moran, J. R.Chem. Lett. 1995, 759.23 Tobe, Y.; Sasaki, S.; Hirose, K.; Koichiro, N. TetrahedronLett. 1997, 38, 4791.24 Schroeder, D. C. Chem. Rev. 1955, 55, 18125 Beecham Group Ltd. BE 819436, 1975 [Chem. Abstr. 1977,87, 201318e].26 Dalluhn, J.; Proehl, H. H.; Moers, O. Z. Naturforsch., B2001, 56, 1188.27 (a) Du, X.-H.; Xu, X.-S.; Fu, Y.-F.; Lou, Y.-L.; Xu, Z.-Y.Agrochemicals2004, 43, 78 (in Chinese).(杜晓华, 许响生, 傅幼锋, 楼泳淋, 徐振元, 农药, 2004, 43, 78.)(b) Kou, J.-P.; Luo, X.-Y.; Qin, C.-Y., Gao, J.-J.; Li, J.-Z.Chem. Reag.2009, 31, 67 (in Chinese)(寇景平, 罗旭阳, 秦翠英, 高俊杰, 李继贞, 化学试剂, 2009, 31, 67.)28 Chrisstoffels, L. A. J.; Jong, F.; Reinhoudt, D. N.; Sivelli,S.; Gazzola, L.; Casnati, A.; Ungaro, R. J. Am. Chem. Soc.1999, 121, 10142.29 Neville, R. G.; McGee, J. J. Can. J. Chem.1963, 41, 2123.30 Scheerder, J.; Fochi, M.; Engbersen, J. F. J.; Reinhoudt, D.N. J. Org. Chem. 1994, 59, 7815.31 Yang, F.-F.; Yu, T.-X.; Yang, X.-J. Chin. J. Org. Chem.2002, 22, 1040 (in Chinese).(杨发福, 余天祥, 杨先金, 有机化学, 2002, 22, 1040.)32 Kurzer, F. Chem. Rev. 1952, 50, 1.33 Faidallah, H. M.; Albar, H. A.; Makki, M. S. I.; Sharshira,E. M. Phosphorus, Sulfur Silicon Relat. Elem.2002, 177,685.34 McFarland, J. W.; Kozel, T. H.; Stuhlmacher, K. R.; Cheva-lier, T. S. J. Heterocycl. Chem. 1980, 17, 273.35 Cutting, G. A.; Stainforth, N. E.; John, M. P.; Kociok-Kohn,G.; Willis, M. C. J. Am. Chem. Soc. 2007, 129, 10632.36 Xiao, M. L.; Chen, F. H.; Chen, Z. J.; Guo, B. S.; Lü, X. H.;Tang, W. M. Chin. Chem. Lett.2007, 18, 258.37 Sridevi, G.; Rao, J. P.; Reddy, K. K. Synth. Commun. 1989,19, 965.38 Shi, D.-Q.; Wang, H.-Y.; Yang, F., Li, X.-Y. Acta Chim.Sinica2007, 65, 1713 (in Chinese).(史达清, 王海营, 杨芳, 李小跃, 化学学报, 2007, 65,180有机化学V ol. 30, 20101713.)39 Reeves, W. P.; Simmons, J. A.; Rudis, J. A. Synth. Com-mun. 1981, 11, 781.40 Gil-Molto, J.; Karlstrom, S.; Najera, C. Tetrahedron2005,61, 12168.41 Wei, T.-B.; Chen, J.-C.; Wang, X.-C. Chem. J. Chin. Univ.1992, 9, 1217 (in Chinese).(魏太保, 陈继畴, 王秀春, 高等学校化学学报, 1992, 9, 1217.)42 Li, Z.; Wang, X. C.; Da, Y. X.; Chen, J. C. Synth. Commun.2001, 31, 1433.43 (a)Bose, A. K.; Manhas, M. S.; Ganguly, S. N.; Sharma, A.H.; Banik, B. K. Synthesis2002, 1578.(b) Ii, Z.; Wang, X. C. Synth. Commun. 2002, 32, 3087.44 Li, Z.; Li, Z.-J.; Wang, X.-C. Chin. J. Org. Chem. 2003, 23,822 (in Chinese).(李正, 权正军, 王喜存, 有机化学, 2003, 23, 822.)45 (a) Jia, Z.-X.; Li, Y.-R.; Liu, C.-J. Chin.J. Org. Chem.2005, 25, 1450 (in Chinese).(贾兆祥, 李燕萍, 刘晨江, 有机化学, 2005, 25, 1450.)(b) Zhang, X. L.; Li, Y. P.; Liu, C. J.; Wang, J. D. J. Mol.Catal. A: Chem. 2006, 253, 207.46 Xue, S.-J.; Guo, Y.-L.; Li, J.-Z. Chin. J. Appl.Chem. 2006,12, 1381 (in Chinese).(薛思佳, 郭彦玲, 李景智, 应用化学, 2006, 12, 1381.)47 Sun, Y.-R.; Li, Y.-P.; Liu, C.-J.; Wang, J.-D. Chin. J. Org.Chem. 2008, 28, 151 (in Chinese).(孙燕荣, 李燕萍, 刘晨江, 王吉德, 有机化学, 2008, 28, 151.)48 Wang, X.-C.; Zhang, Z.; Quan, Z.-J.; Wang, M.-G.; Wang,F.; Li, Z.; Yang, C.-Y. Chin. J. Org. Chem. 2006, 26, 967(in Chinese).(王喜存, 张彰, 权正军, 王满刚, 王芳, 李正, 杨春燕, 有机化学, 2006, 26, 967.)49 Gedye, R.; Smith, F.; Westaway, K.; Ali, H.; Baldisera, L.;Laberge, L.; Rousell, R. Tetrahedron Lett. 1986, 27, 279.50 (a) Caddick, S. Tetrahedron1995, 51, 10403.(b) Galema, S. A. Chem. Soc. Rev. 1977, 26, 233. 51 Wang, X. C.; Quan, Z. J.; Li, Z. J.Chem. Res., Synop. 2005,71.52 Allen, C. F. H.; Edens, C. O.; VanAllan, J. Organic Synthe-ses, Vol. 3, Wiley, New York, 1955, p. 394.53 Ballabeni, M.; Ballini, R.; Bigi, F.; Maggi, R.; Parrini, M.;Predieri, G.; Sartori, G. J. Org. Chem. 1999, 64, 1029.54 Li, G.; Tajima, H.; Ohtani, T. J. Org. Chem. 1997, 62, 4539.55 Sasaki, S. I.; Mizuno, M.; Naemura, K.; Tobe, Y. J. Org.Chem. 2000, 65, 275.56 Sandin, H.; Swanstein, M. L.; Wellner, E. J. Org. Chem.2004, 69, 1571.57 (a) Tamura, Y.; Adachi, M.; Kawasaki, T.; Kita, Y. Tetra-hedron Lett. 1978, 1753.(b) Tamura, Y.; Kawasaki, T.; Tanio, M.; Kita, Y. Synthesis1979, 120.(c) Tamura, Y.; Kawasaki, T.; Adachi, M.; Kita, Y. Chem.Pharm. Bull. 1979, 27, 1636.58 Takikawa, Y.; Inoue, N.; Sato, R.; Yakizawa, S. Chem. Lett.1982, 641.59 Ramadas, K.; Srinivasan, N. Synth. Commun. 1995, 25,3381.60 Larsen, C.; Steliou, K.; Harpp, D. N. J. Org. Chem. 1978,43, 337.61 Sugimoto, H.; Makino, I.; Hirai, K. J. Org. Chem. 1988, 53,2263.62 Mohanta, P. K.; Dhar, S.; Samal, S. K.; Ila, H.; Junjappa, H.Tetrahedron2000, 56, 629.63 Xian, M.; Zhu, X. Q.; Li, Q.; Cheng, J. P. Tetrahedron Lett.1999, 40, 1957.64 Okawata, T.; Nakayama, K.; Furukawa, M. Chem. Pharm.Bull. 1983, 31, 507.65 Ramadas, K.; Srinivasan, N.; Janarthanan, N. TetrahedronLett. 1993, 34, 6447.66 Chatterjee, A.; Das, B.; Chaudhury, A. N.; Kirtaniya, D. S.Indian J. Chem. 1980, 19B, 163.67 Wang, J.-J.; Shen, Z.-X.; Zhang, Y.-W. Chin. J. Org. Chem.2008, 28, 1222 (in Chinese).(王进家, 沈宗旋, 张雅文, 有机化学, 2008, 28, 1222.)(Y0902165 Zhao, X.)。
硫脲衍生物的合成和生物活性研究

第34卷第7期2006年7月 化 学 工 程CHE M I CAL E NGI N EER I N G (CH I N A ) Vol .34No .7Jul .2006基金项目:陕西省自然科学基金资助项目(2001H11)作者简介:孙晓红(1959—),女,博士,研究方向为有机合成,电话:(029)88302681,E 2mail:xhsun888@s ohu .com 。
硫脲衍生物的合成和生物活性研究孙晓红1,刘源发2,王慧芳2(西北大学11化学研究所;21化学系,陕西西安 710069)摘要:为了寻找新的更为优秀的杀菌剂品种,选用取代含氮杂环取代嘧啶与烷氧羰基异硫氰酸酯反应,合成了21个硫脲衍生物42取代嘧啶基硫代脲酸酯类化合物,其中19个化合物为新化合物。
结构组成经元素分析、I R 及1H NMR 确认,并测定了其中5种植物病菌的室内毒力作用,结果表明:大部分化合物具有良好的抑菌和杀菌活性。
这些参数为新的硫脲类化合物的合成和筛选提供了依据。
关键词:合成;硫脲衍生物;杀菌剂;毒力作用中图分类号:T Q 455.41 文献标识码:A 文章编号:100529954(2006)0720054204Synthesis and bi ologi cal acti viti es of thi ourea deri vati vesSUN X i a o 2hong 1,L I U Y uan 2fa 2,W ANG Hu i 2fang1(1.Che m ical Research I nstitute,2.Depart m ent of Che m istry,North west University,Xi ′an 710069,Shaanxi Pr ovince,China )Abstract:T wenty 2one thi ourea derivatives were synthesized by reacti on of heter ocycle co mpounds containing bi ol ogical substituted pyri m idina m ine with alkoxycarbonyl is othi ocyanates .Nineteen of the m were ne w co mpounds and reported first ti m e .Their structures were confir med by I R,1H NMR and ele mental analysis .The bi ol ogical activity tests showthat most of the m exhibit excellent bi ol ogical activities .The relati onshi p bet w een the structures and the fungicidal activities of the compounds was als o discussed .These para meters will p r ovide a scientific data for screening and synthesis ne w thi ourea compounds .Key words:synthesis;thi ourea derivatives;fungicide;t oxicity acti on 硫脲类化合物具有很强的抗菌性和杀菌性,已被广泛应用于农药及医药合成中,该类化合物的结构中含有较强的生物活性的(—HN —CS —NH —)键,至今仍是人们研究的热点[1—3]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硕士学位论文
巾文摘要
Abstract
Acylthiourea derivatives have been patented as antidiabetic,antiarthritic, antineoplastic,and anticoagulant and prostate disorder.Herbicidal,fungicidal, bactericidal,insecticidal and plant growth regulator activities have also been reported.
1.简要介绍阴离子识别的发展现状,包括(i)分子识别:(ii)阴离子的结构 特点;(iii)阴离子识别研究中所涉及的分子间相互作用力;(iv)脲、硫脲类化 合物的15月离子识别性质研究进展:(V)在含水介质中硫脲受体阴离子识别发展 概述。
2.合成了20种N-含氟苯甲酰基w.芳基硫脲,对其进行了表征。利用紫外.司见
硕士学位论文
中文摘要
confirmed hydrogen interaction between the receptors and anions.The binding properties for anions of these N-flurobenzoyl一.Ⅳt—phenylthioureas and 5 N-benzoyl-N、一phenyl thiourea were examined by UV-vis and 1H NMR spectroscopy. By fluorination of the benzoyl chromophore,the receptors had higher binding affinity for tested anions than the receptor 5.Especially,we studied the anion binding efficiency of the receptor 4a N-(3一flurobenzoyl)一妒-phenylthiourea and 5 in DMSO and DMSO-water binary solutions in detail respectively.In pure DMSO,the receptors 4a and 5 had higher binding affinity for F‘over AcO一.However,as the ratio of water 幻DMSO increases,we fotmd the binding properties for tested anions of 4a and 5 changed in DMSO—water binary solutions.The receptors showed higher binding affinity and selective ability for AcO。over F’in dimethyl sulfoxide containing water with varied ratios.It was further demonstrated that the receptor 4a had higher binding affinity for AcO—over F‘in DMSO-water binary solutions by studying the changes of red shifts of the absorption bands and the changes of the isosbestic point during the UV-Vis spectral titrations,
(保密的沦文在解密后应遵守此规定)
繇篷缒新虢.刍溯望玲吼笙也翌
硕I叠}位论文
中文摘要
摘要
酰基硫脲及其衍生物具有厂‘泛医药应用(作为抗糖尿病药,治风湿病药,抑 制肿瘤药,抗凝剂以及治疗前列腺紊乱的药物)和工业应用(主要用于金属螫合 提炼)。关于作为除草剂,防霉剂,杀菌剂,杀虫剂和植物生长调节活性也多被 报道。近年来,其阴离子识别作用研究也逐渐开展起来。另外,芳香族含氟有机 化合物在医药、农药及染料等方面用途十分广泛。本文报道了含氟苯甲酰基硫脲 衍生物的合成、阴离子识别性能及植物生长调节活性的研究。
2.A novel series of N-flurobenzoyl-N'一phenylthiourea have been prepared by simple steps in good yields and characterized,The binding properties of some of the receptors with anions such as F‘,C1‘Br-,CH3COO+,HS04’and N03’were examined by UV-Vis and 1H NMR spectroscopy methods.The results showed that these receptors had better selectivities for F—and CH3COO—in dimethyl sulfoxide(DMSO), but no evident binding with C1。,Br一,HS04。and N03一.A clear color change was observed from light yellow to yellow upon addition ofF’or CH3C001 to the solution of the receptor N-(3一flnrobenzoyl)-N'-r2一nitrophenylthiourea)in DMSO.The UV-Vis data indicated that a 1:1 stoichiometry complex was formed between the receptor N-(3-flurobenzoyl)-N'一(2一nitrophenylthinurea)and anions,while 1H NMR titrations
硕士学位论文ຫໍສະໝຸດ 中文摘要析化学提供了一种可鉴的方法。
3.概述了植物生长调节剂、酰基硫脲类衍生物在农药方面应用以及芳香族含氟 化合物的特性、在生物活性方面的应用。
4.利用简便方法合成并表征了3种2,2’一二含氟苯甲酰基硫脲基乙二醇二苯醚。
采用平皿培养法,比较了在彳i同溶液浓度下其与Ⅳ-含氟苯甲酰基w一芳基硫脲对
吸收光谱(Uv—vis,DMSO为溶剂)及核磁共振氢谱(1ttNMR,CDCl3为溶剂) 考察了部分受体与F一,C1。,Br-,CH3C001,HS04。,N03"等阴离子的作用。结果 表明,加入F一,CH3COO一时,紫外可见光谱吸光度曲线、核磁氢谱有明显变化, 而加入其它阴离子则无变化,说明该类硫脲受体对F一,CH3COO一识别,而对cI一, Br一,HS041,N03"等阴离子没有识别作用。其中,N-(3-氟苯甲酰基)-N"一(2一硝基 苯基)一硫脲主体DMSO溶液在加入F一,CH3COO一后,颜色由淡黄变成黄色,从 而实现对这两种阴离子的裸眼检测。由JOB曲线可知主客体问形成l:1的配合物。 1H NMR滴定及质子溶剂效应为受体分子与阴离子间的氢键作用本质提供了依 据。通过比较Ⅳ-含氟苯甲酰基一Ⅳ一苯基硫脲与Ⅳ-苯甲酰基.Ⅳ'.苯基硫脲在含不同 比例水的DMSO中的阴离子识别性能,结果发现除Ⅳ_2一氟苯甲酰基.Ⅳ,.苯基硫 脲外都对氟离子、醋酸根离子识别,并且在主体Ⅳ-苯甲酰基.Ⅳ,一苯基硫脲合适位 置上引入氟原子,受体的阴离子识别性能大大提高。另外,随着DMSO中含水 量的增加,主体对氟离子、醋酸根离子识别的络合常数都变小,但对醋酸根离子 的识别性增强。通过比较两种新现象,即在不同含水量DMSO溶剂中主体滴定 阴离子的紫外可见光谱的最大吸收峰及新形成的吸收峰随阴离子的加入的红移 值以及等吸收点清晰度的变化,也进一步证明在水相中主体对醋酸根离子的识别 优于对氟离子,并探讨识别机理。在不同比例的含水介质中研究阴离子识别为分
外,论文中不包括其他人已经发表或撰写过的研究成果,也不包含为
获得西北师范大学或其他教育机构的学位或证书而使用过的材料。与
我一同工作的同志对本研究所做的任何贡献均已在论文中作了明确 的说明并表示了谢意。
签名:後弘纬
日期:钿6.7-%
关于论文使用授权的说明
本人完全了解西北师范大学有关保留、使用学位论文的规定,即: 学校有权保留送交论文的复印件,允许论文被查阅和借阅;学校可以 公布论文的全部或部分内容,可以采用影印、缩印或其他复制手段保 存论文。
COntents are as follows:
1.Researches in the development of anion recognition were briefly reviewed.The content of this chapter includes:(i)molecular of recognition,(ii)the structural characters of anions,(iii)noncovalent interactions existed in anion coordination,(iv)the development of"anion recognition researchers of urea and thiourea derivative receptors,(V)the development of anion recognition properties of ttfiourea in water-containing media.
copper sulfides and precious metals.Moreover fluorinated aromatiC compounds play an important role as intermediates or materials in preparation pharmaceuticals, pesticides and dyes last decade.In this thesis,we have synthesized some novel
