化学必修二同步练习:1-第2节元素周期律和元素周期表 含答案
人教版高中化学必修二 第一章 物质结构 元素周期律 第一节 元素周期表 同步训练 含答案

第一章物质结构元素周期律第一节元素周期表1.下列关于元素周期表的叙述正确的是( )A.元素周期表中所含元素种类最多的族是Ⅷ族B.同族元素的最外层电子数一定相同C.同周期元素的电子层数相同D.每一周期的元素都是从碱金属开始,以稀有气体结束2.在元素周期表中,铂的表示如图所示,下列对图示解读正确的是( )78 Pt铂195.1 5d96s1A.铂是非金属元素,在常温下呈固态 B.“78”是铂的原子序数C.“195.1”是铂的质量数 D.铂的名称为Pt3.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )4.下列说法中,错误的是( )A.原子及其离子的核外电子层数等于该元素所在的周期序数B.元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素C.除He外的稀有气体元素原子的最外层电子数都是8D.第ⅡA族与第ⅢA族之间隔着10个纵行5.俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子。
这4个原子生成数微秒后衰变成第113号元素。
下列有关叙述正确的是( )A.115号元素在第六周期B.113号元素在第七周期第ⅢA族C.115号和113号元素都是非金属元素D.镅元素和115号元素不在同一周期6.国际无机化学命名委员会将元素周期表原先的主、副族族号取消,从左往右改为18列,碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是( )A.不仅第2列元素的原子最外层有2个电子B.第3~12列元素全为金属C.第3列元素种类最多D.第16、17列元素都是非金属元素7.下列说法中正确的是( )A.每一周期的元素都从碱金属开始,最后以稀有气体结束B.同一周期中,从左到右,各元素最外层电子数都是从1个逐渐增加到8个C.第二、三周期上下相邻元素的原子序数相差8D.第七周期只有23种元素8.某周期第ⅡA族元素的原子序数为x,则同周期的ⅣA族元素的原子序数为( )A.只能是x+2 B.可能是x+8或x+18C.可能是x+13 D.可能是x+2或x+12或x+269. 1869年,俄国化学家________首制第一张元素周期表。
人教版高中化学选择性必修第2册 课后练习 第1章 第2节 第2课时 元素周期律(一)

第2课时元素周期律(一)[核心素养发展目标] 1.能从原子结构的角度理解原子半径、元素第一电离能之间的递变规律,能利用递变规律比较原子(离子)半径、元素第一电离能的相对大小。
2.通过原子半径、元素第一电离能递变规律的学习,建立“结构决定性质”的认知模型,并能利用认知模型解释元素性质的规律性和特殊性。
一、原子半径1.影响原子半径大小的因素(1)电子的能层数:电子的能层越多,电子之间的排斥作用使原子半径增大。
(2)核电荷数:核电荷数越大,核对电子的吸引作用就越大,使原子半径减小。
2.原子半径的递变规律(1)同周期:从左至右,核电荷数越大,半径越小。
(2)同主族:从上到下,核电荷数越大,半径越大。
3.原子或离子半径的比较方法(1)同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。
例如:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)。
(2)能层结构相同的离子:核电荷数越大,半径越小。
例如:r(O2-)>r(F -)>r(Na+)>r(Mg2+)>r(Al3+)。
(3)带相同电荷的离子:能层数越多,半径越大。
例如:r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+),r(O2-)<r(S2-)<r(Se2-)<r(Te2-)。
(4)核电荷数、能层数均不同的离子:可选一种离子参照比较。
例如:比较r(K+)与r(Mg2+),可选r(Na+)为参照,r(K+)>r(Na+)>r(Mg2+)。
(1)能层数少的元素原子半径一定小于能层数多的元素的原子半径( )(2)核外能层结构相同的单核粒子,半径相同( )(3)质子数相同的不同单核粒子,电子数越多,半径越大( )(4)各元素的原子半径总比离子半径大( )(5)同周期元素从左到右,原子半径、离子半径均逐渐减小( )答案(1)×(2)×(3)√(4)×(5)×1.下列各组微粒不是按半径逐渐增大的顺序排列的是( )A.Na、K、Rb B.F、Cl、BrC.Mg2+、Al3+、Zn2+D.Cl-、Br-、I-答案 C解析同主族元素,从上到下,原子半径(离子半径)逐渐增大,故A、B、D三项中的各微粒的半径逐渐增大;电子层数相同,核电荷数越大半径越小,Mg2+、Al3+能层数相同但铝的核电荷数大,所以Al3+的半径小,故C 项微粒不是按半径逐渐增大的顺序排列的。
(人教版)高中化学必修2课时作业 第一章 第二节 第1课时(含答案)

第二节元素周期律第1课时原子核外电子的排布一、核外电子的分层排布1.电子的能量(1)在多电子原子里,电子的能量________。
(2)在离核较近的区域内运动的电子的能量________,在离核较远的区域内运动的电子的能量________。
2.电子层(1)概念:在多电子的原子里,电子运动的________的区域简化为________的壳层,称作电子层。
核外电子的排布一般总是尽先从________排起,当一层________后再填充下一层。
4.核外电子的排布规律分析下表和课本表1-2,填写下列空白:(1)最多是____;次外层所能容纳的电子数最多是____;K、L、M、N各电子层所能容纳的电子数最多依次是____、____、____、____。
(2)在元素周期表中,随着元素核电荷数的增加,在____族元素之后,增加了新的电子层并出现了新的周期,该元素最外层电子数是____。
研究各元素原子核外电子排布(课本表1-2)可以发现,稀有气体元素的原子各电子层电子数已达到最多所能容纳的电子数。
原子核外各电子层最多容纳的电子数(电子层数为n)是______。
5.核外电子的分层运动,又叫核外电子的分层排布,其主要规律:(1)原子核外电子总是先排能量________的电子层,然后由____向____,依次排布在能量____________的电子层即排满了____层才排____层,排满了____层才排____层。
(2)原子核外每个电子层最多容纳______个电子。
(3)原子最外层电子数不超过____个电子(K层为最外层不能超过_____个电子)。
(4)原子次外层电子数不超过____个电子(K层为次外层不能超过____个电子。
)二、核外电子排布的表示方法——结构示意图1.原子结构示意图用小圆圈表示原子核,圆圈内的数字表示核内质子数,弧线表示各电子层,弧线上的数字表示该电子层上的电子数,这样的图示称为原子结构示意图。
例如,钠原子的结构示意图为:2.离子结构示意图离子结构示意图与原子结构示意图写法相同,只是在原子结构示意图中,核内质子数等于____________;离子结构示意图中,二者____相等。
人教版高一化学必修二同步练习及答案:第一章第二节第二课时元素周期律的应用

人教版高一化学必修2同步练习第2课时元素周期律的应用一、单选题1.在元素周期表中金属与非金属的分界处,可以找到()A. 合金B. 农药C. 催化剂D. 半导体材料2.运用元素周期律分析下面的推断,其中不正确的是()A. 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂B. 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸C. 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>SD. 硅、锗都位于金属与非金属的交界处,都可以做半导体材料3.下列有关元素周期表结构的说法正确的是()A. 原子最外层电子数为2的元素一定处于周期表II A族B. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素C. 某元素原子核外的电子数为63,则它是第6周期副族元素D. 除短周期外,其他周期均为18种元素,副族元素没有非金属元素4.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是()A. 虚线右上方的元素为均为金属元素B. 紧靠虚线两侧的元素都是两性金属元素C. 可在虚线附近寻找半导体材料(如Ge、Si等)D. 可在虚线的右上方,可寻找耐高温材料5.运用元素周期律分析下列推断,其中错误的是()A. 铍的最高价氧化物的水化物可能具有两性B. 砹单质是有色固体,砹化氢很不稳定C. 碳酸锶难溶于水,但易溶于盐酸D. 砷的最高价氧化物的水化物是一种强酸6.现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是()A. 简单阳离子的氧化性:Y>XB. 气态氢化物的沸点:Z>MC. X、Z与M不可能存在同一离子化合物中D. Y2Z的溶液:c(Y+):c(Z2−)>2:17.X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中R元素是短周期中除稀有气体之外原子半径最大的元素。
高一化学必修二同步检测:1.+2.1+元素周期律含答案(1)

1.2.1 元素周期律一.选择题(每题6分,共60分)1.元素性质呈周期性变化的决定因素是()A.元素相对原子质量依次递增B.元素的最高正化合价呈周期性变化C.元素原子最外层电子排布呈周期性变化D.元素金属性或非金属性呈周期性变化2.下列说法中正确的是()①常温下为气体的单质都是由非金属组成②非金属氧化物都可以与水反应生成酸③非金属元素都是主族元素,其最外层电子数都大于等于4④因为非金属具有得电子的性质,其单质均不能作还原剂A. ①正确B. ①③正确C. ②④正确D. 都不正确3.元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是()A.XY2B.X2Y3C.X3Y2D.X2Y4.与OH-具有相同质子数和电子数的微粒()A.F-B.NH3C.H2O D.Na+5.元素R的最高价含氧酸化学式为H n RO2n+2,在它的气态氢化物中R的化合价是()A.3n – 10 B.3n – 4 C.3n – 12 D.4 – 3n6.已知a A n+、b B(n+1)+、c C n-、d D(n-1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是()A.原子半径:A>B>C>D B.离子半径:d D(n-1)-> C n-> b B(n+1)+> a A n+C.原子序数:b>a>c>d D.金属性B>A,非金属性:D>C7.某电子层n,当它作为最外电子层时,最多容纳的电子数与n-1层电子数相同,则此电子层是()A.K层B.L层C.M 层D.N层8.某含氧酸的化学式是H n RO2n+2,试判断该化合物中R的化合价最为合理的是()A.+7 B.+6 C.+5 D.+49.X、Y、Z是周期表中相邻的三种元素。
已知X和Y是同主族,Y和Z同周期,它们最外层上的电子数之和为16,则这三种元素可能是 ( )A.Na、K、Ca B.N、P、S C.N、P、Si D.F、Cl、S10.两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前10号元素中,满足上述关系的元素共有()A.1对B.2对C.3对D.4对二.非选择题(每题10分,共40分)11.A、B、C、D四种元素中,A元素所在的周期数、主族序数和原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2;C的阴离子与D的阳离子具有相同的电子排布,两种元素可形成化合物D2C。
人教版高一化学必修二同步练习及答案:第一章第一节第一课时元素周期表

人教版高一化学必修2同步练习第一章物质结构元素周期律第一节元素周期表第1课时元素周期表一、单选题1.市场上有“锌硒茶”、“含氟牙膏”等商品,这里的“锌、硒、氟”指的是()A. 分子B. 原子C. 单质D. 元素2.下列元素不属于第三周期元素的是()A. 溴B. 硫C. 磷D. 钠3.下列各组中,属同一周期的是()A. Mg、Al、PB. O、Na、SC. N、O、ClD. H、Li、Na4.元素周期表是学习化学的重要工具,如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是()A. 该元素的名称是钠B. 该元素的原子序数为11C. 该元素在地壳中的含量为22.99%D. 该元素的元素符号为Na5.地壳中含量最多的元素在周期表中的位置是()A. 第二周期VIA族B. 第二周期VA族C. 第三周期VIA族D. 第三周期VA族6.0.1mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是()A. 第三周期第IA族B. 第四周期第IA族C. 第三周期第ⅡA族D. 第四周期第ⅡA族7.图中的数字代表的是原子序数,图中数字所表示的元素与它们在元素周期表中的实际位置相符的是()A. B. C. D.8.如图为元素周期表中前四周期元素的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为()A. 5x+10B. 5xC. 5x+14D. 5x+169.2016年IUPAC命名117号元素为Ts(中文名“”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是()A. Ts是第七周期第ⅦA族元素B. Ts的同位素原子具有相同的电子数C. Ts在同族元素中非金属性最弱176TsD. 中子数为176的Ts核素符号是 11710.在元素周期表中,金属元素与非金属元素分界线附近,能找到()A. 制半导体材料的元素B. 制农药的元素C. 制催化剂的元素D. 制耐高温合金的元素11.若已发现了116号元素则下列推断正确的是()①其钠盐的化学式为Na2R②其最高价氧化物对应的水化物的酸性比硫酸强③R是金属元素④R是非金属元素⑤最外电子层有6个电子A. ①②③B. ①③⑤C. ②④⑤D. ③⑤12.有关元素周期表的说法中错误的是()A. 元素周期表中第16个纵行表示为ⅥAB. ⅦA元素也称为卤族元素C. 元素周期表中,Ⅷ包括第8、9、10纵行D. 0族元素的原子最外层电子数为8,元素化合价为013.下列各图为元素周期表的一部分,表中数字为原子序数,其中X为17的是()A. B.C. D.14.下列关于元素周期表的说法正确的是()人教版高一化学必修2同步练习A.短周期是指第1、2周期B. 过渡元素全部是金属元素C. 元素周期表有8个副族D. IA族的元素全部是金属元素二、填空题15.绘制元素周期表并标上周期、主族、零族信息,然后将前20号元素写在相对应的位置。
高一化学必修二同步检测:第一章 物质结构元素周期律 含答案
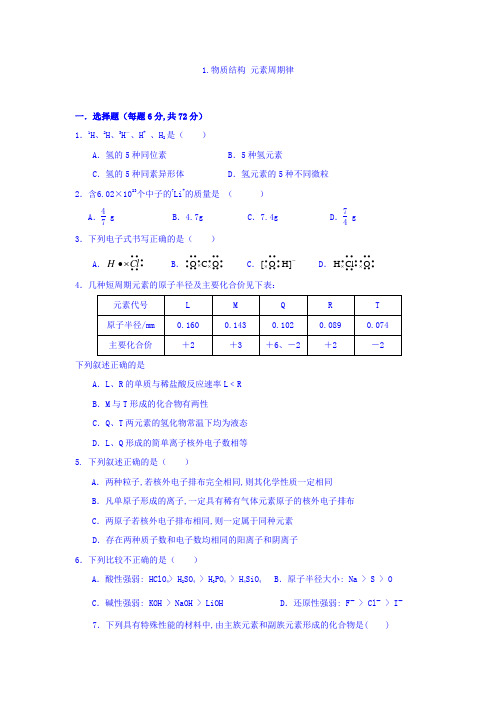
1.物质结构 元素周期律一.选择题(每题6分,共72分) 1.1H 、2H 、3H -、H +、H 2是( )A .氢的5种同位素B .5种氢元素C .氢的5种同素异形体D .氢元素的5种不同微粒 2.含6.02×1023个中子的7Li +的质量是 ( ) A .47g B .4.7gC .7.4gD .74g 3.下列电子式书写正确的是( )A .••••••⨯•Cl H B .•••••••⨯•⨯••••••O C O C .-•••••••⨯]H O [ D .•••••••⨯•••••••⨯O Cl H4.几种短周期元素的原子半径及主要化合价见下表:元素代号 L M Q R T 原子半径/mm 0.160 0.143 0.102 0.089 0.074 主要化合价+2+3+6、-2+2-2下列叙述正确的是A .L 、R 的单质与稀盐酸反应速率L ﹤RB .M 与T 形成的化合物有两性C .Q 、T 两元素的氢化物常温下均为液态D .L 、Q 形成的简单离子核外电子数相等 5. 下列叙述正确的是( )A .两种粒子,若核外电子排布完全相同,则其化学性质一定相同B .凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布C .两原子若核外电子排布相同,则一定属于同种元素D .存在两种质子数和电子数均相同的阳离子和阴离子 6.下列比较不正确的是( )A .酸性强弱: HClO 4> H 2SO 4 > H 3PO 4 > H 4SiO 4B .原子半径大小: Na > S > OC .碱性强弱: KOH > NaOH > LiOHD .还原性强弱: F - > Cl - > I - 7.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )A .半导体材料砷化镓B .吸氢材料镧镍合金C .透明陶瓷材料硒化锌D .超导材料K 3C 608.有X 、Y 两种元素,原子序数≤20,X 的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m,n 均为正整数)。
人教版高中化学必修2全册同步练习及答案

高中化学必修2全册同步练习第一章物质结构元素周期律 (3)第一节元素周期表 (3)第1课时元素周期表 (3)第2课时元素的性质与原子结构 (6)第3课时核素 (9)第二节元素周期律 (11)第1课时原子核外电子的排布元素周期律 (11)第2课时元素周期表和元素周期律的应用 (14)第三节化学键 (17)第1课时离子键 (17)第2课时共价键 (19)第二章化学反应与能量 (21)第一节化学能与热能 (21)第二节化学能与电能 (24)第1课时化学能转化为电能 (24)第2课时发展中的化学电源 (28)第三节化学反应的速率和限度 (32)第1课时化学反应的速率 (32)第2课时化学反应的限度及其应用 (36)第三章有机化合物 (40)第一节最简单的有机化合物——甲烷 (40)第1课时甲烷 (40)第2课时烷烃 (43)第二节来自石油和煤的两种基本化工原料 (46)第1课时乙烯 (46)第2课时苯 (49)第三节生活中两种常见的有机物 (52)第1课时乙醇 (52)第2课时乙酸 (55)第四节基本营养物质 (58)第四章化学与自然资源的开发利用 (61)第一节开发利用金属矿物和海水资源 (61)第1课时金属矿物的开发利用 (61)第2课时海水资源的利用 (64)第二节资源综合利用环境保护 (67)第1课时煤、石油和天然气的综合利用 (67)第2课时环境保护与绿色化学 (70)参考答案第一章物质结构元素周期律 (73)第一节元素周期表 (73)第二节元素周期律 (75)第三节化学键 (77)第二章化学反应与能量 (79)第一节化学能与热能 (79)第二节化学能与电能 (80)第三节化学反应的速率和限度 (81)第三章有机化合物 (83)第一节最简单的有机化合物——甲烷 (83)第二节来自石油和煤的两种基本化工原料 (85)第三节生活中两种常见的有机物 (86)第四节基本营养物质 (88)第四章化学与自然资源的开发利用 (89)第一节开发利用金属矿物和海水资源 (89)第二节资源综合利用环境保护 (90)第一章物质结构元素周期律第一节元素周期表第1课时元素周期表一、单项选择题1.某元素原子最外层上只有两个电子,则该元素()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
自我小测第1课时元素周期律1根据元素的原子序数,可推知原子的()①质子数②中子数③质量数④核电荷数⑤核外电子数A.①②③B.①④⑤C.②③④D.①③⑤2核电荷数为11~17的元素,随核电荷数的递增而逐渐变小的是()A.电子层数B.最外层电子数C.原子半径D.元素最高化合价3元素的以下性质,随着原子序数的递增不呈现周期性变化的是()A.化合价B.原子半径C.元素原子的得电子能力和失电子能力D.相对原子质量4下列说法中正确的是()A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数B.非金属元素容易得到电子,表现正化合价C.最外层有2个电子的原子都是金属元素原子D.最外层有5个电子的原子都是非金属元素原子5已知下列元素的原子半径为:根据以上数据,磷原子的半径可能是()A.0.80×10-10 m B.1.10×10-10 mC.1.20×10-10 m D.0.70×10-10 m6原子半径由小到大且最高正价依次降低的是()A.Al、Mg、Na B.N、O、FC.Ar、Cl、S D.Cl、P、Si7下列各组给定原子序数的元素,不能..形成原子数之比为1∶1稳定化合物的是()A. 3和17B. 1和8C. 11和8D. 7和128某元素R的最高正价与负价的绝对值之差为2,其气态氢化物中含氢的质量分数为8.8%,试推断该元素是()A.N B.P C.S D.O9A、B、C、D四元素的核电荷数依次增加,它们的离子的电子层数相同且最外层电子数均为8。
A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。
回答下列问题:(1)四元素的符号依次是A________,B________,C________,D________;它们原子半径由大到小的顺序是________。
(2)试写出四元素的离子结构示意图A________,B________,C________,D________。
它们离子的半径由大到小的顺序________________。
(3)写出最高价氧化物对应水化物的化学式_______________________________________________________________________ _________。
(4)写出气态氢化物的分子式________。
10已知元素的电负性跟元素的原子半径一样,也是元素的一种基本性质。
下表给出了14种元素的电负性:试根据上表数据,结合元素周期律知识完成下列问题:元素的电负性具有的变化规律是_______________________________________________________________________ _。
参考答案1解析:原子序数是根据元素的核电荷数给元素编的序号。
原子序数=质子数=核电荷数=原子的核外电子数。
答案:B2解析:核电荷数为11~17的元素,电子层数相同,随着核电荷数的递增,最外层电子数由1逐渐增加到7,元素最高化合价由+1逐渐增加到+7,而原子半径逐渐变小。
答案:C3解析:根据元素周期律的内容可知,元素的化合价、原子半径及元素原子得电子和失电子能力都随原子序数的递增呈现周期性的变化,而相对原子质量一般随原子序数的递增呈现增大的趋势,绝不会出现周期性的变化。
答案:D4解析:最外层电子数为1或2的原子大多数是金属元素原子,但也有非金属元素原子,如H和He最外层电子数分别为1和2。
最外层电子数等于或大于4(小于8)的一般是非金属元素原子,但也有金属元素原子。
答案:A5解析:磷的原子序数在S和Si之间,故半径应在其间。
答案:B6解析:A项中Al→Mg→Na,具有相同电子层,且原子序数逐渐减小,故原子半径由小到大,最高正价由+3→+2→+1,符合题意。
B项中,从N→O→F,原子半径逐渐减小,最高正价N为+5。
O、F一般不呈现正价。
C项中,氩原子半径因测量标准与其他原子不一样,故不作比较。
Cl→S半径逐渐增大,最高正价由+7→+6。
D项中,Cl→P→Si随原子序数变小,原子半径逐渐增大,最高正价则由+7→+5→+4依次降低,符合题意。
答案:AD7解析:各选项对应的元素和构成符合要求的化合物依次是:A选项,锂和氯,LiCl;B选项,H和O,H2O2;C选项,Na和O,Na2O2。
只有D项中,N和Mg 不能形成原子数之比为1∶1稳定化合物,而是形成Mg3N2。
答案:D8解析:由题意知,最高正化合价-|负化合价|=2……①,而最高正化合价+|负化合价|=8……②,将②式-①式得:|负化合价|=3,该元素的负化合价为-3。
元素R的气态氢化物的化学式是RH3,氢元素的质量分数为3A r(H)A r®+3A r(H)×100%=8.8%,A r(R)=31,查表可知,R是磷元素。
答案:B9解析:由A原子的L层电子数与K、M层电子数之和相等,所以A的核电荷数为2×8=16,A为硫元素。
D原子的K、L层电子数之和等于其电子总数的一半,所以D原子的核电荷数是(2+8)×2=20,D为钙元素。
根据核电荷数依次增大,并都形成离子,排除氩和磷元素,B为氯元素,C为钾元素。
答案:(1)S Cl K CaClK>Ca>S>(3)H2SO4、HClO4、KOH 、Ca(OH)2(4)H2S、HCl10解析:元素的电负性也是元素的一种基本性质,因而随原子序数的递增应该呈周期性变化。
将表中14种元素按原子序数从小到大重新排列,应该能够观察出元素电负性的周期性变化规律:答案:随着元素原子序数(或核电荷数)的递增,元素的电负性呈现周期性变化:同周期从左往右逐渐增大第2课时元素周期表1由长周期元素和短周期元素共同组成的族是()A.0族B.副族C.主族D.Ⅷ族2IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。
下列关于Ds的说法不正确的是() A.Ds原子的电子层数为7 B.Ds是超铀元素C.Ds原子的质量数为110 D.Ds为金属元素3下列有关原子结构和元素周期律的表述正确的是()①原子序数为15的元素的最高化合价为+3②ⅦA族元素是同周期中非金属性最强的元素③第2周期ⅣA族元素的原子核电荷数和中子数一定为6④原子序数为12的元素位于元素周期表的第3周期ⅡA族A.①②B.①③C.②④D.③④4下列叙述中正确的是()A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B.除短周期外,其他周期均有18种元素C.副族元素中没有非金属元素D.碱金属元素是指ⅠA族的所有元素5下列说法中错误的是()A.原子及其离子的核外电子层数等于该元素所在的周期数B.元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素C.除氦外的稀有气体原子的最外层电子数都是8D.同一元素的各种同位素的物理性质、化学性质均相同6全国科学技术名词审定委员会近日公布:111号元素(符号为Rg)的中文名称为“钅仑”(读音同伦)。
下列说法正确的是()A.111号元素是第6周期、第ⅠA族的金属元素B.111号元素属于过渡元素C.111号元素为非金属元素D.111号元素质量数为1117某元素X的核外电子数等于核内中子数,取2.8 g该元素的单质与氧气充分作用,可得到6 g化合物XO2。
该元素在周期表中的位置是()A.第3周期B.第2周期C.ⅣA族D.ⅤA族8核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。
已知只有质子数或中子数为奇数的原子核有NMR现象。
试判断下列哪组原子均可产生NMR现象()A.18O、31P、119SnB.27Al、19F、12CC.元素周期表中ⅤA族所有元素的原子D.元素周期表中第1周期所有元素的原子9在下列各组元素中,除一种元素外,其余都可以按照某种共性归属一类,请选出各组的例外元素,并将该组其他元素的可能归属按所给六种类型的编号填入表内。
其他元素所属类型编号:①主族元素,②过渡元素,③同周期元素,④同主族元素,⑤金属元素,⑥非金属元素。
10有A、B、C、D、E五种短周期元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3∶4,且A、B、C分别与D形成三种化合物分子且所含的电子数相等,E的周期序数等于主族序数。
请回答:(1)X、Y、Z、W都是由上述元素中的两种组成的化合物,若X分子含4个原子核10个电子,则X的分子式为________。
已知Y被称为绿色氧化剂,Z与Y具有相同的电子数且经常联合在一起作为火箭推进器的燃料,则Y为________(填化学式),Z为________(填化学式),W是中学化学中常见的物质,工业用W冶炼铁,写出化学方程式:________________________________。
(2)E元素在周期表中的位置为________。
由B、C、D三种元素组成一种盐,写出该盐水溶液与烧碱浓溶液在加热条件下反应的离子方程式:______________________。
参考答案1解析:观察元素周期表的结构即可得出答案。
答案:AC2解析:该题利用元素周期表的知识推断未知元素的性质,考查了学生运用已学过的知识解决新问题的能力。
根据稀有气体的原子序数递增规律:He:2、Ne:10、Ar:18、Kr:36、Xe:54、Rn:86,第7周期元素从87号开始到118号结束,都是金属元素,A、D项正确。
铀是92号元素,原子序数大于92的元素称为超铀元素,B项正确。
Ds的原子序数为110,可知质子数等于110,但其中中子数不可能为0,所以,Ds原子的质量数大于110,C项不正确。
答案:C3解析:原子序数为15的元素是磷,最高正价为+5,①项错误;同一周期中从左至右元素的非金属性依次增强,ⅦA族元素是同周期中非金属性最强的元素,②正确;第2周期ⅣA族元素是碳元素,它有几种同位素,中子数分别为6、7、8个,③错误;原子序数为12的元素是镁,位于元素周期表的第3周期ⅡA族,④正确。
答案:C4解析:因为ⅥA族的氧元素没有+6价,ⅦA族的氟元素无正价,所以A错误;在元素周期表中,只有第4、5周期为18种元素,第6、7周期有32种元素,所以B错误;所有的副族元素和第Ⅷ族为金属元素,所以C正确;碱金属不包括第ⅠA的氢元素,所以D错误。
答案:C5解析:本题立足于课本内容,重点考查学生对周期表结构划分的基本情况。
A.对原子而言,核外电子层数即该元素所在周期数,离子则要有阴、阳之分,阳离子核外电子层数比元素所在周期数小1;B.周期表中从ⅢB族到ⅡB族10个纵列的元素属于过渡元素,全是金属元素,正确;C.正确;D.同位素之间的物理性质不同,化学性质相似。
