化学科普阅读练习
【化学】 化学科普阅读题练习题(含答案)经典
【化学】化学科普阅读题练习题(含答案)经典一、中考化学科普阅读题1.阅读下面科普短文。
土豆是继水稻、小麦、玉米之后的第四大粮食作物,含淀粉、蛋白质、维生素C等多种营养物质,是餐桌上的美味食材。
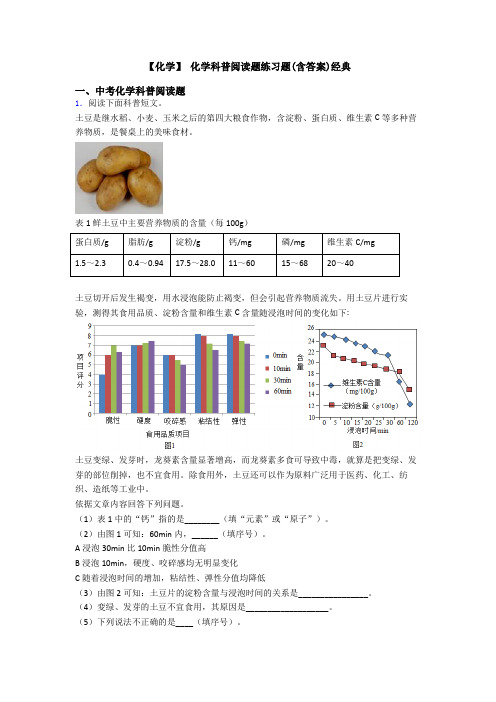
表1鲜土豆中主要营养物质的含量(每100g)蛋白质/g脂肪/g淀粉/g钙/mg磷/mg维生素C/mg1.5~2.30.4~0.9417.5~28.011~6015~6820~40土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。
用土豆片进行实验,测得其食用品质、淀粉含量和维生素C含量随浸泡时间的变化如下:土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒,就算是把变绿、发芽的部位削掉,也不宜食用。
除食用外,土豆还可以作为原料广泛用于医药、化工、纺织、造纸等工业中。
依据文章内容回答下列问题。
(1)表1中的“钙”指的是________(填“元素”或“原子”)。
(2)由图1可知:60min内,______(填序号)。
A浸泡30min比10min脆性分值高B浸泡10min,硬度、咬碎感均无明显变化C随着浸泡时间的增加,粘结性、弹性分值均降低(3)由图2可知:土豆片的淀粉含量与浸泡时间的关系是________________。
(4)変绿、发芽的土豆不宜食用,其原因是___________________。
(5)下列说法不正确的是____(填序号)。
A土豆是四大粮食作物之一 B土豆中维生素C含量最高C用水泡可防止土豆片褐変 D土豆开发应用的前景广阔【答案】元素 ABC 在其他条件相同时,在研究范围内,土豆片的淀粉含量随浸泡时间的延长而降低土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒 B 【解析】【分析】【详解】(1)物质都是由元素组成的,所以表1中的“钙”指的是元素;(2)A、由图1中的信息可知,浸泡30min比10min脆性分值高,故A正确;B、由图1中的信息可知,浸泡10min,硬度、咬碎感均无明显变化,故B正确;C、由图1中的信息可知,随着浸泡时间的增加,粘结性、弹性分值均降低,故C正确;(3)由图2提供的信息可知,在其他条件相同时,在研究范围内,土豆片的淀粉含量随着浸泡时间的延长而降低;(4)由题干提供的信息可知:土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒;(5)A、由题干“土豆是继水稻、小麦、玉米之后的第四大粮食作物”可知,A正确;B、由表1提供的信息可知,淀粉的含量最高,故B错误;C、由题干“土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。
【化学】化学化学科普阅读题练习题20篇

【化学】化学化学科普阅读题练习题20篇一、中考化学科普阅读题1.(5分)阅读下列科普材料,回答相关问题。
(材料1)1915年4月22日下午5时,在第一次世界大战两军对峙的比利时伊珀尔战场,趁着顺风,德军一声令下开启了大约6000只压缩氯气(Cl?)钢瓶。
霎时间,在长约60公里的战线上,黄绿色的云团飘向法军阵地。
所经之地绿色植被枯黄褪色;英法士兵先是咳嗽继而喘息,甚至死亡,部分逃到高高的山上的士兵活了下来;战场上的武器锈迹斑斑。
这就是战争史上第一次化学战。
(1)推测氯气可能具有的物理性质是o(2)推测氯气可能具有的化学性质是o(3)元素周期表中氯元素的信息如图所示,其原子的核外电子数为o(材料2)氯气可用于制备多种消毒剂。
①二氧化氯是一种高效、安全环保型杀菌消毒保鲜剂。
②漂白粉是一种广泛普及的杀菌消毒漂白剂,有效成分是次氯酸钙[Ca(ClO)2],其水溶液遇空气中的二氧化碳生成碳酸钙和次氯酸[HC1O],HClO起到杀菌、消毒、漂白的作用。
(1)①中二氧化氯的化学式为C102,其中氯元素的化合价为。
(2)②中发生反应的化学方程式为。
【答案】【材料1】(1)黄绿色气体(密度比空气大、刺激性气味)(2)毒性、与金属反应(氧化性、漂白性、腐蚀性)(3)17【材料2】(1)+4(2)Ca(ClO)2+H2O+CO产CaCO3J+2HClO【解析】试题分析:根据材料的叙述可知,【材料1】(1)氯气可能具有的物理性质是黄绿色气体(密度比空气大、刺激性气味);(2)氯气可能具有的化学性质是毒性、与金属反应(氧化性、漂白性、腐蚀性);(3)元素周期表中氯元素的原子中,具有质子数=核电荷数=核外电子数,故其原子的核外电子数为17;【材料2】(1)①中二氧化氯的化学式为C1O2,其中氯元素的化合价,可根据化学式中元素的化合价的代数和为0,故为+4价;(2)②中发生反应的化学方程式为Ca(ClO)2+H2O+CO2===CaCO3J+2HClO。
(化学)化学化学科普阅读题练习题含答案含解析

(化学)化学化学科普阅读题练习题含答案含解析一、中考化学科普阅读题1.⑴我国是一个海洋大国,海域面积十分辽阔。
习主席在三亚考察时指出,一定要向海洋进军,加快建设海洋强国。
加强创新协作,加快打造深海研发基地,加快发展深海科技事业,推动我国海洋科技全面发展。
海水中蕴含着丰富的化学资源,我们应予以合理开发及综合利用。
①海水淡化的常见方法有_____(至少答一条)。
②海水制镁工艺中,电解熔融氯化镁制取金属镁的化学方程式为_____。
③海水晒盐的基本原理为_____(选填“蒸发结晶”或“降温结晶”)。
④我国著名化学家_____创立了联合制碱法,极大优化了纯碱Na2CO3的生产工艺。
⑵我国有9900多万公顷盐碱地,根据土壤类型和气候条件,分为滨海盐渍区、黄淮海平原盐渍区、荒漠及荒漠草原盐渍区、草原盐渍区四大类型。
盐碱地影响农作物正常生长,农作物产量极低,甚至寸草不生。
盐碱土形成的根本原因在于水分状况不良,各种易溶性盐类在集盐地区的土壤表层逐渐积聚起来。
有些地区春季地表水分蒸发强烈,地下水中的盐分随毛管水上升而聚集在土壤表层,此即"返盐"季节;有些地区到了秋季,土壤中会析出芒硝(主要成分是Na2SO4•10H2O),人们将上述现象俗称为“春泛盐,秋泛硝”。
根据上述信息,试回答下列问题:①由图2可知,50℃时,两者中溶解度较大的物质是_____。
②将40℃等质量的NaCl和Na2SO4的饱和溶液同时降温到10℃,析出晶体较多的是_____。
③40℃时,将25gNa2SO4固体放入50g水中,充分溶解后,可得到Na2SO4的_____溶液。
(选填“饱和”或“不饱和”)④结合图2中的溶解度曲线,试解释“秋泛硝”的原理_____。
⑤盐碱地也是一种珍贵的土地资源,许多科技工作者正以满腔热情投入到治理盐碱地的工作中,目前已有许多可喜的实质性进展。
下列方法措施中,不能改良盐碱地的是_____(选填序号之一)。
化学科普阅读题专题(含答案)

化学科普阅读题专题(含答案)一、中考化学科普阅读题1.阅读下面科普短文。
2017年,我国在南海北部神狐海域进行的可燃冰试采获得成功。
你对可燃冰有多少了解呢?什么是可燃冰?可燃冰外观像冰,主要含甲烷水合物(由甲烷分子和水分子组成),还含少量二氧化碳等气体。
甲烷水合物的分子结构就像一个一个由若干水分子组成的笼子,每个笼子里“关”一个甲烷分子。
可燃冰是怎样形成的?可燃冰的形成要满足三个条件:(1)温度不能太高。
(2)压力要足够大。
(3)要有甲烷气源。
在上述三个条件都具备的情况下,天然气可与水生成甲烷水合物,分散在海底岩层的空隙中。
甲烷水合物能稳定存在的压强和温度范围如图所示:为什么开采困难?可燃冰开采的最大难点是保证甲烷气体不泄露、不引发温室效应,甲烷引发的温室效应比二氧化碳厉害10至20倍,可燃冰一离开海床便迅速分解,容易发生喷井意外,还可能会破坏地壳稳定平衡,引发海底塌方,导致大规模海啸。
可燃冰有哪些用途?一体积可燃冰可储载约164倍体积的甲烷气体,具有能量高、燃烧值大等优点,而且储量丰富,因而被各国视为未来石油天然气的替代能源。
甲烷还是重要的化工原料,可制造碳黑、乙炔、氰化氢等。
依据文章内容,回答下列问题:(1)可燃冰形成的适宜条件是_________。
A 高温高压B 低温高压C 低温低压(2)可燃冰作为能源的优点是_________________。
(3)甲烷燃烧的化学方程式为_________________。
(4)有关可燃冰的说法正确的是___________。
A 可燃冰不是冰B 可燃冰开采时若出现差错,可能引发严重的环境灾害C 在1atm和25℃时,可燃冰能稳定存在【答案】B 能量高,燃烧值大 CH4+2O2点燃CO2+2H2O AB【解析】【分析】【详解】(1)由题干信息可知,可燃冰形成的适宜条件是低温高压;故填:B;(2)可燃冰具有能量高、燃烧值大等优点,而且储量丰富;故填:能量高,燃烧值大;(3)甲烷与氧气在点燃的条件下反应生成水和二氧化碳;故填:CH4+2O2点燃CO2+2H2O;(4)A.可燃主要含甲烷水合物,冰的成分是水,可燃冰不是冰,说法正确;B.甲烷引发的温室效应比二氧化碳厉害10至20倍,可燃冰一离开海床便迅速分解,容易发生井喷意外,还可能会破坏地壳稳定平衡,引发海底塌方,导致大规模海啸,因此可燃冰开采时若出现差错,可能引发严重的环境灾害,说法正确;B.由图象可知,在1atm和25℃时,可燃冰不能稳定存在,说法错误。
化学化学科普阅读题练习题20篇

化学化学科普阅读题练习题20篇化学化学科普阅读题练习题20篇第一篇:化学与生活化学与我们的生活密切相关,它涉及到日常生活中的方方面面。
从我们吃的食物到我们居住的房屋,从我们穿的衣服到我们使用的电器,化学在其中扮演着重要的角色。
关键词:化学、生活、食品、材料、能源、健康第二篇:化学简史化学作为一门学科,有着悠久的历史。
从古代炼金术的发展到现代分子科学的兴起,化学史就是一部人类对物质世界认识不断深化的历史。
关键词:化学史、炼金术、化学分子、科学发现第三篇:化学元素周期表元素周期表是化学的重要工具,它按照元素原子核外电子排布规律,将元素进行了有序的排列。
元素周期表揭示了元素之间的内在联系,为预测元素性质提供了基础。
关键词:元素周期表、元素、电子排布、化学性质第四篇:化学键与分子结构化学键是原子间相互作用力的方式,分子结构则描述了分子中原子的空间排列。
理解化学键与分子结构是掌握化学反应和材料性质的基础。
关键词:化学键、分子结构、化学反应、材料科学第五篇:化学反应速率化学反应速率描述了化学反应进行的快慢。
通过对反应速率的测量和研究,我们可以更好地理解和控制化学反应过程。
关键词:化学反应速率、反应速度、控制化学反应第六篇:化学与环保化学在环境保护中发挥着重要作用。
通过研究污染物的化学性质,我们可以开发出新的环保技术和方法,减少环境污染。
关键词:化学、环保、污染、环境保护、可持续发展第七篇:化学与新材料新材料是当代科技发展的重要驱动力。
通过化学方法,我们可以设计和制造具有特殊性能的材料,满足各种需求。
关键词:化学、新材料、性能、制造、科技发展第八篇:化学与生命科学生命科学是研究生命现象和生命过程的科学。
化学在其中发挥着重要作用,通过研究生物分子的化学性质,我们可以更好地理解生命的本质。
关键词:化学、生命科学、生物分子、生命过程、生命本质第九篇:化学与能源能源是推动社会发展的基础。
通过化学方法,我们可以开发出新的能源转换技术和存储技术,为可持续发展提供支持。
化学科普阅读试题及答案

化学科普阅读试题及答案一、选择题1. 化学元素周期表中,氧元素的原子序数是多少?A. 6B. 8C. 16D. 18答案:C2. 以下哪种物质不属于碱?A. 氢氧化钠B. 氢氧化钾C. 硫酸D. 氨水答案:C3. 铁在空气中锈蚀的主要原因是?A. 氧气B. 水C. 氧气和水共同作用D. 温度答案:C二、填空题4. 请写出化学方程式中表示水的化学式:______。
答案:H2O5. 碳在氧气中燃烧的化学方程式是:______。
答案:C + O2 → CO2三、简答题6. 请简述什么是氧化还原反应?答案:氧化还原反应是指在化学反应中,原子或离子之间发生电子转移的过程。
在这种反应中,一个物质失去电子(被氧化),而另一个物质获得电子(被还原)。
7. 为什么说水是生命之源?答案:水是生命之源,因为它是所有生物体的基本组成部分,参与细胞的构成和代谢过程。
水还参与了生物体内的许多化学反应,如光合作用、呼吸作用等,是维持生命活动不可或缺的物质。
四、计算题8. 已知某化合物的化学式为H2SO4,求其相对分子质量。
答案:H2SO4的相对分子质量为2×1(氢)+ 32(硫)+ 4×16(氧)= 98。
五、实验题9. 描述如何通过实验验证氧气支持燃烧的性质。
答案:将一根燃烧的木条放入装有氧气的集气瓶中,观察到木条燃烧更加旺盛,说明氧气支持燃烧。
六、论述题10. 论述化学在环境保护中的作用。
答案:化学在环境保护中起着至关重要的作用。
通过化学方法可以处理和净化废水、废气和固体废物,减少对环境的污染。
此外,化学还可以开发和利用清洁能源,如太阳能、风能等,减少对化石燃料的依赖,从而降低温室气体排放,保护地球环境。
化学化学科普阅读题题20套(带答案)及解析

化学化学科普阅读题题20套(带答案)及解析一、中考化学科普阅读题1.宁厂古镇位于重庆巫溪县附近,是中国早期制盐地之一,距今约5000年之久。
其主要的工艺流程如下:先将盐卤(亦称卤水或卤汁)引入深达数米的贮卤池沉淀杂质,再经笕管导入纵向排列的数口铁锅中开始熬。
卤水先经大火煎煮,迅速蒸发水分,然后利用豆汁或蛋清、猪血等吸附硫酸钙等杂质,再用竹编的筛子舀起,称为“提浆”。
提浆之后的锅内盐卤“清澈见底”,之后用小火慢慢熬煮,适时下母子渣盐(盐种),促使卤水结晶成盐粒。
已经结晶的盐粒还需要经过淋花水的工序。
花水是一种卤汁,将卤汁一遍遍淋在刚刚结晶的盐粒上,洗去盐粒表面残留的杂质,增加盐粒的亮泽度。
之后滤去残留的水分,再转至烘干炕摊开烘干,最后打包、计重、入库房。
(1)“提浆”和实验室“过滤”一样,都是为了除去溶液中不溶性杂质,在实验室的过滤操作中必需要用到的玻璃仪器有烧杯、玻璃棒和____。
(2)熬盐和实验室的____原理相同。
(3)竹编的筛子相当于实验室的过滤操作中所用到的____。
(4)花水是氯化钠的____(填“饱和”或“不饱和”)溶液。
(5)氯化钠是重要的化工原料。
工业上通过电解饱和食盐水来大量制取烧碱, 同时得到二种副产物氢气和氯气,反应的化学方程式为____。
【答案】漏斗 蒸发 滤纸 饱和 2222NaCl 2H O2NaOH Cl H ++↑+↑通电 【解析】【分析】【详解】(1)过滤过程中用到玻璃仪器有烧杯玻璃棒漏斗,故填:漏斗;(2)熬盐和实验室蒸发的原理相同,故填:蒸发;(3)竹编的筛子起到过滤作用,相当于滤纸,故填:滤纸;(4)花水是一种卤汁,洗去盐粒表面残留的杂质,只去除杂质不溶解氯化钠,是氯化钠的饱和溶液,故填:饱和;(5)电解饱和食盐水制取烧碱, 同时得到副产物氢气和氯气,化学方程式为: 2222NaCl 2H O2NaOH Cl H ++↑+↑通电【点睛】 该题考察过滤操作的原理,及注意事项2.2016年1月29日《科技日报》报道:科学家首次将从空气捕获的二氧化碳用氢气将其转化为甲醇,同时有水生成。
化学科普阅读题专题含答案经典
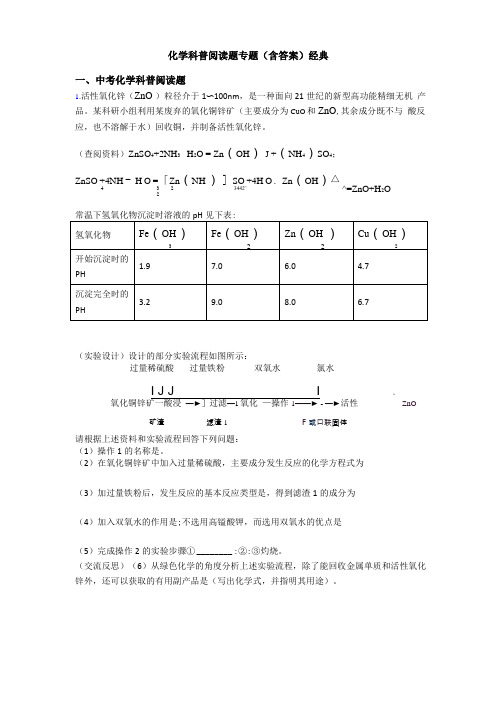
化学科普阅读题专题(含答案)经典一、中考化学科普阅读题1.活性氧化锌(ZnO )粒径介于1〜100nm ,是一种面向21世纪的新型高功能精细无机 产品。
某科研小组利用某废弃的氧化铜锌矿(主要成分为CuO 和ZnO ,其余成分既不与 酸反应,也不溶解于水)回收铜,并制备活性氧化锌。
(查阅资料)ZnSO 4+2NH 3 - H 2O = Zn (OH ) J +(NH 4)SO 4;ZnSO +4NH - H O =「Zn (NH ) ] SO +4H O . Zn (OH ) 4 3 2 3442’ 2(实验设计)设计的部分实验流程如图所示:过量稀硫酸 过量铁粉 双氧水 氯水I J JI 、 氧化铜锌矿一酸浸 —►]过滤—1氧化 —操作1——► - —►活性 __ ZnO矿渣 滤渣1 F 或口联固体 请根据上述资料和实验流程回答下列问题:(1)操作1的名称是。
(2)在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为(3)加过量铁粉后,发生反应的基本反应类型是,得到滤渣1的成分为(4)加入双氧水的作用是;不选用高镒酸钾,而选用双氧水的优点是(5)完成操作2的实验步骤① ________ :②:③灼烧。
(交流反思)(6)从绿色化学的角度分析上述实验流程,除了能回收金属单质和活性氧化 锌外,还可以获取的有用副产品是(写出化学式,并指明其用途)。
△^=ZnO+H 2O【答案】过滤CuO+H2sO4=CuSO4+H2O ;ZnO+H2sO4 =ZnSO4+H2。
置换反应Cu、Fe将FeSO 4 (Fe2+)氧化成Fe2(SO4)3 (Fe3+ ),以便在后续操作中将溶液中的铁元素除去不引入较难除去的杂质加入适量稀硫酸,调节溶液的pH至8.0过滤、洗涤、干燥Fe2O3作颜料、(NH4)2 sO4作化肥【解析】【分析】【详解】实验设计:(1)操作1是使不溶性物质氢氧化铁和其他可溶性物质分离的过程,为过滤;(2)在氧化铜锌矿中加入过量稀硫酸,目的是使氧化铜和氧化锌完全反应进入溶液,主要成分发生反应的化学方程式为:CuO+H2s04二Cu SO4+H2O、ZnO+H2SO4 =ZnSO4 +H2O ;(3)由于加入铁粉前是硫酸铜、硫酸锌以及剩余的硫酸的混合溶液,加入铁粉,反应的反应分别为:Fe+CuSO4=Cu+FeSO4 和Fe+H2sO4=FeSO4+H2T,都是单质和化合物反应生成新的单质和新的化合物,为置换反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
科普阅读理解练习1、阅读下面的科普短文空气质量与氮氧化物有着密切的关系。
一氧化氮和二氧化氮是两种重要的氮氧化物。
一氧化氮(化学式为NO)是一种无色气体,熔点-163.6℃,沸点-151℃,密度比空气略大,微溶于水。
NO不稳定,易于空气中氧气发生反应,生成红棕色有刺激性气味的二氧化氮(NO2)。
实验室用铜与稀硝酸反应来制备NO。
工业上可用氨气与氧气为原料,在加热和催化剂条件下制得一氧化氮。
汽车尾气(含有CO与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化转换器”,使CO与NO 反应,生成两种可参与大气生态环境循环的无毒气体。
NO被发现广泛分布于生物体内各组织中。
1992年被美国Science杂志评选为“明星分子”。
NO在心、脑血管调节等方面有着十分重要的生物学作用,是心脑血管的保护神。
依据文章内容,请回答下列问题:(1)NO的物理性质。
(2)NO不稳定的原因是。
(3)NO可用法收集。
(4)治理NO的化学方程式为。
(5)NO对人类有利的一面主要体现在。
虎门海水浸化法的办法是在海边挖两个大池注水后,将烟土抛入池中,浸泡后再投入生石灰,生石灰遇水沸腾,烟土溶解。
如今的超市中有一种称之“一拉热”方便加热食品,加热剂是分开包装的生石灰和水,使用时将绳子一拉,生石灰和水反应,放出热量,加热食品。
此法也可以用于制备氢氧化钙。
氢氧化钙是一种白色粉末状固体,加入水后,呈上下两层,上层水溶液称作澄清石灰水,下层悬浊液称作石灰乳或石灰浆。
上层清液澄清石灰水可以检验二氧化碳,下层浑浊液体石灰乳是一种建筑材料。
石灰乳也可以与纯碱进行苛化反应,用来制备烧碱。
根据以上科普短文,回答下列问题。
(1(2(3(4有人推算过:地球上现有的化石燃料只能再用100年。
那之后人类使用什么能源呢?有的科学家想把氢气作为未来的新能源,因为氢气具有资源丰富、放热量高以及无污染等优点。
目前工业上制取氢的方法主要是水煤气法(用碳和水蒸气高温生成一氧化碳和氢气)和电解水法。
可这两种方法都要消耗大量能量,现在科学家已开始用太阳光分解水来制取氢气。
氢气是非常危险的气体,动不动就爆炸。
要是能把氢气变成类似金属的固体,使用起来就既方便又安全了。
早在1926年,英国物理学家贝纳尔就提出了一个大胆的预言:只要有足够的压强,任何元素都能变成金属。
从理论上说,如果把氢气放到-260℃和250至260个标准大气压下,就能把氢原子非常紧密地挤在一起,从而得到金属氢。
到了20世纪70年代末,人类在高压技术方面取得了突破性进展,预言终于在实验室里实现了。
实验室里的金属氢,是在-268.8℃、107个标准大气压下得到的,金属氢形成后,可保持稳定的状态。
金属氢是一种室温下的超导材料,如果用在输电、配电和电机上,将引起电力工业的一场革命。
金属氢是一种高密度的储能材料,用它制成的高能燃料,是理想的火箭推进剂。
氢是宇宙物质中含量最多的元素,金属氢的出现,给人类利用氢资源带来了光明的前景!回答下列问题:(1)金属氢中氢元素的化合价为。
(2)得到金属氢的条件是。
(3)写出水煤气法制取氢气的化学方程式。
(4)氢气和金属氢物理性质的不同点是(至少写两点)。
(5)从微观的角度来分析,你认为氢气和金属氢的主要区别是钙元素与氧元素能组成两种物质——氧化钙和过氧化钙,它们在生产生活中有着非常广泛的用途。
自热米饭是一种常见的方便食品,军队作战时经常需要携带。
饭盒包装内带有一个密封的发热包(主要成份是生石灰),使用时将其与水混合,在3-5秒钟内即刻升温,温度高达200℃,从而将米饭快速加热。
氧化钙还可用作干燥剂。
它具有很好的干燥吸湿效果,且价格低廉。
一些休闲食品如“旺旺雪饼”中所使用的就是这种类型的干燥剂。
但由于其吸水生成的物质具有腐蚀性,逐渐被其他干燥剂替代。
在工业生产中,氧化钙还能起到燃煤固硫、保护环境的作用。
它可以吸收煤燃烧产生的二氧化硫,并与氧气一起反应转化为重要的化工原料——硫酸钙。
过氧化钙(CaO2)也为人类做出了很大的贡献。
它不仅可以被用作种子消毒剂、高温氧化剂,还可以做鱼池增氧剂。
长途运输鱼苗时,人们常在水中加入少量的过氧化钙固体,其与水反应生成氧气和一种常见的强碱,从而为鱼苗提供氧气。
问题:(1)自热米饭的发热包中发生反应的化学反应方程式是(2)你认为氧化钙作为食品干燥剂的优点与缺点是(3)过氧化钙中氧元素的化合价是(4)过氧化钙与水反应的化学方程式是(5)工业制备氧化钙的方法是油饼中有一股刺鼻的臭味,这是怎么回事儿呢?这种油饼可以食用吗?是否对人体有害呢?为了弄清该问题,查阅了以下资料:材料一:油条之所以出现了刺鼻的臭味,与其配方有关。
传统的油条制作工艺中,面粉中会加入一定量的明矾(含铝化合物)作为膨松剂,这样炸出来的油条膨松酥脆,但是长期食用这类油条,会造成人体摄入过量的铝,损害身体。
铝从人体内排出速度很慢,应该在食物中严格控制明矾的使用,并尽量少吃含铝的食物。
针对这一情况,早餐食品行业逐渐开始采用新的油条配方,即不使用明矾,改成使用名为碳酸氢铵(俗称臭粉)和碳酸氢钠(俗称小苏打)的食品添加剂,能解决油条铝含量超标的食品安全问题。
碳酸氢铵是白色粉末,略带氨臭,熔点107.5℃。
60℃以上迅速分解为氨气、二氧化碳和水。
是一种食品膨松剂,可用于制造面包、饼干时起疏松作用。
一般用在油炸品中时,氨气会在高温下挥发,但会残留一点氨气的气味,食客品尝时,就会感觉闻到了臭味。
其实碳酸氢铵是符合国家食品安全、允许使用的食品添加剂。
因为其反应产物也是人体代谢的产物,只要不过量使用,不会导致明显的健康问题,但会破坏食物中的某些营养成分如维生素等。
碳酸氢钠在受热时,也会发生分解,生成碳酸钠、水和二氧化碳,起到膨松面点的作用。
材料二:酵母是一种单细胞的兼性厌氧真核微生物,添加到面团后,可以通过自身的新陈代谢产生二氧化碳气体达到膨松的目的,这个过程通常就叫发酵。
酵母本身是由蛋白质和糖类构成的,并且含有丰富的B族维生素和钙、铁等元素,具有很高的营养价值。
但酵母作为面食膨松剂,需要足够的时间和温度产生二氧化碳。
请依据所学知识和材料内容回答下列问题:1、油饼中有刺激性臭味的原因是。
2、碳酸氢铵的物理性质有。
3、碳酸氢铵的化学性质有。
4、碳酸氢钠受热分解的化学反应方程式为。
5、在家中制作面点时,你会建议母亲用进行发酵,原因是。
镉(Cd)元素位于第五周期ⅡB族,原子序数是48;镉(Cd)是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8.64g/cm3,能导电、导热,有延展性;镉在潮湿空气中缓慢氧化并失去金属光泽;镉可溶于酸,但不溶于碱;镉在金属活动顺序表中位于铁、锡之间,镉元素在化合物中常显+2价。
水体中的镉元素通常以氯化镉的形式存在,氯化镉易溶于水,氢氧化镉、碳酸镉均难溶于水。
镉一直稳定地存在于大自然中,与人类相安无事。
是人类的工业革命将安静的镉发掘出来,成了一个日常生活中随处可见的“多面手”:塑胶、电镀金属外壳、颜料、油漆、染料、电池,都可见到镉的身影。
但是,镉并不是生命活动所必需的微量元素,镉对人体十分有害,摄入过量镉污染的食品和水,会引起肺和肾脏疾病。
目前治理被镉污染的河水或土壤方法是投入一些药剂,使Cd2+形成沉淀,以降Cd2+的浓度。
依据文章内容,回答下列问题:(1)单质镉的物理性质有;(2)镉与盐酸反应的化学方程式为。
(3)碳酸镉的化学式为;(4)目前治理被镉污染的河水或土壤的方法是投入一些药剂,使Cd 2+形成沉淀,以降Cd 2+的浓度。
若某河段主要含有氯化镉,你认为应投放的药剂有。
7、[科普阅读1] 碘钟反应碘钟反应是一种化学振荡反应。
在碘钟反应中,两种(或三种)无色的液体被混合在一起,并在几秒后变成碘蓝色。
碘钟反应可以通过不同的途径实现。
八秒一变化,溶液颜色呈现“无色→蓝黑色→无色→蓝黑色→……”的周期性变化,亦即反应体系在两种情况之间震荡。
在反应中双氧水与碘酸(HIO3)反应,得到碘单质(I2),当I2的形成积集到一定浓度会使淀粉变蓝,而过量的H2O2又会氧化I2生成碘酸和水。
使淀粉溶液褪色。
HIO3的形成积集到一定浓度又引发与H2O2新一轮反应的发生。
在生物体中也存在振荡现象,如动物心脏的有节律的跳动,生物钟等,实际上生态平衡离不开振荡现象。
问题1:生成I2的反应为5H2O2 + 2HIO3 = I2 + 5O2↑ + 6 。
问题2:H2O2与I2反应的化学方程式为。
[科普阅读2] 碘巴黎药剂师库特瓦大量制造硝石(KNO3),用海藻灰作为钾的来源。
1811年的一天,他添加硫酸后,蒸发时意外地发现一种美丽的紫色蒸气,竟然充满了实验室。
当蒸气在冷的物体上凝结时,它并不变成液体,而凝成片状的紫黑色晶体,并具有金属光泽。
他进一步研究发现这种新物质不易跟氧气或碳反应,但能与氢气和磷化合,也能与锌直接化合。
这种物质高温不能分解。
据此推想,它可能是一种新元素。
又经过几位科学家的继续研究,1814年该元素被定名为碘(I),取希腊文紫色的意义。
现已发现,碘在自然界中含量稀少,但以化合物形式广泛存在于自然界。
不论土块、岩石、水晶,还是海水、土壤、流水都含有碘。
动植物和人体也含碘。
碘单质(I2)微溶于水,易溶于乙醇、乙醚、甘油等有机溶剂。
碘遇淀粉呈蓝色,据此可以作定性、定量检测。
海藻中碘含量最丰富,并为提取纯碘的主要原料。
工业上碘亦来源于海藻,主要用于医药、燃料、感光材料及化学试剂等。
问题1:I2的物理性质。
(从短文中划出)问题2:I2的化学性质。
(从短文中划出)[科普阅读3]碘盐碘是人体必需的微量元素,缺乏时会危害大脑发育及正常功能,严重时会导致甲状腺肿大和克汀病。
食用加碘盐可有效地对人体补碘。
国家标准GB14880-1994中规定加碘盐中碘含量应为20-60mg/kg。
食盐中添加的碘酸钾(KIO3),可以通过单质碘(I2)与氯酸钾(KClO3)在一定条件下发生置换反应制得。
常用下表是某品牌“加碘食盐”包装袋上的部分文字说明:问题1:由食用方法、贮藏指南中,可以推测到碘酸钾具有的化学性质之一是_____ ______。
问题2:国家质量检测部门在集贸市场某商店抽样检测该品牌500 g袋装加碘食盐,经化验其中含碘酸钾30 mg,即含碘17.8 mg,则质量检测结论是________(填“合格”或“不合格”)产品。
