初三化学用语复习
(完整版)初三化学全册必背知识点(精华)

初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根铵根OH- NO3- CO32- SO4 2- NH4+2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O42、红色固体:Cu、Fe2O3、红磷▲硫磺:淡黄色▲绿色:碱式碳酸铜(铜锈,俗称铜绿)3、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。
初中化学用语(全)
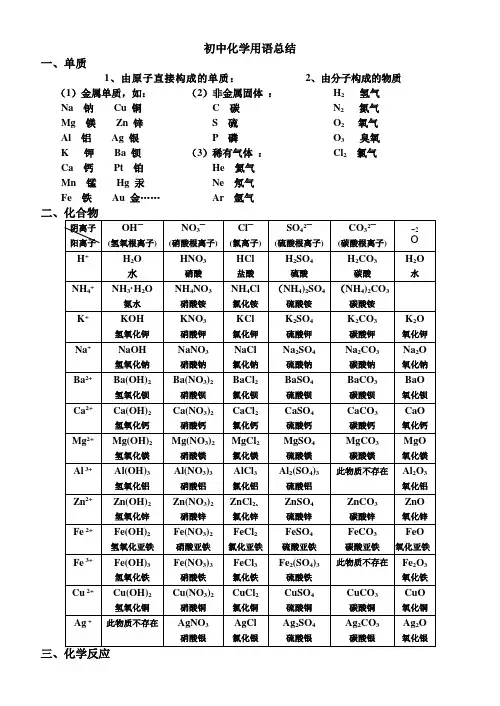
初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金……(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+2、红磷燃烧: 五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+12、二氧化碳溶于水:碳酸水二氧化碳→+13、生石灰遇水反应:氢氧化钙水氧化钙→+(二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2Og H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 23、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→−4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+ 金属活动顺序:3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+ 9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+ 8、硝酸与氢氧化铜反应:水硝酸铜氢氧化铜硝酸+→+9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:氯化钠碳酸钡碳酸钠氯化钡+→+10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应: 1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯22dP t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁:二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe COO e F ++高温6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C COCuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。
初三化学化学用语专题复习

初三化学化学用语专题一、基本概念:【概念复习】1、分子:是的最小粒子。
2、原子:是的最小粒子。
分子和原子的本质区别是在中,。
构成原子的三种粒子是、和;其中带正电,带负电荷,不带电荷;在原子中,数= = 。
在原子中,相对原子质量= 数+ 数。
3、离子:带电的原子或原子团叫离子。
常见的原子团有、、、、。
【同步练习】1、下列微粒中,能保持水化学性质的粒子是()A、H2B、O2C、2HD、H2O2、分子和原子的本质区别是()A、分子能构成物质,原子不能构成物质B、分子比原子运动速度慢C、分子在化学变化中可以再分,原子不能D、分子大,原子小3、构成物质的三种基本粒子是、和;例如:二氧化碳是由许多的构成的,钙是由许多的构成的,厨房内的调味品食盐(主要成分氯化钠)则是由和构成的。
【基本概念】4、元素:是具有相同的即的同一类原子总称为元素。
由此可见,元素的种类决定于原子的核电荷数即核内质子数。
【同步练习】4、每个人都有自己独特的气味,训练有素的警犬可以根据人体气味识别犯罪嫌疑人。
请从微观角度分析警犬能闻到犯罪嫌疑人气味的原因是 ( )A.分子的质量小 B.分子不断运动C.分子间有间隔 D.在化学变化中,分子可以再分,原子不能5、元素的化学性质决定于()A、中子数相同B、电子数相同C、最外层电子数相同D、质子数相同6、某矿泉水标签上印有水质成分如下(mg/L):硒:0.013;锶:0.596;锌:0.00162;钠:18.4;钙:4.69。
这里的硒、锶、锌、钠、钙是指()A、原子B、分子C、元素D、电子二、数字的表示意义1、前面的数字:表示微粒(包括分子、原子、离子的个数)▼▼▼化学式、元素符号、离子符号【同步练习】8、用元素符号或化学式及数字表示下列粒子:(1)两个氮分子;(2)三个钙原子;(3)两个水分子;(4)两个铁离子。
(5)两个五氧化二磷分子;(6)三个硫酸根离子。
(7)两个氢氧根离子;(8)两个硫离子。
初三化学中考必记的化学用语(带答案)
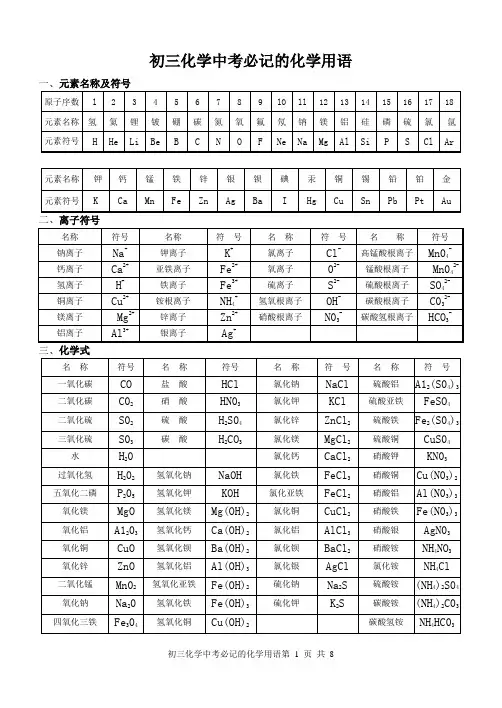
初三化学中考必记的化学用语一、元素名称及符号三、化学式四、化合价1.元素化合价:+1价:K、Na、Ag、H ;+2价:Ca、Mg、Ba、Zn、Hg ;+3价:Al ;+4价:Si ;+1、+2价Cu ;+2、+3价Fe ;+2、+4价C;+2、+4、+6价:S;-1价:F、Cl ;-2价:O、S;-3价:N、P2.原子团化合价:(化合价数目与离子所带电荷数目相等,符号相同,但位置顺序相反)名称:铵根氢氧根硝酸根硫酸根碳酸根磷酸根符号:NH4OH NO3SO4CO3PO4化合价:+1 -1 -1 -2 -2 -3离子符号:NH4+OH—NO3—SO42—CO32—PO43—五、金属活动性顺序(由强到弱):元素符号:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au元素名称:钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金六、部分酸、碱、盐的溶解性规律:1、酸:全部溶于水;2、碱:大多数不溶于水,NH3·H2O、KOH、NaOH、Ba(OH)2溶于水,Ca(OH)2微溶;3、盐:a、钾盐、钠盐、铵盐、硝酸盐四类盐都易溶于水;b、盐酸盐(即氯化物)绝大多数溶于水,只有AgCl不溶于水;c、硫酸盐绝大多数溶于水,只有BaSO4不溶于水,Ag2SO4、CaSO4微溶于水;d、碳酸盐绝大多数不溶于水,Na2CO3、K2CO3、(NH4)2CO3溶于水,MgCO3微溶于水。
七、物质的俗名、学名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)硫磺、硫:S(4) 生石灰、氧化钙:CaO (5)干冰(固体二氧化碳):CO2 (6)盐酸、氢氯酸:HCl (7)亚硫酸:H2SO3(8)氢硫酸:H2S (9)熟石灰、消石灰、氢氧化钙:Ca(OH)2 (10)苛性钠、火碱、烧碱:NaOH (11)食盐氯化钠:NaCl(12)纯碱、碳酸钠:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3·10H2O(13)碳酸氢钠、酸式碳酸钠:NaHCO3(也叫小苏打)碳铵、碳酸氢铵:NH4HCO3(14)胆矾、蓝矾、硫酸铜晶体:CuSO4·5H2O(五水合硫酸铜)(15)铜绿、孔雀石、碱式碳酸铜:Cu2(OH)2CO3(分解生成三种氧化物的物质)(16)甲醇:CH3OH 有毒、失明、死亡(17)酒精、乙醇:C2H5OH (18) )氨气:NH3(碱性气体)(19)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(20) 氨水、一水合氨:NH3·H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(21)亚硝酸钠:NaNO2(工业用盐、有毒)八、常见物质的颜色及状态1、白色固体:白磷P、P2O5、MgO、CaO、NaOH、Ca(OH)2、KClO3、KCl、NaCl、Na2CO3、NaHCO3、无水CuSO4;CaCO3、BaCO3、Mg(OH)2、AgCl、BaSO4;银白色固体:铁(铁粉为黑色)、铝、镁等多数金属(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4、I2为紫黑色(碘蒸气为紫红色)3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、绿色固体:Cu(OH)2CO3、K2MnO4 蓝色固体:CuSO4·5H2O 淡黄色固体:S5、溶液的颜色:含Cu2+的溶液——蓝色;含Fe2+的溶液——浅绿色;含Fe3+的溶液——黄色,含MnO4—高锰酸根离子的溶液——紫红色;其余溶液一般——无色。
化学常见用语

(一)化学用语1.元素符号:氢H 氦He锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P硫S 氯Cl 氩Ar钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 锡Sn 铅Pb (氢H)铜Cu 汞Hg 银Ag 铂Pt 金Au2.化学式:气体:氧气O2氢气H2氮气N2氯气Cl2二氧化碳CO2二氧化硫SO2一氧化碳CO 二氧化氮NO2甲烷CH4氨气NH3氯化氢HCl固体:白色:五氧化二磷P2O 5氧化镁MgO 氯酸钾KClO3碳酸钙CaCO3硫酸钡BaSO4氯化银AgCl 生石灰CaO 熟石灰Ca(OH) 2黑色:木炭C 氧化铜CuO 四氧化三铁Fe3O4二氧化锰MnO2蓝色:胆矾CuSO4 . 5H2O 氢氧化铜Cu(OH) 2绿色:碱式碳酸铜Cu2 (OH) 2CO3红褐色:氧化铁(铁锈)Fe2O3氢氧化铁Fe(OH) 3常见的酸:硫酸H2SO4盐酸HCl 硝酸HNO3碳酸H2CO3常见的碱:氢氧化钠(烧碱,火碱,苛性钠)NaOH 熟石灰Ca(OH) 2常见的盐:氯化钠NaCl 氯化钡BaCl2硝酸银AgNO3碳酸钠(纯碱)Na2CO3氯化铁FeCl33.离子符号:氢离子H+钠离子Na+镁离子Mg2+氯离子Cl--离子Ag+钙离子Ca2+钡离子Ba2+硫离子S2--硝酸根离子NO3--氢氧根离子OH-- 硫酸根离子SO42--碳酸根离子CO32--4.化学方程式:化合反应:木炭充分燃烧:木炭不完全燃烧:硫的燃烧:磷的燃烧:铁丝燃烧:镁条燃烧:氢气燃烧:一氧化碳燃烧:碳还原二氧化碳:二氧化碳与水反应分解反应:加热氯酸钾:加热高锰酸钾:加热碱式碳酸铜:电解水:煅烧石灰石:氢氧化铁受热分解:碳酸分解:氧化汞受热分解:置换反应:锌和稀硫酸反应,镁和稀硫酸反应:铁和稀盐酸反应:木炭还原氧化铜:氢气还原氧化铜:锌和硫酸铜溶液反应:复分解反应:二氧化碳通入澄清石灰水:实验室制取二氧化碳:碳酸钠与盐酸反应:其他反应类型:甲烷燃烧:一氧化碳还原氧化铜:炼铁的原理:(一)化学用语1.元素符号:氢_______ 氦_______锂Li 铍Be 硼B 碳______ 氮______ 氧_____ 氟F 氖_______钠____镁____铝___ 硅_______ 磷_______ 硫_______ 氯______ 氩_______钾______ 钙______ 钠______ 镁______ 铝______ 锌_______ 铁_______锡Sn 铅Pb (氢_______)铜_______ 汞_______ 银_______ 铂Pt 金Au2.化学式:A.气体:氧气_______ 氢气_______ 氮气_______ 氯气_______ 二氧化碳_______ 二氧化硫_______ 一氧化碳_______ 二氧化氮_______甲烷_______ 氨气_______ 氯化氢_______B.常见物质颜色:____色:五氧化二磷_______ 氧化镁_______ 氯酸钾_______ 碳酸钙_______ 硫酸钡_______ 氯化银_______ 生石灰_______ 熟石灰_______镁_______、铝_______、纯铁_______、水银_______、白磷_______、碳酸钙_______、碳酸钡___________色:木炭_______ 氧化铜_______ 四氧化三铁_______ 二氧化锰_______无色:水、金刚石、许多无色溶液、大多数气体。
初中化学用语汇总

初中化学用语汇总1. 原子:构成分子的最小粒子。
2. 元素:由同种原子组成的物质。
4. 分子:由两个及以上原子组成的不带电荷的粒子。
6. 原子量:一个原子质量单位。
8. 周期表:元素根据其原子核结构的排列方式排列的表格。
9. 金属:具有良好的导电性和热传导性质的物质。
11. 金属元素:处于周期表左侧的元素。
16. 原子核:由质子和中子组成的原子中心部分。
17. 共价键:由电子对共享形成的键。
18. 离子键:带正电荷和负电荷之间的相互作用。
21. 化学键:元素通过共享或转移电子形成的化学物质的力。
22. 化学式:用元素符号表示化合物的组成。
23. 反应物:在化学反应中参与反应的物质。
25. 化学反应:物质之间的化学相互作用。
26. 酸:会释放出氢离子的物质。
28. 盐:由阳离子和阴离子组成的离子化合物。
30. 溶解:由固体或气体转变为液体。
31. 溶质:溶解在溶剂中的物质。
34. 沉淀:在溶液中形成的固体颗粒。
36. 电离:在溶液中将电解质分解为离子。
39. 化学平衡:反应物和生成物在化学反应中达到平衡状态。
40. 配位化合物:由中心金属离子和其它分子和离子中的原子和分子共价结合而成的化合物。
41. 化学式计算:根据化学式计算元素的质量。
42. 摩尔质量:化学式中一个摩尔的质量。
43. 密度:单位体积内的物质质量。
44. 燃烧:化合物与氧气彻底反应的化学反应。
46. 温度:温度代表了物体内部分子的平均运动速度。
47. 热力学系统:研究热和压力与化学反应之间的关系。
48. 热能:热能是物体或系统储存的能量。
49. 热动力学:热的能量学,研究物质内部热运动的规律。
50. 热量:由于温度差异而流动的能量。
51. 热容:物质单位质量的温度变化时吸收或释放的热量。
52. 热传导:热能通过物质的传递。
53. 热平衡:两个物体之间热能的交换达到相同的温度。
54. 热力学第一性原理:能量守恒。
55. 内能:热力学系统内分子内部相互作用引起的能量总和。
初三化学化学用语专题复习
初三化学专题复习1——化学用语一、元素符号1、写出下列元素的符号(教材62页27种元素的符号)。
氢氦碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙锰铁铜锌银钡铂金汞碘2、默写1~20号元素的名称及符号。
;;;。
二、离子符号(写出下列离子的符号)铜离子锌离子钡离子铁离子亚铁离子银离子氢离子氧离子氟离子钠离子镁离子铝离子硫离子氯离子钾离子钙离子氢氧根离子硝酸根离子碳酸根离子硫酸根离子铵根离子三、原子或离子结构示意图(写出下列原子或离子的符号并画出结构示意图。
)氢原子氦原子碳原子氮原子氧离子氟离子氖原子钠离子镁离子铝离子硅原子磷原子硫离子氯离子氩原子钾离子钙离子四、化学式1、单质:氧气氮气氢气氯气氦气氖气氩气碳(金刚石、石墨)硫磷汞铁铜镁铝钾钙钠银锌2、化合物:高锰酸钾锰酸钾氯酸钾氯化钾硫酸铜硫酸亚铁碳酸碳酸钙(石灰石、大理石)氯化钙氯化氢(盐酸)碳酸钠氯化钠氢氧化钙3、氧化物:二氧化碳(干冰)二氧化硫二氧化氮一氧化碳(煤气)水过氧化氢二氧化锰五氧化二磷四氧化三铁氧化铁氧化亚铁氧化铝氧化铜氧化汞氧化镁氧化钙(生石灰)五.化合价1.默写常见元素的化合价(10句)2.默写常见原子团的化合价(4句)3.写出下列元素或原子团在化合物中的化合价氢氧化物中的氧过氧化物中的氧氯化物中的氯碳氟钠镁铝硅磷硫氮钾钙钡锌铜汞银铁氢氧根硝酸根硫酸根碳酸根铵根六、化学方程式(1~6单元重要的22个化学方程式)(1)白磷(红磷)燃烧(2)木炭充分燃烧和不充分燃烧(3)细铁丝在氧气中燃烧(4)镁条燃烧(5)氢气燃烧(6)一氧化碳燃烧(7)电解水(8)用过氧化氢溶液制取氧气(9)用氯酸钾制取氧气(10)用高锰酸钾制取氧气(11)铁和硫酸铜溶液反应(12)木炭还原氧化铜(13)木炭和二氧化碳反应(14)一氧化碳还原氧化铜(15)氢气还原氧化铜(16)实验室制取二氧化碳(17)碳酸钠和稀盐酸反应(18)二氧化碳使石蕊溶液变红的原因(19)碳酸分解(20)二氧化碳使澄清的石灰水变浑浊的原因(21)高温煅烧石灰石※化学符号过关练习:(用化学用语填空)(1) 保持水的化学性质的微粒是(2) 2个亚铁离子(3)2个氢原子(4) 五氧化二氮分子(5)地壳中含量最高的金属元素(6)二氧化硫(7)2个氢分子_________ (8)2个硫酸根离子________(9)3个硝酸根离子(10) 四个二氧化碳分子(11)写出氧化铁的化学式并标出其中铁元素的化合价(12)空气中含量最多的气体(13)人体中含量最多的物质(14)用于人工降雨的干冰(15) 三个铁原子(16) 写出过氧化氢的化学式并标出其中氧元素的化合价(17)2个氢氧根离子(18)2个硫离子(19)3个铵根离子(20)两个氢离子(21)写出氯化亚铁的化学式并标出其中铁元素的化合价(22)地壳中含量最多的元素(23)写出五氧化二磷的化学式,并标出其中磷元素的化合价(24)氯化亚铁中的阳离子(25)2个氯原子(26)能与血液里的血红蛋白结合造成人体中毒的气体_(27)3个锌原子(28)3个铁离子_____________ (29)写出氧化铝的化学式并标出其中铝元素的化合价(30)2个氮分子(31)2个钾离子(32)2个铝离子____________(33)5个碳酸根离子(34)3个镁离子(35)写出高锰酸钾的化学式并标出其中锰元素的化合价(36)写出氯酸钾的化学式并标出其中氯元素的化合价(37)2个钙离子(38)氧化亚铁(39)1个氟离子(40)2个钠离子(41)写出锰酸钾的化学式并标出其中锰元素的化合价(42)写出硝酸铜的化学式并标出其中铜元素的化合价(43)2个氯离子(44)2个氯分子(45)地壳中含量最多的非金属元素与最多的金属元素形成的化合物(46)写出碳酸钠的化学式并标出其中碳元素的化合价(47)水银(48)氩气(49)地壳中含量最多的非金属元素形成的离子(50)3个二氧化氮分子(51)相对分子质量最小的物质(52)温度计中填充的液态金属(53)大理石的主要成分(54)地壳中含量最多的金属元素形成的离子(55)2个氮原子(56)相对分子质量最小的氧化物(57)2个氢离子(58) 水通电分解过程中,不变的微粒是(59)氯化钠中的阴离子(60)写出氢氧化亚铁的化学式并标出其中铁元素的化合价。
(完整版)初三化学全册必背知识点(精华)
初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根铵根OH- NO3- CO32- SO4 2- NH4+2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O42、红色固体:Cu、Fe2O3、红磷▲硫磺:淡黄色▲绿色:碱式碳酸铜(铜锈,俗称铜绿)3、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。
九年级化学化学用语复习资料
九年级化学化学用语复习资料一、常见的元素符号:氢氦碳氮氧氖钠镁铝硅磷硫氯氩钾钙锰铁铜银钡金汞碘锌铅溴二、常见的离子符号:氢离子氧离子钠离子镁离子铝离子硫离子氯离子钙离子铁离子亚铁离子铜离子钾离子银离子锌离子钡离子氢氧根离子硝酸根离子碳酸根离子硫酸根离子铵根离子三、常见物质化学式:单质:氧气氮气氢气氯气碘碳60化合物:水二氧化碳二氧化硫氧化汞氧化镁氧化铜氧化钙氧化铁氧化铝氨气甲烷乙醇乙酸(醋酸)葡萄糖四氧化三铁五氧化二磷二氧化氮二氧化锰一氧化碳高锰酸钾锰酸钾氯酸钾氯化钾氯化钠氯化氢氯化镁氯化钙氯化铜氯化锌(三)氯化铁氯化亚铁氯化铝过氧化氢碳酸硫酸硝酸盐酸氢氧化钠氢氧化钙氢氧化钾氢氧化铜氢氧化铁氢氧化亚铁氢氧化铝氢氧化镁氢氧化钡碳酸钙碳酸钠碳酸钡碳酸钾硫酸铜硫酸钠硫酸亚铁硫酸锌硫酸钾硫酸镁硫酸铝硝酸铵硝酸银亚硝酸钠NaNO2硝酸铜硝酸铁四、常见的化学用语:两个磷原子三个二氧化碳分子两个氢离子两个镁离子三个氢氧根离子三个硫酸根离子两个铵根离子两个碳酸根离子两个硝酸根离子带两个单位正电荷的钙离子带两个单位负电荷的硫离子氧化铁中铁的化合价为+3价二氧化硅中硅的化合价为+4价五、常见的化学方程式:化合反应:碳在氧气中燃烧;硫在氧气中燃烧;磷在氧气中燃烧;镁在氧气中燃烧;铁在氧气中燃烧;氢气在氧气中燃烧;汞在氧气中加热;铜在氧气中加热;二氧化碳与水反应;一氧化碳在氧气中燃烧;二氧化碳与红热的碳反应;氧化钙与水反应生成氢氧化钙:;分解反应:加热高锰酸钾制氧气;加热氯酸钾和二氧化锰制氧气;分解过氧化氢制氧气;电解水;碳酸受热分解;高温锻烧石灰石;置换反应:加热时氢气还原氧化铜;铁与硫酸铜反应生成铜和硫酸亚铁;高温时碳与氧化铜反应:;高温时碳与氧化铁反应:;高温时碳与水反应生成氢气和一氧化碳;镁与盐酸反应生成氯化镁和氢气;锌与盐酸反应生成氯化锌和氢气;铁与盐酸反应生成氯化亚铁和氢气;镁与硫酸反应生成硫酸镁和氢气;锌与硫酸反应生成硫酸锌和氢气;铁与硫酸反应生成硫酸亚铁和氢气;铜与硝酸银反应生成银和硝酸铜;铝与硫酸铜反应生成铜和硫酸铝:;锌与硫酸铜反应生成铜和硫酸锌;其他反应:甲烷在氧气中燃烧;乙醇在氧气中燃烧;二氧化碳与石灰水反应:;实验室制二氧化碳;氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜(难溶);碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳(泡沫灭火器原理);一氧化碳在加热时还原氧化铜;高温时CO还原氧化铁生成铁和二氧化碳;。
九年级化学化学用语复习
九年级化学化学用语复习在九年级学习化学时,我们学习了许多重要的化学用语。
这些化学用语对于理解化学概念和现象非常重要,同时也是后续化学学习的基础。
本文将对九年级化学中涉及的一些重要化学用语进行复习和总结。
1. 元素(Element)元素是由相同类型的原子组成的纯物质。
每个元素都有自己的原子序数,原子序数决定了元素的化学性质和原子结构。
例如,氢、氧和铁都是元素。
在化学符号中,元素用拉丁字母表示,如H代表氢,O代表氧。
2. 化合物(Compound)化合物是由两种或更多不同元素的原子通过化学键结合在一起形成的物质。
化合物具有独特的化学和物理性质,其成分比例是恒定的。
例如,水(H2O)是由氢和氧元素组成的化合物。
3. 混合物(Mixture)混合物是由两种或更多物质的粒子混合在一起形成的物质。
混合物的组成可以有多种比例,可以通过物理方法进行分离。
例如,沙和水的混合物可以通过过滤来分离。
4. 原子(Atom)原子是构成所有物质的最小单位。
它由质子(带正电荷)、中子(无电荷)和电子(带负电荷)组成。
原子的核心(即原子核)由质子和中子组成,而电子以围绕核心的轨道中运动。
5. 分子(Molecule)分子是由两个或更多原子通过共用电子成对结合在一起形成的最小化学单位。
分子可以是同种元素(如氧气,O2)或不同元素(如水,H2O)。
分子中的原子通过化学键连接在一起。
6. 离子(Ion)离子是带电的原子或原子团。
当原子失去或获得电子时,会形成带正电荷(正离子)或带负电荷(负离子)的离子。
例如,氯原子(Cl)获得一个电子就成为氯离子(Cl-)。
7. 反应物(Reactant)和生成物(Product)化学反应发生时,参与反应的物质称为反应物,而反应后生成的新物质称为生成物。
化学反应通常用化学方程式表示,方程式中将反应物和生成物用化学式表示。
8. 摩尔质量(Molar Mass)摩尔质量是指一个物质中1摩尔(即6.02×1023个粒子)的质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学用语专题复习
2课时
学习目标:
1.初中阶段31个元素符号,按顺序会读会写,注意规范书写;
2.知道元素符号的意义;
3.学会利用化合价去确定物质的化学式;
4.会求某元素的化合价;
5.化学式的有关计算;
6.正确书写化学方程式;
7.化学方程式的简单计算;
一、元素符号与原子团(根)符号
1.考纲要求,会正确书写下列各元素的元素符号:
注意:①书写元素符号注意大小写,第一个字母第二个字母
氢、氦、锂、铍、硼、碳、氮、氧、氟、氖、钠、镁、铝、硅、磷、硫、氯、氩、钾、钙、锰、铁、铜、锌、溴、银、碘、钡、金、汞、铅
2.“5个原子团(根)”
氢氧根硝酸根碳酸根硫酸根铵根
二、元素的分类
1.元素大约有100多种,为了更好地研究,有必要对元素进行。
元素可以分为:、、
【练习1】
1.写出下列元素的名称或符号并判断下列元素的类别。
铁铝Mg Na 铜锌
汞氢氧氮氯氟
氦氖氩碳硫磷
溴
2.判断下列元素符号书写是否正确,错误的请用红笔更正。
氯:cL 铝:Cl 氯:Al 锌:Xi 钙:Ka
g u
镁:mg 镁:M 铜:C 锰:MN 溴:Xu
So2 H2o
归纳
【练习2】
1.判断下列元素是金属元素、非金属元素或稀有气体。
铁铜镁钡汞
Mg Na Li Ca 铷
·金属元素偏旁为
碳硫磷氢氧
氯氮溴
氦氖氩
·非金属元素偏旁为偏旁为表明一般情况下它的单质为固体;偏旁为表明一样情况下它的单质为气体;偏旁为表明一般情况下它的单质为液体。
·稀有气体有
2.画出下列原子的结构示意图,并判断属于金属元素还是非金属元素还是稀
有气体。
·归纳:可以通过画出原子结构示意图,根据判断;若最外层电子数则为金属元素;若最外层电子数则为非金属元素;若最外层电子数为填满状态(对第一层来说填满为个,“288”相对稳定结构)。
【练习3】把下列物质进行分类并在横线上写出它们的化学式。
氧气、氢气、氮气、氖气、氦气、氯气、镁、铜、铁、汞、铝、硫、磷、碳、硅、锌。
金属:固态非金属:
稀有气体:双原子气体:
三、物质的分类
【练习】
(1)分类在人类活动中常见吗?
1.化学是研究;世界上物质种类(多、少);人类为了更好地研究物质,有必要对物质进行;请你用大括号对物质进行分类。
(2)将下列物质进行分类并养成见到名称写出它们的化学式的习惯。
①空气②洁净的空气③清新的空气④自来水⑤海水⑥河水⑦雪碧⑧可乐⑨大理石⑩冰与水混合物
属于纯净物的是
属于混合物的是
(3)将下列物质进行分类。
(养成见到名称写化学式的习惯)
①空气②氧气③液氧④水蒸气⑤二氧化碳⑥高锰酸钾⑦铁粉⑧氮气⑨石灰石
属于混合物的是属于纯净物的是
属于单质的是属于化合物的是
属于氧化物的是
(4)下列各图中和分别表示两种不同元素的原子,其中表示混合物
的是;表示纯净物的是;表示单质的是
表示化合物的是。
四、化学式的书写
1.单质化学式的书写。
氧气氢气氮气氯气氟气碘单质
氦气氖气氩气铁铝镁铜
碳硫磷
·归纳方法
(1)单质的化学式不用利用化合价去确定,因为单质中元素的化合价为0;(2)从单质化学式可以看出,C、S、P、Fe等由直接构成,H2、O2等由直接构成。
2.化合物化学式的书写。
利用标化合价去确定物质的化学式。
(1)化合价口诀
一价氢铵(ǎn)钠钾银,二价镁钙锌钡子。
三铝四硅五氮磷,一二铜二三铁,二四六硫二四碳。
负一氯硝氢氧根,负二氧硫碳酸根。
注:+2价的铁为;﹢3价的铁为;+1价的铜为;﹢2价的铜为;
(2)用化学式去确定化合价。
写出下列物质的化学式,并归纳书写方法。
二氧化硫二氧化碳五氧化二磷水
氯化钠氯化镁氯化钙氯化氢氯化钡
氧化镁氧化铜氧化铝氧化铁氧化亚铁
氢氧化钠氢氧化钡氢氧化镁氢氧化铝
氢氧化钙氢氧化亚铁氢氧化铁氢氧化亚铜
硫酸钙硫酸铜硫酸钠硫酸铵
碳酸钙碳酸钠碳酸钾碳酸钡
硝酸钡硝酸钙硝酸铁硝酸铵
硫酸盐酸碳酸硝酸
(3)找出下列书写常见的错误并改正。
氧化镁:Mg2O2氧化铜:Cu2O2氢氧化钠:Na(OH)
氢氧化钙:CaOH2(Na)2Co3
·归纳方法
1.书写规则。
先念写,先后念。
化合价正写在,负写在
2.书写步骤。
写出元素符号,对应标化合价,取绝对值,约分,交叉。
3.什么情况下要加括号?
四、离子符号的书写
1.离子是通过电子形成的。
2.画出Na、Cl、Mg原子结构示意图
Na原子容易个电子,形成(填符号,下同);Cl原子容易个电子,形成;Mg原子易个电子,形成。
3.离子符号的书写。
【练习】例如:氢(H)的化合价为+1价,氢离子:H+
(1)镁离子钠离子氯离子铝离子
氧离子硫离子硫酸根离子氢氧根离子
硝酸根离子碳酸根离子铵根离子亚铁离子
·归纳方法
(1)可以通过画出原子结构示意图,判断得失电子写出离子符号。
(2)离子所带的电荷数与化合价数值相等,书写顺序不同。
4.如何根据结构示意图去判断微粒为原子、离子?判断下列微粒属于原子还是离子(用编号填空)。
(养成见到结构示意图写出微粒符号的习惯)
属于原子的粒子是;属于阳离子的是;属于阴离子是,达到稳定结构的是。
5.下列是五种粒子的结构示意图。
(1)图中粒子共表示种元素,C所表示的元素位于元素周期表的第周期。
(2)图中表示阴离子的是(填字母),E的粒子符号是
·归纳方法
1.用质子数(圈内的数)—核外电子数。
若>0,则为离子;若<0,则为离子。
2.元素的种类由决定。
元素的化学性质由决定。
五、各种化学用语的涵义
1.元素符号的涵义
①宏观:表示;②微观:表示;另:对于金属元素、固态非金属、稀有气体元素的元素符号还能表示,如:铁(Fe)硫(S)、氦(He)等。
【练习】
(1)H:①表示;②表示。
(2)Fe:①表示;②表示。
(3)2个氢原子3个钾离子5O 2个氧气分子2个氢氧根离子4个硫酸根离子
2.化学式的意义
(1)宏观:①表示;②表示
微观:①表示;②表示
【练习】
(1)H2O:宏观:①;②
微观:①;②
(2)1个水分子;2个水分子;5个五氧化二磷分子
3.化学方程式的意义
点燃
(1)C+O2CO2
宏观:(1)表示和在条件下反应生成了;(2)表示每份质量的C和每质量的O2反应生成质量的CO2。
微观:表示个碳原子和1个反应生成分子。
4.离子符号的意义
例如:mR n±
(1)m表示有m个这样的微粒;(2)n表示1个R离子带的电荷数。
【练习】
(2)Na+表示
(3)3个钠离子(4)2个氯离子(5)2个氢氧根离子
六、化学式的有关计算
1.计算某元素的化合价。
典例:已知Na2FeO4是一种净水剂,求Fe元素的化合价。
解:假设Fe元素的化合价为x。
+1×2+x+(-2)×4=0,解得x=+6.
【练习】
(1)已知食盐中加碘盐加入的是KIO3,求I元素的化合价。
(2)含磷洗衣粉中含有Na5P3O10,求P元素的化合价。
(3)偏钛酸钡(Ba x TiO3)中钛元素的化合价为+4价,则x为
(4)IO4-,求I元素的化合价。
2.求相对分子质量(Mr)
【练习】求出下列物质的相对分子质量(H-1 O-16 C-12 Na-23 Cl-35.5)
(1)H2O (2)CO2(3)C a(OH)2(4)Na2CO3(5)CH3COOH (6)C2H5OH
3.已知醋酸化学式:CH3COOH。
(1)醋酸由种元素组成;
(2)醋酸由构成;
(3)1个醋酸分子由构成;
(4)1个醋酸分子有个原子;
(5)碳原子与氢原子个数比为
(6)碳元素与氢元素的质量比
(7)碳元素的质量分数(C%)
(8)120g醋酸含碳元素的质量为
【练习】
青少年要“珍爱生命,远离毒品”。
“病毒”是指合成的毒品甲基苯丙胺,化学式为:C10H15N。
甲基苯丙胺也是毒品“摇头丸”的主要成分,具有强烈的兴奋和致幻效果。
(1)甲基苯丙胺的相对分子质量为
(2)甲基苯丙胺中C、H元素的质量比为
(3)甲基苯丙胺中氮元素的质量分数(相对原子质量:C-12 H-1 N-14)。
