电子焓熵图中符号及单位
理想气体的内能、焓、比热容、熵介绍

一般用组成气体的含量与混合物总量的比值
来表示混合物的组成。
w 质量分数(mass fraction): i
mi m
y nn pp 摩尔分数(mole fraction): i
i
i
piV ni RT pV nRT
VV 容积分数(volume fraction): i
i
显然
w1 w2 wn 1
得
wi
yi
Mi M
由
wi
mi m
Vi i V
得
wi
i
i
3.4.3 混合物的密度、摩尔质量及折合气体常数
由密度的定义,混合物的密度为:
m m1 m2 mi 1V1 2V2 iVi
V
V
V
n
即得: 11 22 ii ii
单位摩尔数的物质温度升高1K所需要的热
量,称为摩尔比热容Cm (kJ/kmol.K)
C Mc c dqT 定容比热(specific
m
heat
at
constant
volume)
:
v
v
c 定压比热(specific heat at constant pressure) : p
qp dT
pV nRT pV mRgT
混合物的质量等于各组成气体质量之和:
n
m mi i 1
m m1 m2 mi mn
混合物物质的量等于各组成气体物质的量之和:
n
n ni n n1 n2 ni nn
i 1
动态i-d图-电子焓熵图
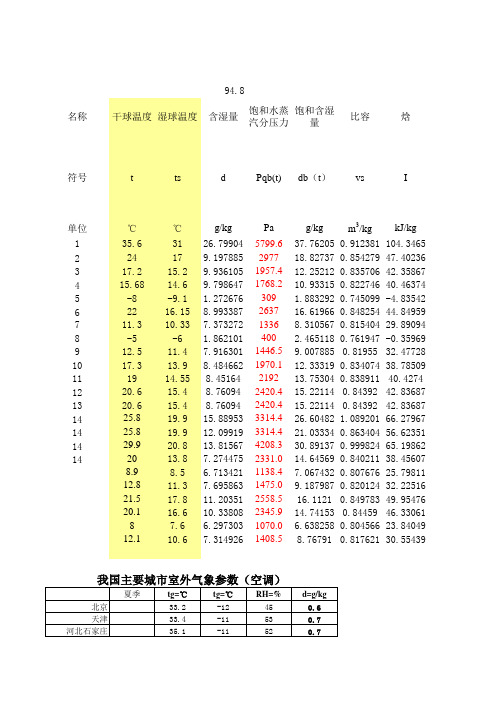
大气压101325Pa 饱和空气 空气温度 的水蒸汽 分压力 注:饱和空气的水蒸汽分压力只与温度有关 Pa ℃ -20 -19.9 -19.8 -19.7 -19.6 -19.5 -19.4 -19.3 -19.2 -19.1 -19 -18.9 -18.8 -18.7 -18.6 -18.5 -18.4 -18.3 -18.2 -18.1 -18 -17.9 -17.8 -17.7 -17.6 -17.5 -17.4 -17.3 -17.2 -17.1 -17 -16.9 -16.8 -16.7 -16.6 -16.5 102
3
焓 I kJ/kg 104.3465 47.40236 42.35867 40.46374 -4.83542 44.84959 29.89094 -0.35969 32.47728 38.78509 40.4274 42.83687 42.83687 66.27967 56.62351 65.19862 38.45607 25.79811 32.22516 49.95476 46.33061 23.84049 30.55439
0 0 0 0 2 1.2 1.1 1.3 1.6 1.6 1.5 1.8 2.4 2.4 2.4 1.5 1.5 3.8 3.9 2 2 2.1 1 0.9 0.7 0.8 1.1 1 1.2 1.3 1.7 2.3 2.3 3.7 6.1 2.7 3.9 3.2 3.6 2.3 2.7 0.4 0.5 1.2 0.4 0.7 0.4
144.8 146.1 147.4 148.7
150
151.5 153.0 154.5 156.0 157.5 159.0 160.5 162.0 163.5
165
166.6 168.2 169.8 171.4 173.0 174.6 176.2 177.8 179.4
常见热力学符号的意义

引言:在热力学领域,符号是非常重要的。
它们代表着特定的物理量和概念,使我们能够更好地理解和描述热力学系统的行为。
在前一篇文章中,我们已经介绍了一些常见热力学符号的意义。
本文将继续介绍更多常见热力学符号的意义,帮助读者更全面地了解热力学的基本概念。
概述:在热力学中,符号的使用起着至关重要的作用。
它们代表着不同的物理量和概念,提供了一种统一的描述和理解热力学系统的方式。
本文将重点介绍一些常见的热力学符号及其意义,包括熵的符号S、焓的符号H、内能的符号U、自由能的符号F、吉布斯自由能的符号G等。
1.熵的符号S熵是一个描述系统混乱程度的物理量。
它的符号是S,代表着系统的无序程度。
熵增加意味着系统的无序程度增加,而熵减少则代表着系统的有序程度增加。
通过熵的变化可以了解系统在各种过程中的无序程度变化。
小点1:熵的计算方法小点2:熵在热力学中的应用小点3:熵增定律的意义2.焓的符号H焓是一个描述系统的热能和物质能之和的物理量。
它的符号是H,代表着系统的热力学状态。
焓的变化可以帮助我们理解系统在各种过程中的能量变化。
小点1:焓的计算方法小点2:焓在热力学中的应用小点3:焓变化与温度变化的关系3.内能的符号U内能是一个描述系统总能量的物理量。
它的符号是U,代表着系统的内部能量。
内能的变化可以帮助我们理解系统在各种过程中的能量转化。
小点1:内能的计算方法小点2:内能在热力学中的应用小点3:内能与焓的关系4.自由能的符号F自由能是一个描述系统可用能量的物理量。
它的符号是F,代表着系统在恒温恒容条件下可供做功的能量。
自由能的变化可以帮助我们了解系统的稳定性和平衡条件。
小点1:自由能的计算方法小点2:自由能在热力学中的应用小点3:自由能与熵的关系5.吉布斯自由能的符号G吉布斯自由能是一个描述系统可用能量和系统的熵的物理量。
它的符号是G,代表着系统在恒温恒压条件下可供做功的最大能量。
吉布斯自由能的变化可以帮助我们判断系统的稳定性和平衡条件。
熵和焓是什么?有什么区别?焓变与熵变又是什么?怎么计算?

熵和焓是什么?有什么区别?焓变与熵变又是什么?怎么计算?1.熵与焓是什么?熵是描述物质混乱程度的物理量,用符号S来表示,单位是J/(mol·K)焓也是物质的一种物理量,跟内能有点关系,但又不是内能,是在做一些计算时,人为引入的一个物理量。
用符号H来表示,单位是kJ/mol。
焓值与内能的关系可以用一个公式表示:H=U+pV(U是内能,p是压强,V是体积)但是在高中可以把焓简单认为是物质的内能。
由此可见,熵是对物质混乱程度的描述,而焓是有关“内能”的物理量,区别还是很大的。
2.熵的大小比较与熵变熵值的大小关系:物质越混乱熵值越大,对于同一种物质,熵值大小关系是气态>液态>固态;在一个化学反应中,由固态变成液态或者气态,或者由液态变成气态,以及气态分子数由少变多的等过程熵的值都会增加。
至于熵值是如何得出来的,一般可以根据实验数据、按一定规律计算,也可以按统计力学方法计算,方法较为复杂,这里暂时不做探讨。
如果想要知道具体某个物质的熵值是多少,如果是常见的物质,可以直接通过查询标准熵值表得到,这些熵值是科学家们通过实验和计算得到的,可以自行搜索。
在一个化学反应中,从反应物变为生成物的过程中,熵的值是会发生变化的,这个变化的值我们称为“熵变”,用生成物的熵减去反应物的熵来得到,公式如下:熵变这个公式既是熵变的定义,也能直接用于计算熵变的具体值,只要查询熵值表找到生成物与反应物的熵值就能进行计算。
注意,熵值增大,熵变为正值,熵值减小,熵变为负值。
3.焓的大小比较与焓变焓值的大小关系:一般内能越高,焓值越大,但是一种物质的内能是无法直接测定的,也就无法得到焓值的具体数值。
但是我们可以通过实验或者计算比较一个化学变化中生成物与反应物的焓值的差值,这样的差值我们称作“焓变”,公式如下:焓变注意,这个公式是焓变的定义公式,但是无法用它计算焓变的具体值,因为反应物和生成物的焓值是无法得到的。
那么如何得到某个反应焓变的具体值呢,一个方法就是在恒压的环境中,实验测定该化学反应释放或吸收的热量(注意要求释放出的能量只做体积功,不做非体积功),而这个热量就是焓变的绝对值。
焓和熵的介绍

焓(enthalpy),符号H,是一个系统的热力学参数。
定义一个系统内: H = U + pV 式子中"H"为焓,U为系统内能,p为其压强,V则为体积。
焓不是能量,仅具有能量的量纲,它没有明确的物理意义。
焓有下述一些特性: 焓的绝对值无法求得,使用配分函数求出的焓值也不是绝对值。
焓是系统的容量性质,与系统内物质的数量成正比。
焓是一个状态函数,也就是说,系统的状态一定,焓是值就定了。
单位质量的物质所含有的热量叫作焓. "系统的状态一定,焓值也确定了。
" 焓是代表流动工质沿着流动方向往前方传递的总能量(内能、推动功、动能、势能)中,直接取决于热力状态的那部分能量。
举例:单位时间内锅炉主蒸汽的热焓-(锅炉给水的热焓+排污水的热焓)/单位时间内进炉煤的低位发热值,就是锅炉的效率啊。
引用焓的概念,可使热工计算大为简单,对借助于图解法来研究工质的热力过程更为方便。
熵的说明:热量是工质与外界存在温差时所传递的能量,则温度T是传热的推动力,只要工质与外界有微小的温差就能传热,于是相应地也应有某一状态参数的变化来标志有无传热,这个状态参数定名为熵。
根据熵的变化,可以判断工质在可逆过程中是吸热、放热,还是绝热。
熵的更重要的作用是用以恒量过程的不可逆程度。
如:蒸汽经过节流孔板,喷嘴等处可以理解为等熵绝热过程的。
焓是单位物质所含能量的多少!汽轮机中就是一个焓降的过程,焓降的过程就是对外做功的过程!实际上,哪怕效率非常高的机组,焓降也不会很高,我们为什么不能让焓降更大呢?这就引出了熵,霍金语:“熵是一种新的世界观” 熵的多少代表了我们利用这些能量所需要付出代价的多少。
焓降的过程伴随着熵增,当焓降到一定程度,熵会增到一定程度,也就说我们利用这些能所需要的代价越来越高,熵增到一定程度,需要付出的代价已经不划算利用这些能源了!熵是一种代价,它决定了我们不能靠能量守恒定律而尽情挥霍能源。
举例,同样参数的汽轮机,背压机组能发电20-30MW,凝气机组能发电100MW,因为我们建立了真空,付出了循环水的“代价”熵描述热力学系统的重要态函数之一。
熵焓自由能

熵、焓、自由能熵.熵:热量与温度之商乘坐熵,记作S。
S = Q / T .熵变; 熵的变化量称为熵变,记作ΔSΔS = ΔQ / T .Q 为系统吸收的热量,T为系统的温度。
熵变等于系统从热源吸收的热量与系统的热力学温度之比,可用于度量热量转变为功的程度。
熵表示热量转化为功的程度,也表示系统中的无序程度,1、熵越大,其做功能力下降,无序程度增加。
2、熵是表示物质系统状态的一个物理量,它表示该状态可能出现的程度。
、3、孤立体系(即绝热体系)中实际发生的过程必然要使它的熵增加。
4、对于纯物质的晶体,在热力学零度时,熵为零.热力学第三定律:有两种表述形式。
表述1:不可能用有限个手段和程序使一个物体冷却到绝对温度零度。
表述2:一切纯物质的晶体,在热力学零度时,熵为零。
标准熵:1 mol物质在标准状态下所计算出的熵值,称标准摩尔熵,简称标准熵。
用ST q表示,单位:J·mol-1 ·K-1熵的规律:(1) 同一物质,气态熵大于液态熵,液态熵大于固态熵; ST q(g) > ST q(l) > ST q(s)S q H2O (g) > H2O (l) > H2O (s)(2) 相同原子组成的分子中,分子中原子数目越多,熵值越大;S q O2 (g) < S q O3 (g)S q NO (g) < S q NO2 (g) < S q N2O4 (g)S q CH2=CH2 (g) < S q CH3-CH3 (g)(3) 相同元素的原子组成的分子中,分子量越大,熵值越大;S q CH3Cl(g) < S q CH2Cl2 (g) < S q CHCl3(g)(4) 同一类物质,摩尔质量越大,结构越复杂,熵值越大;S qCuSO4(s) < S qCuSO4·H2O(s) < SqCuSO4·3H2O(s) < SqCuSO4·5H2O (s)S qF2(g) < S qCl2(g) < S qBr2(g) < SqI2 (g)(5) 固体或液体溶于水时,熵值增大,气体溶于水时,熵值减少。
焓和熵,你必须掌握的知识学习资料

焓和熵,你必须掌握的知识焓和熵,你必须掌握的知识焓hán英语为:enthalpy在介绍焓之前我们需要了解一下分子热运动、热力学能和热力学第一定律:1827年,英国植物学家布朗把非常细小的花粉放在水面上并用显微镜观察,发现花粉在水面上不停地运动,且运动轨迹极不规则。
起初人们以为是外界影响,如振动或液体对流等,后经实验证明这种运动的的原因不在外界,而在液体内部。
原来花粉在水面运动是受到各个方向水分子的撞击引起的。
于是这种运动叫做布朗运动,布朗运动表明液体分子在不停地做无规则运动。
从实验中可以观察到,布朗运动随着温度的升高而愈加剧烈。
这表示分子的无规则运动跟温度有关系,温度越高,分子的无规则运动就越激烈。
正因为分子的无规则运动与温度有关系,所以通常把分子的这种运动叫做分子的热运动。
在热学中,分子、原子、离子做热运动时遵从相同的规律,所以统称为分子。
既然组成物体的分子不停地做无规则运动,那么,像一切运动着的物体一样,做热运动的分子也具有动能。
个别分子的运动现象(速度大小和方向)是偶然的,但从大量分子整体来看,在一定条件下,它们遵循着一定的统计规律,与热运动有关的宏观量——温度,就是大量分子热运动的统计平均值。
分子动能与温度有关,温度越高,分子的平均动能就越大,反之越小。
所以从分子动理论的角度看,温度是物体分子热运动的平均动能的标志(即微观含义,宏观:表示物体的冷热程度)。
分子间存在相互作用力,即化学上所说的分子间作用力(范德华力)。
分子间作用力是分子引力与分子斥力的合力,存在一距离r0使引力等于斥力,在这个位置上分子间作用力为零。
分子引力与分子斥力都随分子间距减小而增大,但是斥力的变化幅度相对较大,所以分子间距大于r0时表现为引力,小于r0时表现为斥力。
因为分子间存在相互作用力,所以分子间具有由它们相对位置决定的势能,叫做分子势能。
分子势能与弹簧弹性势能的变化相似。
物体的体积发生变化时,分子间距也发生变化,所以分子势能同物体的体积有关系。
水蒸汽的焓熵图

水蒸汽的焓熵图水蒸汽的焓熵图如下图所示。
图中饱和水线x=1的上方为过热蒸汽区;c-d线为干饱和蒸汽线,在a-c-d 线下面为湿蒸汽区,c-d线的上方为过热蒸汽区。
h-s图中还绘制了等压线、等温线、等干度线和等容线。
在湿蒸汽区,等压线与等温线重合,而且是一组斜率不同的直线。
在过热蒸汽区,等压线与等温线分开,等压线为向上倾斜的曲线,而等温线是弯曲而后趋于平坦。
此外,在h-s图上还有等容线(图中未画出),在湿蒸汽区中还有等干度线。
由于等容线与等压线在延伸方向上有些近似(但更陡些),为了便于区别,在通常的焓熵图中,常将等容线印成红线或虚线。
水蒸汽的h-s图由于工程上用到的蒸汽,常常是过热蒸汽或干度大于50%的湿蒸汽,故h-s图的实用部分仅是它的右上角。
工程上实用的h-s图,即是将这部分放大而绘制的。
水和水蒸汽性质计算机程序简介目前大多数水和水蒸汽热力性质的计算软件均采用第六届国际水蒸汽性质会议上成立的国际公式化委员会提出的一套水和水蒸汽热力性质的公式。
这套公式的适用范围:温度从273.16K到1073.15K,压力从理想气体极限值(p=0)到100MPa。
可以预计,在今后相当长的一段时间里工业上应用的水和水蒸汽的参数不会超出此一范围。
国际公式化委员会拟定的水和水蒸汽热力性质公式简称IFC公式,IFC公式把整个区域分成6个子区域,如图2-10所示。
不同的子区域采用不同的计算公式,各区域之间的边界线方程也分别用函数表达。
各子区域的计算公式及边界线函数请读者参阅有关文献。
水蒸汽作工质的大量工程应用问题,主要关键是工质初、终态参数的确定。
为了能适应各种工程问题热力计算的需要,计算程序都以子程序形式编制,应用时,只要根据不同的已知参数调用相应的子程序,即可确定其他状态参数。
如文献[9]提供的“确定水和水蒸汽热力计算的FORTRAN程序”编制了9个子程序,各子程序的输入参数及功能如下:序号子程序名功能已知输入参数输出结果参数函数子程序1 PSK(T)T P2 TSK(P)P T子例程子程序3 PTF(P,T,V,H,S)p,t 过冷水、饱和水v,h、s4 PTG(P,T,V,H,S)p,t 过热蒸汽、饱和蒸汽:v,h、s5 PT(P,T,X,V,H,S)p,t 过冷水、过热蒸汽:v,h、s6 PH(P,H,X,T,V,S)p,h过冷水、饱和水、过热蒸汽、饱和蒸汽、湿蒸汽:x,t,v,s7 PS(P,S,X,T,V,H)p,s 过冷水、饱和水、过热蒸汽、饱和蒸汽、湿蒸汽:x,t,v,h8 HS(H,S,X,P,T,V)h,s 过热蒸汽、饱和蒸汽、湿蒸汽:x,p、t,v9 PX(P,X,T,V,H,S)p,x 饱和水、饱和蒸汽、湿蒸汽:t,v,h、s热工水力计算中常还需粘度和导热系数等物性值,它们通常都以温度和比体积或密度为自变量,因而可以编制从T,v为变量的函数子程序分别确定粘度和导热系数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电子焓熵图中符号及单位
整理路学军
计算时减去熵值
压力:符号P. 单位MPa. 温度:符号t. 单位℃
过热蒸汽区
比容符号υ 单位m3/kg 焓(比焓)符号h单位kj/kg. 比熵符号S. 单位kj/kg.K
饱和状态(蒸汽,水)
压力符号Ps 单位MPa
饱和温度(饱和水=饱和蒸汽)符号t s单位℃
比容υ1饱和水单位m3/kg
比容υ11饱和蒸汽单位m3/kg
比焓符号h1饱和水单位kj/kg
比焓符号h11饱和蒸汽单位kj/kg
汽化潜热符号г 单位kj/kg
饱和水的比熵S1单位kj/kg.k
饱和蒸汽的比熵S11单位kj/kg.k
注:过冷水(未饱和水)的焓熵在过热蒸汽区
《发电厂热力设备》中的纸质焓熵图
流动速度V换算成为焓差V单位为m/S △h单位为j/kg时用式V=√2△h
如取值计算中V单位为m/S,△h单位为kj/kg,侧V=44.72√△h
等压热Qp及热焓H(推导过程)《物理、化学》54页
Qp=△H=△U+p△υ=(U2+p2υ2)(U1+p1υ1)
H=m Cp T 其中Cp为等压比热单位kj/kg.K
H≡U+pυH为技术功U为内能(物质温度的热能)pυ为膨胀功(工质的流动能,产生位移,具有压力势能)膨胀功产生位移的推动功
能量传递
做功→△w=p △υ(比容)传热→△q=T △S(比熵)
dq R(功)=T ds(熵)绝热过程本式都为零
熵是体系混乱程度的量度。
没有熵就没有热功的传递和转换
H=ST(绝热熵)+F(功函)+pυ(膨胀功)
H=ST(绝热熵)+G(自由能)
功函的定义F≡U-TS(热温熵)
自由能的定义G=U+pυ-TS(热温熵)
功函、自由能具有方向和限度(矢量)
功函是电子要脱离原子,必须从费米能级跃进到真空静止电子(自由电子)能级这一跃进所需要的能量,叫功函。
这一定义和电子的逸出功一样,只是从不同的角度讲的而已。
焓= +㶲(自己认为)。
