第十章 化学键与分子结构
第十章分子轨道化学键与分子结构

第十章化学键与分子结构1.离子键理论离子键的形成离子键的特点离子键的强度离子晶体的特点离子晶体的空间结构2.共价键理论路易斯理论价键理论价层电子对互斥理论杂化轨道理论分子轨道理论3.金属键理论§本章大纲§金属键的改性共价键理论金属晶体的密齐集结构金属能带理论4.分子间作用力分子间偶极矩分子间作用力 --范德华力氢键5.离子极化学说简介响对离子特点的描述离子极化现象影响变形性的因素相互极化(附加极化)反极化作用影响极化能力的因素离子极化对键型的影§2. 共价键理论五分子轨道理论1.分子轨道理论在化学键理论中的地址分子轨道理论是现代共价键理论的一个分支。
其与现代共价键理论的重要差异在于,分子轨道理论认为原子轨道组合成分子轨道,电子在分子轨道中填充、运动。
而现代共价键理论则议论原子轨道,认为电子在原子轨道中运动。
2.理论要点1)分子轨道由原子轨道线性组合而成分子轨道的数量与参加组合的原子轨道数量相等。
H2中的两个H 有两个1s,可组合成两个分子轨道。
两个 s 轨道只能只能“头仇人”组合成σ分子轨道,MO 和* MO,能量总和与原来AO (2个)总和相等,σ*的能量比 AO 低,称为成键轨道,σ比 AO 高,称为反键轨道。
成键轨道在核间无节面,反键轨道有节面.当原子沿x 轴凑近时, p x与p x头仇人组合成σ P x和σP*x,同时 p y和 p y, p z和 p z分别肩并肩组合成π* p y , πp y和π* p z ,πp z 分子轨道,π轨道有经过两核连线的节面,σ轨道没有。
3) 分子磁学性质电子自旋产生磁场,分子中有不能够对电子时,各单电子平行自旋,磁场加强。
这时物质呈顺磁性。
表现在外磁场中显磁2) 线性组合三原则性,在磁天平中增重。
a)对称性一致原则对核间连线呈同样的对称性的轨道可组合,除上述讲的s-s, p-p 之外,还有 :若分子中无成单电子时,电子自旋磁场抵消,物质显抗磁性 (逆磁性或反磁性 ), 表现在于外磁场作用下出现引诱磁矩,与外磁场相排斥 , 故使磁天平减重.若s和px 沿y轴凑近,对称不一致,不能够组成分子轨道实验表示,单质O2 是顺磁性的.用分子轨道理论讲解,见O2的分子轨道图和分子轨道式 :b) 能量周边原则按路易斯理论 , 氧气分子电子构型为 :H 1s -1312 kJ/mol Na 3s - 496 kJ/mol 用路易斯理论,不能够讲解氧气分子无单电子. 用现代价键Cl 3p -1251 kJ/mol 理论也讲解不通, px-p x成σ键, py-p y 成π键,单电子全部成对 ,O 2p -1314 kJ/mol(以上数据按 I1值估计)形成共价键 , 无单电子 .左面 3个轨道能量周边,相互间均可组合, 形成分子 ,分子轨道理论在讲解 O2的磁性上特别成功。
第十章化学键与分子结构

体原子时,所吸收的能量,用 Ei 表示。
NaCl ( g ) = Na ( g ) + Cl ( g ) 键能 Ei 越大,表示离子键越强。
H = Ei
晶格能 气态的正负离子,结合成 1 mol NaCl 晶体时,放
出的能量,用 U 表示。
Na + ( g ) + Cl- ( g ) = NaCl ( s )
形成 Ne 和 Ar 的稀有气体原子的结构,形成稳定离子。
第二步 靠静电吸引, 形成化学键 。
非极性共价键
极性增大 极性共价键
离子键
化合物中不存在百分之百的离子键,即使是 NaF 的化学键, 其中也有共价键的成分。即除离子间靠静电相互吸引外,尚有共 用电子对的作用。
X > 1.7 ,实际上是指离子键的成分大于 50 %。
由盖斯定律 所以 即
H 6 = H 1 + H2 + H 3 + H 4 + H 5 H 5 = H 6 - ( H1 + H 2 + H 3 + H 4 )
U = H1 + H 2 + H 3 + H 4 - H 6 = S + 1/2 D + I1 - E - f HmӨ
U = 108.8 + 119.7 + 496 - 348.7 + 410.9 = 786.7 ( kJ·mol-1 )
2° 易形成稳定离子 Na + 2s 2 2p 6,Cl- 3s 2 3p 6 ,达到稀有气体式稳定结构。 Ag + 4d10 , Zn 2 + 3d10 , d 轨道全充满的稳定结构。 只转移少数的电子,就达到稳定结构。 而 C 和 Si 原子的电子结构为 s 2 p 2 ,要失去或得到 4 e,才 能形成稳定离子,比较困难。所以一般不形成离子键。如
基础化学第二版李保山10 化学键与分子结构习题解答-学生
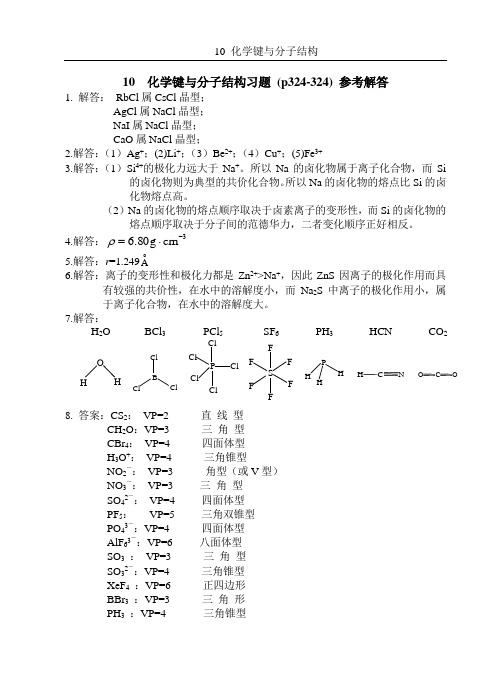
10 化学键与分子结构习题 (p324-324) 参考解答1. 解答: RbCl 属CsCl 晶型;AgCl 属NaCl 晶型;NaI 属NaCl 晶型;CaO 属NaCl 晶型;2.解答:(1)Ag +;(2)Li +;(3)Be 2+;(4)Cu +;(5)Fe 3+3.解答:(1)Si 4+的极化力远大于Na +。
所以Na 的卤化物属于离子化合物,而Si的卤化物则为典型的共价化合物。
所以Na 的卤化物的熔点比Si 的卤化物熔点高。
(2)Na 的卤化物的熔点顺序取决于卤素离子的变形性,而Si 的卤化物的熔点顺序取决于分子间的范德华力,二者变化顺序正好相反。
4.解答:3cm g 80.6-⋅=ρ5.解答:r =1.249o A6.解答:离子的变形性和极化力都是Zn 2+>Na +,因此ZnS 因离子的极化作用而具有较强的共价性,在水中的溶解度小,而Na 2S 中离子的极化作用小,属于离子化合物,在水中的溶解度大。
7.解答:H 2O BCl 3 PCl 5 SF 6 PH 3 HCN CO 2 OH B Cl Cl Cl PCl Cl Cl Cl ClS F F F F F F P H H C N H O C O8. 答案:CS 2: VP=2 直 线 型CH 2O :VP=3 三 角 型CBr 4: VP=4 四面体型H 3O +: VP=4 三角锥型NO 2-: VP=3 角型(或V 型)NO 3-: VP=3 三 角 型SO 42-: VP=4 四面体型PF 5: VP=5 三角双锥型PO 43-:VP=4 四面体型AlF 63-:VP=6 八面体型SO 3 : VP=3 三 角 型SO 32-:VP=4 三角锥型XeF 4 :VP=6 正四边形BBr 3 :VP=3 三 角 形PH 3 :VP=4 三角锥型H2S :VP=4 角型(或V型)CCl4:VP=4 四面体型NH4+:VP=4 四面体型9.答案:本题不适于8隅体规则。
化学键与分子结构的关系

化学键与分子结构的关系化学键是在化学反应中形成的一种化学结合。
它对于构建分子结构和决定物质的性质至关重要。
在化学中,共价键、离子键和金属键是最常见的三种化学键。
本文将讨论这些化学键与分子结构之间的关系。
1. 共价键与分子结构共价键是由两个非金属原子之间的电子共享形成的。
电子共享能力的不同可以导致不同类型的共价键,如单、双或三重共价键。
共价键的形成决定了分子的几何结构和空间构型。
例如,水分子(H2O)由两个氢原子和一个氧原子组成。
每个氢原子与氧原子之间通过共用电子配对形成共价键。
由于氧原子比氢原子更电负,它的电子云更集中,在分子中形成了两个类似于“V”形的共价键角度约为104.5度。
这种几何结构使水分子呈现出极性,并导致了一系列特殊的性质,如高沸点、高表面张力和溶解度。
2. 离子键与分子结构离子键是由一个阴离子和一个阳离子之间的电荷吸引力形成的。
在离子键中,电子从金属原子转移到非金属原子,形成正负电荷,从而吸引彼此。
离子键的强度比共价键高得多,因此离子化合物通常具有高熔点和硬度。
例如,氯化钠(NaCl)是一个由钠离子和氯离子组成的晶体。
钠离子失去一个电子成为正离子,氯离子获得一个电子成为负离子,通过电的吸引力形成了离子键。
这种离子结构使得氯化钠在固态下是一个晶体,但在溶液中则以离散的离子存在。
3. 金属键与分子结构金属键是由金属原子间的电子云共享形成的。
金属键在金属中形成一个连续的电子海,并对金属的性质产生重要影响。
金属键具有高导电性(电子在金属中的自由移动),高热导率和可塑性。
例如,铁(Fe)是一个典型的金属元素。
铁原子通过金属键形成一个紧密排列的网络,在其中电子可以自由移动。
这种金属结构使铁具有特殊的性质,如高强度、高熔点和良好的导电性。
总而言之,化学键的类型直接决定了分子结构的几何形状和物质的性质。
共价键决定了分子的形状和极性,离子键导致形成离子晶体,而金属键形成具有特殊物理性质的金属结构。
化学键与分子结构

化学键与分子结构在化学领域中,化学键和分子结构是两个关键概念。
化学键是指将原子相互连接并形成化合物的力,而分子结构则描述了化合物中原子的排列方式和空间结构。
通过理解化学键与分子结构之间的关系,我们可以更好地理解物质的性质和反应机理。
在本文中,将详细介绍不同类型的化学键和其在分子结构中的作用。
一、离子键离子键是指由离子间的静电吸引力在正负电荷之间形成的键。
一般来说,金属与非金属形成离子化合物,如氯化钠(NaCl)。
在氯化钠中,钠离子失去一个电子,成为正离子(Na+),而氯离子获得一个电子,成为负离子(Cl-)。
这些离子通过静电吸引力形成了强大的离子键。
离子键通常具有高熔点和高沸点,因为需要克服大量的离子间吸引力才能改变其相态。
此外,离子键还给物质带来了电导性和溶解性。
二、共价键共价键是指原子通过共享电子而形成的化学键。
共价键的形成涉及到非金属原子之间的电子云重叠。
共价键可以进一步分为两种类型:极性共价键和非极性共价键。
极性共价键是指电子在共享时被一个原子更强烈地吸引,导致两个原子间形成部分正、负电荷。
而非极性共价键是指电子在两个原子之间均匀地共享,没有电荷偏移。
比如,氧气(O2)中的氧原子通过非极性共价键相互连接。
共价键的强度通常比离子键弱,因此共价化合物的熔点和沸点较低。
共价键也可以形成双键或三键,例如乙炔(C2H2)中的碳碳三键。
共价键的长度和强度受到原子间距离和电负性之间的影响。
较短的共价键通常更强,而较长的共价键通常较弱。
三、金属键金属键是金属原子之间形成的一种特殊化学键。
金属键的形成涉及金属原子之间的电子云共享,使得金属中的原子由正离子核团和移动的自由电子构成。
这些自由电子在整个金属中移动,并形成所谓的“海洋模型”。
金属键使得金属具有高导电性和高热导率的特点。
此外,金属键通常具有高密度和良好的延展性和形变性。
四、氢键氢键是用氢原子连接两个原子之间的相互作用力。
氢键通常发生在含有氧、氮或氟的原子与具有部分正电荷的氢原子之间。
化学键与分子结构

化学键与分子结构在我们的日常生活中,从我们呼吸的空气到我们所吃的食物,从我们所穿的衣物到我们使用的各种材料,无一不与化学相关。
而在化学的世界中,化学键与分子结构则是理解物质性质和化学反应的关键所在。
让我们先来聊聊什么是化学键。
简单来说,化学键就是将原子结合在一起形成分子的“强力胶水”。
想象一下,原子就像是一个个独立的小珠子,而化学键就是把这些小珠子串起来的线。
不同类型的化学键有着不同的强度和性质,从而决定了所形成分子的特性。
最常见的化学键类型有离子键、共价键和金属键。
离子键通常在金属元素和非金属元素之间形成。
比如说,氯化钠(NaCl)就是一个典型的例子。
钠原子失去一个电子变成带正电的钠离子,氯原子得到一个电子变成带负电的氯离子,这两种带相反电荷的离子通过静电引力相互吸引,从而形成了离子键。
这种键的强度较大,使得离子化合物在常温下通常是固体,具有较高的熔点和沸点。
共价键则是原子之间通过共用电子对形成的化学键。
例如氢气(H₂),两个氢原子各自拿出一个电子形成共用电子对,从而把两个氢原子紧紧地“绑”在一起。
共价键又可以分为极性共价键和非极性共价键。
如果两个原子对共用电子对的吸引能力相同,比如氢气中的氢原子,那么形成的就是非极性共价键;而如果两个原子对共用电子对的吸引能力不同,就像氯化氢(HCl)中氢原子和氯原子,形成的就是极性共价键。
金属键则存在于金属单质中。
金属原子失去部分或全部外层电子,形成“电子气”,这些自由电子在整个金属晶体中自由移动,将金属原子或离子“胶合”在一起。
这也解释了为什么金属具有良好的导电性和导热性。
了解了化学键的类型,接下来我们看看分子结构。
分子结构指的是分子中原子的排列方式和空间构型。
分子的结构对于其物理和化学性质有着至关重要的影响。
比如甲烷(CH₄),它的分子结构是正四面体。
碳原子位于正四面体的中心,四个氢原子分别位于正四面体的四个顶点。
这种结构使得甲烷分子具有相对稳定的性质。
化学反应中的化学键与分子结构知识点总结

化学反应中的化学键与分子结构知识点总结在化学反应中,化学键和分子结构是重要的基础知识点。
理解化学键形成和断裂的机制,以及不同分子的结构与性质之间的关系,对于解释和预测化学反应是至关重要的。
本文将对化学键和分子结构的相关知识点进行总结。
一、原子与化学键形成化学键是由原子之间的电子共享或转移而形成的。
共价键是最常见的化学键类型,形成于非金属原子之间。
共价键的形成需要原子外层电子轨道中存在未成对电子。
这些未成对电子可以与其他原子的未成对电子形成共享电子对,从而形成共价键。
例如,氢气(H2)中的两个氢原子通过一个共享电子形成了共价键。
另一种常见的化学键类型是离子键,形成于金属与非金属原子之间。
离子键的形成涉及电子的转移。
金属原子往往失去电子成为阳离子,非金属原子则接受这些电子成为阴离子,通过电荷吸引力形成离子结晶。
二、分子间与分子内力除了化学键,分子之间还存在其他力,如范德华力和氢键。
范德华力是由于瞬时生成的偶极矩引起的分子间相互吸引力。
虽然范德华力比化学键弱,但在大量的分子之间可以起到重要的作用,例如在液体和气体中。
氢键是一种极为重要的分子间力,通常形成于含氢原子与电负性较高的原子之间。
氢键既可以在分子间形成,也可以在分子内形成。
在水中,氢键通过氧原子与氢原子的相互作用而形成水的特殊结构和性质。
分子内力是指分子内部原子之间的相互作用力。
分子内力可以影响分子的构象和性质。
例如,氢键和范德华力等分子间力可以使蛋白质等生物大分子折叠成特定的三维结构。
三、分子结构与化学反应分子的结构对于化学反应的发生和速率有重要的影响。
分子的构型(形状)以及键的强度和稳定性直接影响反应的进行。
分子结构中的不饱和键可以作为反应的活性中心,容易发生化学反应。
另外,分子的立体构型也会影响反应的发生,例如立体异构体之间的化学反应速率常常不同。
此外,分子的结构与性质之间存在着密切的关系。
分子的结构决定了其化学和物理性质。
例如,具有不饱和键的分子往往具有较高的反应活性;具有更大分子量的分子往往具有更高的沸点和熔点。
10化学键与分子结构-PPT课件

三方 a = b = c α=β=γ≠90°
Al2O3
NaCl
SnO2
I2
Al2O3
S
CuSO4.5H2O
Mg
自然界晶体和人工晶体,外形上很难和七 大晶系完全相同,但是晶轴夹角总是不变的,我 们只要测出晶轴夹角和晶轴长短,就能准确地确 定晶体所属晶系。
三、晶体的内部结构
1. 十四种晶格
2.
晶体的外形是晶体内部结构的反映,是构成
原子或离子半径是无法严格确定的。当正负离子
通过离子键形成离子晶体时,正负离子通过静电
引力和核外电子之间的排斥达到平衡,使正负离
子保持着一定的平衡距离,这个距离叫核间距,
用d表示。
如果近似将构成AB型离子晶体的质点 A+ 和B- 看作互相接触的球体,
r1 r2
d
则,d = r1 +r2
其中d 可以通过X- 射线衍射法测得,只
四、晶格能(P176)
离子键的强度通常用晶格能U的大小来度 量。所谓晶格能,是指相互远离的气态正离子和 负离子结合成离子晶体时所释放的能量,
m Mn+ (g) + n Xm- (g) MmXn (s) -△H = U 晶格能可用波恩~哈伯(Born-Haber)循环
法通过热化学计算求得。以NaCl为例,
4. 离子键的本质是静电作用力
q q f R2
4. 离子键的强度一般用晶格能U来代表。 5. 离子键没有方向性(P150) 6. 离子键没有饱和性 7. 离子键的离子性与元素的电负性有关。
电负性差越大,它们之间键的离子性也就越大。
Xa-Xb 离子性百分比(%)Xa-Xb 离子性百分比(%)
0.2
实例
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章化学键与分子结构
§本章摘要§1.离子键理论
离子键的形成离子键的特征离子键的强度离子晶体的特点离子晶体的空间结构
2.共价键理论
路易斯理论价键理论价层电子对互斥理论杂化轨道理论分子轨道理论3.金属键理论
金属键的改性共价键理论金属晶体的密堆积结构金属能带理论
4.分子间作用力
分子间偶极矩分子间作用力--范德华力氢键
5.离子极化学说简介
对离子特征的描述离子极化现象影响变形性的因素影响极化能力的因素离子极化对键型的影响相互极化(附加极化)反极化作用
X > 1.7,
X < 1.7,
X
, Cl,
d
原子的电子结构为,
出
和r之和:
1926年
法测定, 得到了和的半径
和132pm,
子半径:
H
H
H
H4
H
第十章化学键与分子结构
§本章摘要
§1.离子键理论
离子键的形成离子键的特征离子键的强度离子晶体的特点离子晶体的空间结构
2.共价键理论
路易斯理论价键理论价层电子对互斥理论杂化轨道理论分子轨道理论
3.金属键理论
金属键的改性共价键理论金属晶体的密堆积结构金属能带理论
4.分子间作用力
分子间偶极矩分子间作用力--范德华力氢键
5.离子极化学说简介
对离子特征的描述离子极化现象影响变形性的因素影响极化能力的因素离子极化对键型的影响相互极化(附加极化)反极化作用
解释了X
电子构型的
H A, B 两原子各有一个成单电子,当
时, 两电子以自旋相反的方式结成电子对电子所在的原子轨道能相互重叠
形成化学键
形成的共价键越多
分子越稳定
多地形成共价键
例如:
个共价键
构:
每个N原子有三个单电子
与N 原子之间可形成三个共价键
成:
:
各原子轨道在空间分布是固定的
最大重叠
例: HCl
而不能如此重叠
a) 键
键特点
即键轨道对键轴呈圆柱
b) 键键特点
则键的:
两个原子沿形成键形成键个键个键三个D 值不同大, 则键强b) 键长
分子中成键两原子之间的距离
第十章 化学键与分子结构
§本章摘要§
1.离子键理论
离子键的形成 离子键的特征 离子键的强度 离子晶体的特点 离子晶体的空间结构
2.共价键理论
路易斯理论 价键理论 价层电子对互斥理论 杂化轨道理论 分子轨道理论
3.金属键理论
金属键的改性共价键理论 金属晶体的密堆积结构 金属能带理论 4.分子间作用力
分子间偶极矩 分子间作用力--范德华力 氢键 5.离子极化学说简介
对离子特征的描述 离子极化现象 影响变形性的因素 影响极化能力的因素 离子极化对键型的影响 相互极化(附加极化) 反极化作用
§3. 金属键理论
.
属键强3500K
低 充在低能量的能级中原子单独存在时的能量总和
第十章 化学键与分子结构
§本章摘要§
1.离子键理论
离子键的形成 离子键的特征 离子键的强度 离子晶体的特点 离子晶体的空间结构
2.共价键理论
路易斯理论 价键理论 价层电子对互斥理论 杂化轨道理论 分子轨道理论
3.金属键理论
金属键的改性共价键理论 金属晶体的密堆积结构 金属能带理论 4.分子间作用力
分子间偶极矩 分子间作用力--范德华力 氢键 5.离子极化学说简介
对离子特征的描述 离子极化现象 影响变形性的因素 影响极化能力的因素 离子极化对键型的影响 相互极化(附加极化) 反极化作用
§4. 分子间作用力 一.分子间偶极矩
1.62库仑
1.0 时
μ
1.0kJ/mol
无方向性和饱和性; 是近程力,
第十章 化学键与分子结构
§本章摘要§
1.离子键理论
离子键的形成 离子键的特征 离子键的强度 离子晶体的特点 离子晶体的空间结构
2.共价键理论
路易斯理论 价键理论 价层电子对互斥理论 杂化轨道理论 分子轨道理论
3.金属键理论
金属键的改性共价键理论 金属晶体的密堆积结构 金属能带理论 4.分子间作用力
分子间偶极矩 分子间作用力--范德华力 氢键 5.离子极化学说简介
对离子特征的描述 离子极化现象 影响变形性的因素 影响极化能力的因素 离子极化对键型的影响 相互极化(附加极化) 反极化作用
象.
等
如:
:
等
电荷数越高极化能力越强.
的极化能力强
2.82m,
中对施加电场作用变形对也有极化能力23
变形性极小,
只考虑对
的
果是不相符的原因在于没有考虑的变形性的变形性最小, 的变形性最大
, CdI
2
等时
使氧的电子变形:
的作用相反:。
