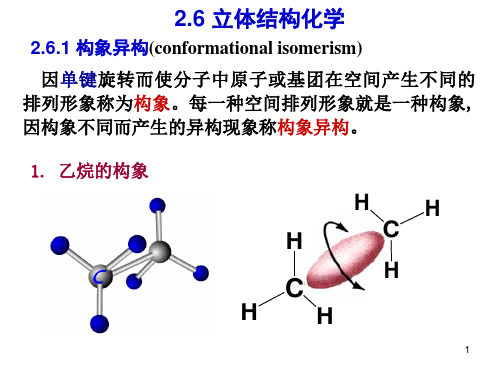
构象异构现象
顺反异构体定义

顺反异构体定义
顺反异构体(Stereoisomers)是指具有相同的分子式和相同的原子连接顺序,但由于原子在空间排列不同而导致分子整体构型不同的一对或一组化合物。
顺反异构体是一种立体异构现象,可分为两大类:构象异构体(Conformational Isomers)和构型异构体(Configurational Isomers)。
1. 构象异构体
构象异构体是由于单键周围的原子或基团的旋转而产生的异构现象。
构象异构体之间可以通过旋转单键相互转化,能垒较低,属于动力学异构体。
常见的构象异构体有:
- 烷烃的旋转异构体
- 环丁烷的椅式和船式构象
- 环己烷的椅式和船式构象
2. 构型异构体
构型异构体是由于分子中含有手性中心或手性轴而产生的异构现象。
构型异构体之间不能简单地通过旋转单键相互转化,需要断开化学键并重新连接。
常见的构型异构体有:
- 手性碳原子引起的异构体(对映异构体)
- 手性轴引起的顺反异构体
- 手性平面引起的顺反异构体
顺反异构体是指由于分子中存在手性轴或手性平面而导致整体构型不同的一对立体异构体。
它们是构型异构体的一种,与对映异构体并列,是立体化学的重要内容。
第二章 共价键与分子结构-2
(a)
(b)
(c)
(d)
(a) 和 (b) 是对映体 (a) 和 (c) 是非对映体 (b) 与 (c) 是非对映体
(c) 和 (d) 之间 是何种关系?
28 ( c )非手性的,为内消旋化合物,是纯净物,不具有旋光性。
有一个简单的方法可以辨认内消旋 化合物。就是它具有对称面。
COOH
内消旋酒石酸 分子中的对称面
2. 考察分子有无对称面或手性中心。如果分子有
对称面或手性中心,则该分子与其镜像就能重合,没 有对映异构现象。 3. 大多数情况下,可根据分子中是否存在手性碳 原子(或手性中心) 来判断分子是否有手性。
15
问题:下列化合物是否存在对映异构体?
CH3 C H C H CH3
H F
3
Cl H Cl H
H
转动使H 远离视线
HO
CH3
C2H5
C2H5
S-2-丁醇
CHO HO H OH H CH2OH
HO H
CHO SC
RC
S 构型
H
2S,3R-2,3-二羟基丁醛
OH
CH2OH
23
课堂练习:根据Fischer投影式命名。
2# CO2H
CO2H HO H CH3
H
OH 1#
3# CH3 R-(-)-乳酸
任何物体都有它的镜像,一个有机分子也会有它的镜像。
2、手性分子和对映体
COOH H C H CH3
COOH H C H CH3
COOH H C CH3 H
若实物与 其镜像能够完 全重合,则实 物与镜像所代 表的两个分子 为同一个分子。
11
但有些分子如乳酸, 两个互为实物与镜像关系的分子不能重合。
有机化学中的异构体

有机化学中的同分异构同分异构体包括构造异构体与立体异构体而构造异构体中包括碳架异构、位置异构、官能团异构。
立体异构又包括构象异构与构型异构。
(一)立体异构一、构象异构1、定义由于高分子链的构象不同所造成的异构体,又称内旋转异构体。
注:(1)小分子的稳定构象数=3^(n-3) (n为分子中单键碳原子数目,n>2)(2)高分子的可实现构象数远小于3^(n-3),但一个高分子的可实现构象数远多于一个小分子的稳定构象数(因高分子的n值很大)。
2、构象与构型的主要区别(1)、从起因方面瞧,构象就是由单键内旋转所造成的原子空间排布方式;构型就是由化学键所固定的原子空间排列方式。
(2)、从改变方面瞧,构象发生改变时不虚破坏化学键,所需能量较少(有时分子的热运动就足够),较易于改变;而构型发生改变时需要破坏化学键,所需能量较大,不轻易改变。
(3)、从分离方面瞧,不同的构象不能用化学的方法分离,而不同构型可以用化学的方法分离。
(4)、从数目方面瞧,稳定构象数只具有统计性,且稳定构象数远多于有规构型数;而有规立构的构型数目可数。
3、晶体中的高分子链构象晶体中的分子链构象有螺旋形构象、平面锯齿形构象等。
(1)、两个原子或基团之间距离小于范德华半径之与时,将产生排斥作用。
(2)、分子链在晶体中的构象,取决于分子链上所带基团的相互排斥或吸引作用的情况。
(3)、有规立构高分子链在形成晶体时,在条件许可下总就是尽量形成时能最低的构象形式。
(4)、基本结构单元中含有两个主链原子的等规聚合物,大多倾向于形成螺旋体构象。
(5)、若存在分子内氢键,将影响分子链的构象。
4、溶液中的高分子链构象(1)、高分子溶液中,除了刚性很大的棒状分子之外,柔性分子链大多都呈无规线团状。
(2)、当呈螺旋形构象的高聚物晶体溶解时,可由棒状螺旋变成部分保持棒状螺旋小段的线团状构象。
二、构型异构构型异构:就是原子在大分子中不同空间排列所产生的异构现象。
第二章 有机化合物的同分异构现象

C CH 相相于
C
C H
(C) H
(C) (C)
O C OH 相相于 O C O
(O )
(N) C N
相相于
C N (N)
故有:
O C OH C N C CH CH=CH2
14
举例
CH3 CH3 C=C H C2H5
(E)-3-甲基-2-戊烯
CH3 C2H5 C=C H CH3
C H3 C H3 C H3 H CH3 C =C C =C H C H 3 H C=C CH H H H 3 顺-2-丁烯(b.p.3.5℃) 反-2-丁烯(b.p.0.65℃) 顺反异构体也叫几何异构体,属于构型异构体。 顺反异构产生的条件:
a c a ≠ b且c ≠ d C=C b d
CH3 C=C H H H C=C
7
练习:写出分子式为 7H14的环烷烃的碳架异构体。 写出分子式为C 的环烷烃的碳架异构体。
二、位置异构 位置异构: 官能团在碳链或碳环上的位置不同 而产生的异构。 丁炔:CH3CH2C≡CH 丁醇 CH3CH2CH2CH2OH
正丁醇
CH3 CH3 NO2 NO2
CH3C≡CCH3
CH2CH2CHCH3 OH
H C6H5
C=C H
H C=C CH3 H H C6H5
反,顺
H C=C
C=C H
H CH3
_ _ _ _ 1 苯基 1,3 戊二烯 _ _ _ _ (1Z , 3Z) 1 苯基 1,3 戊二烯 顺,顺
H C6H5 C=C H H C=C H CH3
_ _ _ _ 1 苯基 1,3 戊二烯 _ _ _ _ (1E , 3Z) 1 苯基 1,3 戊二烯
有机化学教学之四:对映异构

第四章对映异构异构现象在有机化学中非常普遍,前面我们学过了构造异构,构型异构,顺反异构,构象异构等,下面我们把它们归纳一下异构现象包括构造异构和立体异构,其中构造异构按原子相互连接方式、次序不同,又可分为碳架异构和位置异构;立体异构按原子在空间排列方式不同分为构型异构和构象异构(单键旋转产生构型不同),构型异构按构型方式分为顺反异构(环的存在引起构型不同)和对映异构。
本章主要讨论对映异构。
对映异构体与旋光性密切相关,要测定物质旋光度的大小,需要用旋光仪,下面分别介绍有关内容。
§4.1 旋光性4.1.1偏振光光波是一种电磁波,它的振动方向与其前进方向垂直,在普通光里,光波在垂直前进方向上可以有无数个振动平面。
如果有圆圈代表光线前进方向的一个横截面,那么光线透过Nicol棱晶时,只有振动面与棱晶光轴平行的光才能通过,而在其他平面上振动的光被阻挡,即产生偏振光。
这种只在一个平面上振动的光叫平面偏振光或偏光。
当偏光射到另一个Nicol棱晶上时,若其光轴相互垂直,光线全被阻挡。
这就是旋光仪的工作原理。
4.1.2 旋光仪在两个光轴平行的Nicol棱晶之间放一样品管(旋光管),自然光透过第一个固定的棱晶后成为偏光,偏光透过旋光管后射到第二个棱晶上(可转动)。
若样品对偏光没发生作用,我们可以观察到光线能全部透过第二个棱晶(见偏时),我们从目镜中看到视场最亮。
此时,刻度盘为零。
若样品与偏光发生作用,使其偏转,这时光线就不可能全部通过第二个棱晶,从目镜中观察到视场变暗,我们可通过旋转检偏器,使视场恢复到最亮。
检偏器所旋转的角度。
即旋光度。
使检偏器顺时针旋转的物质,称右旋物质,用+α表示;使检偏器逆时针旋转的物质,称左旋物质,用-α表示。
旋光度的大小与溶液的浓度、样品管的长度、光的波、温度及溶剂都有关系, 为便于比较,常用比旋度[α]t λα][表示。
4.1.3比旋光度比旋光度——偏光透过厚度为10cm ,浓度为1g/ml 样品溶液所产生的旋光度。
有机化合物普遍存在同分异构现象

H
CH 3 H
CH 3
反-l,3-二甲基环己烷
(二)Z、E命名法
顺、反命名法只适用于双键或环上至 少有一对原子或原子团是相同的情况。若 双键或脂环碳原子上所连的 4 个原子或原 子团都不相同,就无法用顺、反命名法命 名。为克服顺、反命名法的局限性,国际 系统命名法规定以字母Z和E表示顺反异构 体的两种构型,即为Z、E命名法。
序数相同,就延伸比较第一碳原子上
所连接的原子。-CH3与第一碳原子相 连的是H、H、H,而在-CH2CH3中与 之相连的是C、H、H,由于碳的原子
序数大于氢,故
CH 3 CH >
H
C(C、H、H)
H CH
H
C(H、H、H)
同理
CH 3 C CH3 >
CH 3
CH 3 C CH3 >
H
CH 2CH 3 CH
第十章 立体异构 有机化合物普遍存在同分异构现象, 简称异构现象,这是有机化合物的结 构特点之一。各种异构的相互关系归 纳如下:
同分异构
碳链异构 碳架异构
碳环异构
构造异构
位置异构 官能团异构 互变异构
顺反异构
命过程本身包含着复杂的立体化学 问题。生物体在新陈代谢过程中所产 生的化学物质具有高度的立体专一性; 一切具有生物活性物质的功能,都与 其构型或构象紧密地联系着。如药物 的构型与受体之间的构效关系,生物 反应过程中的立体选择性,都需从立 体化学的角度来理解和阐明。
H3C
CH 3
CC
H
H
Z-2-丁烯 顺-2-丁烯
H3C
H
CC
H
CH 3
E-2-丁烯 反-2-丁烯
H3C
有机化合物的结构、命名、同分异构现象及电子效应
(2)σ 键与π 键:
σ键 两个原子的轨道沿键轴方向重叠,电子云绕着键 轴对称分布。
π键
两个原子的轨道互相平行 进行最大的侧面重叠,电 子云分布在两个原子键轴 的平面的上方和下方。
甲烷的分子结构
乙烷的分子结构
乙烯的分子结构
乙炔的分子结构
(3)电子的离域——离域键 分子轨道理论:组成 分子的所有原子的价 电子不只从属于相邻 的原子,而是处于整 个分子的不同能级的 分子轨道中。
N 1 H
N
1
O
1
OCH3
H 3C
N
2- 甲 基 - 4- 甲 氧 基 吡 啶
9、部分化合物的俗名、部分缩写
蚁酸、醋酸、草酸、硬脂酸、软脂酸、酒石 酸、肉桂酸、苦味酸、葡萄糖、果糖、麦芽 糖、蔗糖、核糖、脱氧核糖、甘氨酸、卤仿、 甘油;DMF、THF、DMSO、DNA、RNA
要点:
1、掌握母体的选择、主碳链的选择以 及编号原则。
5 - 溴 - 2 - 己 炔
6、次序规则
在系统命名法中,取代基排列的先后顺序、顺反构 型的确定、手性化合物的构型等都是根据次序规则, 按一定的方法确定。 (i) 将原子或原子团游离价所在的原子按原子序数大 小排列,原子序数大的原子优先于原子序数小的 原子。 例如:Br>Cl>O>C>H (ii) 对同位素元素,则按相对原子质量大的优先于相 对原子质量小的排列。 例如:T>D>H
路易斯式
H H HC C H H H H H HC C H
H H CC HC CH CC H H
凯库勒式
H H HC C H H H
H H C C H H
结构简式:CH3CH2CH2CH2CH3 键线式
3-构象异构
Li Ligeng
Department of Medicinal Natural Product Chemistry College of Pharmaceutical Science, Hebei Medical University
河北医科大学药学院 天然药物化学教研室
李力更
1
没有理论上的总结和提高,
H CH3
H3C H
15.9
CH3 CH3
CH3
H3C CH3
18.8 kj.mol-1 3.7
CH3
-
-
0
60 120 180 240 300
360
旋转角度
19
[copy]
20
三、取代的正丁烷体系的构象 一般情况下,当分子中除立体因素外,不
存在其它相互作用的因素(如:偶极作用、氢 键等)时,对位交叉是最稳定的构象。
HH
不相似重叠式(a1c8)
中英文对照名词:
邻位交叉 不相似重叠 部分重叠 相似重叠 全重叠
gauche unlike eclipsed partially eclipsed like eclipsed fully eclipsed
正丁烷构象的能量图
E 能量
H3C CH 3
CH3 CH3
H CH3 H CH3
bond),简称 e 键。 36
环已烷的椅式构象-2
a e
e a
☞ 椅式构象中,6 个 C 原子实际上成 2 个平面, 即相互间隔的 3 个 C 原子在同一平面,另外 3 个 C 原子在另一平面,两个平面间隔约 0.056 nm。
37
环已烷的椅式构象-3
a e
e a
第四章 立体异构
Cl
C CH3
C Br
CH3
C
C H
(E)- 2-氯-1-溴丙烯
(Z)- 2-氯-1-溴丙烯
2. 次序规则
(1)将与双键碳原子直接相连的原子按原 子序数大小排列,原子ቤተ መጻሕፍቲ ባይዱ数大者为“较优”基 团;若为同位素,则质量高者为“较优”基团。
I > Br > Cl > S > P > F > O > N > C > D > H
H C CH3
这种在有双键或环状结构的分子中,由于旋转受阻 使与双键或环相连接的原子或原子团在空间的排布方式不 同所引起的立体异构现象叫做顺反异构现象。各种异构 体互称为顺反异构,又称几何异构。
2.产生顺反异构的原因和条件
产生的原因:由于双键中的π键限制了σ键 的自由旋转,使得两个甲基和两个氢原子在空间 有两种不同的排列方式。
三、含一个手性碳原子的化合物的旋光异构
1.对映体和外消旋体 H3C
C
CH3 H HO
C
HOOC
H OH
COOH
乳酸的一对对映体(透视式) 对映体:互为实物和镜像关系的异构体叫做对 映异构体,简称对映体。
外消旋体;它们的等量混合物可组成一个外消 旋体,用(±)表示 。外消旋体无旋光性。
2.构型的表示方法
构象的两种表示方法
透视式
H
H H C H H C H H
H C H H H
C H
交叉式
重叠式
纽曼投影式:
H H H H
H H
H H
HH
H H
交叉式
重叠式
交叉式构象为优势构象
乙烷处于交叉式构象时,两个碳 上的氢原子相距最远,相互排斥力最 小,因而内能最低。重叠式构象内能 最高。但二者内能相差仅12.5kJ/mol, 室温时,分子热运动所提供的能量就 能使各个构象相互转化,因而不能分 离出乙烷的某一构象异构体。
立体化学基础
(2)取代环己烷的构象
当环己烷分子中的一个氢被其它基团取代时,可取代 a键,也可以取代e键,得到两种不同的构象。
甲基环己烷:
优势构象(95%)
22
(2)取代环己烷的构象
取代环己烷优势构象判断的一般规律: 一元取代环己烷,e键取代最稳定; 多个相同取代基的环己烷,e键取代最多的
构象最稳定; 含不同的取代基的环己烷,较大的基团在e
键(平伏键)或e键。
18
椅式构象中的横键和竖键
竖键(a)
横键(e)
三上三下, 三左三右, ae夹角109°
19
(2)椅式构象中的横键和竖键
翻环作用: 当环己烷的一个椅式构象转变为另一个椅 式构象时,原来的a键将转变为e键,而e键也相应 转变为a键。
20
椅式构象中的横键和竖键 椅式构象的特点:
① 椅式构象中1.3.5碳在一个平面, 2.4.6碳在另一平面,两平面相距 0.5nm。 ② 分子中有6个α键(直立键),6个 e键(平伏键)。 ③ 构象具有转环作用(104~105次/秒)。
2 x 1.0 = 2.0
2 x 11.4 = 22.8
叔丁基是一个很大的基团,一般占据e键。
26
26
(2)二取代环己烷的构象
某些取代环己烷,张力特别大时,环己烷的椅 式构象会发生变形,甚至会转变为船式构象
CH3
H3C
CH3
C
H
H C(CH3)3
C(CH3)3 C(CH3)3
H
椅式
船式 优势构象
27
CH3
(2)
Br
(H3C)3C Br
H
OH OH
CH3 H
OH
H O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
,产生无数个
构象异构体,其中有两个典型构象异构体,称为极限构象异
构体——重叠式(顺叠式)构象、叉式(反叠式)构象。
重叠式构象
交叉式构象
构象异构体的表示:三维结构;锯架结构和纽曼投 影式
H
H
H H
H H
三维结构
H
HH H
H
H
H HH HH H
锯架式结构
HH H
H
HH
H H
H
三维结构
H H
H
H H
H
H3C CH3
H H
H H
全重叠式
(顺叠式)
C H3
H
H
H
H
C H3
对位交叉式
(反叠式)
C H3
H
C H3
H
H
H 邻位交叉式
(顺错式)
H CH3
H
H H
C H3
部分重叠式
(反错式)
H CH3
H H
HCH3
部分重叠式
(反错式)
C H3
C H3
H
H
H
H
邻位交叉式 (顺错式)
丁烷有四种极限构象,其热力学能及动态平衡中各异 构体含量如下:
全重叠式 部分交叉式 部分重叠式 对位交叉式
热力学能 18.8
3.7
15.9
0
/kJ·mol-1
室温下含 ≈0
18
≈0
72
量/%
丁烷分子不同构象的能量曲线如下图所示:
E 能量
H3C C H3
C H3 C H3
H C H3 H C H3
H C H3
H3C H
15.9
C H3 C H3
C H3
H3C C H3
5.分子构象的作用
构象影响分子间作用力等,因而影响化合物的性 质(如熔点)和反应机理。
注意:
这里讨论是链烷烃的构象,在分析其他类化合物
构象时,在相邻碳原子上连有可形成氢键的基团
时,会改变构象。
例:CH2Cl—CH2OH的稳定构象是
邻位交叉式。
因为氢键的能量远大于稳定构象的能量。
二、环烷烃的构象
1.环丙烷的构象
稳定构象:在一系列构象中能量最低(最稳定、 存在时间最长或出现几率最大)的构象称为稳 定构象,又称为优势构象。如乙烷的交叉式构 象;环己烷的椅式构象。 构象分析:
构象异构产生的原因:
由于以σ键 连接的两个原子可以相对的自由旋转, 从而使分子中的原子或基团在空间有不同的排布方式。
2.乙烷的构象
乙烷分子绕C—C σ 键旋转
椅型构象:C1、C2、C4、C5在一个平面上, C6和C3分别在平面的下方和平面的上 方,很象椅脚和椅背,故称“椅型”。
椅型构象
船型构象 动画
在椅型构象中,从透视式和纽曼式中可以看 到:相邻的两个碳上的 C—H 都是交叉式构象,非 键合的氢间最近距离0.25 nm,大于0.24 nm(正常非 键合氢之间的距离)。C原子的键角109.5°。无各 种张力,是优势构象,在平衡构象中约占99.9%。
18.8 kj.mol-1 3.7
C H3
-
-
0
60 120 180 240 300
360
旋转角度
由此可见:丁烷四种典型构象能量的高低顺序是: 全重叠式 > 部分重叠式 > 邻位交叉式 > 反交叉式
结论:反交叉式是丁烷的优势构象
(又称:最稳定构象)
反交叉式构象稳定的原因(即构象分析):
在对位反交叉式构象中,扭转张力最小,两个 大基团(CH3)相距最远,非键张力(范德华排 斥力)最小,能量最低,是优势构象;其次是部分 交叉构象,能量较低;再次是部分重叠构象,能量 较高;能量最高的是全重叠式构象,其σ键电子对 扭转张力最大,两个大基团相距最近,非键张力也 最大,是最不稳定构象。
提出环己烷有船型、椅型两种构象。
(1) 椅型和船型构象
环己烷保持碳原子的109.5°键角,提出了椅型和船型 构象。
0.18 nm
4
1
56
3
2
船式构象
椅式结构
4
H
3
5
H
H
2
16
H
HH
HH
纽曼投影式
a键 e键
船型构象:C1、C2、C4、C5在一个平面上, C3和C6在平面上方。形状象只船,C3 和C6相当船头和船尾,故称“船型”。
乙烷分子不同构象的能量曲线如下图所示:
E
12.6 kj.mol-1
能
量
-
0
60 120 180 240 300
360
旋转角度
由此可见,交叉式构象的能量较低,故为稳定构象。
分子处于热运动状态,从交叉式构象转到另一交 叉式构象仅需要克服12.6 kJ·mol-1能垒,因此各种构 象处于动态平衡。
重叠式构象不稳定的原因是两个碳上的 C—H 键 处于重叠位置,相距最近,两个 C—H 的两个σ电 子对互相排斥,产生扭转张力最大,分子的热力学 能最高。
在交叉式构象中,两 C—H 键距离最远,扭转张 力最小,分子热力学能最低,是最稳定构象。温度
降低,稳定构象数量增加。
3.丁烷的构象:
丁烷的结构比乙烷复杂,先讨论绕 C2— C3 σ键旋转产生的构象。
丁烷有四种极限构象,其热力学能及动 态平衡中各异构体含量如下:
丁烷绕 C2—C3σ键 旋转的典型构象有四种:
环丙烷是三个碳原子的环,只能是平面构象, 即它的构型。
尽管只有一种构象,但这个环极不稳定,主要因 为:
(1)所有C-H键都是重叠构象,扭转张力大。 (2)C原子是不等性杂化或弯曲键,有“角张力” 存在。
2.环丁烷的构象
环丁烷有两种极限构象:
平面式构象:像环丙烷一样,不稳定,因为扭转张 力和“角张力”存在。 蝶式构象:能缓解扭转张力和角张力,呈蝶式构象。
这些构象能量差 18.8 kJ.mol-1,室温下仍可以绕 C2-C3 σ键自由转动,相互转化,呈动态平衡。
丁烷分子也可以绕 C1—C2 和 C3—C4 σ键旋转产生 类似的构象。
相邻的两碳上的 C—H 键都处于反位交叉式,碳链 呈锯齿状排列:
4.正构烷烃的构象
高碳数链烷烃的优势构象:相邻的碳 原子的构象都是反位交叉式,碳链呈 锯齿状排列 。
通过平面式构象,由一种蝶式翻转成为另一种蝶式 构象,处于动态平衡。蝶式是优势构象。
3.环戊烷的构象
环戊烷的构象主要是信封型和半椅型构象。 两者处于平衡。因为平面构象能量较大,一 般认为环戊烷采取这种构象可能性很少。
E相对=kJ/mol 信封式E=0
半椅型E=0
4.环己烷的构象
环己烷的构象经过近百年的努力才建立起 来 。Baeyer 1885年提出张力学说,认为环状化合 物是平面构型 Sachse(萨克森) 1889年质疑张力学说只适合小环,
H
H
H
纽曼 ( Newman ) 投影式
重叠式构象
交叉式构象
构象的表示方法:锯架式、立体透视式(三维结构)和 纽曼(Newman)投影式,其中扭曼投影式最重要。 扭曼投影式:把乙烷分子模型的C—C键的一端对着观 察者,另一端远离观察者,进行投影操作,两碳原子 重合。前碳用 表示,后碳用 表示。
用前碳和后碳上的两个C—H键分别与C—C键确定 的两平面的二面角“θ”旋转的角度表示构象。有重 叠式构象和交叉式构象。
