§3-2_构象异构现象解析
§3-2_构象异构现象解析

用前碳和后碳上的两个C—H键分别与C—C键确定 的两平面的二面角“θ”旋转的角度表示构象。有重 叠式构象和交叉式构象。
乙烷分子不同构象的能量曲线如下图所示:
E 能 量
12.6 kj.mol
-1
-
-
-
-
-
-
0
60
120
180
240
300
360
旋转角度
由此可见,交叉式构象的能量较低,故为稳定构象。
分子处于热运动状态,从交叉式构象转到另一交 叉式构象仅需要克服12.6 kJ· mol-1能垒,因此各种构 象处于动态平衡。 重叠式构象不稳定的原因是两个碳上的 C—H 键 处于重叠位置,相距最近,两个 C—H 的两个σ电 子对互相排斥,产生扭转张力最大,分子的热力学 能最高。 在交叉式构象中,两 C—H 键距离最远,扭转张 力最小,分子热力学能最低,是最稳定构象。温度 降低,稳定构象数量增加。
环己烷的半椅型构象 与椅型相比:由于扭转张力和角张力存在,比椅 型构象高 46 kJ∙mol-1。
(4)环的翻转
当由一种椅型翻转成另一种椅型构象时,要 经过两个半椅型,两个扭船型和一个船型等构象:
5. 取代环己烷的优势构象
(1) 一取代环己烷
一取代环己烷:有取代基 R 在 a 键上和在 e 键上两种构象。在 e 键上的构象稳定。因为, R 在e 键上是对位交叉构象,在 a 键上是邻 位交叉构象。随着 R 基团的增大,在 e 键 上的构象比例增加。
椅型构象
船型构象
动画
在椅型构象中,从透视式和纽曼式中可以看 到:相邻的两个碳上的 C—H 都是交叉式构象,非 键合的氢间最近距离0.25 nm,大于0.24 nm(正常非 键合氢之间的距离)。C原子的键角109.5°。无各 种张力,是优势构象,在平衡构象中约占99.9%。
大学有机化学之立体异构

凡有对称面的分子,不具旋光性,也没有对映异构体。
对大多数有机化合物来说 ( 尤其是链状化合物 ) , 对称面(能将分子分成实物和镜像关系的平面称为对 称面)是最常见的对称因素。如反-1,2-二氯乙烯和二 氯甲烷分子中都存在对称面 (图9-2),它们都不具有 手性,也就没有旋光性。
图9-2 1,2-二氯乙烯和二氯甲烷
任何一个不能和它的镜像完全重叠的分子称为手性 分子。所谓手性 (chirality) ,就是指实物与镜像对映而 不能完全重叠的特性,就如同左手与右手的关系一样。
左手的镜像是右手 对映关系
左手
镜
右手
镜面
实物与镜像
1. 任何一个不能和它的镜像完全重叠的分子称 为手性分子。所谓手性 (chirality),就是指实物与 镜像对映而不能完全重叠的特性,就如同左手与右 手的关系一样。 2.物质产生旋光性的根本原因是分子的手性, 即任何一个具有旋光性的分子必定是手性分子。手 性分子通常必定产生旋光性,但也有极少数手性分 子没有或旋光活性很小,或者在某些波长的光段不 表现出旋光性。 3.任何一个能够和它的镜像完全重叠的分子, 都不具有旋光性,这样的分子称为非手性分子 (achiral molecules)。
COOH H (Ⅰ) OH CH3 HO
CH3 H COOH (Ⅱ) H3C
OH COOH HOOC H (Ⅲ)
H CH3 OH (Ⅳ) H
OH CH3 COOH (V)
如何判定不同Fischer投影式是否为同一构型? 1.不离开纸平面旋转180˚投影式相同,构型相 同,如(Ⅰ)和(Ⅱ),(Ⅲ)和(Ⅳ)。 2.同一手性碳原子上基团进行偶次交换后投影 式相同,构型相同。
含一个手性碳原子的化合物,可以有两种空间 构型,如乳酸。
第三章立体异构现象

[] 值与符号取决于温度: 1.)温度引起的相对密度的变化 2.)温度引起的解离常数的变化 3.)温度引起的构像数量变化
温度的影响:
HOOC CH(NH2) H2C COOH (水溶液)
T D
室温为右旋光(+); 75℃ []=0; 高温为左旋光(-); [] D= 5.0 CHCl3 0.7 CHCl3 +1.7 CHCl3 +18.9 CHCl3
非对映体或非对映构象分子间作用不同。
二、外消旋体
由相同但光学纯度不同的两个对映体组成的任何 两个混合物(非对映体混合物),它们的物理性 质或多或少不相同。
1、消旋体
两个对映体等量地组成的混合物称为消旋体。
写成dl-对或(±)-对。
消旋体和相应的对映体的物理性质不同,值得注意的是熔 点和溶解度。
3、左旋和右旋圆偏振光
任何一种单色平面偏振光(非手性的 )如钠黄光是由左旋 圆偏振光(左手性)和右旋偏振光(右手性)组合成的。
一束单色平面偏振光穿过付若斯诺(Fresnel)复棱镜能分 为两束光——右旋圆偏振光和左旋圆偏振光。
右旋偏振光在右旋石英中折射率大; 左旋偏振光在左旋石英中折射率大;? 右旋偏振光在右旋石英中路径长; 左旋偏振光在左旋石英中路径长;
3.1 立体异构体的分类
一、分类
按对称性分类和按能障分类 。 这是两种分类方法是互相独立、之间无联系的分类方法。
1,按对称性分类
相同分子式的分子 是 相同分子 可重合性 否
异构体(结构异构) 是 构造是否相同 否 构造异构 否
立体异构 是 对映体 是否镜像并不重合
非对映体
对映体是手性的(非对称的),手性是对映体的充分必要 条件。 对映体有旋光性,用(+)或(-)表示,互为对映体的两 物质其旋光性大小相等,方向相反。
3-构象异构

Li Ligeng
Department of Medicinal Natural Product Chemistry College of Pharmaceutical Science, Hebei Medical University
河北医科大学药学院 天然药物化学教研室
李力更
1
没有理论上的总结和提高,
H CH3
H3C H
15.9
CH3 CH3
CH3
H3C CH3
18.8 kj.mol-1 3.7
CH3
-
-
0
60 120 180 240 300
360
旋转角度
19
[copy]
20
三、取代的正丁烷体系的构象 一般情况下,当分子中除立体因素外,不
存在其它相互作用的因素(如:偶极作用、氢 键等)时,对位交叉是最稳定的构象。
HH
不相似重叠式(a1c8)
中英文对照名词:
邻位交叉 不相似重叠 部分重叠 相似重叠 全重叠
gauche unlike eclipsed partially eclipsed like eclipsed fully eclipsed
正丁烷构象的能量图
E 能量
H3C CH 3
CH3 CH3
H CH3 H CH3
bond),简称 e 键。 36
环已烷的椅式构象-2
a e
e a
☞ 椅式构象中,6 个 C 原子实际上成 2 个平面, 即相互间隔的 3 个 C 原子在同一平面,另外 3 个 C 原子在另一平面,两个平面间隔约 0.056 nm。
37
环已烷的椅式构象-3
a e
e a
第一节 有机化学中的构象和顺反异构

H CH3
CH2CH3
H H3C
H
C
D
H CH2CH3
稳定性: D>B >A>C
2021/10/27
优势构象判断的三条规则:
(1)环己烷最稳定的构象是椅式构 象;
(2)环己烷多元取代物最稳定的构象是 e 取代基最多的构象;
(3)有不同取代基时,大的取代基在 e键上的稳定。
2021/10/27
1. 写出反-1-甲基-4- 乙基环己烷的优势构象
24/25CH3
2、构象异构的特点,环已烷及取代 环已烷的构象分析
构象异构:由于碳碳σ键的自由旋转, 使得碳原子上的原子或基团在空间的排列 不同,所产生的异构现象。
2021/10/27
乙烷分子的构象异构现象
H
H
H
H
H
H
交叉式
2021/10/27
H
H
H
H
H
H
重叠式
H H
H A Eclipsed
H
CH3 CH3
H
H
2021/10/27
HH
C Eclipsed
D Anti
2021/10/27
CH3H
CHH3 H H
CH3 H
H
H
H CH3
C Eclipsed
HCH3
H H
H CH3
B Gauche
2021/10/27
CH3 H
CH3 H
H H
A C
A C
E 0
B
B
D
60 120 180 240 300 360
Br
Br
顺-1,2-二溴乙烯
有机化学基础知识点整理有机物的分子构象与立体异构

有机化学基础知识点整理有机物的分子构象与立体异构有机化学基础知识点整理有机物的分子构象与立体异构有机化学是研究含碳化合物的科学,它是化学的一个重要分支。
在有机化学中,分子构象和立体异构是两个基本的概念。
本文将对有机物的分子构象和立体异构进行整理和介绍。
一、分子构象分子构象是指有机物分子在空间中不同的排列方式和形式。
有机物的分子构象取决于它的键角和键长,以及它在空间中的排列方式。
以下是一些常见的分子构象:1. 扭曲构象扭曲构象是指分子中存在旋转自由度的碳原子之间的扭曲关系。
这种构象常见于含有多个旋转自由度的柔性链状分子中,如烷烃。
通过扭曲构象,分子可以在空间中采取多种不同的形式。
2. 错合构象错合构象是指由于化学键的自由旋转而产生的分子构象。
当两个键相对旋转时,分子的构象也会发生变化。
这种构象常见于双键和环状化合物中。
3. 键长和键角的变化分子的构象还取决于化学键的长度和角度。
当化学键发生变化时,分子的构象也会相应改变。
键角和键长的变化可以通过实验和计算方法来确定。
二、立体异构立体异构是指分子在空间中的排列方式不同,但化学式相同的现象。
立体异构可以分为构造异构和空间异构两种类型。
1. 构造异构构造异构是指分子中原子的连接方式不同所产生的异构体。
常见的构造异构有链式异构、官能团异构和位置异构。
链式异构是指碳链长度不同的异构体,如正丁烷和异丁烷。
官能团异构是指官能团的位置不同所产生的异构体,如醇和醚的异构体。
位置异构是指分子中原子或官能团的位置不同,如2-丙醇和1-丙醇。
2. 空间异构空间异构是指分子在空间中的排列方式不同所产生的异构体。
常见的空间异构有立体异构、对映异构和构象异构。
立体异构是指分子中原子或官能团的空间排列方式不同,如顺式异构和反式异构。
对映异构是指分子与镜像分子对称但非同一结构的异构体,如手性分子。
构象异构是指分子扭转或旋转而形成的不同构象。
综上所述,有机化学中的分子构象和立体异构是有机物分子在空间中的排列和形态的不同表现。
有机化学基础知识点整理立体异构体的分类与判断

有机化学基础知识点整理立体异构体的分类与判断有机化学基础知识点整理:立体异构体的分类与判断在有机化学中,立体异构体是指化学结构相同但空间结构不同的化合物,它们的分子式和分子量相同,但具有不同的物理和化学性质。
本文将对立体异构体的分类与判断进行整理。
一、立体异构体的分类立体异构体可分为两大类:构型异构体和构象异构体。
1. 构型异构体构型异构体是指分子中的原子通过化学键的重新组合,产生化学键的对称性不同而产生的异构体。
构型异构体的特征是键合关系不同,原子的连接方式不同。
构型异构体根据键的旋转方向,可分为各向同性构型异构体和各向异性构型异构体。
各向同性构型异构体是指分子中化学键的旋转方向不影响它们的重叠,常见的例子是顺式异构体和反式异构体。
顺式异构体中,两个偶极矩相对而立的取向,使分子具有较大的亲水性;反式异构体中,两个偶极矩相背离的取向,使分子具有较小的亲水性。
各向异性构型异构体是指分子中化学键的旋转方向影响它们的重叠行为。
最常见的例子是环状分子的构型异构体,如环状烷烃分子中的立体异构体。
2. 构象异构体构象异构体是指分子在空间中的不同构象或构象体,其分子间的键合关系、原子的连接方式相同,但键或基团的存在位置或取向不同。
构象异构体的特征是键的旋转方向不影响键的重叠,分子结构可以通过键的旋转或轴向旋转进行转换。
构象异构体的分类较多,常见的包括构象异构体、构象体、立体异构体等。
构象异构体的判断可以通过键的旋转方向、骨架结构的平面角度等进行确定。
二、立体异构体的判断立体异构体的判断可以通过以下几种方法进行:1. 空间取向判断通过分子的空间取向关系,确定立体异构体的构象。
常见的方法包括手性分子体系的判断、碳原子取向的判断等。
2. 分子结构的旋转通过旋转分子结构,观察分子是否能与其他立体异构体重叠或进行转换。
常见的方法包括构象结构的旋转、键的旋转等。
3. 立体异构体的性质比较通过比较立体异构体的物理性质和化学性质,判断其是否属于同一分子的立体异构体。
构象异构实用营养学
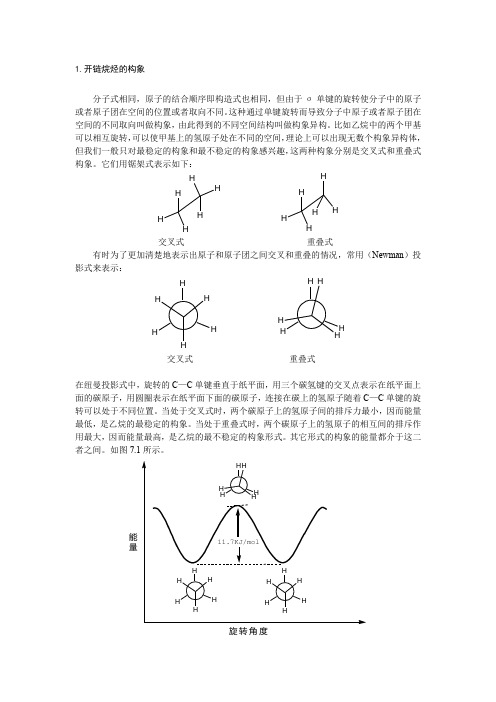
1.开链烷烃的构象分子式相同,原子的结合顺序即构造式也相同,但由于σ单键的旋转使分子中的原子或者原子团在空间的位置或者取向不同。
这种通过单键旋转而导致分子中原子或者原子团在空间的不同取向叫做构象,由此得到的不同空间结构叫做构象异构。
比如乙烷中的两个甲基可以相互旋转,可以使甲基上的氢原子处在不同的空间,理论上可以出现无数个构象异构体,但我们一般只对最稳定的构象和最不稳定的构象感兴趣,这两种构象分别是交叉式和重叠式构象。
它们用锯架式表示如下:H HHHH HH HHH H交叉式 重叠式有时为了更加清楚地表示出原子和原子团之间交叉和重叠的情况,常用(Newman )投影式来表示:HHHHHHH HHH H H交叉式 重叠式在纽曼投影式中,旋转的C —C 单键垂直于纸平面,用三个碳氢键的交叉点表示在纸平面上面的碳原子,用圆圈表示在纸平面下面的碳原子,连接在碳上的氢原子随着C —C 单键的旋转可以处于不同位置。
当处于交叉式时,两个碳原子上的氢原子间的排斥力最小,因而能量最低,是乙烷的最稳定的构象。
当处于重叠式时,两个碳原子上的氢原子的相互间的排斥作用最大,因而能量最高,是乙烷的最不稳定的构象形式。
其它形式的构象的能量都介于这二者之间。
如图7.1所示。
能量图7.1 乙烷不同构象能量大小图乙烷从交叉式构象旋转到重叠式构象,能量相差约为11.7KJ/mol, 这个位能差或者势垒是很小的,所以乙烷的构象之间很容易转化,一般分离不出纯的构象异构体。
但从构象异构体的位能可以知道,最稳定的构象所占比例最大,最不稳定的构象所占比例最小,因此在乙烷中,交叉式构象出现的几率最多,所占比例最大,为优势构象。
丁烷比乙烷多两个C -C 单键,其构象异构体更多,更复杂。
从丁烷中间的C -C 键旋转看,相当于乙烷的每个碳上的氢被一个甲基取代,具有如下四种典型的构象异构体。
H CH 3H CH 3HHH H CH 3H 3C H HH H CH 3CH 3HHHCH 3HH 3C H H邻位交叉式部分重叠式对位交叉式全重叠式能量旋转角度图7.2 丁烷不同构象能量大小图从图7.2可知,全重叠式的两个甲基之间距离最小,范德华斥力最大,位能最高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注意:
这里讨论是链烷烃的构象,在分析其他类化合物
构象时,在相邻碳原子上连有可形成氢键的基团
时,会改变构象。
例:CH2Cl—CH2OH的稳定构象是 邻位交叉式。 因为氢键的能量远大于稳定构象的能量。
二、环烷烃的构象
1.环丙烷的构象
环丙烷是三个碳原子的环,只能是平面构象, 即它的构型。
尽管只有一种构象,但这个环极不稳定,主要 因为: (1)所有C-H键都是重叠构象,扭转张力大。 (2)C原子是不等性杂化或弯曲键,有“角张力” 存在。
① 环己烷的六个碳原子构成两个平面; ②六个a、e键分别为三上三下;
③同一碳原子若a键在上,e键必然在下;
①直立键:每个碳上有一根与轴平行的 C—H 键,
称直立键,也称竖直键(a 键)。有三根向上,三
根向下。 ②平伏键:每个碳上有一根与平行平面成 19°角 的C—H 键称平伏键,也称水平键(e 键)。有三根 向上偏19°,三根向下偏 19°。 ③直立与平伏键转换:当从一种椅型构象翻转成 另一种椅型构象时,平伏键转)
H
部分重叠式 ( 反错式 )
CH3 H H CH3 对位交叉式 ( 反叠式 ) H H H
H CH3 H H
CH3 CH3 H H ( 顺错式 ) H H
CH3
部分重叠式 ( 反错式 )
邻位交叉式
丁烷有四种极限构象,其热力学能及动态平衡中各异 构体含量如下:
全重叠式 部分交叉式 部分重叠式 对位交叉式 热力学能
变成平伏键。
a → e e → a
a、e 键可以相互转化。
动画
(3) 扭船型和半椅型构象。 ①扭船型构象: 将船型构象的碳扭转约30°,变成扭船型:
环己烷的扭船型构象
与船型相比:旗杆键的氢非键张力减少;比船型 构象低 7 kJ∙mol-1。
②半椅型构象:
3 1 6 5 2 4 1 6 5 4 3 2
CH3 CH3 H3C CH3
2.写出下面化合物的优势构象。
CH3
CH3
H
C2H5 H
CH(CH3)2
(H3C)2HC
CH3 C2H5
C2H5
(CH3)2CH
H
反式-1-甲基-4-叔丁 基环己烷构象
顺式-1-甲基-4-叔丁基环己 烷构象
①
1,2-二取代环己烷
CH3
5 6 3 2 1
顺 式 :
4
CH3 H
H
4 3
5
CH3
2
6
CH3
1
H
H
a、e 键 CH3
5 6 3 2 1
a、e 键 H
2
反 式 :
4
H CH3
H
4 3
5
6
CH3
1
CH3
H
a、a 键
e、e 键
-1
C H3
-
-
-
-
-
0
60
120
180
240
300
360
旋转角度
由此可见:丁烷四种典型构象能量的高低顺序是:
全重叠式 > 部分重叠式 > 邻位交叉式 > 反交叉式
结论:反交叉式是丁烷的优势构象
(又称:最稳定构象)
反交叉式构象稳定的原因(即构象分析): 在对位反交叉式构象中,扭转张力最小,两个 大基团(CH3)相距最远,非键张力(范德华排 斥力)最小,能量最低,是优势构象;其次是部分 交叉构象,能量较低;再次是部分重叠构象,能量 较高;能量最高的是全重叠式构象,其σ键电子对 扭转张力最大,两个大基团相距最近,非键张力也 最大,是最不稳定构象。 这些构象能量差 18.8 kJ.mol-1,室温下仍可以绕 C2-C3 σ键自由转动,相互转化,呈动态平衡。
R在a键和e键
R在a键和e键的稳定性
非键张力大 H
5 4
CH3 H
3 6 2 1
H
H
4
5 3 2
6 1
H
CH3 H
5 4
3
CH3
1 2 4 2 3 5 1 6
CH3
6
H
H
结论:取代基处于e 键稳定。
(2).二取代环己烷
二取代环己烷:二取代基的情况有几种取代位 置,还有顺反关系。一般是大取代基在 e 键上的是 稳定构象。立体化学中研究环已烷衍生物性质时, 经常引入一个叔丁基,此时,叔丁基在 e 键的构象 稳定,环不易再翻转,称为 “锁住效应” 。
丁烷分子也可以绕 C1—C2 和 C3—C4 σ键旋转产生 类似的构象。
相邻的两碳上的 C—H 键都处于反位交叉式,碳链 呈锯齿状排列:
4.正构烷烃的构象
高碳数链烷烃的优势构象:相邻的碳 原子的构象都是反位交叉式,碳链呈 锯齿状排列 。
5.分子构象的作用
构象影响分子间作用力等,因而影响化合物的性 质(如熔点)和反应机理。
用前碳和后碳上的两个C—H键分别与C—C键确定 的两平面的二面角“θ”旋转的角度表示构象。有重 叠式构象和交叉式构象。
乙烷分子不同构象的能量曲线如下图所示:
E 能 量
12.6 kj.mol
-1
-
-
-
-
-
-
0
60
120
180
240
300
360
旋转角度
由此可见,交叉式构象的能量较低,故为稳定构象。
分子处于热运动状态,从交叉式构象转到另一交 叉式构象仅需要克服12.6 kJ· mol-1能垒,因此各种构 象处于动态平衡。 重叠式构象不稳定的原因是两个碳上的 C—H 键 处于重叠位置,相距最近,两个 C—H 的两个σ电 子对互相排斥,产生扭转张力最大,分子的热力学 能最高。 在交叉式构象中,两 C—H 键距离最远,扭转张 力最小,分子热力学能最低,是最稳定构象。温度 降低,稳定构象数量增加。
和 C5 是重叠构象,有扭转张力,船头和船尾上两 个伸向船内的氢(旗杆键上氢)相距0.183nm,小于 正常非键氢原子间距离(>0.24nm),有非键张力,它 的能量比椅型高 30 kJ∙mol-1。
(2)平伏键与直立键
环己烷的椅型构象中,六个碳原子分别在两 个平行的平面中。C1、C3、C5在上面的平面中, C2、C4、C6在下面的平面中。一个三重对称轴, 垂直于两平面。
结论: 稳定性 —— 反式 > 顺式。
①处于e键的取代基越多越稳定。
②当有两个不同的取代基时,大的取代基处于e键稳定。 ② 1,3-二取代环己烷
CH3
5
CH3
3
6 2
1
4
顺 式 :
H
5 3 2
6 1
CH3 H
CH3 H
4
H
a、a 键
CH3
5
e、e 键
H
3
6 2
1
4
反 式 :
H
5 3 2
6 1
4
H
CH3 H
CH3
CH3 a 、e 键 a 、e 键
结论: 稳定性 —— 顺式 > 反式。
(3)多取代基环己烷: 在确定多取代环己烷的构象时,一般是大取 代基在 e 键上,多个取代基在 e 键上的构象稳定。
CH3 CH3 OH 反-2,2-二甲基-r-1-环己醇 H3C H3C
OH
练习:
1. 试写出1,4-二甲基环己烷顺反异构体的构象异 构体,并比较其稳定性。
/kJ· mol-1
室温下含 量/%
18.8
3.7
15.9
0
≈0
18
≈0
72
丁烷分子不同构象的能量曲线如下图所示:
H 3 C C H3 H C H3 H C H3 H3C H H C H3 H 3 C C H3
E 能量
15.9
C H3 C H3 C H3 C H3 C H3
18.8 kj.mol 3.7
0.18 nm
4 5 3 2 1 6
H H
3 2
4 5 1 6
H H
HH
HH
船式构象
纽曼投影式
a键 e键
椅 式 结 构
船型构象:C1、C2、C4、C5在一个平面上, C3和C6在平面上方。形状象只船,C3 和C6相当船头和船尾,故称“船型”。
椅型构象:C1、C2、C4、C5在一个平面上, C6和C3分别在平面的下方和平面的上 方,很象椅脚和椅背,故称“椅型”。
§3-2 构象异构现象
一、链烷烃的构象异构现象
1.基本概念
分子的构象:在常温下,分子中的原子或基团绕着 单键(σ键)旋转,在空间产生了一系列不同的 排列,这一系列排列称为分子的构象。每一种 排列称为构象异构体。 异象体:同一构型,不同的构象异构体又称为异象 体,通常称为不同的构象。如乙烷的重叠式和 交叉式构象式。
E相对=kJ/mol
信封式E=0
半椅型E=0
4.环己烷的构象
环己烷的构象经过近百年的努力才建立起 来 。Baeyer 1885年提出张力学说,认为环状化 合 物是平面构型 Sachse(萨克森) 1889年质疑张力学说只适合小环, 提出环己烷有船型、椅型两种构象。
(1) 椅型和船型构象
环己烷保持碳原子的109.5°键角,提出了椅型和船 型构象。
重叠式构象
交叉式构象
构象异构体的表示:三维结构;锯架结构和纽曼投 影式
H
H H H
H H H H H 锯架式结构 H
H H H H H
H H
H
H
H
H
H
H 三维结构
H
三维结构
HH H H
H H H H H H
H H
纽曼 ( Newman ) 投影式
重叠式构象
交叉式构象
