1~6章常见化学方程式
高中化学方程式大全和重要离子方程式

高中化学方程式大全和重要离子方程式高中化学方程式总结高考总复习之高中化学方程式总结化学第一册第一章卤素第一节氯气1、2 Na Cl 2 点燃 2 NaCl2、Cu Cl 2 点燃CuCl 23、 2 Fe 3Cl 2 点燃 2 FeCl 34、H2 Cl 2 点燃(光照) 2 HCl5、 2P 3Cl 点燃 2 PCl 326、PCl 3 Cl 2 PCl 57、 Cl 2 H 2 O HCl HClO8、 2 Ca ( OH )2 2 Cl 2 Ca ( ClO )2 CaCl 2 2H 2O9、Ca(ClO)2 CO 2 H 2 O CaCO 3 2 HClO10、2 NaOH Cl 2 NaClO NaCl H 2 O11、4HCl MnO 2 MnCl 2 2H 2O Cl 212、2 KMnO 4 16 HCl (浓)2MnCl 2 2 KCl 5Cl 28 H 2 O13、2 HClO 见光O 22 HCl第二节氯化氢14、NaCl H 2 SO (浓)4 NaHSO 4 HCl15、NaHSO 4 NaCl Na 2 SO 4 HCl17、 HCl AgNO3AgCl HNO318、 NaClAgNO3AgClNaNO 319、 KClAgNO3AgCl KNO320、 2 HCl CaCO 3CaCl2H 2 O CO 2 第三节氧化还原反应21、 CuOH 2 Cu H 2 O22、 C4HNO 3CO 24NO 2 2H 2O23、 4 Zn10 HNO (极稀) 4 Zn () NH 4NO 3 3H 2O 3NO 3 224、 11 P 15 CuSO 424H 2O5 Cu 3 P 6H 3PO 415H 2SO 425、 KClO36HCl (浓)3 Cl 2KCl3H 2O26、 4 Mg10 HNO(极稀)4Mg ( NO )NH 4NO 33H 2O33 227、 K 2Cr 2O76 Fe 3 O4 31 H 2SO4 Cr ( SO ) 9 Fe (SO ) K 2SO4 31 H 2O24 324 328、 2 KNO 33C SK 2 S N 2 3CO 2第四节卤族元素29、 H30、 H2F 2 2HF2 Br 2 2 HBr31、H 2I 22 HI32、 2 NaBr Cl 22 NaCl Br 233、 2KI Cl 2 2 KCl I 234、 2 KI Br 22 KBrI 235、 NaBrAgNO3AgBrNaNO 336、 KI AgNO 3AgIKNO337、 2 AgBr 光照2 Ag Br 2第二章摩尔反应热第一节摩尔38、 C O 2 CO 239、Mg 2 HCl MgCl 2 H 2第二节气体摩尔体积40、 Zn 2HCl ZnCl 2 H 2第三节物质的量浓度41、 2 NaOH H2SO4 Na 2 SO 4 2 H 2 O第四节反应热42、C(固)O (气)2 点燃CO (气)2 393 .5kJ43、 2 H (气)2 O (气)2 2H 2 O(气)483 .6 kJ44、 2 H (气)2 O (气)2 2H 2 O(液)571 .6 kJ45、C(固)H 2O(气)CO (气)H (2气)131 .3kJ第三章硫硫酸第一节硫46、2Cu S Cu 2 S47、Fe S FeS48、S H 2 H 2S49、S高温CS 2 C50、S点燃O 2 SO 251、3S 6 KOH 2K 2S K2SO4 3H2O 第二节硫的氢化物和氧化物52、H2S H 2 S53、2H2S 3O2(足)点燃2SO 22H 2O54、2H2S O 2 (不足)点燃2 S2H 2O点燃2H 2O 3S 55、2H2S SO256、H 2S Br2 S2 HBr57、FeS 2 HCl FeCl 2 H 2 S58、CuSO 4 H 2 S CuS H2SO459、PbAc 2 H 2 S PbS 2 HAc60、 H 2S NaOH NaHS H 2 O61、 NaHS NaOH Na 2 S H 2 O62、 H 2S 2 NaOH Na 2 S 2H 2O (60、61 结合)63、H2S 2 FeCl 3 S 2 FeCl 2 2 HCl64、H2SO(4 稀)FeS FeSO 4 H 2 S65、SO2 H 2 O H2SO366、 2SO 2 O 2 V2O5 2SO 367、SO3 H 2 O H2SO468、Na2SO3H2SO4 Na 2 SO 4 H2O SO269、SO2 2 NaOH Na 2 SO 3 H 2 O70、SO2 CaO CaSO 371、SO2 2Ca ( OH )2 CaSO 3 H 2 O72、SO73、SO74、 SO75、 SO 2CaSO 3 H 2 O Ca ( HSO 3)2 22H 2S 3S 2H 2O2Cl 2 2H 2O 2 HCl H2SO4 2Br 2 2H 2O 2 HBr H2SO476、 5SO 2 2 H 2 O 2 KMnO 4MnSO 4 K 2 SO 4 2 H 2 SO 4 第三节硫酸的工业制法高温78、2SO2 O2 V2O5 2SO 379、H2O SO3 H2SO4第四节硫酸硫酸盐80、C 2H 2SO (4浓)CO81、S 2H 2SO (4浓)3SO 2 2SO 2 2H 2O 22 H 2 O82、P H(浓)H3PO4 SO 2 2H 2O 2SO483、H2S H 2SO (4 浓)S SO2 2H 2O84、Cu 2H 2SO (4 浓)CuSO 4 SO 2 2H 2O85、BaCl86、BaCl87、BaCl 2H2SO4 BaSO 4 2 HCl2Na 2SO 4 BaSO 4 2 NaCl 2 Na 2CO3 BaCO 3 2 NaCl88、BaCO 3 2 HCl BaCl 2 H 2 O CO 289、BaCO 3 2 HNO 3 Ba ( NO 3)2 H 2 O CO 290、Na2CO3 H2SO3 Na 2 S H 2 O CO 291、2H2SO3 O 2 2H 2SO 492、2 Na2SO3O2 2Na 2 SO 493、2CaSO 3 O 2 2 CaSO 494、2 Fe 6 H(浓)()3SO 2 6H 2O 2SO4 Fe 2 SO 4 395、2 NaBr 2H 2SO (4浓)Br 2 SO 2 Na 2 SO 4 H 2 O96、2 NaCl H 2SO (4浓)Na 2 SO 4 2 HCl浓H2SO 412 C 11H 2O97、C11H22O11第四章碱金属第一节钠98、 4 Na O 2 Na O99、 2 NaO 2Na 2 O 2100、 2 Na点燃2 NaClCl 2101、 2 Na S 研磨Na 2 S102、 2 Na 2H 2O 2 NaOH H 2103、 2 Na 2H 2OCuSO 4Cu ( OH )2 Na 2 SO 4 H 2第二节钠的氧化物104、 Na 2OH 2 O2 NaOH105、 2 Na 2 O 22H 2O 4 NaOH O 2106、 Na2OCO 2 Na 2 CO 3107、 2 Na 2 O 22CO 2 2 Na 2 CO 3 O 2108、 Na 2 O2HCl2 NaClH 2 O109、 Na2O24 HCl 4 NaCl 2H 2O O 2 110、 Na 2 CO 3 2 HCl2 NaClCO 2 H 2 O 111、 NaHCO 3 HCl NaCl CO 2 H 2 O 112、 2 NaHCO3Na 2 CO 3CO 2H 2 O113、 NaHCO114、 2 NaHCO3NaOH Na 2 CO 3 H 2 O3 Ca ( OH )(少量)CaCO3Na 2CO3 2 H 2O2115、 NaHCO3Ca ( OH )(足量)CaCO3NaOHH 2O2116、 Na 2 CO 3 117、 Na 2 CO 3 BaClCaCl22BaCOCaCO332 NaCl2 NaCl118、 Ca ( HCO 3)22 HCl CaCl 2 2 CO 22H 2O119、 Ca ( HCO3)22NaOHCaCO 3 Na 2 CO 3 2H 2 O 120、 NaHSO HClNaClSO H O第三节碱金属元素121、4 Li点燃O 2 2Li 2 O122、K点燃KO 2 O 2123、2 M X 2 2 MX ( M 表示氧族元素, X 代表卤族元素)124、2 M H 2 2 MH125、2 M 2H2O 2MOHH 2第五章物质结构元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
高一化学必背的化学方程式汇总
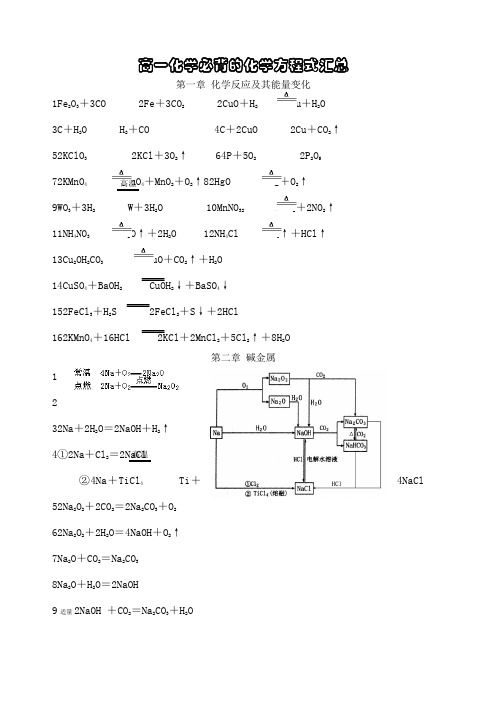
高一化学必背的化学方程式汇总第一章 化学反应及其能量变化1Fe 2O 3+3CO 2Fe +3CO 2 2CuO +H 2 Cu +H 2O 3C +H 2O H 2+CO 4C +2CuO 2Cu +CO 2↑ 52KClO 3 2KCl +3O 2↑ 64P +5O 2 2P 2O 5 72KMnO 4 K 2MnO 4+MnO 2+O 2↑82HgO 2Hg +O 2↑ 9WO 3+3H 2 W +3H 2O 10MnNO 32 MnO 2+2NO 2↑ 11NH 4NO 3 N 2O ↑+2H 2O 12NH 4Cl NH 3↑+HCl ↑ 13Cu 2OH 2CO 3 2CuO +CO 2↑+H 2O 14CuSO 4+BaOH 2 CuOH 2↓+BaSO 4↓ 152FeCl 3+H 2S 2FeCl 2+S ↓+2HCl162KMnO 4+16HCl 2KCl +2MnCl 2+5Cl 2↑+8H 2O第二章 碱金属1 232Na +2H 2O =2NaOH +H 2↑4①2Na +Cl 2=2NaCl②4Na +TiCl 4 Ti +4NaCl52Na 2O 2+2CO 2=2Na 2CO 3+O 2 62Na 2O 2+2H 2O =4NaOH +O 2↑ 7Na 2O +CO 2=Na 2CO 3 8Na 2O +H 2O =2NaOH9适量2NaOH +CO 2=Na 2CO 3+H 2O高温 高温10过量NaOH +CO 2=NaHCO 311NaOH +HCl =NaCl +H 2O 122NaCl +2H 2O 2NaOH +H 2↑+Cl 2↑ 13Na 2CO 3+CO 2+H 2O =2NaHCO 3142NaHCO 3 Na 2CO 3+CO 2↑+H 2O 15Na 2CO 3+2HCl =2NaCl +H 2O +CO 2↑反应相对NaHCO 3慢 16NaHCO 3+HCl =NaCl +H 2O +CO 2↑ 反应相对Na 2CO 3 快 17①CaOH 2适量 CaOH 2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O②CaOH 2过量 CaOH 2+NaHCO 3=CaCO 3↓+NaOH +H 2O184Li +O 2 2Li 2O 192K +2H 2O =2KOH +H 2↑202Na +CuSO 4+2H 2O =CuOH 2↓+Na 2SO 4+H 2↑21NaH +H 2O =NaOH +H 2↑ 222Na +S Na 2S22NH 4HCO 3 NH 3↑+H 2O ↑+CO 2↑232NaCl 熔融 2Na +Cl 2↑242NH 4Cl + CaOH 2 △ CaCl 2 + 2H 2O + 2NH 3↑第三章 物质的量 第四章 卤 素1Cu +Cl 2 CuCl 2 22Fe +3Cl 2 2FeCl 3 32P +3Cl 2 2PCl 32P +5Cl 2 2PCl 542Na +Cl 2=2NaCl52NaCl +2H 2O 2NaOH+H 2↑+Cl 2↑ 6H 2+Cl 2 2HCl 7 8电解点燃点燃电解点燃 点燃 点燃 点燃 电解 点燃9Cl 2+2NaOH =NaCl +NaClO +H 2O 10Cl 2+H 2O =HCl +HClO 11Cl 2+2KI =I 2+2KCl 123Cl 2+2FeBr 2=2FeCl 3+2Br 2 13NaCls +H 2SO 4浓=NaHSO 4+HCl ↑2NaCls +H 2SO 4浓 Na 2SO 4+2HCl ↑14NaOH +HCl =NaCl +H 2O 15Fe +2HCl =FeCl 2+H 2↑ 16CuO +2HCl =CuCl 2+H 2O17CaCO 3+2HCl =CaCl 2+H 2O +CO 2↑ 183Cl 2+6KOH 浓 5KCl +KClO 3+3H 2O 195KCl +KClO 3+3H 2SO 4=3K 2SO 4+3Cl 2↑+3H 2O202KClO 3+I 2=2KIO3+Cl 2 21KClO 3+6HCl 浓=KCl +3H 2O +3Cl 2↑ 224HCl +O 2 2Cl 2↑+2H 2O23CaClO 2+CO 2+H 2O =CaCO 3↓+2HClO24H 2+F 2=2HF 25H 2+Br 2 2HBr26H 2+I 2 2HI 272HClO 2HCl +O 2↑282F 2+2H 2O =4HF +O 2 292NaBr +Cl 2=2NaCl +Br 230Br 2+2KI =I 2+2KBr31KBr +AgNO 3=AgBr↓+KNO 332KI +AgNO 3=AgI ↓+KNO 3 332AgBr 2 2Ag +Br 2 342NH 4Cl + CaOH 2 △ CaCl 2 + 2H 2O + 2NH 3↑ 35I 2+5Cl 2+6H 2O =2HIO 3+10HCl第五章 物质结构 元素周期律1Mg +2H 2O MgOH 2↓+H 2↑2Mg +2HCl =MgCl 2+H 2↑32Al +6HCl =2AlCl 3+3H 2↑ 42Al +2NaOH +2H 2O =2NaAlO 2+3H 2↑ 5Al 2O 3+6HCl =2AlCl 3+3H 2O 6Al 2O 3+2NaOH =2NaAlO 2+H 2O 7NaOH 适量 AlCl 3+3NaOH =AlOH 3↓+3NaClC 450 ︒C 500 ︒光照 光照NaOH过量 AlCl3+4NaOH=NaAlO2+3NaCl+2H2O8AlOH3+3HCl=AlCl3+3H2O9AlOH3+NaOH=NaAlO2+2H2O第六章硫和硫的化合物环境保护1S+H2 H2S 22Na+S Na2S 3Fe+S FeS42Cu+S Cu2S 5Hg+S HgS 6S+O2SO272H2S+O22S↓+2H2OO2不足2H2S+3O22SO2+2H2OO2足量8SO2+2H2S=3S↓+2H2O 9H2S+X2=2HX+S↓X=Cl、Br、I10FeS+2HCl=FeCl2+H2S↑ 11Na2S+FeCl2=FeS↓+2NaCl12Na2S+2HCl=2NaCl+H2S↑13H2S+2NaOH=Na2S+2H2O14H2S+HgNO32=HgS↓+2HNO315Na2S+PbSO4=Na2SO4+PbS↓16Na2S+CuCl2=2NaCl+CuS↓ 17Na2S+2AgNO3=2NaNO3+Ag2S↓18H2S+PbSO4=H2SO4+PbS↓19H2S+CuCl2=2HCl+CuS↓20H2S+2AgNO3=2HNO3+Ag2S↓ 21SO2+H2O H2SO322SO2适量SO2+2NaOH=Na2SO3+H2O,SO2过量SO2+NaOH=NaHSO323SO2+Na2SO3+H2O=2NaHSO324Na2SO3+2HCl=2NaCl+H2O+SO2↑252Na2SO3+O2=2Na2SO4262SO2+O22SO327SO3+H2O=H2SO428SO2+X2+2H2O=H2SO4+2HXX=Cl、Br、I295SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO430Na2SO3+X2+H2O=Na2SO4+2HXX=Cl、Br、I31Na2SO3+H2SO4浓 Na2SO4+H2O+SO2↑32Cu+2H2SO4浓 CuSO4+SO2↑+2H2O33C+2H2SO4浓 CO2↑+2SO2↑+2H2O34S+2H2SO4浓 3SO2↑+2H2O△点燃点燃点燃△△△△△352HX+H2SO4浓 SO2↑+X2↑+2H2OX=Br、I364FeS2+11O22Fe2O3+8SO2372NaHSO3Na2SO3+SO2↑+H2O38H2S+H2SO4浓=S↓+SO2↑+2H2O3H2S+H2SO4浓=4S↓+4H2OH2S过量H2S+3H2SO4浓 4SO2↑+4H2O浓H2SO4过量39H2SO4+2NaOH=Na2SO4+2H2O40H2SO4+BaOH2=BaSO4↓+2H2O41H2SO4+CuOH2=CuSO4+2H2O42CuSO4+BaOH2=CuOH2↓+BaSO4↓433O2 2O3442H2O22H2O+O2↑453S+6KOH浓 2K2S+K2SO3+3H2O462K2S+K2SO3+3H2SO4=3S↓+3K2SO4+3H2O47H2S+Na2S=2NaHS 48NaHS+HCl=NaCl+H2S↑49NaHS+NaOH=Na2S+H2O50SO3+CaO=CaSO451S+2KNO3+3C K2S+N2↑+3CO2↑52NH42SO4 + 2NaOH△ 2NH3↑ + Na2SO4 + 2H2O第七章硅和硅酸盐工业1C+O2 CO22CO2+2Mg C+2MgO32NaOH+CO2=Na2CO3+H2O 4Na2CO3+2HCl=2NaCl+H2O+CO2↑5Na2CO3+CO2+H2O=2NaHCO362C+O22CO72NaHCO3 Na2CO3+CO2↑+H2O,NaHCO3+NaOH=Na2CO3+H2O8Na2CO3+CaOH2=CaCO3↓+2NaOH 9CO2+C 2CO102CO+O2 2CO211CaCO3+2HCl=CaCl2+CO2↑+H2O12CO2+CaOH2=CaCO3↓+H2OCO2适量2CO2+CaOH2=CaHCO32CO2过量高温△△放电2MnO△点燃△高温点燃点燃13CO 2+CaCO 3+H 2O =CaHCO 3214Na 2CO 3+BaOH 2=BaCO 3↓+2NaOH 15CaHCO 32+2NaOH =CaCO 3↓+Na 2CO 3+2H 2O16C +Si SiC 17Si +2F 2=SiF 4 18Si +O 2 SiO 219Si +2Cl 2 SiCl 4 20Si +4HF =SiF 4↑+2H 2↑21Si +2NaOH +H 2O =Na 2SiO 3+2H 2↑22SiO 2+2C Si+2CO ↑ 23SiO 2+3C SiC +2CO ↑ 24SiO 2+CaO CaSiO 3 25SiO 2+2NaOH =Na 2SiO 3+H 2O 26SiO 2+4HF =SiF 4↑+2H 2O 27Na 2SiO 3+2HCl +H 2O =2NaCl +H 4SiO 4↓ 28Na 2SiO 3+CO 2+2H 2O =Na 2CO 3+H 4SiO 4↓H 2O 过量 29Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓30Na 2SiO 3+2CO2+2H 2O =2NaHCO 3+H 2SiO 3↓CO 2过量 31H 2SiO 4 2H 2O +SiO 2 32H 2SiO 3 H 2O +SiO 2 33H 2SiO 3+2NaOH =Na 2SiO 3+2H 2O 34H 4SiO 4+2NaOH =Na 2SiO 3+3H 2O高温△℃500400 高温 高温 高温 △。
九年级化学各章节化学方程式

九年级化学各章节的化学方程式包括:
1. 氧气的性质:
* 镁在空气中燃烧:2Mg + O2 点燃2MgO
* 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O4 * 铜在空气中受热:2Cu + O2 △ 2CuO
* 铝在空气中燃烧:4Al + 3O2 点燃2Al2O3 * 氢气中空气中燃烧:2H2 + O2 点燃2H2O * 红磷在空气中燃烧:4P + 5O2 点燃2P2O5 * 硫粉在空气中燃烧:S + O2 点燃SO2
* 碳在氧气中充分燃烧:C + O2 点燃CO2
* 碳在氧气中不充分燃烧:2C + O2 点燃2CO 2. 化合反应:
* 单质与氧气的反应:(化合反应)
+ Mg + O2 点燃2MgO
+ Fe + O2 点燃Fe3O4
+ Cu + O2 加热2CuO
+ Al + O2 点燃2Al2O3
+ H2 + O2 点燃2H2O
+ P + O2 点燃P2O5
+ S + O2 点燃SO2
+ C + O2 点燃CO2
* 化合物与氧气的反应:
+ CO2 + H2O = H2CO3
+ SO3 + H2O = H2SO4
+ SO3 + H2O = H2SO4
+ CO3 + H2O = H2CO3
3. 单质、氧化物、酸碱盐的相互关系:
* 单质、氧化物、酸碱盐的相互转化关系:
+ O2 → CO → CO2 → H2CO3 → NaHCO3
+ O2 → SO2 → SO3 → H2SO4 → NaHSO4
+ O2 → NO → NO2 → HNO3 → NaNO3
+ O2 → P → P2O5 → H3PO4 → Na3PO4。
九年级化学第一章方程式汇总

九年级化学第一章方程式汇总(1)金属单质 +酸 -------- 盐+氢气(置换反应)1.锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑2.铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑3.镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑4.铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑5.锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑6.铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑7.镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑8.铝和稀盐酸2Al + 6HCl== 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐9.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu10.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu(3)碱性氧化物 +酸 -------- 盐 +水11.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O12.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O13.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O14.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O15.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O16.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水17.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 18.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O19.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 20.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O 21. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水22.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O23. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O24.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O25. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O26. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O27.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O28.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O29.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O30.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O31. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O32. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 +另一种盐33.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑34.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑35.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑36.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO337.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑38.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐39.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO440.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl41.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl42. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl43. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐44.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO345.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl46.2HCl + Na2CO3=2NaCl + H2O + CO2↑CO32-的检验:加盐酸,能产生使澄清石灰水变浑浊的气体(二氧化碳)47.BaCl2 + H2SO4 = BaSO4↓+ 2HClSO42—的检验方法:滴加硝酸钡溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。
高中必修二化学方程式大全汇总(精华版)

高中必修二化学方程式大全汇总(精华版)方程式是化学学科内容的重中之重。
下面是高中必修二化学方程式,希望对大家有所帮助。
高中必修二化学方程式1必修二各章节化学方程式第一章物质结构元素周期律1、li与o2反应(点燃):4li+o22li2ona与o2反应(点燃):2na+o2na2o2na与h2o反应:2na+2h2o===2naoh+h2↑k与h2o反应:2k+2h2o===2koh+h2↑2、卤素单质f2、cl2、br2、i2与氢气反应:f2+h2===2hfcl2+h2===2hclbr2+h2===2bri2+h2===2hi3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①cl2+2nabr===br2+2nacl②cl2+2nai===i2+2nacl(2)溴水与碘化钠溶液反应:br2+2nai===i2+2nabr4、mg与h2o反应:mg+2h2o===mg(oh)2+h2↑al与hcl反应:2al+6hcl===2alcl3+3h2↑mg与hcl反应:mg+2hcl===mgcl2+h2↑点击查看:高一必修二常用化学方程式总结第二章化学反应与能量1、ba(oh)2?8h2o与nh4cl的反应:ba(oh)2·8h2o+2nh4cl==bacl2+2nh3↑+10h2o2、原电池原理典型的原电池(zn-cu原电池)负极(锌):zn-2e-===zn2+(氧化反应)正极(铜):2h++2e-===h2↑(还原反应)、用电子式表示电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:zn+2h+===zn2++h2↑3、h2o2在催化剂作用下受热分解:2h2o22h2o+o2↑4、na2so4与cacl2反应:na2so4+cacl2===caso4↓+na2co35、高炉炼铁:2c+o2===2cofe2o3+3co==2fe+3co2第三章有机化合物1、甲烷的主要化学性质(1)氧化反应(与o2的反应):ch4(g)+2o2(g)co2(g)+2h2o(l)(2)取代反应(与cl2在光照条件下的反应,生成四种不同的取代物):2、乙烯的主要化学性质(1)氧化反应(与o2的反应):c2h4+3o22co2+2h2o(2)加成反应((与br2的反应):(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:ch2=ch2+h2ch3ch3ch2=ch2+hclch3ch2cl(一氯乙烷)ch2=ch2+h2och3ch2oh(乙醇)(4)聚合反应:(乙烯制聚乙烯)(氯乙烯制聚氯乙烯)3、苯的主要化学性质:(1)氧化反应(与o2的反应):2c6h6+15o212co2+6h2o br(2)取代反应:①与br2的反应:+br2+hbr②苯与硝酸(用hono2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
高中化学方程式大全(完整版)

第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃 2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃 6、523PCl Cl PCl →+ 7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓)13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHS O S O H NaCl 442(浓) 15、↑+−→−+∆HCl S O Na NaCl NaHS O 42416、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+ 19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2 第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀) 24、4243324S O H 15PO H 6P Cu 5O H 24CuS O 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31S O K S O Fe 9S O Cr S O H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+ 30、HBr 2Br H 22→+ 31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+ 33、22I KCl 2Cl KI 2+→+ 34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+ 36、33KNO AgI AgNO KI +↓→+ 37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg 第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+ 第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆ 47、FeS S Fe −→−+∆48、S H H S 22−→−+∆ 49、2CS C S −−→−+高温50、22S O O S −−→−+点燃51、O H 3S O K S K 2KOH 6S 32422++−→−+∆ 第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222S O 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2S O S H 2222点燃 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224S O H CuS S H CuS O +↓→+ 59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合)63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeS O FeS S O H 2442(稀) 65、3222S O H O H S O ⇔+66、3O V 22SO 2O SO 252∆−−→←+ 67、4223S O H O H S O →+68、↑++→+22424232S O O H S O Na S O H S O Na69、O H S O Na NaOH 2S O 2322+→+ 70、32CaSO CaO SO →+71、O H CaS O OH Ca 2S O 2322+↓→+)( 72、23232HS O Ca O H CaS O S O )(→++73、O H 2S 3S H 2S O 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++ 75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++ 第三节 硫酸的工业制法77、↑+−−→−+23222S O 8O Fe 2O 11FeS 4高温 78、3O V 22SO 2O SO 252∆−−→←+ 79、4232S O H S O O H →+第四节 硫酸 硫酸盐80、O H 2S O 2CO S O H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2S O 3S O H 2S 2242+↑−→−+∆(浓)82、O H 2S O PO H S O H P 224342+↑+−→−+∆(浓) 83、O H 2S O S S O H S H 22422++−→−+∆(浓)84、O H 2S O CuS O S O H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaS O S O H BaCl 4422+↓→+ 86、NaCl 2BaS O S O Na BaCl 4422+↓→+ 87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na S O H CO Na91、42232S O H 2O S O H 2→+92、42232S O Na 2O S O Na 2→+ 93、423CaS O 2O CaS O 2→+94、O H 6SO 3S O Fe S O H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H S O Na S O Br S O H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓) 97、O H 11C 12O H C 2SO H 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+ 99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuS O O H 2Na 2)( 第二节 钠的氧化物 104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+ 107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆ 113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+ 117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H S O NaCl HCl NaHS O 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃 122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素)124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律 本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
高中化学方程式大全(完整版)

高中化学方程式大全(完整版) Chapter 1: Halogensn 1: Chlorine Gas1.2NaCl → 2Na + Cl2 (n)2.Cu + Cl2 → CuCl2 (n)3.2Fe + 3Cl2 → 2FeCl3 (n)4.H2 + Cl2 → 2HCl (n under light)5.2P + 3Cl2 → 2PCl3 (n)6.PCl3 + Cl2 → PCl57.Cl2 + H2O → HCl + HClO8.2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9.Ca(ClO)2 + CO2 + H2O → CaCO3 ↓ + 2HClO10.2NaOH + Cl2 → NaClO + NaCl + H2O11.MnCl2 + 2H2O + Cl2 → Δ MnO2 + 2HClO12.2KMnO4 + 16HCl (concentrated) → 2MnCl2 + 2KCl + 5Cl2 ↑ + 8H2O13.2HClO → (light)n 2: Hydrogen Chloride14.NaCl + H2SO4 (concentrated) → NaHSO4 + HCl ↑15.NaHSO4 + NaCl → Na2SO4 + HCl ↑ (combined with 14)16.2NaCl + H2SO4 (concentrated)17.HCl + AgNO3 → AgCl ↓ + HNO318.NaCl + AgNO3 → AgCl ↓ + NaNO319.KCl + AgNO3 → AgCl ↓ + KNO320.2HCl + CaCO3 → CaCl2 + H2O + CO2↑n 3: Redox ns21.CuO + H2 → Cu + H2O22.C + 4HNO3 → CO2 ↑ + 4NO2 ↑ + 2H2O23.4Zn + 10HNO3 (very dilute) → 4Zn(NO3)2 + NH4NO3 + 3H2O24.11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 +15H2SO425.KClO3 + 6HCl (concentrated) → 3Cl2 ↑ + KCl + 3H2O26.4Mg + 10HNO3 (very dilute) → 4Mg(NO3)2 + NH4NO3 + 3H2O27.K2Cr2O7 + 6Fe3O4 + 31H2SO4 → Cr2(SO4)3 +9Fe2(SO4)3 + K2SO4第四节卤族元素卤族元素是指周期表中第17族元素,包括氟、氯、溴、碘和石蕊。
高中化学方程式大全(完整版)

.第一章卤素第一节氯气1、2Na Cl点燃2NaCl 22、Cu Cl 2点燃CuCl 23、2Fe3Cl 2点燃2FeCl34、H2Cl 2点燃(光照)2HCl5、2P3Cl点燃2PCl326、PCl3Cl 2PCl 57、Cl2H 2 O HCl HClO8、2Ca(OH)22Cl 2Ca( ClO )2CaCl 22H 2O9、Ca(ClO)2CO2 H 2O CaCO 32HClO10、2NaOH Cl 2NaClO NaCl H 2 O11、4HCl MnO 2MnCl 2 2H 2 O Cl 212、2KMnO416HCl (浓)2MnCl 22KCl5Cl 28H 2 O13、2HClO见光2HCl O 2第二节氯化氢14、NaCl H 2SO(4浓)NaHSO 4HCl15、NaHSO4NaCl Na 2SO4HCl16、2NaCl H 2SO(4浓)Na 2 SO42HCl( 14、15 联合)17、HCl AgNO 3AgCl HNO 318、NaCl AgNO 3AgCl NaNO 319、KCl AgNO 3AgCl KNO 320、2HCl CaCO 3CaCl 2H 2 O CO 2第三节氧化复原反响.21、CuO H 2Cu H 2O22、C4HNO 3CO 24NO 22H 2O23、4Zn(极稀)4Zn()NH 4NO 3 3H2O 10HNO3NO3 224、11P15CuSO424H2O5Cu 3 P6H 3PO415H 2SO 425、KClO36HCl (浓)3Cl 2KCl3H 2O26、4Mg10HNO (极稀)4Mg()NH 4NO 3 3H 2O 3NO3 227、K2Cr2O76Fe3O 431H 2SO 4Cr(2 SO 4)39Fe(2 SO4)3 K 2 SO4 31H 2O28、2KNO33C S K 2S N 23CO 2第四节卤族元素29、H2F22HF30、H2Br22HBr31、H2I 22HI32、2NaBr Cl 22NaCl Br 233、2KI Cl34、2KI Br 222KCl I2KBr I2235、NaBr AgNO 3 AgBrNaNO 336、KI AgNO 3AgI KNO 337、2AgBr光照2Ag Br 2第二章摩尔反响热第一节摩尔38、C O 2CO 239、Mg2HCl MgCl 2H 2第二节气体摩尔体积40、Zn2HCl ZnCl 2H 2.第三节物质的量浓度41、2NaOH H 2SO4Na 2SO 42H 2O第四节反响热42、C(固)O(气)2点燃CO(气)2393.5kJ43、2H(气)2O(气)22H 2 O(气) 483.6kJ44、2H(气)2O(气)22H 2 O(液) 571.6kJ45、C(固)H2O(气)CO(气)H (2气)131.3kJ第三章硫硫酸第一节硫46、2Cu S Cu 2S47、Fe S FeS48、S H 2H 2S49、S C 高温CS250、S O 2点燃SO251、3S6KOH2K 2S K 2SO43H 2O 第二节硫的氢化物和氧化物52、H2S H 2S53、2H2S3O 2 (足)点燃2H 2O2SO 254、2H2S O 2( 不足)点燃2H 2O2S55、2H2S SO 2点燃2H 2O 3S56、H2S Br 2S2HBr57、FeS 2HCl FeCl 2H 2 S58、CuSO4H2S CuS H 2SO459、PbAc2H 2S PbS2HAc60、H S NaOH NaHS H O61、 NaHS NaOH Na 2 S H 2 O62、 H 2S2NaOH Na 2S 2H 2 O ( 60、61 联合) 63、 H 2S 2FeCl 3S2FeCl 2 2HCl 64、 H 2SO (4稀) FeS FeSO 4H 2 S65、 SO 2 H 2OH 2SO 366、 2SO 2 O 2 V 2O 52SO 367、 SO 3H 2O H 2SO 468、 Na 2SO3H 2SO 4 Na 2SO 4 H 2O SO 269、 SO 2 2NaOH Na 2SO 3 H 2O70、 SO 2 CaOCaSO 371、 SO 2 2Ca ( OH )CaSO3H 2O272、 SO 2 CaSO 3 H 2O Ca ( HSO 3)2 73、 SO 2 2H 2S 3S2H 2O74、 SO 2 Cl 2 2H 2O 2HCl H 2SO 4 75、 SO 2 Br 22H 2O2HBrH 2SO 476、 5SO 2 2H 2O 2KMnO 4MnSO 4K 2SO 4 2H 2SO 4第三节硫酸的工业制法77、 4FeS 2 11O 2 高温2Fe 2O 3 8SO 278、 2SO 2O 2V 2O 52SO 379、 H 2O SO 3 H 2SO 4第四节 硫酸 硫酸盐80、 C 2H 2SO (4 浓) CO 2 2SO 2 2H 2O81、 S2H 2 SO (4浓)3SO 22H 2O(浓)H 3PO4SO 22H 2O82、P H2SO483、H2S H2SO(4浓)S SO22H 2O84、Cu 2H2SO(4浓)CuSO 4SO22H 2O85、BaCl2H 2SO4BaSO 42HCl86、BaCl2Na 2 SO4BaSO42NaCl87、BaCl2Na 2 CO3BaCO 32NaCl88、BaCO32HCl BaCl 2H2O CO289、BaCO32HNO 3Ba( NO 3)2H 2O CO 290、Na2CO3H 2SO3Na 2 S H 2 O CO 291、2H2SO3O 22H 2SO 492、2Na2SO3O 22Na 2 SO493、2CaSO3O 22CaSO494、2Fe6H(浓)()2SO4Fe2 SO4 3 3SO26H 2O95、2NaBr2H 2 SO(4浓)Br 2SO2Na 2SO4 H 2O96、2NaCl H 2SO(4浓)Na 2 SO 4 2HCl97、C11H22O浓H2SO412C11H 2O 11第四章碱金属第一节钠98、4Na O 22Na 2 O99、2Na O 2Na 2O 2 100、2Na Cl 2点燃2NaCl101、2Na S 研磨Na 2S102、2Na2H 2O 2NaOH H 2103、2Na2H 2O CuSO 4Cu( OH )2 Na 2 SO4H 2第二节钠的氧化物104、Na2O H 2 O2NaOH105、2Na2O22H 2O4NaOH O 2106、Na2O CO 2Na 2 CO 3107、2Na 2O 22CO 22Na 2CO 3O 2108、Na2O2HCl2NaCl H 2 O109、Na2O24HCl4NaCl2H 2O O 2110、Na2CO32HCl2NaCl CO 2H 2 O111、NaHCO3HCl NaCl CO 2H 2 O112、2NaHCO3Na 2 CO 3CO 2H 2 O113、NaHCO3NaOH Na 2 CO 3H 2 O114、2NaHCO3Ca( OH)(少许)CaCO3Na2CO32H O22115、NaHCO3Ca( OH )(足量)2CaCO 3NaOH H 2 O 116、Na2CO3BaCl 2BaCO 32NaCl117、Na2CO3CaCl 2CaCO 32NaCl118、Ca(HCO)2HCl CaCl22CO22H2O32119、Ca(HCO3)22NaOH CaCO 3Na 2CO 32H2O 120、NaHSO3HCl NaCl SO2H 2 O第三节碱金属元素121、4Li O 2点燃2Li 2 O122、K O 2点燃KO 2123、2M X 22MX (M表示氧族元素,X代表卤族元素)124、 2M H 2 2MH125、 2M2H 2O2MOH H 2第五章 物质构造 元素周期律本章内容、性质特别,全部化学反响方程式均融在其余章节中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四、其它反应:
1.碳酸盐与酸的反应:;
①实验室制二氧化碳:;
②碳酸钠与稀硫酸反应:;
③碳酸钾与稀盐酸反应;
2.二氧化碳通入澄清石灰水:;
3.甲烷完全燃烧:;
4.一氧化碳还原氧化铁:;
1~6章常见化学方程式
一、化合反应:
1.单质+单质===化合物(碳、硫、磷、铁、镁、氢气等的燃烧)
①;②;
③;④;
⑤;⑥;
⑦;
2.单质+化合物===化合物
①一氧化碳燃烧:;
②二氧化碳与碳反应;
3.化合物+化合物===化合物
①二氧化碳与水反应;
②氧化钙与水反应;
二、分解反应:
1.化合物===单质+单质
①电解水;
2.化合物===化合物+化合物
①碳酸不稳定分解:;
②煅烧石灰石:;
3.化合物===单质+化合物
①双氧水制氧气:;
②高锰酸钾制氧气:;
三、置换反应:
①;3价金属R与稀盐酸反应:;
③+2价金属R与稀硫酸反应:;
④+3价金属R与稀硫酸反应:;
⑤曾青得铁则化为铜:;
注:+2价金属元素常见的有;
