有机化学实验本学期考试复习内容
《基础有机化学及实验》期末复习题

《基础有机化学及实验》期末考试复习题(SGS)一. 填空题1、根据名称写出相应物质的结构简式酒精 邻二甲苯 氯仿 β-萘酚 苯磺酸 丙炔 2-丁炔 环丙烷 环戊烷 石炭酸 安息香酸 TNT 2,4-二硝基苯肼 甘油 木精 甘醇 1,3-丁二烯 苯 呋喃 吡咯 吡啶 卢卡斯试剂 阿斯匹林 蚁酸 乙酸异戊酯 六六六 萘 2、请写出下列常见的有机基团的名称:CH 3甲基CH 2CH 3乙基CH 3CCH 3异丙基苯基CH 2苄基CHCH 3CH 丙烯基CHCH 2CH 2烯丙基NO 2硝基OH 羟基NH 2氨基CHO醛基COOH 羧基OCH 3甲氧基CCH 3O不知道3、请说出两个有机化合物种类繁多的原因:a 、 碳链异构 。
b 、 结构异构(我猜的) 。
4、水分子中的一个H 原子被 烷基 取代后的产物称为醇,水分子中的一个H原子被苯基取代后的产物称为酚。
5、苯酚俗称石碳酸。
6、亲核加成反应是指:。
7、可发生卤仿反应的两种结构为:和。
8、俗称“三乙”的化合物的构造式为:。
9、杂环化合物是指:。
10、—N2—官能团的两端都和碳原子直接相连的化合物称为偶氮化合物化合物,如果—N2—官能团的一端与非碳原子直接相连的化合物称为重氮化合物化合物。
11、蜜峰蛰人时产生的肿痛是由于分泌了所致。
12、水杨酸构造式为:,硝化甘油构造式为:,苦味酸构造式为:,13、亚硫酸氢钠可与,,反应析出白色结晶。
14、苯酚酸性比羧酸强,比碳酸弱。
15、饱和一元羧酸的烃基上连有吸电子基团时,其酸性会变强。
饱和一元羧酸的烃基上连有供电子基团时,其酸性会变弱。
16、饱和一元羧酸中,最强的为甲酸。
17、根据俗名写出相应物质的结构简式:偶氮苯苦味酸呋喃三乙胺硝化甘油18、饱和一元脂肪族羧酸的烃基上连有吸电子基团时,其酸性会。
19、只与一个碳原子相连的碳原子叫伯碳原子,与两个碳原子相连的碳原子叫仲碳原子,与三个碳原子相连的碳原子叫叔碳原子,与四个碳原子相连的碳原子叫季碳原子。
有机化学实验考核复习题

有机化学实验技能考核复习题二、回答问题1、格氏反应对金属镁有什么要求?反应操作中如何隔绝水汽?答;镁条擦光亮并剪成小段。
所用仪器,在烘箱中烘干后,取出稍冷即放入干燥器中冷却。
或将仪器取出后,在开口处用塞子塞紧,以防止在冷却过程中玻璃壁吸附空气中的水分。
反应体系中与大气相通处用装有无水氯化钙干燥管相连。
2、重结晶的作用是什么?何种操作可检测重结晶后产品的纯度?答:利用物质中各组分在同一溶剂中的溶解性能不同而将杂质除去得到纯净的有机物。
(分离提纯的效果)测定重结晶后的熔程。
一般纯物质熔程在1-2℃。
3、为什么蒸馏前要把无水氯化钙干燥剂过滤掉?答:氯化钙干燥脱水时形成氯化钙六水络合物,此络合物遇热时分解放出水,因此蒸馏前么要先过滤除去氯化钙。
4、常压蒸馏中,圆底烧瓶中为什么要加入沸石?如果加热后才知道未加入,应该怎样处理才安全?怎样才能保证冷凝管套管中充满水?答:⑴止暴剂的作用是防止液体暴沸,使沸腾保持平衡。
当液体加热到沸腾时,止暴剂能产生细小的气泡,成为沸腾中心。
⑵如果事前忘记加入沸石,则应在冷却后再加入,绝不可在液体较热时加入,因为这样会引起剧烈的暴沸。
⑶冷凝管要保持竖直,水要从下口进,上口出来。
5、酯化反应的特点是什么?答:酯化反应是一个可逆反应,酯化平衡常数只是温度的数。
6、为什么在制备正溴丁烷时,溴化钠不能事先与硫酸混合,然后再加正丁醇与水?答:因为溴化钠与硫酸一混合即发生反应生成溴化氢气体,还未等加入正丁醇,溴化氢气体就会逸出,导致反应物减少了,产量也就会减少。
7、重结晶实验时,抽气过滤中布氏漏斗中的晶体应使用下列哪种物质进行洗涤?(B )A、母液B 、新鲜的冷溶剂C、冷水D、热水8、什么冷凝管用于冷凝回流?什么冷凝管用于蒸馏沸点高于130°C的液体?什么冷凝管用于蒸馏沸点低于130°C的液体?本学期的有机实验中分别在哪个实验中用过?(各举一例)答:⑴球形冷凝管制备2-甲基-2-已醇⑵空气冷凝管制备2-甲基2-已醇直形冷凝管;(3)直形冷凝管环已烯的制备(乙酸乙酯(提纯蒸馏部分))9、在正溴丁烷的制备中,将粗产物移至分液漏斗中,依次用(1)10ml 水(2)8ml 浓硫酸(3)10ml 水(4)10ml 饱和碳酸氢钠溶液(5)10ml 水洗涤,请说说每步洗涤的作用并判断产物是上层还是下层?答:(1)10ml 水—洗去HBr、正丁醇—下层;(2)8ml 浓硫酸—少量正丁醚、正丁醇、烯—上层;(3)10ml 水—洗去硫酸—下层;(4)10ml 饱和碳酸氢钠溶液—洗去硫酸—下层;(5)10ml 水洗涤—洗去碳酸氢钠—下层10、分馏的原理是什么?在制备环己烯的过程中为什么要控制分馏柱顶部的温度不超过90 C?本学期哪个有机实验用到了分馏柱?请写出该实验的原理。
有机化学实验复习

有机化学实验复习实验二萃取1.萃取的原理。
利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使物质从一种溶剂内转移到另外一种溶剂中。
经过反复多次萃取,可将绝大部分的化合物提取出来。
2.作为萃取用的溶剂有何要求?为什么?对被分离物质溶解度大(分配系数K大),对杂质很少溶解;与被提取液的互溶度要小;有适宜的比重、沸点、黏度;性质稳定和毒性小。
3.如何正确使用分液漏斗?萃取时所选择的分液漏斗的容积应较萃取溶液和被萃取溶液体积之和大一倍左右,在操作之前先检查它的活塞和顶塞与磨口是否匹配;右手顶住端塞,左手控制活塞,两手同时振摇分液漏斗,每振摇几下后应将漏斗下端向上倾斜,打开活塞放气;将漏斗静置在铁圈上,等其自行分层;等液体分成清晰的上下两层后,先取下端塞,将下层溶液放入锥形瓶中,待快分离完毕时,关闭活塞,轻轻晃动分液漏斗,使黏在壁上的液体流下,再开启活塞使下层溶液逐滴流出;剩下的溶液则从分液漏斗上口倒在另一只锥形瓶中。
4.影响萃取效率的因素,如何提高萃取的效率?被分离物质在萃取剂与被萃取液中溶解度的差异(分配系数的大小);萃取剂与被萃取液的互溶度;萃取剂与被萃取液的接触面积,是否振荡、搅拌;萃取次数;温度。
实验三熔点的测定1.描述一个正确的Thiele管熔点测定装置:如液体石蜡油的液面;温度计的位置;酒精灯加热的位置;毛细管的位置;软木塞为什么有一缺口等。
液体石蜡油的液面高出上侧管少许即可;温度计的水银球位于b形管两支管中间;酒精灯应加热b形管的“腹部”;将装好样品的毛细管用小橡皮圈固定在温度计下端,毛细管中的样品部分位于水银球的中部;橡皮圈应套在毛细管上端,不能让其触及浴液;温度计的刻度向着软木塞的缺口,方便读数。
2.样品装填;温度观察;熔点记录这三个步骤中的要点各是什么?样品装填:样品一定要研的极细,将熔点管的开口垂直插于粉末中,使粉末进入熔点管,然后把熔点管倒过来,开口向上,从一根垂直的长约40cm的玻璃管中自由落到表面皿上,重复以上操作几次。
有机化学试验操作考试试题和参考答案

1
(2)使温度计水银球的上缘与蒸馏头支管的下缘相平,过高则温度计表示的沸点低于馏 出物的沸点,过低则高于。
六、安装一套简单分馏的装置,并回答下列问题: (1)分馏与蒸馏在原理及装置上由哪些异同? (2)沸石在蒸馏和分馏中起什么作用?在液体沸腾时为何不能补加沸石?
答: (1)同上(1) (2)加入沸石防止瀑沸,液体沸腾时补加沸石则沸腾太剧烈,使液体冲出反应瓶。
答: (1)同上(1)。 (2)粗产品中含有少量未反应的正丁醇和副产物 1-丁烯,2-丁烯,丁醚等,这些杂质可用 浓 H2SO4 除去,因为正丁醇和丁醚能与与浓 H2SO4 生成盐,而 1-丁烯,2-丁烯与浓 H2SO4 发生加成反而被除去。
2
十一、
1、请安装一个环己烯制备的装置;演示分液漏斗的操作。
2、制备正溴丁烷的洗涤操作中用碳酸氢钠洗涤的目的是什么?产品在哪层?
答:中和硫酸
上层
3、什么冷凝管用于冷凝回流?什么冷凝管用于蒸馏沸点高于 130C 的液体?什么冷凝管
用于蒸馏沸点低于 130C 的液体?本学期的有机实验中你分别在哪个实验中用过?
(各举一例)
答:球形冷凝管 空气冷凝管
直形冷凝管
制备 2-甲基-2-已醇 制备 2-甲基 2-已醇
有机化学实验操作考试试题和参考答案
一、 1、请安装一个蒸馏乙醚的装置;演示分液漏斗的操作。 2、格氏反应对金属镁有什么要求?反应操作中如何隔绝水汽? 答;镁条擦光亮并剪成小段。 所用仪器,在烘箱中烘干后,取出稍冷即放入干燥器中冷却。或将仪器取出后,在开口处用 塞子塞紧,以防止在冷却过程中玻璃壁吸附空气中的水分。 反应体系中与大气相通处用装有无水氯化钙干燥管相连。
答:洗去副反应生成的醇、醚、烯,
有机化学实验复习
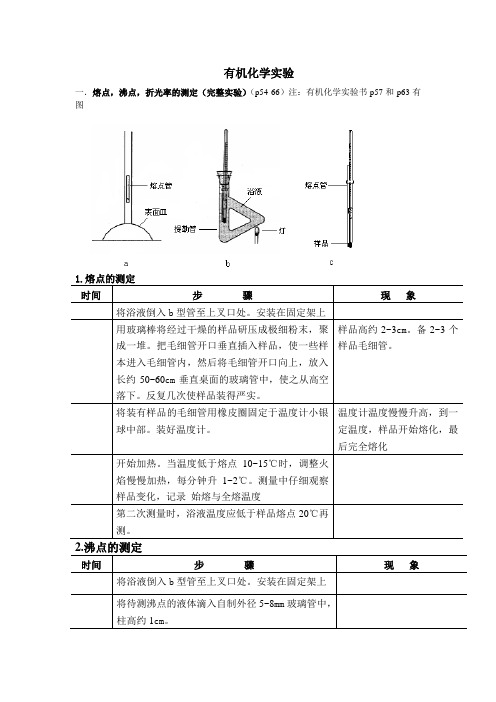
有机化学实验一.熔点,沸点,折光率的测定(完整实验)(p54-66)注:有机化学实验书p57和p63有图1.熔点的测定时间步骤现象将浴液倒入b型管至上叉口处。
安装在固定架上用玻璃棒将经过干燥的样品研压成极细粉末,聚成一堆。
把毛细管开口垂直插入样品,使一些样本进入毛细管内,然后将毛细管开口向上,放入长约50~60cm垂直桌面的玻璃管中,使之从高空落下。
反复几次使样品装得严实。
样品高约2~3cm。
备2~3个样品毛细管。
将装有样品的毛细管用橡皮圈固定于温度计小银球中部。
装好温度计。
温度计温度慢慢升高,到一定温度,样品开始熔化,最后完全熔化开始加热。
当温度低于熔点10~15℃时,调整火焰慢慢加热,每分钟升1~2℃。
测量中仔细观察样品变化,记录始熔与全熔温度第二次测量时,浴液温度应低于样品熔点20℃再测。
2.沸点的测定时间步骤现象将浴液倒入b型管至上叉口处。
安装在固定架上将待测沸点的液体滴入自制外径5~8mm玻璃管中,柱高约1cm。
将一端密闭的毛细管封口在上倒插入待测液中,把其用橡皮管固定于温度计上,安装在b形管中不停有气泡冒出。
酒精灯加热,当有一连串气泡快速逸出停止加热。
观察,当气泡恰好停止停止外逸液体刚好要进入毛细管的瞬间。
记下温度注意事项:(1) 熔点管本身要干净,若如含有灰尘,会产生4~10℃的误差。
管壁不能太厚,封口要均匀。
千万不能让封口一端发生弯曲或使封口端壁太厚。
因此在毛细管封口时,毛细管按垂直方向伸入火焰,且长度要尽量短,火焰温度不宜太高,最好用酒精灯,断断续续地加热,封口要圆滑,以不漏气为原则。
(2) 样品一定要干燥,并要研成细粉末,往毛细管内装样品时,一定要反复墩实,管外样品要用卫生纸擦干净。
(3) 用橡皮圈将毛细管缚在温度计旁,并使装样部分和温度计水银球处在同一水平位置,同时要使温度计水银球处于b形管两侧管中心部位。
(4) 升温速度不宜太快,特别是当温度将要接近该样品的熔点时,升温速度更不能快。
有机化学实验复习

CH3COOH + HOCH2CH3 → CH3COOCH2CH3 + H2O
60 88
12.6g xg
13. 什么是水蒸气蒸馏?其用途是什么?和常压蒸馏相比,有何优点?其原理料必须具备什么条件?如何判断需蒸出的物质已经蒸完?
答:⑴ 水蒸汽蒸馏就是以水作为混合液的一种组分,将在水中基本不溶的物质以其与水的混合态在低于100°C时蒸馏出来的一种过程。
⑵ 其用途是分离和提纯有机化合物。
⑶ 其优点在于:使所需要的有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压蒸馏时所造成的损失。
⑵ 不可以;因为酯易溶于乙酸,且乙酸沸点较高,难以分离。
(3)①吸收未反应的酸;降低乙酸乙酯的溶解度 ②除去碳酸钠,同时为了降低酯在水中溶解度 ③饱和氯化钙溶液可以除去乙醚(形成络合物)。
11. 在制备阿司匹林的实验中,如何将产物于高聚物分开?乙酸酐是水杨酸的4倍,多余的乙酸酐是如何让除掉的?用化学方程式写出本学期制备阿司匹林的原理,写出两种酸性催化剂和两种碱性催化剂。
⑶ 饱和氯化钙溶液的作用是出去醇类物质,显然,乙酸乙酯实验中乙醇是过量的,故要洗涤两次;丁酯和异戊酯只残留少量的醇,洗涤一次就行了。
20. 通过本学期的有机化学实验,你学会哪些分离提纯的方法?
答:常压蒸馏,分馏,重结晶,水蒸汽蒸馏,索氏提取等。
21. 请写出已二酸的制备原理,实验中除去未反应的高锰酸钾所选用的试剂是什么?在制备己二酸时,用盐酸酸化,冷却后过滤得到的晶体用什么溶剂洗涤?该溶剂是热的好还是冷的好?为什么?
3. 很多反应(或过程)是放热的,请举例说明本学期有机化学实验中有哪些具体例子(至少三个),并简单说明你是如何解决这些放热问题的。
大学有机化学实验 复习题

有机化学实验考试复习题一、简答部分1.测定熔点时,遇到下列情况将产生什么结果?(1) 熔点管壁太厚;(2) 熔点管不洁净;(3) 试料研的不细或装得不实;(4)加热太快;(5) 第一次熔点测定后,热浴液不冷却立即做第二次;(6)温度计歪斜或熔点管及温度计不附贴。
答:(1) 熔点管壁太厚,影响传热,其结果是测得的初熔温度偏高。
(2) 熔点管不洁净,相当于在试料中掺入杂质,其结果将导致测得的熔点偏低。
(3) 试料研得不细或装得不实,这样试料颗粒之间空隙较大,其空隙之间为空气所占据,而空气导热系数较小,结果导致熔距加大,测得的熔点数值偏高。
(4)加热太快,则热浴体温度大于热量转移到待测样品中的转移能力,而导致测得的熔点偏高,熔距加大。
(5) 若连续测几次时,当第一次完成后需将溶液冷却至原熔点温度的二分之一以下,才可测第二次,不冷却马上做第二次测量,测得的熔点偏高。
(6) 齐列熔点测定的缺点就是温度分布不均匀,若温度计歪斜或熔点管及温度计不附贴,这样所测数值会有不同程度的偏差。
2.是否可以使用第一次测定熔点时已经熔化了的试料使其固化后做第二次测定?答:不可以。
因为有时某些物质会发生部分分解,有些物质则可能转变为具有不同熔点的其它结晶体。
3.测得A、B两种样品的熔点相同,将它们研细,并以等量混合(1) 测得混合物的熔点有下降现象且熔程增宽;(2)测得混合物的熔点及纯A、纯B的熔点均相同。
试分析以上情况各说明什么?答:(1)说明A、B两个样品不是同一种物质,一种物质在此充当了另一种物质的杂质,故混合物的熔点降低,熔程增宽。
(2)除少数情况(如形成固熔体)外,一般可认为这两个样品为同一化合物。
4.沸石(即止暴剂或助沸剂)为什么能止暴?如果加热后才发现没加沸石怎么办?由于某种原因中途停止加热,再重新开始蒸馏时,是否需要补加沸石?为什么?答:(1)沸石为多孔性物质,它在溶液中受热时会产生一股稳定而细小的空气泡流,这一泡流以及随之而产生的湍动,能使液体中的大气泡破裂,成为液体分子的气化中心,从而使液体平稳地沸腾,防止了液体因过热而产生的暴沸。
有机化学实验中考复习资料

有机化学实验中考复习资料在有机化学实验中,考试是必不可少的一环。
为了让自己在考试中取得好成绩,我们需要在平时的实验中多加练习,同时也需要熟练掌握一些考试重点。
首先,我们需要掌握有机化学实验室中的基本操作。
比如说,溶液的配制、反应物的称量、实验器材的使用等等。
这些操作看似简单,但都十分重要。
在考试中,如果这些基本操作都做不好,无论实验结果如何,都难以取得好成绩。
其次,我们需要熟练掌握有机化学的常用反应和实验方法。
这些反应和方法包括但不限于:重氮化反应、格氏反应、酯化反应、烷基化、醇的酸碱滴定、蒸馏收集等等。
在考试中,这些反应和方法常常会被要求操作或让你给出相应的反应方程式,因此熟练掌握这些内容是非常必要的。
第三,我们需要掌握有机化学实验室中的安全知识。
在实验中,安全性是最重要的。
我们需要熟知有机化合物的性质,避免误操作引起的火灾、爆炸等危险。
同时,在进行实验前必须要做好实验前安全检查,保证实验操作和实验环境的安全。
在考试中,安全知识也往往会被考察。
除此之外,我们还需要认真阅读教材、实验指导书。
在实验中,教材和实验指导书是我们最重要的参考资料之一。
一些反应的操作方法、反应条件以及相应的反应机理等信息都可以在这些资料中找到。
因此,我们需要认真阅读相关资料,掌握重点内容。
最后,我们还可以参考一些有机化学实验考试的学习资料。
不同的学校、不同的老师对有机化学实验的考试内容和难度要求都不尽相同。
因此,参考一些学校或老师提供的考试资料,对自己的考试备考也会有一定的帮助。
总之,为了在有机化学实验考试中取得好成绩,我们需要多加实验练习,掌握实验基本操作和实验安全知识,熟练掌握常用反应和实验方法,并认真阅读相应的实验资料。
通过不断地练习和总结,相信大家一定能够取得很好的成绩。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙酸丁酯的反应原理:含主反应,副反应
思考题:1、粗产品中含有哪些杂质?如何将它们除去?答:粗产品中含有原料乙酸、丁醇及副产物丁醚,用碳酸钠溶液洗涤酸,其他各物质用水洗涤除去。
2、如果最后蒸馏前的粗产品中含有正丁醇,能否用分馏的方法将它除去?这样做好不好?答:可以,但是,正丁醇和正丁醚在117.6℃一同蒸出,但是,在正丁醇的馏分中还含有一部分产物正丁醚,造成产率下降。
3、若无分水器是否有办法除去反应生成的水?若能,如何做?答:有办法。
通常可以利用水与某一原料或某一产物形成二元或多元共沸物从反应体系内蒸出,达到分离水,促进反应平衡的目的。
注意事项:此反应为可逆反应,可采用使反应物过量和移去生成物的方法使反应向产物方向移动。
一种方法是使价格较便宜的乙酸过量,从而提高反应产率。
另一方法是除使乙酸过量外,使用一个分水器,使反应生成的水随时脱离反应体系,从而达到提高产率的目的。
2、在加入反应物之前,所有仪器都必须干燥。
乙酸乙酯的制备:
反应原理:
思考题:1、在本实验中硫酸起什么作用?答:催化。
2、制取乙酸乙酯时,哪一种试剂过量?为什么?答:乙醇过量。
使平衡向右移动,充分利用较贵的原料乙酸。
3、蒸出的粗乙酸乙酯中主要有哪些杂质?用饱和碳酸钠洗涤乙酸乙酯的目的是什么?是否可用氢氧化钠溶液代替?答:主要杂质有:乙醇、乙酸。
中和反应中的酸。
不能,因为氢氧化钠碱性太强不易控制,容易造成乙酸乙酯的碱性水解。
4、用饱和氯化钙溶液洗涤能除去什么?为什么先要用饱和食盐水洗涤?是否可用水洗?答:目的是除去水和未反应的乙醇,用饱和食盐水的目的是洗掉过量的碳酸根离子,反之碳酸钙沉淀出现。
用水洗会增大有机物在水中的溶解度,使产物损失。
注意事项:硫酸的用量为醇量的3%时,即可起到催化作用。
若稍微增加硫酸用量,由于它的吸水作用而增加酯的产率。
但硫酸用量过多时,其氧化作用增强,结果反而对主反应不利。
2、用饱和氯化钙溶液洗涤的目的是除去未反应的乙醇。
因为氯化钙能与乙醇形成溶于水的络合物。
用碳酸钠洗涤之后,必须用饱和氯化钠溶液洗二次,再用饱和氯化钙溶液洗涤。
否则,酯层中残留的碳酸钠会和加入的氯化钙反应形成碳酸钙悬浊液,致使分离操作难以进行。
3、乙酸乙酯与水、乙醇可形成二元或三元共沸混合物,故乙酸乙酯中的酸和醇皆应除去,否则影响产率。
减压蒸馏:
反应原理:有些有机化合物热稳定性较差,常常在受热温度还未到达其沸点就已发生分解、氧化或聚合。
对这类化合物的纯化或分离就不宜采取常压蒸馏的方法而应该在减压条件下进行蒸馏。
由于有机化合物的沸腾气化温度与体系的压力有关,压力降低,其沸腾温度也随之下降,从而可使有机化合物在减压下于低于其沸点的温度下蒸出,减压蒸馏又称真空蒸馏。
减压蒸馏尤其适合于蒸馏哪些沸点高、热稳定性差的有机化合物。
液体化合物的沸点与外界压力有密切的关系。
当外界压力降低时,使液体表面分子逸出而沸腾所需要的能量也会降低。
换句话说,如果降低外界压力,液体沸点就会随之下降。
液体压力、常压下沸点和减压下沸点的关系。
思考题:1、进行减压蒸馏时,为什么须待体系压力稳定后方能开始加热?答:液体表面压强不稳,则液体的沸点也会随着发生波动,不利于控制热源的强度,可能会产生过热状态。
2、为什么减压蒸馏时不用沸石,而用可以调节气流量的毛细管?答:在减压蒸馏装置中,从克氏蒸馏头直插蒸馏瓶底的是末端如细针般的毛细管,它起到连续引入气化中心的作用,使蒸馏平稳,效果比沸石好得多。
(如果待蒸馏物对空气敏感,则应通过毛细管导入惰性气体,如氮气,来加以防护。
)
注意事项:如果蒸馏少量高沸点物质或低熔点物质,则可采用无冷凝装置进行蒸馏,即省略冷凝管;如果蒸馏温度较高,在高温蒸馏时,为了减少散热,可在克氏蒸馏头处用玻璃棉等绝热材料缠绕起来;如果在减压条件下,液体沸点低于40~50℃,可用冷水浴对接受瓶冷却。
丙酮的制备:
反应原理:
思考题:1、应以何为标准计算丙酮产率?答:以重铬酸钾为标准,计算丙酮产率。
本实验异丙醇过量,防止过量的重铬酸钾进一步氧化丙酮。
2、以异丙醇为原料催化脱氢能否生成丙酮?答:能。
注意事项:滴加稀硫酸时一定要控制速度,不能太快,以防止反应太剧烈,反应混合物喷出。
因丙酮沸点低,反应时接受瓶要浸在冷水浴中。
从桂皮中提取肉桂醛:
反应原理:肉桂油的主要成分是肉桂醛。
用衍生物法鉴别肉桂醛。
方程式:
思考题:1、为了鉴定肉桂醛,还可以选择什么合适的衍生物?写出反应方程式。
答:还可以选择制成苯腙衍生物。
2、肉桂醛的红外光谱有几个特征峰?试分别作出解释(何种官能团,何种类型震动)答:Wc=o 1700/cm ; Voc-h 2750/cm ; Vc=c 1600~1450/cm三重峰;Vc-h 3100/cm
注意事项:水蒸气蒸馏时,要注意水蒸气发生装置的安全管,防止其发生堵塞。
要控制好水蒸气的释放速度,防止水蒸气过快溢出。
加热温度不能高,以能蒸出氯仿为宜。
防止肉桂醛挥发、分解。
肉桂醛的衍生化反应要在水浴中进行,防止温度过高发生副反应。
乙酰苯胺的制备:
反应原理:
思考题:1、反应时为什么要控制柱顶温度在100~105℃?答:该反应为平衡反应,把生成的水蒸出,把原料和反应物留在反应器中,以提高产率。
2、为什么反应完成后要将混合物趁热倒入50ml冷水中?答:产物乙酰苯胺的熔点较高,温度下降就会使产物凝固在反应瓶中。
3、在重结晶操作中,必须注意那几点才能使产品产率高、质量好?答:溶剂的加入量应使其在80℃下为饱和状态;活性炭的用量要适当;热滤漏斗要预热并保持在高温状态;滤纸与漏斗的接触面小。
注意事项:在用活性炭脱色时,应移去火源,使溶液稍冷,然后加入活性炭,继续煮沸。
切不可在沸腾状态下加活性炭,否则将引起暴沸。
在制备乙酰苯胺时,柱顶温度不可超过105,否则,收率降低。
环己烯的制备:
反应原理:
思考题:1、醇类的酸催化脱水的反应机理是怎样的?答:见课件。
2、在粗产品环己烯中,加入氯化钠使水层饱和的目的是什么?答:降低环己烯在水中溶解度,减少产物在洗涤过程中的损失。
3、在制备过程中为什么要控制柱顶温度?答:由于反应中环己烯与水形成共沸液沸点为70.8℃,含水10%,环己醇环己烯也形成共沸液沸点为64.9℃,环己醇30.5%,环己醇与水形成共沸液沸点97.8℃,含水80%。
因此,在加热时,温度不可过高,蒸馏速度不宜过快,以减少未作用的环己醇蒸出。
4、用磷酸做脱水剂比用浓硫酸做脱水剂有什么优点?答:浓硫酸有氧化性,容易使环己醇发生碳化。
正丁醚的制备:
反应原理:
思考题:1、计算理论上分出的水量,如果你分出的水层超过理论数值,试探讨其原因。
答:水与正丁醇和正丁醚可以生成二元或三元共沸物。
2、如果最后蒸馏前的粗产品中含有正丁醇,能否用分馏的方法将它除去?这样做好不好?答:可以。
但是,正丁醇和正丁醚在117.6℃一同蒸出,但是,在正丁醇的馏分中,还含有一部分产物正丁醚,造成产率下降。
