卟啉光敏剂的合成、生物活性筛选与构效关系研究
水溶性稀土卟啉配合物的合成及应用性质研究

水溶性稀土卟啉配合物的合成及应用性质研究Ξ赵吉寿,颜 莉,戴建辉(云南民族大学化学系,云南 昆明,650031) 摘 要:用固相法合成了水溶性卟啉配合物[L nT PPS4(C3H4N2)2]・3H2O(L n=Gd,D y,Tm,Yb),并对它们进行了配合物-氯铂酸钾-三氯化钛三组分体系的光敏催化性能研究。
关键词:水溶性卟啉配合物;稀土;光敏剂中图分类号:O614133 文献标识码:A 文章编号:100420277(2003)0320001203 大杂环共轭体系卟啉及金属卟啉配合物已经引起许多化学工作者及其它科学工作者的极大兴趣,经过广泛研究发现了它们在各个方面的应用性质,如卟啉及其配合物能选择性地聚集在癌细胞周围,可用于诊断和治疗癌症和其它一些疾病。
在材料科学上,大共轭环状化合物卟啉及其多聚物可用于有机半导体和有机合成半导体材料。
在化学上,卟啉及金属卟啉配合物作为电化学过程、氧化-还原反应过程、异构化和聚合反应过程、光化学和光电化学反应过程的催化剂以及分析试剂等方面得到广泛的应用。
在生物模拟方面也有重要意义[1,2],Po rter以水溶性锰卟啉为光敏剂,苯醌作为电子受体实现光解水放氧,并对其光化学特性和反应机理进行了一系列研究,Gratzel,H arri m an,O ku ra等先后发现水溶性卟啉在三乙醇胺和ED TA作电子给体,甲基紫精作中继物,胶态铂或氢化酶为还原剂时,可以有效光解水放氢。
何云陔、梁永武、贾殿增等先后分别用贵金属(Pd,R u,R h)水溶性卟啉为光敏剂,K2P tC l6为催化剂实现了光解水放氢[1~5]。
本文合成了三种水溶性稀土卟啉配合物并对其进行表征,分别用它们作光敏剂,K2P tC l6为催化剂,T i C l3为电子给体的三组分体系进行光解水性能研究。
1 实验部分111 试剂和仪器所用试剂有:吡咯(C1P)、苯甲醛(A R)、Gd2O3 (9918%)、D y2O3(9919%)、Tm2O3(光谱纯)、Yb2O3 (9918%)、乙酰丙酮(A R)、咪唑(A R),其它试剂均为分析纯,吡咯和苯甲醛使用前新蒸,其它试剂使用时按其它方法处理。
生物体内卟啉合成生物学研究

生物体内卟啉合成生物学研究卟啉是一种重要的有机分子,在生物体内扮演着重要的角色。
它是叶绿素、血红素、呼吸色素、光敏染料等多种生物分子的基础结构单位。
卟啉的合成涉及多种酶的催化作用,是一个复杂而严密的生物过程。
本文将从卟啉的合成入手,探讨生物体内卟啉合成的生物学研究进展及其意义。
卟啉的合成过程分为两个阶段:第一阶段是戊糖磷酸途径(C5途径)和三羧酸循环途径(C4途径)合成δ- 氨基莫尼酸(ALA),第二阶段是ALA通过一系列反应生成卟啉。
这两个阶段涉及的酶和催化反应非常复杂,是一个精密的调节网络。
近年来,生物学家们对这个网络进行了深入的研究,取得了一系列重要的成果。
在第一阶段中,C5途径和C4途径的合成机制和调控机制一直是生物学家们研究的热点。
在C5途径中,包括3种酶的催化反应,需要通过四个中间体的转化才能生成ALA。
在C4途径中,有7种酶的催化反应,同样需要通过若干中间体的转化才能生成ALA。
C4途径的不同之处在于,它具有更强的反馈调节机制,可以对酶的活性进行调控。
生物学家们对这两个途径的合成机制和调控机制进行了深入研究,在分子水平上揭示了酶的结构和催化机制。
在第二阶段中,ALA经过一系列复杂的反应生成卟啉。
这个过程中,显著的一步是ALA在环化酶的催化下形成环丙烷卟啉,之后通过多种不同的酶反应,逐步生成多种卟啉结构。
在这个过程中,不同的酶反应必须高度协调,才能保证卟啉的正常合成。
为此,生物学家们不断挖掘卟啉合成途径中的新酶和新反应,在解析整个合成网络的同时,揭示酶与酶之间协调的偏好和规律。
生物体内卟啉合成的研究对于了解这个过程本身的机制,以及对于生物体调控机制的认识和疾病治疗都具有重要意义。
在疾病治疗方面,以光敏剂治疗肿瘤是目前最新的治疗方式之一。
该方法需要通过激活光敏染料对肿瘤进行光化学疗法。
而光敏染料正是卟啉的一种衍生物。
了解卟啉合成的调控机制,可以为这种新型治疗方法的研究提供基础,从而设计出更加有效和可控性的疗法。
卟啉分子结构与性质的理论研究

卟啉分子结构与性质的理论研究卟啉分子结构与性质的理论研究卟啉是一类特殊的有机分子,具有广泛的应用价值。
如何理解卟啉分子的结构和性质,对于深入研究其应用和开发新的卟啉类化合物具有重要意义。
本文将从卟啉分子的结构、电子结构和光谱性质等方面进行理论研究,探讨卟啉分子在不同环境下的性质变化和应用前景。
首先,我们来看卟啉分子的结构。
卟啉分子由四个吡咯环通过共轭双键连接而成,中间有一个金属离子与卟啉分子配位。
卟啉分子的结构决定了其独特的光学和电化学性质。
吡咯环之间的共轭双键使得卟啉分子呈现出扁平的结构,而金属离子的存在会造成卟啉分子内部的电子重新分布。
这些结构特点不仅影响了卟啉分子的电子结构,还决定了其物理化学性质,如光谱响应和电化学活性。
在理论研究中,电子结构计算是一个重要的手段。
通过量子化学计算方法,我们可以计算卟啉分子的电子能级、分子轨道和电子密度分布等信息。
这些计算结果有助于解释实验观测到的光谱和电化学行为,并揭示卟啉分子内部电子的行为规律。
同时,通过与实验结果的对比,可以验证理论模型的准确性,并不断改进模型以提高计算精度。
卟啉分子的电子结构对其光谱性质有着决定性影响。
卟啉分子吸收、荧光和振动光谱的研究已成为理论和实验研究的热点。
通过理论模拟,在不同环境下模拟卟啉分子的光谱响应,可以预测不同条件下的荧光效率、荧光寿命和吸收峰位置等。
这对于设计新的荧光材料和开发光电子器件具有重要意义。
此外,卟啉分子在电化学领域也具有广泛的应用。
卟啉分子可以作为催化剂、电极材料和传感器等用于电化学系统中。
通过理论计算,我们可以研究卟啉分子在电极表面的吸附行为、电荷转移过程和催化反应机理等。
这些研究有助于优化电化学系统的性能,并指导实验工作的开展。
总之,卟啉分子结构和性质的理论研究对于深入了解其光学、电化学性质具有重要意义。
通过电子结构计算和光谱模拟,可以揭示卟啉分子的电子行为规律,并为开发新的卟啉类化合物提供理论指导。
卟啉类化合物光化学特性的应用及研究进展

湖南科技学院学报
J u n l f n n Un v r i f ce c n n i e rn o r a o Hu a i est o i n ea dE g n e i g y S
、 1 1NO8 b . . 3 Au .0 0 g2 1
卟啉化合物是构成血红蛋自、 细胞色素等生物大分子 的 核心部分,参与生物体 内一系列 重要 的化学生理过程 , 对一
啉经一定波长的光照后可吸收能量并激发 出单线态氧而杀
死病灶部位的癌细胞 , 从而达到治疗的 目的。 血卟啉衍生物
些增殖异常 的组织细胞有特殊 的亲和力 , 其在组织细胞 中 使
收稿 日期:2 1 —o —1 OO 6 8
(P ) H D 是第一个被批准上市的光敏剂,临床用来 治疗皮肤 癌 、支气管癌、食道癌、膀 胱癌等 。我国的血卟啉衍生物 J 研究也相当迅速 , 不仅在治疗上紧跟 国际水平 , 而且有所发 展。 如解放军总医院的顾瑛教授等首先对血卟啉单 甲醚进行
了临床前研究, 结果表明该衍生物具有 良好的临床应用前景
’
项 目基金:湖 南省科技厅基础研究支持项 目 (7 J0 0 F3 9 ) ;湖南省教 育厅研究支持项 目 (9 4 1 3 0 C 4 )。 作者简介:张卫军 (9 9 ),男 ,湖南冷水滩人 ,高 16 -
级实验 师,从事有机合成及分析化学方面 的研究。
卟啉类化合物光化学特性 的应用及研 究进展
张卫军
( 南科技学院 生命科学与化学工程系,湖 南 永州 4 5 0 ) 湖 2 10
摘 要:卟啉化合物具有 非常好的光学性质 , 其光化 学性质 已 广泛地用于化 学、光学 、 催化、仿生、生命科学、医学科
卟啉类化合物的合成与性质研究

卟啉类化合物的合成与性质研究卟啉类化合物是一类具有特殊结构和重要应用价值的有机化合物。
它们由四个吡咯环通过共享碳原子构成,并且在一个或多个环上含有金属原子。
卟啉类化合物在生物学、材料科学和光电子学等领域具有广泛的应用。
本文将探讨卟啉类化合物的合成方法和性质研究。
一、卟啉类化合物的合成方法卟啉类化合物的合成方法多种多样,其中最常见的方法是通过酸催化的缩合反应合成。
这种方法利用吡咯环上的氨基和醛基或酮基之间的反应,生成卟啉环。
此外,还可以通过金属催化的反应合成卟啉类化合物。
金属催化反应的优势在于反应条件温和,产率高,适用范围广。
二、卟啉类化合物的性质研究卟啉类化合物具有许多独特的性质,其中最引人注目的是它们的光学性质。
由于卟啉环中的共轭双键结构,卟啉类化合物具有很强的吸收和发射光谱。
这使得它们在光电子学领域有着广泛的应用,如光敏染料、光电转换器件等。
此外,卟啉类化合物还具有良好的电子传输性质。
由于卟啉环中的共轭结构,电子在分子内可以自由传输,使得卟啉类化合物成为一种优良的电子传输材料。
这一性质使得卟啉类化合物在有机电子器件中有着广泛的应用,如有机太阳能电池、有机场效应晶体管等。
此外,卟啉类化合物还具有较强的配位性质。
由于卟啉环上的氮原子可以与金属形成配位键,卟啉类化合物可以与金属离子形成稳定的配合物。
这些配合物在生物学和催化领域有着重要的应用,如血红素和维生素B12等。
三、卟啉类化合物的应用前景卟啉类化合物由于其独特的结构和多样的性质,具有广泛的应用前景。
在生物学领域,卟啉类化合物被广泛应用于光动力疗法、荧光探针和生物传感器等。
在材料科学领域,卟啉类化合物可用于制备光电材料、催化剂和分子电子器件等。
在光电子学领域,卟啉类化合物可用于制备光电转换器件、光敏染料和有机发光二极管等。
总之,卟啉类化合物的合成与性质研究对于推动生物学、材料科学和光电子学等领域的发展具有重要意义。
通过不断深入研究,我们可以进一步了解卟啉类化合物的结构与性质之间的关系,为其应用提供更加可靠的理论基础。
卟啉化学及其在药物设计中的应用

卟啉化学及其在药物设计中的应用卟啉是一种具有重要生物学功能的化合物,也是一种有机分子中常见的平面色素。
卟啉分子的核心是四个氮原子和一个苯环,周围还有不同的侧链基团。
卟啉及其衍生物具有重要的化学、物理和生物学性质,被应用于医药、光电、催化等众多领域。
本文着重介绍卟啉在药物设计中的应用,包括卟啉类化合物的抗肿瘤、抗病毒、抗炎等作用机制,以及卟啉在药物靶点识别和筛选方面的应用。
一、卟啉类化合物的抗肿瘤作用卟啉类化合物已被广泛研究和应用于肿瘤治疗。
其中,卟啉类光敏剂是一种独特的肿瘤治疗药物。
光敏剂在体内注射后能够渗透到肿瘤组织中,被激活后能够产生化学反应,从而破坏癌细胞的结构和代谢的功能。
此外,卟啉还具有抗肿瘤的其他机制。
例如,卟啉类化合物可以靶阻黑色素瘤细胞中线粒体的呼吸和ATP合成,促进程序性细胞死亡。
卟啉还可以影响肿瘤细胞中的某些酶的活性,抑制癌细胞的增殖和转移。
此外,最近的研究显示,卟啉类化合物还可以作为肿瘤免疫治疗的潜在药物。
二、卟啉类化合物的抗病毒作用除了其抗肿瘤作用之外,卟啉类化合物还具有抗病毒的作用。
例如,一些卟啉类分子被发现可以抵抗乙型肝炎病毒(HBV)的复制,其机制可能是通过直接干扰病毒蛋白和DNA结合来抑制病毒复制。
此外,卟啉类化合物还可以作为新型抗病毒药物的潜在靶点。
例如,由于卟啉类化合物对病毒的抑制作用,研究人员开始开发卟啉类化合物作为病毒感染治疗的新药。
三、卟啉类化合物的抗炎作用除了其抗肿瘤和抗病毒作用之外,卟啉类化合物还具有抗炎作用。
例如,卟啉类化合物可以抑制关节炎和其它自身免疫性炎症性疾病的发生和发展。
此外,卟啉类化合物还可以促进伤口愈合,避免炎症反应过度导致的组织损伤。
四、卟啉在药物靶点识别和筛选中的应用卟啉不仅在疾病治疗中具有广泛应用,还在药物设计中扮演重要角色。
例如,卟啉和其衍生物被广泛应用于药物靶点的筛选和识别。
由于卟啉具有特定的光谱性质,可以容易地和某些蛋白质相互作用。
β-萘并冠醚卟啉的合成及光敏活性

光 动 力 疗 法 ( h td n mi t ea y D 是 一 P oo y a c h r p ,P T)
司 ; 0 B 型 元 素 分 析 仪 , 国 P r i- l r公 司 ; 24 美 eknE me Mec r 0 ruy3 0型 超 导 核 磁 共 振 仪 , 国 V r n公 司 ; 美 ai a
21,o2 N. 02VI9 o7亿 亏 与 生 物 互程 .
Ch mity & Bie gie r g e sr on n ei n
d i1 . 9 9 jis . 6 2 5 2 . 0 2 0 . 0 o : 0 3 6 /.s n 1 7 — 4 5 2 1 . 7 0 6
萘 并 冠 醚 卟 啉 的 合 成 及 光 敏 活 性
厂 ; 羟 甲基氨 基 甲烷 一 乙酸 / 酸 ( 三 盐 TAE T E / B )缓 冲溶 液 ( H一7 4 0 0 o ・I T i HC , . l p . ,. 5t l o 一 rs 10 1mo —
・
图1
( 。- 羟 基 萘 并 一一 3 5 l ,5 2一 2 3二 9冠一 卜 。O 1 。0 四苯 基 卟 啉 的 合成 路 线
生物 工程公 司 。
9c o n3 5 .5 2 一 t p e yp r h r -r w - 卜 0 1 , 0 t r h n lo p y i I 1 ea n
1 2 1 化合 物 Ⅲ的合 成 .. 称 取 2 0mg 0 2 0 ( . 4mmo) 合 物 I投 入 1 0mI 1化 0
种 以光 、 敏剂 和氧 的相 互作 用 为基 础 的 癌症 治疗 方 光 法 [ 。其 中光 敏剂是 光 动 力 疗法 的关 键 所 在 [ , 敏 1 ] 2光 ]
卟啉的生物合成途径与化学合成方法的比较
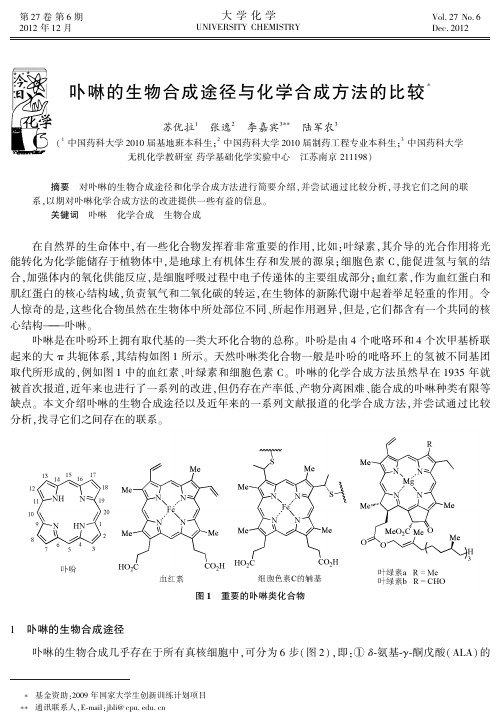
第27卷第6期2012年12月 大学化学UNIVERSITY CHEMISTRY Vol.27No.6Dec.2012 卟啉的生物合成途径与化学合成方法的比较*苏优拉1 张逸2 李嘉宾3** 陆军农3 (1中国药科大学2010届基地班本科生;2中国药科大学2010届制药工程专业本科生;3中国药科大学无机化学教研室药学基础化学实验中心 江苏南京211198) 摘要 对卟啉的生物合成途径和化学合成方法进行简要介绍,并尝试通过比较分析,寻找它们之间的联系,以期对卟啉化学合成方法的改进提供一些有益的信息㊂ 关键词 卟啉 化学合成 生物合成 在自然界的生命体中,有一些化合物发挥着非常重要的作用,比如:叶绿素,其介导的光合作用将光能转化为化学能储存于植物体中,是地球上有机体生存和发展的源泉;细胞色素C,能促进氢与氧的结合,加强体内的氧化供能反应,是细胞呼吸过程中电子传递体的主要组成部分;血红素,作为血红蛋白和肌红蛋白的核心结构域,负责氧气和二氧化碳的转运,在生物体的新陈代谢中起着举足轻重的作用㊂令人惊奇的是,这些化合物虽然在生物体中所处部位不同㊁所起作用迥异,但是,它们都含有一个共同的核心结构 卟啉㊂ 卟啉是在卟吩环上拥有取代基的一类大环化合物的总称㊂卟吩是由4个吡咯环和4个次甲基桥联起来的大π共轭体系,其结构如图1所示㊂天然卟啉类化合物一般是卟吩的吡咯环上的氢被不同基团取代所形成的,例如图1中的血红素㊁叶绿素和细胞色素C㊂卟啉的化学合成方法虽然早在1935年就被首次报道,近年来也进行了一系列的改进,但仍存在产率低㊁产物分离困难㊁能合成的卟啉种类有限等缺点㊂本文介绍卟啉的生物合成途径以及近年来的一系列文献报道的化学合成方法,并尝试通过比较分析,找寻它们之间存在的联系㊂图1摇重要的卟啉类化合物1 卟啉的生物合成途径 卟啉的生物合成几乎存在于所有真核细胞中,可分为6步(图2),即:①δ⁃氨基⁃γ⁃酮戊酸(ALA)的* **基金资助:2009年国家大学生创新训练计划项目通讯联系人,E⁃mail:jbli@2大学化学第27卷 形成;②吡咯单元(PBG)的形成;③尿卟啉原Ⅲ(含HMB中间体)的形成;④尿卟啉原Ⅲ的氧化;⑤粪卟啉原Ⅲ的氧化;⑥原卟啉原Ⅸ的氧化㊂其中,第②步缩合㊁第③步环合和第⑥步氧化涉及卟啉环骨架的构建,而第④步和第⑤步只是对卟啉环上侧链的修饰㊂图2 卟啉类化合物的生物合成途径[1⁃2]1.1 ALA的形成 ALA的形成是卟啉生物合成中的第一步,也是限速步骤[2]㊂在生物体中,ALA可由两条途径形成(图3)㊂Shemin途径[4]由David Shemin于1945年首次发现并逐步完善,主要存在于不进行光合作用的真核生物中,如动物和真菌[5]㊂ALA合成酶末端含一个赖氨酸(Lys)残基,当没有底物时,辅基磷酸吡哆醛(pyridoxal⁃5′⁃phosphate,PLP)与其形成Schiff碱,存在底物甘氨酸(Gly)时,Gly与PLP形成Schiff 碱再和琥珀酰CoA缩合形成ALA的同时释放CO2[3]㊂Beale等于20世纪70年代中期发现了以谷氨酸(Glu)为起始原料的C5途径[6]㊂它存在于植物㊁大多数细菌和所有古细菌中㊂C5途径主要依赖3种酶,连接酶通过形成谷氨酰基⁃1⁃t RNA激活1位羧基,还原酶将羧基还原为醛基,再经转氨酶的作用形成ALA[3]㊂在少数几种生物中也发现两条途径都存在[5]㊂图3 ALA形成的两种途径[3]1.2 PBG 的形成 两分子ALA 之间不对称缩合产生第一个吡咯衍生物 PBG(porphobilinogen)[5](图4)㊂反应机制与Knorr 吡咯缩合反应相似,首先,2个ALA 分子与酶活性部位的保守Lys 残基形成Schiff 碱,P 位ALA 分子的C 4和A 位ALA 分子的C 3进行Aldol 缩合形成C C 键,接着P 位ALA 分子的氨基进攻羰基碳原子形成C N 键[7]㊂图4 两分子ALA 缩合形成PBG1.3 HMB 的形成及其转化为尿卟啉原Ⅲ 4分子PBG 缩合形成尿卟啉原Ⅲ(uroporphyrinogen Ⅲ)是卟啉环生成的一个关键步骤,很多人对其具体过程提出了不同的猜想[8⁃10]㊂1980年Battersby A.R.等通过同位素标记证明了HMB(1⁃hydroxym⁃ethylbilane,羟甲基胆色烷)是尿卟啉原Ⅲ合成过程中的中间体;1987年他们又发现了新型辅基 二吡咯甲烷(dipyrromethane,DPM)[11],为阐明具体步骤奠定了基础㊂尿卟啉原Ⅲ的形成由两种酶共同完图5 尿卟啉原的形成(HMB 中间体)[3,10,13]成(图5)㊂首先,脱氨酶将4个PBG 组装形成开链HMB;在此过程中,先合成出二吡咯甲烷辅助因子,与脱氨酶末端的半胱氨酸巯基以硫醚键相结合,DPM 再和4分子底物相连接;当DPM 上连有4个吡咯单体时,a 环和DPM 之间的键断裂形成HMB㊂第二步,HMB 被转运到尿卟啉原Ⅲ合成酶上,在环合的同时,d 环重排生成尿卟啉原Ⅲ[12]㊂在无尿卟啉原Ⅲ合成酶时,HMB 在酸催化下迅速形成有毒性的不被代谢的尿卟啉原Ⅰ㊂值得注意的是,编码两种酶的基因位于同一操纵子内,两个基因协同表达[5],但3 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较尿卟啉原Ⅲ合成酶的表达量远远超过脱氨酶,以保证在生理条件下总是生成尿卟啉原Ⅲ[8]㊂1.4 尿卟啉原Ⅲ 粪卟啉原Ⅲ 原卟啉原Ⅸ 尿卟啉原脱羧酶(uroporphyrinogen Ⅲdecarboxylase,UROD)和粪卟啉原氧化酶(coproporphyrinogen Ⅲoxidase,CPOs)催化卟啉环侧链的修饰(图6)㊂在生理底物浓度下,4个环的脱羧作用是按d →a →b →c 的顺序发生;当底物浓度超过生理浓度时,脱羧作用以随机方式发生[5]㊂脱羧后生成的粪卟啉原Ⅲ(coproporphyrinogen Ⅲ)在哺乳动物中,经过位于线粒体外膜的依赖O 2的CPOs 催化,最终把电子传递给O 2㊂此过程不需要金属和辅助因子辅助[2],CPOs 的催化机理至今仍不清楚[5],详细过程见文献[14]㊂图6 卟啉环侧链的修饰[2]1.5 原卟啉原Ⅸ的氧化[15] 原卟啉原氧化酶(protoporphyrinogen Ⅸoxidase,PPOs)位于线粒体内膜的外表面,以O 2作为最终的电子受体,以FAD 为辅助因子,催化原卟啉原Ⅸ(protoporphyrinogen Ⅸ)的氧化,最终形成完全共轭的大环体系(图7)㊂生成的原卟啉Ⅸ(protoporphyrin Ⅸ)被直接转运到亚铁螯合酶上,以避免其对细胞的损害(原卟啉Ⅸ对光高度敏感,在O 2存在下,经光照射会产生自由基)㊂图7 原卟啉原Ⅸ的氧化2 卟啉的化学合成方法总结 目前,卟啉的化学合成方法主要有两种:①4个吡咯单体直接缩合环化生成卟啉(简称四吡咯合成法);②模块法㊂合成方法和路线的选择取决于目标卟啉分子的结构特点,中位对称取代的卟啉主要用四吡咯合成法,而不对称卟啉㊁天然卟啉及其类似物主要采用模块法合成㊂2.1 四吡咯合成法2.1.1 Rothemund 法 卟啉类化合物最早由Rothemund 合成[16]㊂Rothemund 法以醛类化合物(甲醛㊁乙醛㊁苯甲醛等)和吡咯为原料,以吡啶和甲醇为溶剂在封管中反应,90~95℃下反应24~48h(图8)㊂该法反应时间长,所需反应条件苛刻,而且后处理非常麻烦,产率很低;在此条件下,能用来作反应物的取代苯甲醛极少[17]㊂4大学化学第27卷 图8 Rothemund 法2.1.2 Adler⁃Longo 法及其改进 Adler 和Longo 等以有机质子酸作催化剂成功地制备了卟啉,并在1964年提出了卟啉生成的反应机理[18]㊂该法采用苯甲醛和吡咯在丙酸中回流反应30min,经冷却㊁过滤㊁洗涤及真空干燥,得到四苯基卟啉,产率达20%(图9)㊂此法的优点是操作比较简单,实验条件不算苛刻,产率较高㊂但由于反应条件的限制,一些带敏感基团的取代苯甲醛不能用作原料,带有强吸电子基的苯甲醛为底物时产率特别低;反应极易产生大量焦油状物,导致纯化非常困难;另外反应中的副产物四苯基二氢卟啉与四苯基卟啉分离较困难[17]㊂图9 Adler⁃Longo 法 潘继刚等[19]对Adler⁃Longo 法作了进一步调整,他们采用催化量的有机酸和极性溶剂代替丙酸介质,反应过程中产生的杂质明显减少,四苯基卟啉的产率最高达到50%㊂研究溶剂和催化剂对反应的影响,发现H +在反应过程中起催化剂的作用,p K a 2.0~4.0的酸作催化剂,合成产率较高㊂以二甲苯㊁甲苯㊁氯苯㊁硝基苯㊁苯甲醚为溶剂,四苯基卟啉产率较高,可达30%~50%㊂2.1.3 Lindsey 法及其改进 Lindsey 等[20]进一步改进了四苯基卟啉的合成,采用苯甲醛和吡咯在氮气保护下,在二氯甲烷中,以三氟化硼和乙醚络合物催化,整个反应分两步进行,先得到卟啉合成的中间体卟啉原(porphyrinogen),然后,以二氯二腈基苯醌(DDQ)或四氯苯醌(TCQ)将卟啉原氧化得到最终产物卟啉,从而使反应可以在常温下进行㊂近20年来,Lindsey 小组进一步研究了此一锅两步合成法的影响因素,发现酸催化剂的种类和用量㊁醛和吡咯上的取代基以及反应物浓度均会影响反应产率,并对主要副产物 链状聚合物的组成进行了分析[22⁃24]㊂由于Lindsey 法的反应温度较低,较少产生焦油状副产物,目标产物的分离提纯较容易;同时较低的反应温度也允许反应物先经过化学修饰,连接上一些敏感基团,平均产率可达45%~50%(图10)㊂但该反应浓度低,且最大反应容积为1L,放大后效果不好[21]㊂反应条件较苛刻,需要无水无氧操作,且反应还不能一步生成四苯基卟啉,必须在反应过程中另外加入氧化剂㊂ 郭灿城等[25]采用N ,N ⁃二甲基甲酰胺为溶剂,无水AlCl 3为催化剂,苯甲醛和吡咯缩合生成四苯基卟啉,产率可达30%,高于Adler 法㊂反应过程中不需氮气保护,产物不含副产物四苯基二氢卟啉,并且反应时间也较短,为2h㊂该方法的应用范围较广,对于以取代苯甲醛为原料的合成反应,产率在25%~30%之间㊂缺点是催化剂AlCl 3易与水反应,给产物的分离造成困难㊂5 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较6大学化学第27卷 图10 Lindsey法 Adler⁃Longo法和Lindsey法是目前应用比较广泛的两种方法㊂它们的主要区别在于所用的催化剂不同,Adler⁃Longo法用有机质子酸作为催化剂,而Lindsey法则用Lewis酸作为催化剂㊂2.1.4 微波催化合成法 1986年,Gedye等[26]发现微波可显著加快有机合成反应速率㊂从此,微波在合成化学领域迅速得到重视㊂以二甲苯为溶剂,对硝基苯甲酸为催化剂使苯甲醛和吡咯在微波炉内反应20min,可以得到卟啉,产率为9.5%[27]㊂微波辅助合成卟啉在我国发展较快,研究表明微波作用的时间与强度㊁溶剂及催化剂的选择㊁反应试剂的组成及用量等均对卟啉的合成有较大的影响㊂此法避免了传统加热合成方法的反应时间较长(一般需回流2~3h)㊁副反应多㊁产率不高且产物难提纯等缺点,且符合节能环保㊁绿色化学的发展趋势[28]㊂2.2 模块法 模块法主要包括[2+2]和[3+1]两种方法㊂ [2+2]合成亦称MacDonald方法[29],即两分子二吡咯甲烷缩合产生卟啉母核㊂该法可方便地合成具有C2对称轴的四苯基卟啉,也称为trans⁃卟啉,还可合成中位是4个不同芳基取代的卟啉㊂近年来,随着原料二吡咯甲烷衍生物合成方法的逐步改进和优化,可以合成的衍生物种类逐渐增多,产率也得到了提高,使[2+2]法的应用范围越来越广[30]㊂ [3+1]法是由MacDonald方法衍生出来的,将一个由两个桥碳原子连接的3个吡咯环组成的胆色素分子和一分子a,a′⁃二甲酰基吡咯环合得到卟啉的合成方法㊂此方法总产率较低,能合成一些结构复杂且较为特殊的卟啉,主要用于扩充卟啉的种类[31]㊂ 关于卟啉化学合成方法更详细的总结可参考文献[32]㊂3 化学合成和生物合成之间的联系3.1 起始原料 化学合成和生物合成两种途径都以单个吡咯环作为合成卟啉环的起始原料㊂不同的是,化学合成通常以吡咯或取代吡咯以及醛类为原料,而生物合成途径中由两个ALA分子通过类似Knorr吡咯缩合产生的带亚甲氨基侧链的吡咯单元(PBG)作为起始原料㊂3.2 单体吡咯的聚合方式 在生物合成和化学合成过程中,吡咯都是通过质子化㊁脱氨或脱水㊁再去质子的3步循环逐步加成形成聚合物㊂在此过程中都会产生活泼烯键,以促进吡咯的聚合(图11)㊂在生物合成中,吡咯单元(PBG)自身带有亚甲氨基侧链(来自甘氨酸),侧链脱氨之后形成烯键而被活化;而在化学合成中则是吡咯进攻醛基,产生带羟基的侧链,羟基质子化脱水后形成烯键而被活化㊂图11 单体吡咯聚合的可能机理(a )生物合成;(b )化学合成3.3 链状吡咯聚合物环合形成卟啉原 两种途径都是单体吡咯先聚合成链状吡咯聚合物,然后4个吡咯单体经亚甲基桥再进一步环合成卟啉原(图12)㊂在生物合成途径中,PBG 脱氨酶与辅助因子DPM 和吡咯聚合物形成复合物,当连有4个吡咯时,环a 和酶之间的键会水解断裂形成链状HMB㊂其原因至今仍是一个谜,可能与酶的空间结构和新型辅助因子二吡咯甲烷有关;可能类似于生物体内多糖和多肽的形成过程㊂ 根据Adler 等提出的机理,化学合成时吡咯和醛类先形成长短不一的链状聚合物,推测反应中形成的焦油状副产物很可能是吡咯和醛类的链状聚合物或者吡咯自身的聚合物㊂主要生成环状四聚体可能与卟啉独特的空间结构的稳定性有关㊂ 在环合时,生物合成途径有一步特有的环翻转过程,HMB 的亚甲基被活化后,进攻与其距离较远的C 16,与C 16环合形成螺中间体,d 环翻转,碳链在另一处断裂再环合形成尿卟啉原Ⅲ㊂而化学合成没有环的翻转过程,活泼烯键直接与C 19环合形成卟啉环,与体内尿卟啉原Ⅰ的形成过程类似㊂3.4 卟啉原氧化形成大环共轭的卟啉 在生物合成中,原卟啉原Ⅸ在PPOs 的催化下形成大环共轭的卟啉㊂PPOs 以二聚体形式存在,由3个结构域组成(图13),分别为FAD 结合域㊁底物结合域和膜结合域㊂原卟啉原氧化酶的辅助因子FAD 发挥重要的电子传递作用,以O 2作为最终的电子受体,因其每次只能转移两个电子,所以要经过3个独立的循环才能氧化完全,产生二氢卟啉和四氢卟啉中间体(图14)㊂当酶与底物结合时,底物带负电荷的丙酸基侧链与酶的精氨酸残基结合,使底物以一定方向被固定在酶上,只能以a 环和d 环间的亚甲基桥通过酶的狭缝与FAD 的N 5原子接触,环上的氢原子通过亚胺⁃烯胺互变异构重排并逐步被氧化㊂ 在化学合成中,4分子醛与吡咯缩合,最终环合后产生卟啉原㊂1970年,Dolphin 等证实卟啉原确实是卟啉合成过程的中间体[31]㊂卟啉原不稳定,极易被氧化,但在一般条件下氧化又不完全,产生的二氢卟吩混在卟啉中很难除去[35]㊂在反应中加入氧化剂或在反应结束后再进一步氧化能提高产率㊂硝基7 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较图12 由吡咯单体形成卟啉原的过程(a )生物合成;(b )化学合成图13 原卟啉原氧化酶的空间结构[15]8大学化学第27卷 图14 生物合成中原卟啉原Ⅸ的氧化[18,33⁃34,41]苯[36]㊁DMSO [37]㊁DDQ [20]以及最近文献报道的MnO 2[38]和SeO 2[39]等均能作为氧化剂,实现从卟啉原到卟啉的氧化,但氧化反应的具体机理至今仍不太清楚㊂ 在卟啉原的氧化过程中,生物合成和化学合成都是通过互变异构转移H N 和H C,逐步延长共轭链,产生二氢卟啉和四氢卟啉的中间体并最终形成大环共轭的卟啉㊂不同的是在生物合成过程中,底物被酶包裹,由于酶对底物的固定作用,卟啉原上所有的氢必须都转移到C 20上才能被氧化;而且由于酶蛋白对底物的稳定作用,中间体二氢卟啉和四氢卟啉可以以不太稳定的形式存在㊂而在化学合成过程中,氧化反应可以在任一亚甲基桥上发生,而且氧化后氢转移的最终结果要保证共轭链的延伸,中间体二氢卟啉和四氢卟啉要以相对稳定的形式存在㊂9 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较01大学化学第27卷 4 总结和展望 近年来,由于卟啉类化合物独特的分子结构,在仿生学㊁药物化学㊁分析化学㊁光物理与化学㊁材料化学㊁电化学㊁催化化学等领域中被广泛地研究与应用,但是较低的化学合成产率限制了进一步发展㊂本文通过比较卟啉的生物合成途径和化学合成方法,尝试寻找二者的联系,希望能为改进化学合成方法㊁提高合成产率提供一些启示㊂ 生物合成和化学合成一样,也遵循基本的化学反应规律,反应的本质是相同的㊂只不过由于酶的参与,酶的辅基或酶上的某个保守基团与底物相互作用,固定或增强底物的反应活性,稳定中间体的结构,降低反应的活化能,可使化学反应高效专一地进行㊂在化学合成中,影响产率的主要是底物的活性㊁对聚合度的控制以及卟啉原的氧化;而生物合成在这3方面的控制很精密㊂基于上述生物合成与化学合成的联系与差别,可以尝试从以下几方面对化学合成进行改进㊂ (1)在生物合成过程中,底物的反应活性较高㊂例如,吡咯聚合时,氨基被质子化后经脱氨酶作用迅速形成活泼烯键,易于被进攻㊂而在化学合成中,活泼烯键的形成要通过脱水,而在一般条件下自动脱水比较困难㊂在底物上引入其他适当的离去基团可以促进缩合,有时甚至可以省去最后一步的氧化,直接生成卟啉㊂Pierre Martin小组2010年报道的[2+2]法就是在底物上引入碘原子,缩合时消除碘化氢和水,不用加氧化剂直接在室温下生成大环共轭的卟啉[40]㊂此方法的原理若能推广至其他卟啉合成方法中,有可能显著降低反应温度,提高产率㊂ (2)生物合成途径对副产物的控制非常严格,原料利用率较高㊂吡咯聚合时一端通过巯基与酶相连,只有另一端延伸㊂当尿卟啉原Ⅲ合成酶催化链状吡咯聚合物的环合时,将聚合度严格控制在4,不会生成长链吡咯聚合物或者多元环状吡咯聚合物㊂这一点若化学合成则实现起来较困难㊂而且,目前的化学合成都需要酸催化,吡咯在酸性条件下容易因聚合而被破坏㊂抑制吡咯自身的聚合并精确控制吡咯和醛类的链状聚合物的聚合度尚有待于进一步改善㊂可以先在酸催化下不断延伸生成长链聚合物,将聚合物的一端固定,再用PBG脱氨酶和尿卟啉原Ⅲ合成酶从另一端进行切割和组装;或者在反应中加入具有空腔的材料,而空腔的大小恰好能容纳四聚体,这样就能把反应分割成多个单元,抑制聚合物的形成㊂例如,各种型号的分子筛孔径大小不同,具有一定的酸性,又能吸水,可以尝试㊂此外,既然卟啉能和金属离子形成配合物,可以模拟冠醚的合成方法,通过金属离子的模板效应来促进四聚体的形成㊂ (3)生物合成途径的最后一步为芳构化反应,在辅助因子FAD的作用下,以氧气作为最终的电子受体,实现了大π共轭体系(即卟啉环)的构建㊂在化学合成模拟生物合成时,聚合和氧化这两步分别进行,以避免在聚合过程中生成氧化的中间体,阻碍四聚体的形成㊂最近有文献报道分别以MnO2和SeO2作为氧化剂,用于卟啉原的氧化,能提高产率㊂它们虽然易于后处理,但都会污染环境㊂继续寻找价格低廉且环境友好的氧化剂,温和并高效地完成芳构化反应,符合当前绿色化学的发展趋势和要求㊂参 考 文 献[1] Scott A I.J Org Chem,2003,68(7):2529[2] Ajioka R S,Phillips J D,Kushner J P.Biochimica et Biophysica Acta,2006,1763:723[3] Porra R J.Photochem Photobiol,1997,65(3):492[4] Battersby A R.Nat Prod Rep,2000,17:507[5] Heinemann I U,Jahn M,Jahn D.Arch Biochem Biophys,2008,474:238[6] Beale S I.Proc Natl Acad Sci USA,1975,72(7):2719[7] Leeper F J.Nat Prod Rep,1985,2(1):19[8] Frydman B,Frydman R B.Acc Chem Res,1975,8(6):201[9] Scott A I,Ho K S,Kajiwara M.J Am Chem Soc,1976,98(6):1589[10] Battersby A R,Mcdonald E.Acc Chem Res,1979,12(1):14[11] Hart G J,Miller A D,Battersby A R,et al.J Chem Soc,Chem Commun,1987,23:1762[12] Battersby A R.J Nat Prod,1988,51(4):629[13] Leeper F J.Nat Prod Rep,1985,2:561[14] Jackson A H,Elder G H,Smith S G.Int J Biochem,1978,9(12):877[15] Koch M,Breithaupt C,Messerschmidt A,et al.EMBO J,2004,23:1720[16] Paul R.J Am Chem Soc,1935,57:2010[17] 郝晓伶,韩士田,刘彦钦.河北师范大学学报(自然科学版),2009,33(1):85[18] Adler A D,Longo F R,Williams H.J Am Chem Soc,1964,84(15):3145[19] 潘继刚,何明威,刘轻轻.有机化学,1993,13(5):533[20] Lindsey J S,Schreiman I C,Hsu H C,et al.J Org Chem,1987,52(5):827[21] 杨彪.精细化工,1999,16:56[22] GeierⅢG R,Lindsey J S.J Porphyrins Phthalocyanines,2002,6:159[23] GeierⅢG R,Lindsey J S.J Chem Soc,Perkin Trans2,2001(5):677[24] GeierⅢG R,Lindsey J S.Tetrahedron,2004,60:11435[25] 郭灿城,何兴涛,邹纲要.有机化学,1991,11(4):416[26] Gedye R.Tetrahedron Lett,1986,27(3):279[27] Petit A.Synth Commun,1992,22(8):1137[28] 汉玉霞,韩士田,刘彦钦.化学工程与装备,2008,6:98[29] Arsenault G P,Bullock E,Macdonald S F.J Am Chem Soc,1960,82:4384[30] Lindsey J S.Acc Chem Res,2010,43(2):300[31] 王周锋,邓文礼.化学进展,2007,19(4):520[32] akthitharan S,Edwards C,Boyle R W.Tetrahedron,2000,56:1025[33] Massey V.Biochem Soc Trans,2000,28(4):283[34] Mattevi A.Trends Biochem Sci,2006,31:276[35] 王君文,何明威.化学试剂,2001,23(1):9[36] 杨琴,冯清.中国药物化学杂志,2006,16(3):154[37] 章艳,高保娇.合成化学,2008,16(1):86[38] Bruno F O N,António M R G,Marta P.Inorg Chem Commun,2010,13:395[39] Stephanie M S L,Diogo R B D,Eugênia R D,et al.Tetrahedron Lett,2011,52:1441[40] Pierre M,Markus M,Dietmar F,et Process Res Dev,2010,14:799[41] Banerjee R.REDOX BIOCHEMISTRY.Hoboken,New Jersey:Wiley John&Sons,Inc,200811 第6期李嘉宾等:卟啉的生物合成途径与化学合成方法的比较。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卟啉光敏剂的合成、生物活性筛选与构效关系研究光动力疗法(Photodynamic Therapy, PDT)是近年来发展起来的一种新的物理化学治疗技术,其基本原理是光敏剂在特定波长光源的激发下进行能量跃迁,随后将能量转移给生物体内的氧,后者形成单线态氧、自由基或自由基离子等,它们作用于靶细胞,引起细胞死亡或凋亡。
PDT以有效、可协同性、重复性和相对成本低等优点引起广泛关注。
光敏剂是PDT治疗的关键,针对目前临床常用光敏剂存在的细胞摄取量低、缺乏靶向性和暗毒性较强、代谢缓慢引发滞后的光毒性等缺陷,本论文设计合成了一系列新型的卟啉类光敏剂,并对其光动力生物活性进行了评价和构效关系研究,以期筛选出暗毒性低,选择性强,活性好的光敏剂。
本论文工作主要分为两个部分:第一部分为四苯基卟啉衍生物的合成与光动力抗菌活性研究。
细菌感染近年来呈现上升趋势,而且由于抗生素的过度使用,出现了多重耐药菌。
迫切需要新的药物或新的替代疗法。
光动力抗菌化学疗法(Photodynamic antimicrobial chemotherapy, PACT)是利用光敏剂和可见光诱导微生物病原体光动力灭活的一种抗菌方法,目前尚未发现其耐药性。
卟啉类光敏剂具有良好的光谱特性和较高的单线态氧产率,且在生物体内广泛存在,代谢途径明晰,生物相容性好,作为抗菌光敏剂受到广泛的研究。
以往的文献报道阳离子卟啉光敏剂对革兰氏阳性菌与阴性菌均有灭活作用,但在结构中引入许多非天然的修饰基团,易造成光敏剂的毒性增强,体内生物相容性差、细菌吞噬量有限等缺陷。
考虑到碱性氨基酸如L-赖氨酸、L-精氨酸、L-组氨酸为生物所需营养物质,且在生理条件下携带正电荷,因而作为阳离子基
团卟对卟啉进行修饰将可获得生物相容性优越且靶向性强的新型光敏剂。
在该部分我们以三个天然碱性氨基酸L-赖氨酸、L-精氨酸、L-组氨酸作为
修饰基团合成了新型的阳离子光敏剂,共合成了化合物56个,其中38个化合物未见相关文献报道,目标产物24个。
涉及合成路线5条。
所有化合物的结构均经过‘HNMR、 MS确证。
并对所有目标产物的熔点、紫外光谱、光稳定性、脂水分布系数、单线态氧的产率、热稳定性进行了测定。
化合物的紫外光谱显示:所合成的化合物具有卟啉化合物典型的420nm左右的Soret带与500-670nm弱吸收的Q带,并且随着氨基酸取代数目的增加,化合物的最大吸收波长逐渐发生蓝移。
光漂白实验结果显示:随着激光照射时间的增加,目标化合物的最大紫外吸收波长的吸光度值有稍许降低,且随着氨基酸取代的数目增多,其光漂白速率增加,光稳定性相对下降,但总体变化不大,所得化合物具
有一定的光稳定性,符合作为光敏剂的条件。
化合物的单线态氧测定结果显示:氨基酸的引入使化合物的单线态氧产率有增加的趋势,其中四赖氨酸取代的卟啉轭合物4i有相对较高的产率(ΦΔ=0.95)。
另外,在所测得的目标化合物中,随着氨基酸取代基数目的增多,化合物的脂水分配系数逐渐下降,水溶性得到了改善。
化合物的热重分析实验显示:所得化合物在200℃之前对热稳定。
化合物的光动力抗菌实验包括吞噬曲线的测定、MIC与MBC的测定、浓度效应曲线及激光共聚焦显微成像。
结果显示:氨基酸基团的引入,提高了细菌对光敏剂的吞噬量,其光动力抗菌活性得到了显著提高,且随着氨基酸数目的增多而呈逐渐增加的趋势。
4c,4e,4g 为连接两个赖氨酸基团的化合物,在浓度为10μM时,它们对三种菌的最大杀灭
作用为:存活率降至3.0-log10(E. coli),<6.0-log10(MRSA),2.5-log10(P. aeruginosa)。
其中带有四个赖氨酸基团的化合物4i,具有最强的光动力灭菌活性,浓度在3.9μM时,能够杀灭细菌MRSA使其存活率降至4.0-log10, P. aeruginosa至3.0-log10, E. coli至<6.0-log10,值得进一步的研究。
第二部分为卟啉类化合物光动力抗肿瘤活性的评价与构效关系研究。
本论文在本实验室前期工作的基础上,进一步探讨或完善该类化合物抗肿瘤作用的构效关系,对第一部分与本部分合成的共21个卟啉衍生物进行了光动力抗肿瘤药理活性的评价。
MTT法测试结果显示:随着化合物浓度从1.25μM上升至20μM,其光毒性逐渐增强,具有明显的量效依赖关系,其中化合物4a,4j其浓度在5μM时,抑制率大于80%,且在该浓度下,其暗毒性较小(<30%);化合物4f,4b,4c,4e在2.5μM时化合物对肿瘤细胞Hela的抑制率分别为
87.91%,79.31%,81.64%,85.06%,IC50值分别为:<0.05μM,1.24μM,0.90μM,1.85μM;可以作为新一代的光敏剂先导物进行开发和研究。
该类化合物的光动力抗肿瘤作用的初步构效关系分析表明:四苯基卟啉环上的氨基的存在对活性产生有利影响,而当引入一个或两个氨基酸时,活性增强,而多个氨基酸基团的引入会降低抗肿瘤活性。
